一种海洋链霉菌、及其环肽化合物在制备抗结核分枝杆菌药物中的应用的制作方法
本发明属于天然产物领域,具体涉及一种海洋链霉菌、环肽化合物及其在制备抗结核分枝杆菌药物中的应用。
背景技术:
:
分枝杆菌是一类病菌的总称,其中最为臭名昭著的当数结核分枝杆菌、麻风分枝杆菌和布鲁利杆菌,这些病原菌能够使人畜患上严重的传染性疾病,给人类的健康和畜牧业的发展带来严重不良影响,也已经成为了危及公共卫生安全的社会问题和社会发展的沉重经济负担。在世界范围内,结核病已经是传染病死亡的首要原因,超过了之前的人类免疫缺陷性病毒(HIV)所致的死亡率。据2015年世界卫生组织的肺结核年报显示,世界大约有20亿的人群(世界人口的1/3)为肺结核潜伏感染人群,且其中的1/10将可能复发;每年患结核病及死于结核的人口数量分别为960万和150万。另外,结核病和HIV的并发,多重耐药结核菌和泛耐药结核菌及全耐药结核菌的出现和传播等使结核病的防治工作变的更加棘手。
然而,对结核病治疗药物的研发还相当落后,这与日益严重的结核病的控制很不相称。能有效控制结核菌的疫苗依然匮乏。现在用于结核病治疗的一线药物(异烟肼、利福平、吡嗪酰胺和乙胺丁醇)和二线药物(para-水杨酸、链霉素、乙硫烟胺、氧氟沙星、卷曲霉素、卡那霉素、阿米卡星和环丝氨酸)是发现与上世纪的40年代至70年代,并且这些药物的治疗周期较长,需要6个月及其以上的时间。至此之后到2011年间,没有针对结核病治疗的药物被发现。在2012年,首个用于多重耐药结核菌治疗的药物bedaquiline获美国FDA批准,但是,这个药物由于较严重的毒副作用,较长的治疗周期(且与其他药物联合使用)及昂贵的价格,限制其在临床的广泛应用。而在2014年,被欧盟批准硝基咪唑类化合物delamanid是另外一个用于多重耐药或泛耐药治疗的抗结核药物。然而,该药物由于其独特的作用机制仅限于F420-依赖的氧化还原酶没有缺失的结核杆菌的治疗。所以,我们迫切需求具有新颖的作用机制,较现有药物更为有效的,能够缩短治疗周期的,对多重耐药菌株和泛耐药菌株有效,且不与现有的药物拮抗的药物。
海洋及其微生物已经成为了新型抗生素的重要来源。海洋生物来源的化合物及其衍生物有7个被FDA批准为药物,还有13个在I-III期临床试验阶段,这20个已经批准或正在临床试验阶段的海洋药物主要用于抗癌和抗感染等领域,有17个在生源上可能与其共附生的微生物有关。因此,海洋微生物是结构新颖和作用独特的抗感染和抗肿瘤药物的重要来源。
技术实现要素:
:
本发明的第一个目的是提供一种具有抗结核分枝杆菌活性的环肽化合物。
本发明的环肽化合物,其结构式如式I所示:
本发明的第二个目的是提供一种能产生上述环肽化合物的海洋链霉菌Streptomyces atratus SCSIO Zh16,其保藏编号为:CGMCC No.12198。
本发明的第三个目的是提供如式Ⅱ所示的化合物1-6的制备方法,其特征在于,包括以下步骤:
a、制备海洋链霉菌Streptomyces atratus SCSIO Zh16的发酵培养物;
b、将发酵培养物分离得菌体和发酵液,发酵液用丁酮萃取,浓缩丁酮萃取物得到发酵液萃取物,菌体用丙酮浸提,丙酮浸提液浓缩得到菌体萃取物,将发酵液萃取物和菌体萃取物合并后得到粗浸膏;粗浸膏经硅胶柱层析,用氯仿–甲醇从体积比100:0,98:2,96:4,94:6,92:8,90:10,80:20和50:50梯度洗脱,收集体积比为100:0的氯仿–甲醇洗脱的馏分的AFr.1、收集体积比为98:2的氯仿–甲醇洗脱的馏分的AFr.2、收集体积比为96:4的氯仿–甲醇洗脱的馏分AFr3、收集体积比为94:6的氯仿–甲醇洗脱的馏分Afr4;
将馏分AFr.1-AFr3合并后,经硅胶柱层析,采用石油醚-乙酸乙酯-甲醇从体积比100:0:0,8:2:0,6:4:0,4:6:0,2:8:0,0:100:0,0:95:5和C:M=9:1梯度洗脱,收集石油醚-乙酸乙酯-甲醇体积比2:8:0,0:100:0,0:95:5和C:M=9:1分别洗脱的馏分BFr.5、BFr.6、BFr.7和BFr.8,合并后经纯化分离得到化合物1、2和6;
将馏分Afr4经硅胶柱层析,采用石油醚-乙酸乙酯-甲醇从体积比100:0:0,8:2:0,6:4:0,4:6:0,2:8:0,0:100:0,0:95:5和C:M=9:1梯度洗脱,收集石油醚-乙酸乙酯-甲醇体积比0:95:5洗脱的馏分Cfr7、收集石油醚-乙酸乙酯-甲醇体积比C:M=9:1洗脱的馏分Cfr8,馏分Cfr7和/或馏分Cfr8经纯化分离得到化合物3、4和5。
优选,所述的海洋链霉菌Streptomyces atratus SCSIO Zh16的发酵培养物是将海洋链霉菌Streptomyces atratus SCSIO Zh16接入发酵培养基中发酵得到的,所述的发酵培养基,每升含有:黄豆粉5g,细菌学蛋白胨15g,可溶性淀粉15g,甘油15g,CaCO3 2g,海盐30g,其余为水,pH 7.2–7.4。
本发明的第四个目的是提供Streptomyces atratus SCSIO Zh16在制备式Ⅱ所示的化合物中的任一化合物中的应用;
本发明的第五个目的是提供式Ⅱ所示的化合物1-6中的任一化合物,或其药用盐在制备抗分枝杆菌药物中的应用
优选,所述的抗分枝杆菌药物为抗结核分枝杆菌药物。
本发明的第五个目的是提供一种抗分枝杆菌药物,其特征在于,含有有效量的式Ⅱ所示的化合物1-6中的任一化合物或其药用盐作为活性成份,和药学上可以接受的载体;
优选,所述的抗分枝杆菌药物为抗结核分枝杆菌药物。
本发明从海洋链霉菌Streptomyces atratus SCSIO Zh16的发酵培养物中分离得到六个环肽化合物,其中化合物6是具有强抗结核分枝杆菌活性的环肽化合物,该环肽化合物对结核分枝杆菌具有显著的抑制作用,可以用于制备抗结核药物,用于结核病的治疗,因此本发明为开发新的抗结核药物提供了备选化合物,对开发中国海洋药物资源具有重要的意义。
暗黑链霉菌Streptomyces atratus SCSIO Zh16,该菌株已于2016年3月10日保存到中国微生物菌种保藏管理委员会普通微生物中心(CGMCC),地址:北京市朝阳区北辰西路1号院3号中国科学院微生物研究所邮编100101,菌株保藏编号为:CGMCC No.12198。
附图说明:
图1是Streptomyces atratus SCSIO Zh16在ISP2培养基上的生长形态图;
图2是Streptomyces atratus SCSIO Zh16的发酵培养液HPLC图;
图3是化合物1的质谱图;
图4是化合物6的质谱图;
图5是化合物2的质谱图;
图6是化合物4的质谱图;
图7是化合物3的质谱图;
图8是化合物5的质谱图。
具体实施方式:
以下实施例是对本发明的进一步说明,而不是对本发明的限制。
实施例1:
海洋链霉菌Streptomyces atratus SCSIO Zh16培养、16s rRNA基因鉴定、发酵检测及代谢产物的HPLC分析。
一、S.atratus SCSIO Zh16菌株的发酵检测、HPLC分析及16s rRNA基因序列分析
1.S.atratus SCSIO Zh16的固体培养:
1.1海洋链霉菌S.atratus SCSIO Zh16是从南海深海沉积物种分离得到,该菌种保存于ISP-2培养基斜面,ISP-2培养基组成为:酵母提取粉4g,葡萄糖4g,麦芽提取粉10g,粗海盐30g,琼脂粉20g,水1000mL,pH 7.2-7.4。
1.2S.atratus SCSIO Zh16菌株基因组DNA的提取及16s rRNA基因的PCR扩增、测序及NCBI BLAST比对分析。利用微波法提取S.atratus SCSIO Zh16的基因组DNA并取部分作为模板,利用16S通用引物,用Trans基因公司的rTaqase,在58℃为退火温度等条件下进行PCR扩增,扩增的PCR产物进行TA克隆和化学转化,送阳性克隆子进行测序(其16S rDNA的序列如SEQ ID NO.1所示)。然后对获得的序列进行拼接和BLAST比对分析。
1.2.1微波法基因组DNA的提取
1)用无菌的竹签从固体培养基上挑取少许菌体于无菌离心管中;
2)加入洗涤液1mL,振荡5sec,12000rpm离心10min,弃上清;
3)加入裂解液100μL,振荡悬浮后,在沸水中煮8-10min;
4)加入600μL 65℃预热的抽提液,涡旋振荡5sec;
5)加入等体积的Tris饱和酚/氯仿溶液抽提,10000rpm,离心5min,转移上清至新的Ep管中,加入等体积预冷的异丙醇溶液进行DNA的沉淀、高速离心;
6)用70%的乙醇洗涤沉淀两次,弃上清;
7)放于37℃培养箱中进行风干处理,然后用20μL的TE溶液进行溶解,每次取1μL作为模板,进行PCR扩增。
1.2.2 16s rRNA基因PCR扩增体系及扩增程序:
扩增体系:
去离子水:13.4μL;水模板DNA:1μL;上下游引物各0.5μL;DMSO:1μL;10*buffer:2.0μL;dNTP:1.5μL;rTaq:0.1μL;共20μL体系。
PCR扩增程序:
95℃*2min+(95℃*20sec+58℃*20sec+72℃*90sec)*30cycle+72℃*10min
1.2.3PCR产物的纯化及TA克隆载体连接,转化及测序
按照omega公司的PCR纯化试剂盒进行纯化回收,纯化后的产物按照片段与T载体的摩尔量比为5:1的比例进行连接,按照说明书连接12h后转化至商品化的DH5a的感受态中。挑取阳性克隆子送公司测序分析,序列结果用DNAstar软件进行序列拼接和BLAST比对分析,16S rRNA的序列如SEQ ID NO.1所示。
经16s rRNA基因(其核苷酸序列如SEQ ID NO.1所示)测序及形态学(其在ISP2培养基上的生长形态如图1所示)分析鉴定其为streptomyces atratus链霉菌,命名为:Streptomyces atratus SCSIO Zh16,该菌株已于2016年3月10日保存到中国微生物菌种保藏管理委员会普通微生物中心(CGMCC),地址:北京市朝阳区北辰西路1号院3号中国科学院微生物研究所邮编100101,菌株保藏编号为:CGMCC No.12198。
2.发酵培养及代谢产物的HPLC分析:
(1)配制发酵培养基(Am2ab):将黄豆粉5g,可溶性淀粉5g,葡萄糖20g,蛋白胨2g,酵母提取粉2g,MgSO4.7H2O 0.5g,KH2PO4 0.5g,Nacl 4g,CaCO3 2g,海盐30g,加入到1L水中,调pH 7.2–7.4,平均分装于250mL的锥形瓶中,121℃灭菌25分钟,获得灭菌的发酵培养基。
(2)S.atratus SCSIO Zh16的培养:将海洋链霉菌S.atratus SCSIO Zh16的菌株接入到上述发酵培养基中,在28℃的温度下,置摇床上以200rpm的转速,培养7-9天得发酵培养液。
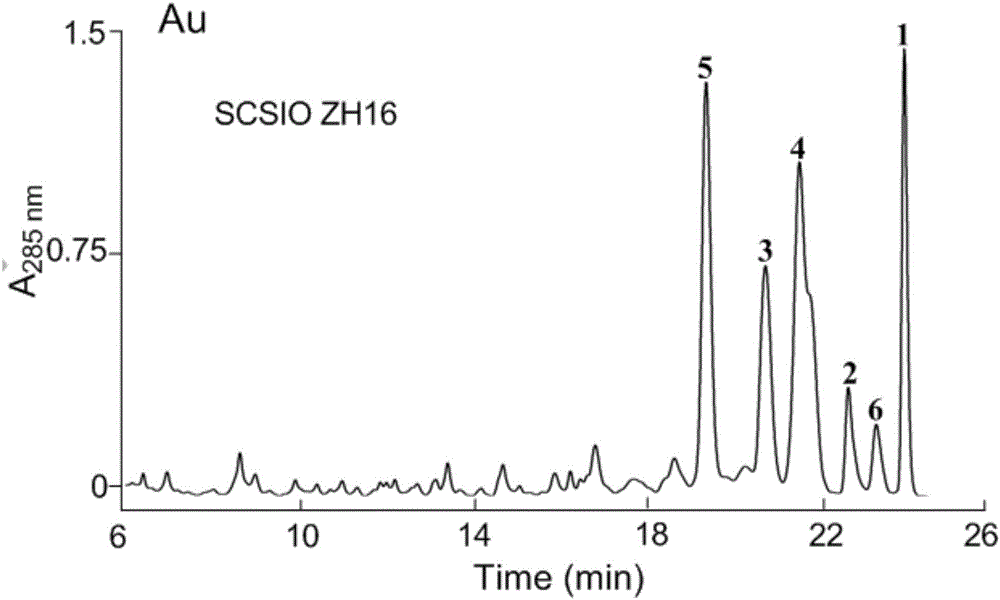
(3)S.atratus SCSIO Zh16的代谢产物的分析:对上述(2)中的发酵培养液进行超声破碎、丁酮萃取和减压旋蒸,然后用甲醇溶解旋蒸终产物于1.5mL的EP管中,14000rpm高速离心10min,取上清100μL到进样管中进行HPLC分析,流动相A为15%的乙腈+去离子水+0.1%的乙酸,流动相B为85%的乙腈+去离子水+0.1%的乙酸,检测波长为230nm,285nm和352nm,所用的程序为20%B to 80%B(线性洗脱,0-20min),80%B to 100%B(线性洗脱,20-21.5min),100%B(21.5-27.0min),100%B to 0%B(27.0-27.1),0%B(27.1-30.0min);流速为1ml/min。检测的结果如图2所示,从图2可以看出,S.atratus SCSIO Zh16的发酵培养液含有化合物1、2、3、4、5和6。
实施例2:
利用S.atratus SCSIO Zh16生产环肽化合物。
一、S.atratus SCSIO Zh16的规模化发酵
(1)种子培养基及发酵培养基的配置
种子培养基的配置(Am2ab):黄豆粉10g,可溶性淀粉10g,葡萄糖40g,蛋白胨4g,酵母提取粉4g,MgSO4.7H2O 1g,KH2PO4 1g,NaCl 8g,CaCO3 4g,海盐60g,加水2L,pH 7.2–7.4,平均分装于40个250mL的锥形瓶中,121℃灭菌25分钟,获得灭菌的种子培养基。
发酵培养基的配制(Am3):黄豆粉5g,细菌学蛋白胨15g,可溶性淀粉15g,甘油15g,CaCO3 2g,海盐30g,水1L,pH 7.2–7.4。总共配置16.2升,分装于72个1000mL的锥形瓶中,121℃灭菌30分钟,获得灭菌的发酵培养基。
(2)发酵培养:
将海洋链霉菌S.atratus SCSIO Zh16的菌株接入到种子培养基中,在28℃的温度下,置摇床上以200rpm的转速,培养72小时得种子培养液。
在超净工作台中,将25mL的种子培养液接入装有225mL发酵培养基的1000mL锥形瓶中,置于28℃摇床上,以200rpm的转速,培养8天,获得海洋链霉菌S.atratus SCSIO Zh16的发酵培养物。
二、环肽化合物的提取分离:
将上述发酵培养物离心得菌体和发酵液,发酵液按体积比为1:1,用丁酮萃取三次,浓缩丁酮萃取液得发酵液萃取物;菌体用其2倍量的丙酮浸提三次,每次24h,浓缩丙酮得菌体萃取物。将发酵液萃取物和菌体萃取物合并,经硅胶(100-200目)柱层析分离,采用氯仿–甲醇(体积比100:0,98:2,96:4,94:6,92:8,90:10,80:20和50:50)梯度淋洗,经减压浓缩后,依次得到相应的馏分AFr.1~AFr.8。经HPLC分析,馏分AFr.1(体积比为100:0的氯仿–甲醇洗脱的馏分)和AFr3(体积比为96:4的氯仿–甲醇洗脱的馏分)合并,经硅胶(100-200目)柱层析分离,采用石油醚-乙酸乙酯-甲醇系统过B柱(体积比100:0:0,8:2:0,6:4:0,4:6:0,2:8:0,0:100:0,0:95:5和C:M(乙酸乙酯-甲醇)=9:1)梯度洗淋,经减压浓缩后,依次得到馏分BFr.1-BFr.8。对BFr.5-BFr.8馏分(BFr.5、BFr.6、BFr.7、BFr.8是石油醚-乙酸乙酯-甲醇体积比2:8:0,0:100:0,0:95:5和C:M=9:1分别洗脱的馏分)合并后用半制备HPLC进行分离(制备的系统是水(A):乙腈(B)系统,检测波长是270nm和354nm,制备的程序是0min 30%A;0.1-18min 30%-0%A;18.1-23min 100%B;23.1-25min 0%-30%A;25.1-30min 30%A,制备柱的规格为5μM×21.2mm×250mm,innoval C18,流速10mL/min)得到化合物1(50mg),化合物6(18mg)和化合物2(40mg)。其中化合物1的保留时间Rt=24.2min,HRESIMS确定其分子式为C54H77N9O10,m/z 1012.5924[M+H]+and m/z 1034.5724[M+Na]+,质谱结果见附图3;化合物6的保留时间为Rt=23.5min,HRESIMS确定其分子式为C54H75N9O11,m/z 1026.5691[M+H]+;m/z 1048.5509[M+Na]+,质谱结果见附图4;化合物2的保留时间Rt=22.9min,HRESIMS确定其分子式为C54H77N9O11,m/z 1028.5863[M+H]+and m/z 1050.5656[M+Na]+,质谱结果见附图5。对Afr4(体积比为94:6的氯仿–甲醇洗脱的馏分)拌样过硅胶柱,经硅胶(100-200目)柱层析分离,采用石油醚-乙酸乙酯-甲醇系统进行梯度过C柱(体积比100:0:0,8:2:0,6:4:0,4:6:0,2:8:0,0:100:0,0:95:5和C:M=9:1)梯度洗淋,经减压浓缩后,依次得到馏分CFr.1-CFr.8。对Cfr7(石油醚-乙酸乙酯-甲醇体积比为0:95:5洗脱的馏分)和Cfr8(体积比C:M=9:1洗脱的馏分)用半制备HPLC分别进行制备分离(制备的系统是水(A):乙腈(B)系统,检测波长是270nm和354nm,制备的程序是0min 30%A;0.1-18min 30%-0%A;18.1-23min 100%B;23.1-25min 0%-30%A;25.1-30min 30%A,制备柱的规格为5μM×21.2mm×250mm,innoval C18,流速10mL/min),制得化合物4(34mg),化合物3(9mg)和化合物5(78mg),馏分Cfr7和Cfr8中都含有化合物3、4、5,用上述HPLC分离,其保留时间都是一致的。其中化合物4的保留时间为Rt=21.8min,HRESIMS确定其分子式为C54H75N9O12,m/z 1042.5643[M+H]+和m/z 1064.5465[M+Na]+,质谱结果见附图6;化合物3的保留时间为Rt=21.0min,HRESIMS确定其分子式为C54H75N9O12,m/z 1042.5645[M+H]+and m/z 1064.5437[M+Na]+,质谱结果见图7;化合物5的保留时间为Rt=19.6min,HRESIMS确定其分子式为C54H75N9O13,m/z 1058.5614[M+H]+和m/z 1080.5419[M+Na]+,质谱结果见图8。
三、化合物1-6的结构鉴定
经HRESIMS m/z及核磁共振分析,其中化合物6为新化合物,其理化性质数据如下:
化合物6:黄色粉末;紫外(PDA)λmax 230,285,352nm;核磁共振1H及13C谱见表1;(+)-HRESIMS m/z 1026.5673([M+H]+,calcd for C54H75N9O11,1026.5620).
表1:化合物6的NMR数据(500/125MHz,TMS为内标,ppm)
由此确定化合物6的结构如式I所示:
化合物1-6的结构如式II所示:
实施例3:
如式II所示的化合物1-6对分枝杆菌的抗菌活性测试分析。
利用肉汤二倍稀释法测试了化合物1-6对分枝杆菌M.smegmatis mc2 155和M.tuberculosis H37RV的抗菌活性。其中对M.smegmatis mc2 155的抗菌活性测试操作步骤简要描述如下:1)把M.smegmatis mc2 155复苏36小时,使用时稀释1000倍作为待测菌液;2)把化合物1-6用DMSO进行溶解配成浓度为3200μg/mL的储存液;3)按照一定的比例把药物储存液与7H9肉汤(添加了0.2%glycerol,0.05%Tween 80)进行稀释,最后稀释成256-0.125μg/mL的终浓度,每孔的药物肉汤体积为100μL;4)用排枪向96孔板的每个孔中添加100μL稀释好的菌液,使得每行各孔的终浓度依次为128-0.0625μg/mL;用稀释好的菌液和空白肉汤分别作为阳性和阴性对照,每个化合物设3个重复。5)把96孔板放在37℃培养箱进行培养,24小时左右进行结果观察和记录。
利用二倍稀释法测定化合物1-6对M.tuberculosis H37RV的抗菌活性的测试操作步骤简要描述如下:1)将-80度冻存的自主发光M.tuberculosis H37Rv(UAlRa)以2mL接种至含有50ml 7H9(含有0.1%twin80)培养基的锥形瓶中,培养至OD值达到0.3~1.0之间;2)把化合物1-6用DMSO配置为10mg/mL的母液,再按照一定比例对各化合物稀释至5120-2.5μg/mL,以RIF(10μg/mL,1μg/mL)为阳性对照,DMSO为阴性对照,将相应化合物以每孔5μL加入到96孔酶标板中,每个化合物设三个重复;3)将菌液原液稀释,取发光值达到3000~5000/200μL的稀释菌液为检测用菌液;4)在96孔酶标板中用排枪每孔加入195μL稀释好的菌液,使各化合物的终浓度依次为128-0.0625μg/mL,于37度孵箱内培养,并于第0-7d检测发光值。活性测试结果见表明(表2),化合物1-6对分枝杆菌的活性具有一定的差异,化合物3和4对耻垢分枝杆菌M.smegmatis mc2 155活性较好;化合物2、化合物5和化合物6显示出强抗结核活性,其中新化合物6的抗结核活性达到0.0098μM,是对照药物利福平抗结核活性的30倍,显示出其在抗结核治疗药物开发中的重要价值。
表2:6个化合物对分枝杆菌的抑制活性(MIC,μM,n=3)
a为卡那霉素作为阳性对照;b为利福平作为对照药物。
- 还没有人留言评论。精彩留言会获得点赞!