包含小肽的细胞培养基的制作方法
背景
细胞培养基提供了在受控、人工和体外环境中维持和生长细胞所必需的营养物。细胞培养基的营养配方(nutrient formulation)、pH和重量摩尔渗透压浓度(osmolality)随参数例如细胞类型、细胞密度和使用的培养系统的变化而变化。
培养基制剂已被用于培养许多细胞类型,包括动物、植物和细菌细胞。培养的细胞具有许多用途,包括用于生理过程的研究和有用的生物学物质的产生。此类有用的产物的实例包括多肽,例如单克隆抗体、激素、生长因子、酶和其它目标多肽。此类产物具有许多商业和治疗性应用,并且随着重组DNA技术的出现,可对细胞进行工程改造以产生大量的此类产物。培养的细胞还常规地用于分离、鉴定和生长可被用作载体和/或疫苗的病毒。因此,体外培养细胞的能力不仅对于细胞生理学的研究是重要的,而且对于否则不能以具有成本效益的方法获得的有用物质的产生是必需的。
细胞培养基制剂已良好地公开于文献中,并且许多培养基是商购可得的。在早期细胞培养工作中,培养基制剂基于血液的化学成分和物理化学性质(例如,重量摩尔渗透压浓度、pH等)并且被称为“生理溶液”Ringer,S.,J.Physiol.3:380-393(1980);Waymouth,C.,In:Cells and Tissues in Culture,第1卷,Academic Press,London,pp.99-142(1965);Waymouth,C.,InVitro 6:109-127(1970)。然而,在氧/二氧化碳分压以及营养物、维生素和痕量元素的浓度方面,哺乳动物身体的不同组织中的细胞暴露于不同的微环境,因此,不同细胞类型的成功体外培养通常需要使用不同的培养基制剂。细胞培养基的典型组分包括氨基酸、有机和无机盐、维生素、矿物质、痕量金属、糖、脂质和核酸,其类型和量可取决于给定的细胞或组织类型的具体要求而变化。
谷氨酰胺通常用于细胞培养基,因为已显示其为培养的细胞的主要能量来源。在1959年,Eagle显示,哺乳动物细胞培养物的最佳生长所必需的谷氨酰胺的量为其它氨基酸的量的3至10倍。Eagle等人,Science 130:432-37(1959)。然而,谷氨酰胺在水溶液中和在升高的温度下不稳定,形成焦谷氨酸盐和氨,这对某些细胞可具有毒性。Roth等人,In Vitro Cellular&Developmental Biology 24(7):696-98(1988)。因此,通常在即将使用时将谷氨酰胺添加至细胞培养基中。
或者,为了避免有毒物质如焦谷氨酸盐和氨的形成,可在细胞培养基中使用含谷氨酰胺的二肽(例如丙氨酰-谷氨酰胺或甘氨酰-谷氨酰胺)替代谷氨酰胺Roth等人,In Vitro Cellular&Developmental Biology 24(7):696-98(1988)。还已使用谷氨酸来替代谷氨酰胺,以减少氨在细胞培养基中的积累,参见Cell Culture Technology for Pharmaceutical and Cell-Based Therapies,52,Sadettin Ozturk和Wei-Shou Hu eds.,Taylor和Francis Group(2006)。
其它人已提出酰化二肽例如丙氨酰谷酰胺,以使二肽在加热灭菌条件下更稳定。例如,美国专利No.5,534,538描述了用于肠道或胃肠外营养的N-酰基二肽,其中N-酰基二肽在加热灭菌条件下比相应的非酰化的二肽更稳定,并且其中N-酰基有利地在其到达肾脏之前延迟了二肽的断裂。美国专利No.5,534,538还发现,N-酰基丙氨酰谷酰胺是用于细胞培养基的适当的谷氨酰胺来源,与相应的非酰化的二肽(丙氨酰谷酰胺)相似,其为细胞培养基的已知组分(参见上文Roth等人)。美国专利No.5,534,538还描述,N-酰基二肽优于游离二肽,这至少部分因为N-酰基二肽在加热灭菌条件下的增强的稳定性。因此,美国专利No.5,534,538实际上教导,不要使用其中N-末端氨基酸具有游离氨基的二肽。
本申请人已发现,某些氨基酸如酪氨酸在用以获得最大细胞生长或蛋白质产量所期望的浓度上具有有限的溶解度。本申请人还已发现,其它氨基酸如半胱氨酸在含水细胞培养基中,特别地在浓缩的细胞培养基中是不稳定的并且易于随时间过去发生沉淀。特别地,因为半胱氨酸具有硫基,因此其易于进行氧化还原反应,其中两个半胱氨酸残基通过二硫键连接在一起形成胱氨酸(SCH2CH(NH2)CO2H)2。胱氨酸在水中具有低溶解度并且易于从溶液中沉淀出来。因此,一直以来无法产生耐贮存的、包含最大细胞生长和/或蛋白质产量所需浓度的酪氨酸和半胱氨酸的液体细胞培养基。
本申请人还尝试通过在含水细胞培养基中使用低于期望浓度的酪氨酸或半胱氨酸来解决该问题。这样做时,能够获得可接受的含水贮存期。然而,这是在牺牲最佳细胞生长、蛋白质产生或病毒产生的情况下实现的。换句话说,与具有最佳浓度的酪氨酸和半胱氨酸的细胞培养基相比较,具有更低浓度的酪氨酸和半胱氨酸的细胞培养基支持减少的细胞生长和/或蛋白质产生。
因此,目前存在对这样的培养基、浓缩培养基或浓缩补料(feed supplement)的需要,其包含足以支持最大细胞生长和/或蛋白质或病毒产生的量的酪氨酸和半胱氨酸,同时避免因酪氨酸的有限溶解度或半胱氨酸的有限稳定性(包括半胱氨酸随时间过去易于从溶液中沉淀出来的倾向)引起的问题。此外,还需要以浓缩形式存在的此类补料,以便其添加不会极大地增加终细胞培养系统的体积。还存在这样的需要:当添加此类营养给料时,所得的系统的pH和重量摩尔渗透压浓度可自动被平衡,并且培养基或浓缩的给料可以以液体或干燥形式获得。最后,存在对这样的单方案、浓缩补料的需要,其包含足以支持最大细胞生长和/或蛋白质产生和/或高质量的蛋白质表达的量的半胱氨酸和酪氨酸。
概述
本发明的组合物,部分涉及细胞培养基、浓缩培养基或浓缩补料,其包含支持最大细胞生长和/或蛋白质或病毒产生的浓度的半胱氨酸和酪氨酸,同时避免因它们有限的溶解度和稳定性引起的问题。在一个方面,培养基、浓缩补料或浓缩培养基可以是无血清组合物。在一个方面,组合物可包含人血清组分,如人血清白蛋白。在其它方面,人血清白蛋白可以是重组的(r-人血清白蛋白),来源于重组来源,在一些优选的情况下,来自植物来源如稻、玉米、小麦、马铃薯、或来自真菌来源,或来自酵母或公知用于本领域(无异物培养(xeno-free culture))的其它等同微生物。在另一个方面,培养基、浓缩补料或浓缩培养基可以为无蛋白质的组合物。在另一个方面,培养基、浓缩补料或浓缩培养基可以为无蛋白质-水解产物的组合物,并且还可以不含蛋白质-水解产物的级分。在某些方面,培养基、浓缩补料或浓缩培养基可以为无血清、无蛋白质和无蛋白质水解产物的组合物。在优选方面,此类组合物可包含化学成分明确的、无血清、无蛋白质和无任何蛋白质水解产物或其级分的组分。在某些实施方案中,具有一种或多种小肽或一种或多种二肽的细胞培养基、浓缩培养基或细胞培养补料也不包含如下物质的一种或多种:脂质、水解产物或其级分、或生长因子。
本发明还部分涉及,就包含半胱氨酸或酪氨酸的短肽的存在或不存在分析上述组合物的方法。利用任何本领域已知的方法,例如利用质谱(LCMS)、毛细管电泳或HPLC进行培养基的分析。
具体地,本公开内容涉及细胞培养基、浓缩给料或细胞培养补充物,其包含一种或多种具有2至6个氨基酸的小肽,如随后在本申请中所定义的。因此,本公开内容提供了细胞培养基、浓缩给料或细胞培养补充物,其中所述培养基、给料或补充物包含选自下述的一种或多种小肽或其盐:X1-5-酪氨酸、X1-5-半胱氨酸、酪氨酸-X1-5和半胱氨酸-X1-5,或其中半胱氨酸或酪氨酸存在于1-6个氨基酸的短肽内的任何位置的任何小肽(例如,X-半胱氨酸-X1-4,X-酪氨酸-X1-4等),其中X为任意氨基酸,并且其中短肽的N-末端氨基酸具有游离氨基。在一个实施方案中,X为丙氨酸或甘氨酸。在另一个实施方案中,X为丝氨酸、缬氨酸、脯氨酸、天冬氨酸或谷氨酸。在具体的实施方案中,本公开内容提供了细胞培养基、浓缩给料或细胞培养补充物,其中所述培养基、给料或补充物包含选自X-酪氨酸、X-半胱氨酸、酪氨酸-X和半胱氨酸-X的一种或多种二肽或其盐,其中X为任意氨基酸,并且其中二肽的N-末端氨基酸具有游离氨基。在一个实施方案中,X为丙氨酸或甘氨酸。在另一个实施方案中,X为丝氨酸、缬氨酸、脯氨酸、天冬氨酸或谷氨酸。在另一个实施方案中,一种或多种二肽为丙氨酰酪氨酸和/或丙氨酰半胱氨酸。细胞培养基、浓缩给料或细胞培养补充物可以为液体溶液或干粉,例如干粉培养基(DPM)或团聚粉(agglomerated powder)(AGTTM)。在一个实施方案中,液体溶液于2-8℃下贮存,且保持无沉淀12个月以上。
在本发明的一个实施方案中,酪氨酸(包含在小肽中)在溶液、培养基、给料或补充物中的浓度可高于以单体存在时在相同溶液中保持可溶的酪氨酸的浓度(即,小肽中的酪氨酸可使得溶液“对于酪氨酸是过饱和的”)。在一个实施方案中,溶液可具有约1至至少约100倍,或约1至至少约25倍的以单体存在时能够达到的可溶性酪氨酸浓度。例如,一些细胞培养基、浓缩给料或补充物中小肽或二肽的浓度可以为以单体存在时能够达到的可溶性酪氨酸浓度的约1至至少约5倍,约1至至少约10倍,约1至至少约15倍,约1至至少约20倍,约1至至少约30倍,约1至至少约40倍,约1至至少约50倍,约1至至少约60倍,约1至至少约70倍,约1至至少约80倍,约1至至少约90倍,约1至至少约100倍,约10至至少约20倍,约10至至少约30倍,约10至至少约40倍,约10至至少约50倍,约10至至少约60倍,约10至至少约70倍等等。
在本发明的一个实施方案中,溶液、培养基、给料或补充物中的半胱氨酸(包含在小肽中)的浓度比当半胱氨酸以单体形式存在时在相同的溶液中保持可溶的半胱氨酸的浓度更高(即,小肽中的半胱氨酸可使得溶液“对于半胱氨酸是过饱和的”)。在一个实施方案中,半胱氨酸的溶解度(或其缺乏)可包括例如,因半胱氨酸至胱氨酸的转化而引起的可溶性的丧失。在一个实施方案中,溶液可包含至少约1至约25倍的当以单体存在时能够达到的可溶性半胱氨酸浓度。例如,小肽或二肽在一些细胞培养基、浓缩给料或补充物中的浓度可以为以单体存在时能够达到的可溶性半胱氨酸浓度的约1至至少约5倍、约1至至少约10倍、约1至至少约15倍、约1至至少约20倍、约1至至少约30倍、约1至至少约40倍、约1至至少约50倍、约1至至少约60倍、约1至至少约70倍、约1至至少约80倍、约1至至少约90倍、约1至至少约100倍、约1至至少约110倍、约10至至少约20倍、约10至至少约30倍、约10至至少约40倍、约10至至少约50倍、约10至至少约60倍、约10至至少约70倍、约10至至少约80倍、约10至至少约90倍、约10至至少约100倍、约10至至少约110倍等。在一个实施方案中,溶液对于酪氨酸和半胱氨酸都是过饱和的。
在一个实施方案中,溶液对于酪氨酸和半胱氨酸都是过饱和的,在例如上文对于酪氨酸或半胱氨酸各自描述的范围内。
在一个实施方案中,上述浓缩给料、培养基或补充物的添加可减少对可能已在进行中的培养系统(例如补料分批培养)的补充的体积。培养可能已在进行中数小时至数天。在另一个实施方案中,增加小肽中包含的半胱氨酸和酪氨酸的溶解度使得能够设计单部分浓缩给料,所述单部分浓缩给料还可以是pH中性的,这是本发明的一部分。本发明部分涉及单方案浓缩给料、浓缩培养基和浓缩补充物,其含有包含在小肽内的半胱氨酸和酪氨酸,以增加它们在组合物中的溶解度和稳定性。
具有一种或多种小肽或一种或多种二肽的细胞培养基、浓缩给料或细胞培养补充物任选地包含如下物质的一种或多种:碳水化合物、维生素、盐、无机元素、缓冲剂和氨基酸或其盐。在一个实施方案中,碳水化合物为己糖。或者,可使用戊糖、己糖或其衍生物或其它等同物。在一些情况下,可使用寡糖或其衍生物;或者,己糖可选自葡萄糖、半乳糖、果糖和麦芽糖。在具体的实施方案中,碳水化合物为葡萄糖。
在一个实施方案中,氨基酸或其盐为精氨酸、天冬酰胺、天冬氨酸、半胱氨酸、谷氨酸、谷氨酰胺、组氨酸、异亮氨酸、亮氨酸、赖氨酸、甲硫氨酸、苯丙氨酸、脯氨酸、丝氨酸、苏氨酸、色氨酸、酪氨酸和缬氨酸的一种或多种。
在一个实施方案中,细胞培养基、浓缩给料或细胞培养补充物包含1)第1二肽X-酪氨酸或其盐,和第2二肽X-半胱氨酸或其盐,其中X为丙氨酸或甘氨酸,并且其中丙氨酸或甘氨酸具有游离氨基,2)碳水化合物,例如葡萄糖,和3)氨基酸或其盐。氨基酸或其盐可包括精氨酸、天冬酰胺、天冬氨酸、半胱氨酸、谷氨酸、组氨酸、异亮氨酸、亮氨酸、赖氨酸、甲硫氨酸、苯丙氨酸、脯氨酸、丝氨酸、苏氨酸、色氨酸、酪氨酸和缬氨酸的一种或多种。
在一个实施方案中,细胞培养基、浓缩给料或细胞培养补充物具有一种或多种小肽,或一种或多种二肽,其适合用于培养细菌细胞、酵母细胞、植物细胞或动物细胞,例如昆虫细胞(例如,果蝇(Drosophila)细胞、斜纹夜蛾细胞(Spodoptera)或粉纹夜蛾(Trichoplusia)细胞)、线虫细胞(例如,秀丽隐杆线虫(C.elegans)细胞)或哺乳动物细胞(例如,CHO细胞、COS细胞、VERO细胞、BHK细胞、AE-1细胞、SP2/0细胞、L5.1细胞、PerC6、杂交瘤细胞、HEK 293,包括人细胞)。
在某些实施方案中,具有一种或多种小肽或一种或多种二肽的细胞培养基为1X制剂。在其它实施方案中,细胞培养基被浓缩为2X或更高的制剂,如本申请中其它地方论述的。在某些实施方案中,一种或多种小肽或二肽,例如X-酪氨酸、X-半胱氨酸、酪氨酸-X或半胱氨酸-X以约1g/L至约16g/L、约1g/L至约10g/L、约1g/L至约5g/L、约2.5g/L至约16g/L、约2.5g/L至约10g/L、约2.5g/L至约5g/L或约2.5g/L至约8.5g/L的浓度存在于细胞培养基中。
在另一个方面,本公开内容提供了培养细胞的方法,包括在支持细胞的培养的条件下将细胞与本文中所述的含有小肽或二肽的细胞培养基接触。可按照本发明的方法培养任何细胞,特别地细菌细胞、酵母细胞、植物细胞或动物细胞。在一个实施方案中,按照本发明的方法进行培养的动物细胞为昆虫细胞(例如,果蝇细胞、斜纹夜蛾细胞或粉纹夜蛾细胞)、线虫细胞(例如,秀丽隐杆线虫细胞)或哺乳动物细胞(例如,CHO细胞、COS细胞人、VERO细胞、BHK细胞、AE-1细胞、SP2/0细胞、L5.1细胞、PerC6、杂交瘤细胞、HEK 293,或其他人细胞)。
在另一个实施方案中,培养细胞的方法包括在支持细胞的培养的条件下将细胞与基础细胞培养基接触,和用本文中描述的具有一种或多种小肽或一种或多种二肽的细胞培养基、细胞培养补充物或细胞培养给料补充基础细胞培养基。在一个实施方案中,一种或多种二肽选自X-酪氨酸、X-半胱氨酸、酪氨酸-X或半胱氨酸-X或其盐,其中X选自丙氨酸、甘氨酸、丝氨酸、缬氨酸、脯氨酸、天冬氨酸或谷氨酸,并且其中一种或多种二肽的N-末端氨基酸具有游离氨基。在另一个实施方案中,一种或多种二肽为丙氨酰酪氨酸和/或丙氨酰半胱氨酸。
在一个实施方案中,在超过一天上,用包含小肽中的半胱氨酸和酪氨酸的溶液补充基础细胞培养基,其中溶液可以是浓缩培养基或浓缩补料。在某些实施方案中,本申请涉及包含小肽的培养基、给料、补充物或其它溶液(包括例如,包含含有至少一个酪氨酸或半胱氨酸残基的二肽的溶液)的用途。事实上,本申请人的发明的一个实施方案是此类溶液在培养细胞中的用途。在该方面,本领域技术人员将理解,在本文的某些叙述中,本申请所涉及的特定补充物、培养基、给料或溶液仅仅是可等同地应用于本文中描述的任何类型的溶液的实施方案的实例。例如,本领域技术人员将理解,关于具有特定氨基酸组成的“补充物”的叙述可等同地描述具有相似组成的“给料”,并且反之亦然。
基础细胞培养基、浓缩培养基、浓缩给料或补充物可在开始细胞培养后第0天、第1天、第2天、第3天、第4天或第5天包含含有小肽或二肽的培养基或给料,以及之后可每天进行补充,直至经过第13或14天或直至培养物的活力下降至低于预定水平(例如50%)。基础细胞培养基任选地以约2%的基础细胞培养基的总体积补充含有小肽或二肽的细胞培养基。在一个实施方案中,细胞产生蛋白质、肽、小RNA(例如,miRNA、siRNA等)。蛋白质意指重组蛋白质或天然存在的蛋白质。蛋白质,无论是重组的还是天然的,也意指全长蛋白质或其部分(如结构域、基序、多肽链或多肽片段)。蛋白质,无论是重组的还是天然的,也意指细胞内蛋白质、细胞外蛋白质、分泌型蛋白质、激素、细胞因子、受体、细胞外基质蛋白质、免疫球蛋白或免疫球蛋白的部分、或其片段。优选,在本发明的包含短肽或二肽的细胞培养基、给料或补充物的情况下,蛋白质产率可以更高。在具体方面,例如,免疫球蛋白的蛋白质产率可在培养至少14天后,大于3000mg/L的免疫球蛋白。在另一个实施方案中,细胞可产生病毒或VLP(病毒样颗粒)。在另一个实施方案中,细胞可产生期望的细胞产物例如维生素、代谢产物、糖蛋白、碳水化合物、脂质或脂蛋白。在另一个实施方案中,培养细胞本身以收获细胞。本发明的培养基和补料组合物包含这样的浓度的半胱氨酸和酪氨酸,其支持最大细胞生长(用于产生病毒或VLP)或最大维生素产生或糖蛋白或疫苗产生等,同时避免由半胱氨酸和酪氨酸的有限的溶解度引起的问题。
可根据本方法培养任何细胞,例如细菌细胞、酵母细胞、植物细胞、昆虫细胞或动物细胞,包括哺乳动物细胞。在一个实施方案中,按照本方法进行培养的动物细胞为昆虫细胞(例如,果蝇细胞、斜纹夜蛾细胞或粉纹夜蛾细胞)、线虫细胞(例如,秀丽隐杆线虫细胞)或哺乳动物细胞(例如,CHO细胞、COS细胞人、VERO细胞、BHK细胞、AE-1细胞、SP2/0细胞、L5.1细胞、PerC6、杂交瘤细胞、或其他人细胞)。在一个实施方案中,细胞为CHO细胞。
另一个方面提供了制备细胞培养基的方法,包括将本文中描述的一种或多种小肽或二肽与碳水化合物例如葡萄糖和至少一种氨基酸或其盐组合,所述氨基酸例如精氨酸、天冬酰胺、天冬氨酸、半胱氨酸、谷氨酸、组氨酸、异亮氨酸、赖氨酸、甲硫氨酸、苯丙氨酸、脯氨酸、羟脯氨酸、丝氨酸、苏氨酸、色氨酸、酪氨酸、谷氨酰胺和缬氨酸。在一个实施方案中,一种或多种二肽选自X-酪氨酸、X-半胱氨酸、酪氨酸-X或半胱氨酸-X或其盐,其中X选自丙氨酸、甘氨酸、丝氨酸、缬氨酸、脯氨酸、天冬氨酸或谷氨酸,并且其中所述一种或多种二肽的N-末端氨基酸具有游离氨基。在另一个实施方案中,所述一种或多种二肽为丙氨酰酪氨酸和/或丙氨酰半胱氨酸。
在其它实施方案中,按照本方法制备的细胞培养基被浓缩为2X或更浓的制剂,如在本申请中其它地方所论述的。在某些实施方案中,一种或多种小肽或二肽例如丙氨酰酪氨酸和/或丙氨酰半胱氨酸存在于按照本方法制备的细胞培养基中。
例如,在一些细胞培养基或浓缩培养基或给料中小肽或二肽的浓度可以为约0.5g/L至约30g/L、约0.5g/L至约25g/L、约0.5g/L至约20g/L、约0.5g/L至约16g/L、约0.5g/L至约10g/L、约0.5g/L至约5g/L、约0.5g/L至约4g/L、约1g/L至约30g/L、约1g/L至约20g/L、约1g/L至约16g/L、约1g/L至约10g/L、约1g/L至约5g/L、约2.5g/L至约30g/L、约2.5g/L至约20g/L、约2.5g/L至约16g/L、约2.5g/L至约10g/L、约2.5g/L至约5g/L或约2.5g/L至约4.5g/L、约5g/L至约30g/L、约5g/L至约25g/L、约5g/L至约20g/L、约5g/L至约16g/L、约5g/L至约10g/L、约5g/L至约5g/L、约5g/L至约4g/L等。
另一个方面提供了包含本文中所述的含有小肽或二肽的细胞培养基和至少一种上述细胞的组合物。在一个实施方案中,至少一种细胞为CHO细胞。
另一个方面涉及用于培养细胞的试剂盒。试剂盒可包括一个或多个装有本文中描述的含有小肽或二肽的细胞培养基的容器。试剂盒任选地包括至少一种选自下述的另外的组分:至少一种生长因子、至少一种动物组织提取物、至少一种动物器官提取物、至少一种动物腺提取物、至少一种酶、至少一种蛋白质、至少一种维生素、至少一种细胞因子、至少一种脂质、至少一种痕量元素、至少一种细胞外基质组分、至少一种缓冲剂、至少一种抗生素和至少一种病毒抑制剂。试剂盒还可包含一种或多种细胞或细胞类型。
另一个方面涉及使用本文中描述的含有小肽或二肽的细胞培养基产生病毒或VLP的方法。具体地,所述方法包括(a)在适合促进病毒感染细胞的条件下将细胞(例如,哺乳动物细胞)与病毒接触;和(b)在适用促进细胞产生病毒的条件下在本文中描述的培养基中培养细胞。在一个实施方案中,产生病毒或VLP的细胞为哺乳动物细胞例如CHO细胞或昆虫细胞或植物细胞或真菌细胞。在另一个实施方案中,对非哺乳动物病毒或VLP进行工程改造以便其可感染哺乳动物细胞例如人细胞。
在另一个方面,本公内容提供了使用本文中描述的含有小肽或二肽的细胞培养基产生多肽例如免疫球蛋白或其片段的方法。具体地,所述方法包括在适合于细胞表达多肽的条件下在含有二肽的培养基中培养已经历基因工程改造以产生多肽的细胞。在一个实施方案中,细胞为哺乳动物细胞例如CHO细胞。
因此,本发明的一个方面涉及包含至少一种小肽的细胞培养基、浓缩给料或浓缩补料,所述肽包含至少两个氨基酸,其中至少一个氨基酸为半胱氨酸或酪氨酸。本发明的另一个方面涉及上述细胞培养基、浓缩给料或浓缩补料,其中小肽的其余氨基酸中的至少一个选自丙氨酸、甘氨酸、丝氨酸、缬氨酸、脯氨酸、天冬氨酸和谷氨酸。本发明的另一个方面,小肽的其余氨基酸中的至少一个为丙氨酸或甘氨酸。本发明的另一个方面涉及上述细胞培养基、浓缩给料或浓缩补料,其中至少一种所述小肽为选自X-酪氨酸、X-半胱氨酸、酪氨酸-X和半胱氨酸-X或其盐的二肽,并且其中X选自丙氨酸、甘氨酸、丝氨酸、缬氨酸、脯氨酸、天冬氨酸和谷氨酸,和/或,其中一种或多种小肽的N-末端氨基酸具有游离氨基。在一个方面,X为丙氨酸或甘氨酸。
在本发明的一些方面,小肽可以为二肽、三肽、四肽、五肽、六肽、七肽、八肽、九肽或十肽;或者,小肽在长度上可以为至少约2至10个氨基酸;或在一些方面,小肽在长度上为至少约10个氨基酸。在一些方面,短肽可以包含2、3、4、5或6个氨基酸。
在其它方面,细胞培养基为液体溶液。
在上述细胞培养基之任一中,细胞培养基、浓缩给料或浓缩补料是干粉或颗粒性干粉。
在其它方面,上述细胞培养基之任一可包含碳水化合物和氨基酸或其盐。在一个实施方案中,碳水化合物为己糖。在其它实施方案中,氨基酸或其盐为精氨酸、天冬酰胺、天冬氨酸、半胱氨酸、谷氨酸、组氨酸、异亮氨酸、赖氨酸、甲硫氨酸、苯丙氨酸、脯氨酸、羟脯氨酸、丝氨酸、苏氨酸、色氨酸、酪氨酸和缬氨酸之任一种或多种。在其它实施方案中,培养基还包含维生素、盐、缓冲剂或无机元素。
在上述一些方面中,细胞培养基、浓缩给料或浓缩补料不包含脂质、水解产物或其级分,或生长因子。在上述其它方面,细胞培养基、浓缩给料或浓缩补料不包含蛋白质。因此在一些优选方面,包含小肽的细胞培养基、浓缩给料或重建的培养基可以不含血清、不含蛋白质和/或不含水解产物。
在具体的方面,将细胞培养基、浓缩给料或浓缩补料浓缩为2X或更浓的制剂。在优选方面,上述细胞培养基、浓缩给料或浓缩补料包含一种或多种二肽,其可以为丙氨酰酪氨酸和/或丙氨酰半胱氨酸和/或丙氨酰胱氨酸二聚体。在优选方面,一种或多种二肽可以以约1g/L至约16g/L的浓度存在;或一种或多种二肽可以以约2.5g/L至约8.5g/L的浓度存在。在一个方面,于2-8℃下贮存的液体溶液可保持无沉淀12个月以上。
本发明还涉及培养细胞的方法,包括在支持细胞的培养的条件下将细胞与基础细胞培养基接触,和用上述浓缩给料或培养基补充基础细胞培养基。可在分批补料培养过程中进行补充;或在现有补料方案之外再进行补充;或,与逐步的弹丸(bolus)添加不同,可连续进行补充。在一些情况下,可在超过一天上用浓缩给料或培养基补充基础细胞培养基;或可用单次浓缩给料或用多次浓缩给料补充基础细胞培养基;或可从开始细胞培养后第0天,第1天,第2天,第3天,第4天或第5天开始进行补充,以及之后每天进行补充,直至第13或14天;或每一次补充可以为约1-10%,或约5-20%的基础培细胞培养基的总起始体积。
在本文中的方法的所有方面,细胞可以是工程改造的细胞;或细胞可以是重组细胞;或细胞可以是植物细胞,或细胞可以是动物、植物、昆虫、禽类、酵母、藻类或鱼类细胞之任一种。动物细胞可以是哺乳动物、昆虫、牛、灵长类动物或多潜能干细胞。在一个方面,动物细胞可以是哺乳动物细胞;哺乳动物细胞可以是角质形成细胞、宫颈上皮细胞、支气管上皮细胞、气管上皮细胞、肾上皮细胞和视网膜上皮细胞)以及已建立的细胞系和其株系(例如,293胚肾细胞、BHK细胞、HeLa宫颈上皮细胞和PER-C6视网膜细胞、MDBK(NBL-1)细胞、911细胞、CRFK细胞、MDCK细胞、CHO细胞、BeWo细胞、Chang细胞、Detroit 562细胞、HeLa 229细胞、HeLa S3细胞、Hep-2细胞、KB细胞、LS180细胞、LS174T细胞、NCI-H-548细胞、RPMI 2650细胞、SW-13细胞、T24细胞、WI-28VA13,2RA细胞、WISH细胞、BS-C-I细胞、LLC-MK2细胞、CloneM-3细胞、1-10细胞、RAG细胞、TCMK-1细胞、Y-1细胞、LLC-PK1细胞、PK(15)细胞、GH1细胞、GH3细胞、L2细胞、LLC-RC 256细胞、MH1C1细胞、XC细胞、MDOK细胞、VSW细胞和TH-I,B1细胞或其衍生物)、来自任何组织或器官(包括但不限于心脏、肝、肾、结肠、肠、食道、胃、神经组织(脑、脊髓)、肺、血管组织(动脉、静脉、毛细血管)、淋巴组织(淋巴腺、腺组织(adenoid)、扁桃体、骨髓和血液)、脾和成纤维细胞以及成纤维细胞样细胞系的成纤维细胞(例如,CHO细胞、TRG-2细胞、IMR-33细胞、Don细胞、GHK-21细胞、瓜氨酸血症细胞、Dempsey细胞、Detroit 551细胞、Detroit 510细胞、Detroit 525细胞、Detroit 529细胞、Detroit 532细胞、Detroit 539细胞、Detroit 548细胞、Detroit 573细胞、HEL 299细胞、IMR-90细胞、MRC-5细胞、WI-38细胞、WI-26细胞、MiCl1细胞、CHO细胞、CV-1细胞、COS-1细胞、COS-3细胞、COS-7细胞、Vero细胞、DBS-FrhL-2细胞、BALB/3T3细胞、F9细胞、SV-T2细胞、M-MSV-BALB/3T3细胞、K-BALB细胞、BLO-11细胞、NOR-10细胞、C3H/IOTI/2细胞、HSDM1C3细胞、KLN2O5细胞、McCoy细胞、小鼠L细胞、株系2071(小鼠L)细胞、L-M株(小鼠L)细胞、L-MTK-(小鼠L)细胞、NCTC克隆2472和2555、SCC-PSA1细胞、Swiss/3T3细胞、印度黄麂(Indian muntjac)细胞、SIRC细胞、CII细胞和Jensen细胞、Sp2/0、NS0、NS1细胞或其工程改造的细胞。在一个方面,哺乳动物细胞可以为CHO细胞。
在本文中的方法的所有方面,细胞可产生免疫球蛋白或其片段;细胞可产生大于3000mg/L的免疫球蛋白或其片段。
或者,在本文中的方法的所有方面,细胞可产生病毒或病毒样颗粒(VLP);并且病毒可以为重组病毒。病毒可以为但不限于腺病毒、慢病毒、杆状病毒、仙台病毒、痘苗病毒或其工程改造的病毒衍生物。在本文描述的这些方面中,VLP可携带核酸,或其可携带RNA。
在另一个方面,本发明还涉及制备细胞培养基、浓缩给料或细胞培养补充物的方法,包括将一种或多种小肽与碳水化合物和至少一种氨基酸或其盐组合,其中一种或多种小肽的每一种包含半胱氨酸或酪氨酸。在一个实施方案中,一种或多种小肽中除半胱氨酸或酪氨酸外的氨基酸(或称为其余氨基酸)可选自丙氨酸、甘氨酸、丝氨酸、缬氨酸、脯氨酸、天冬氨酸、精氨酸、谷氨酰胺或谷氨酸。在一个优选的方面中,除半胱氨酸或酪氨酸外的氨基酸为丙氨酸或甘氨酸。在另一组中,其余氨基酸还可以是精氨酸、天冬酰胺、天冬氨酸、半胱氨酸、谷氨酸、组氨酸、异亮氨酸、赖氨酸、甲硫氨酸、苯丙氨酸、脯氨酸、羟脯氨酸、丝氨酸、苏氨酸、色氨酸、酪氨酸和缬氨酸中的一个或多个。在上述方法的另一个优选方面,一种或多种二肽可选自X-酪氨酸、X-半胱氨酸、酪氨酸-X或半胱氨酸-X或其盐,其中X选自丙氨酸、甘氨酸、丝氨酸、缬氨酸、脯氨酸、天冬氨酸、精氨酸或谷氨酸,并且其中一种或多种二肽的N-末端氨基酸具有游离氨基。在最优选方面,X为丙氨酸或甘氨酸。在最优选方面,碳水化合物可以为葡萄糖。此外,细胞培养基还可包含维生素、盐、缓冲剂或无机元素;或,可以不包含脂质、水解产物或其级分,或生长因子;或可以不包含蛋白质;或细胞培养基可被浓缩为2X或更浓的制剂;或,一种或多种二肽可以为丙氨酰酪氨酸和/或丙氨酰半胱氨酸;或一种或多种二肽以约1g/L至约16g/L的浓度存在于细胞培养基中;或优选,一种或多种二肽以约2.5g/L至约8.5g/L的浓度存在。在大多数方面,于2-8℃下贮存的细胞培养基保持无沉淀12个月以上。
本发明还涉及用于分析细胞培养基、浓缩给料或重建的培养基的方法,所述方法包括测定包含半胱氨酸或酪氨酸的短肽在培养基中的存在或不存在。在一个方面,细胞培养基、浓缩给料或重建的培养基可以不含血清、不含蛋白质、不含水解产物,并且可利用但不限于质谱法(LCMS)、毛细管电泳和HPLC来进行分析。
本发明还涉及包含上述细胞培养基、浓缩给料或重建的培养基以及细胞的组合物。
本发明还涉及在细胞培养基中产生重组蛋白质的方法,包括:将细胞与上述细胞培养基、浓缩给料或重建的培养基接触;和在适合于所述细胞生长和/或所述重组蛋白质表达的条件下培养所述细胞。
本发明还涉及用于体外培养细胞的试剂盒,所述试剂盒包括一个或多个容器,其中第一容器包含含有至少一种上述二肽的培养基,并且其中所述培养基支持培养物中的细胞的生长和/重组蛋白质的表达。可以悬浮培养或贴壁培养细胞。生长可以是高密度生长。
本发明还涉及在上述细胞培养基、浓缩给料或重建的培养基中产生病毒或病毒颗粒的方法,包括:在上述细胞培养基中培养重组细胞,其中所述培养基在适合于所述病毒或病毒颗粒表达的条件下支持所述细胞生长。
本发明还涉及利用上述方法产生的重组蛋白质;或,利用上述方法产生的病毒或病毒颗粒;或上述细胞培养基、浓缩给料或重建的培养基用于产生病毒或重组蛋白质的用途;或利用上述方法产生的培养基、浓缩给料或重建的培养基。
附图概述
包括在本说明书中并且构成本说明书的一部分的附图举例说明了本发明的某些实施方案,并且与书面描述一起用于解释本发明的某些原理。
图1显示在(i)补充有葡萄糖给料的基础细胞培养基(CD FortiCHOTM),和(ii)CD FortiCHOTM+aa(具有低水平的半胱氨酸和酪氨酸的浓缩氨基酸混合物,和葡萄糖)+DP(二肽)给料方案2(FP2)或(iii)CD FortiCHOTM+aa(具有低水平的半胱氨酸和酪氨酸的浓缩氨基酸混合物,和葡萄糖)+DP(二肽)给料方案3(FP3)中生长的CHO细胞的活细胞密度(x106个细胞/mL)(由曲线描述)和IgG滴度(mg/L)(由条块描述)。参见实施例。
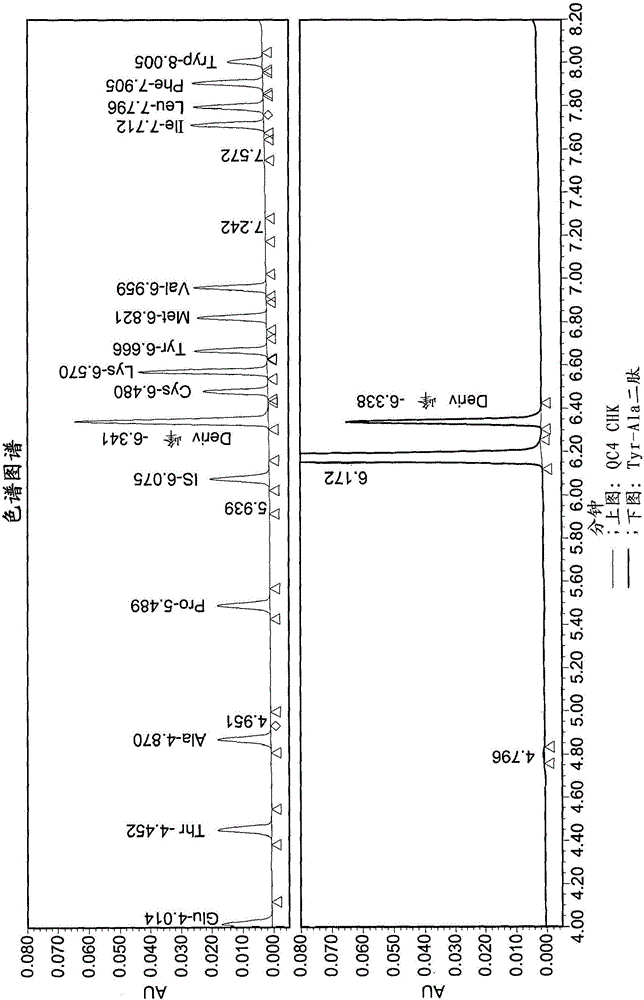
图2显示包含Ala-Tyr二肽的溶液的示例性色谱图谱(profile chromatogram),Ala-Tyr二肽由6.172分钟处的峰表示(下图)。
图3显示包含Ala-Cys二肽的溶液的示例性色谱图谱,Ala-Cys二肽由6.631分钟处的峰表示(下图)。
图4显示包含Ala-Tyr二肽标准品(由8.8分钟处的峰表示)的溶液的示例性提取离子色谱图谱(profile extracted ion chromatogram)。
图5显示包含Ala-Cys二聚体标准品(由9.6分钟处的峰表示)的溶液的示例性提取离子色谱图谱。
图6显示包含Ala-Cys二聚体和Ala-Tyr二肽的示例性给料样品的示例性总离子色谱图谱(profile total ion chromatogram)。
图7显示包含Ala-Tyr二肽和Ala-Cys二聚体的示例性给料样品的示例性提取离子色谱图谱。
详细描述
现详细参考各种示例性实施方案。应理解,提供下列详细描述以给予读者对本发明的方面的某些实施方案、特征和细节的更全面理解,并且下列详细描述不应当被解释为对本发明的范围的限制。
1.定义
为了可更容易地理解本发明,首先定义某些术语。其它定义示于整个详细描述中。
如本文中所使用的,“细胞培养”或“培养”是指在人工(例如,体外)环境中维持细胞。然而,应理解,术语“细胞培养”是概括性术语,其不仅可用于包括单独的原核(例如,细菌)或真核(例如,动物、植物和真菌)细胞的培养,而且可用于包括组织、器官、器官系统或完整生物体的培养,针对于此,术语“组织培养”、“器官培养”、“器官系统培养”或“器官型培养”在有些情况下可与术语“细胞培养”互换使用。
如本文中所使用的,“培育/培养”是指在有利于细胞在活跃或静止状态中生长、分化或连续存活的条件下在人工环境中维持细胞。因此,“培育/培养”可与“细胞培养”或任何其上述同义词互换使用。
如本文中所使用的,“细胞培养基”或“培养基”(和在每一种情况下的复数形式)是指,支持细胞的培养和/或生长的营养组合物。细胞培养基可以为完全制剂,即,不需要补充即可培养细胞的细胞培养基,可以为不完全制剂,即,需要补充的细胞培养基,或可以为这样的培养基,其可补充不完全制剂或在完全制剂的情况下可改善培养或培养结果。除非上下文另外指出,否则术语“细胞培养基”或“培养基”(和在每一种情况下的复数形式)是指,未曾与细胞一起温育的非条件化的细胞培养基。由此,术语“细胞培养基”或“培养基”(和在每一种情况下的复数形式)与“消耗(spent)”培养基或“条件”培养基不同,所述消耗或条件培养基可包含该培养基的许多原始组分以及多种细胞代谢产物和分泌的蛋白质。
如本文中所使用的,“小肽”是指通过一个或多个肽键或等同的键连接在一起的2至6个氨基酸的链,其中至少一个氨基酸为酪氨酸或半胱氨酸。优选,小肽中的除酪氨酸或半胱氨酸外的氨基酸,在中性pH上显示良好的溶解度性质。因此,在一个实施方案中,小肽中的除酪氨酸或半胱氨酸外的氨基酸,选自丙氨酸、甘氨酸、丝氨酸、缬氨酸、脯氨酸、谷氨酸、天冬氨酸、谷氨酰胺和精氨酸。在另一个实施方案中,小肽的N-末端氨基酸具有游离氨基。在本发明的实施方案中,小肽可包含具有游离氨基(如乙醇胺)或游离羧基的非氨基酸,或类似化合物。
如本文中所使用的,“提取物”是指包含物质的组分或物质的亚组的浓缩制备物的组合物,其通常是通过机械(例如,通过压力处理)或化学(例如,通过蒸馏、沉淀、酶促作用或高盐处理)方法处理物质形成的。
如本文中所使用的,术语“成分”是指,可用于细胞培养基中以维持或促进细胞的生长或增殖的任何化合物,无论是化学来源的还是生物学来源的。术语“组分”、“营养物”和“成分”可互换使用并且全都指此类化合物。可用于细胞培养基的常见成分包括氨基酸、盐、金属、糖、碳水化合物、脂质、核酸、激素、维生素、脂肪酸、蛋白质等。促进或维持细胞的离体培养的其它成分可由本领域技术人员根据具体需要来选择。
“1X制剂”是指,以工作浓度包含在细胞培养基中发现的一些或全部成分的任何水溶液。“1X制剂”可以指例如,细胞培养基或该培养基的成分的任何亚组。1X溶液中的成分的浓度与用于体外维持或培养细胞的细胞培养制剂中发现的该成分的浓度大致相同。用于体外培养细胞的细胞培养基根据定义为1X制剂。当存在许多成分时,1X制剂中的每一种成分具有与细胞培养基中的此类成分的浓度大致相等的浓度。例如,RPMI-1640培养基,除其它成分外,包含0.2g/L L-精氨酸、0.05g/L L-天冬酰胺和0.02g/L L-天冬氨酸。此类氨基酸的“1X制剂”在溶液中包含大致相同浓度的此类成分。因此,当提及“1X制剂”时,意指溶液中的每一种成分具有与所描述的细胞培养基中发现的浓度相同或大致相同的浓度。细胞培养基的1X制剂中的成分的浓度对于本领域技术人员来说是公知的。参见Cell Culture Technology for Pharmaceutical and Cell-Based Therapies,42-50(Sadettin Ozturk和Wei-Shou Hu eds.,Taylor and Francis Group 2006),将其通过引用整体并入本文。然而,1X制剂的重量摩尔渗透压浓度和/或pH与培养基相比较可以不同,特别是当较少的成分包含在1X制剂中时。
“10X制剂”意指这样的溶液,其中该溶液中的每一种成分的浓度约为细胞培养基中的相同成分的10倍。例如,RPMI-1640培养基的10X制剂,除其它成分外,可包含2.0g/L L-精氨酸、0.5g/L L-天冬酰胺和0.2g/L L-天冬氨酸(比较上文的1X制剂)。“10X制剂”可以以1X培养基中发现的浓度的约10倍的浓度包含许多另外的成分。很显然的,“5X制剂”、“25X制剂”、“50X制剂”、“100X制剂”、“500X制剂”和“1000X制剂”是指,与1X细胞培养基相比较,分别以约5、25、50、100、500或1000倍的浓度包含成分的溶液。再次地,培养基制剂和浓缩液的重量摩尔渗透压浓度和pH可发生变化。对于具体的细胞培养方案,制剂可以以1X包含组分或成分,但对于不同的培养方案或不同的基础培养基,可以以例如2、2.5、5、6.7、9、12X等的浓度包含所述组分或成分。
二聚体由两个二肽组成。因此,例如,Ala-Cys的二聚体可包含Ala-Cys-Cys-Ala,其中cys-cys通过二硫键键合。Ala-Cys-Cys-Ala也可称为N,N'-二-L-丙氨酰-L-胱氨酸。
1.小肽
本公开内容涉及小肽包括二肽在细胞培养基中的用途。本申请人已发现,制备包含期望浓度的某些氨基酸例如酪氨酸和半胱氨酸的细胞培养基因酪氨酸的低溶解度和半胱氨酸的低稳定性而不可能实现。酪氨酸和半胱氨酸的溶解度和稳定性问题已通过下述得到解决:在含水细胞培养基中使用低于期望浓度的酪氨酸或半胱氨酸,从而当营养物在细胞培养过程中使用时,这使得它们成为最佳细胞生长和/或蛋白质产生的限速氨基酸。虽然使用低于期望浓度的酪氨酸和半胱氨酸可导致可接受的含水贮存期、溶解度和稳定性,但其也可能需要在细胞培养补充过程中例如在分批补料培养系统中添加更大体积的培养基以获得期望的生产率。这是不想要的,因为系统的化学计量平衡、pH和/或重量摩尔渗透压浓度也需要重新调整。
由大体积补充导致的问题可通过使用浓缩补料来解决。期望的浓缩补料是营养成分复杂、化学计量平衡的营养添加剂,其在分批补料培养系统中补充营养物耗竭的培养系统,其另外地以及期望地可具有自动平衡pH和自动平衡重量摩尔渗透压浓度的特征。然而,由于酪氨酸的低溶解度和半胱氨酸的低稳定性,具有高水平的半胱氨酸和酪氨酸的浓缩给料组合物已成为制备的挑战。其通常导致半胱氨酸或酪氨酸随时间过去从溶液中析出。因此,稳定的单部分、pH中性、化学成分明确的浓缩给料一直难以合成。为了克服该问题,已制备了酸性或碱性的多部分浓缩给料。
本申请人已发现,可以用小肽,如二肽丙氨酰-酪氨酸、甘氨酰-酪氨酸、丙氨酰-半胱氨酸(其形成二硫化物二聚体,[AlaCys]2)、或甘氨酰-半胱氨酸(其形成二硫化物二聚体,[GlyCys]2)或包含一个或多个酪氨酸或半胱氨酸的其它小肽替代细胞培养基中的游离氨基酸,酪氨酸和半胱氨酸。包含此类二肽或其它小肽的细胞培养基为细胞提供了足以支持最大细胞生长和/或蛋白质产生的浓度的酪氨酸和/或半胱氨酸,同时避免了与游离酪氨酸和/或半胱氨酸相关的溶解度和稳定性问题。
本发明的小肽具有2至6个氨基酸,其中至少一个氨基酸为半胱氨酸或酪氨酸,并且其中其余氨基酸可以为任意氨基酸。优选,小肽中的除酪氨酸或半胱氨酸外的氨基酸,在中性pH下显示良好的溶解度性质。在一个实施方案中,小肽中的除酪氨酸或半胱氨酸外的氨基酸,选自丙氨酸、甘氨酸、丝氨酸、缬氨酸、脯氨酸、谷氨酸或天冬氨酸。在另一个实施方案中,小肽的N末端氨基酸具有游离氨基。在本发明的实施方案中,小肽(二、三、四、五或六个氨基酸)可包含具有游离胺基(如乙醇胺)或游离羧基的非氨基酸,或可促成肽键的类似化合物。在另一个实施方案中,小肽可包含通过二硫键二聚化的半胱氨酸。由于半胱氨酸-半胱氨酸二聚化(cys-cys),虽然本发明的小肽被定义为具有2-6个氨基酸的长度,但可能存在这样的组合物,其因可能在本发明的培养基或给料中发生的自发半胱氨酸-半胱氨酸二聚化而导致更长的肽。此类化合物也是可溶性的,即使是在高浓度下,因此,其完全在本发明的范围内。
在其它实施方案中,小肽为具有两个氨基酸并且由式:X-酪氨酸、X-半胱氨酸、酪氨酸-X或半胱氨酸-X表示的二肽或其盐,其中X为任意氨基酸,并且其中二肽的N-末端氨基酸具有游离氨基。因此,所述二肽与美国专利No.5,534,538中公开的N-酰基二肽明显不同,所述N-酰基二肽需要共价键合于N-末端氨基酸的氨基的酰基。根据美国专利No.5,534,538,正是酰基的存在赋予了二肽更优的稳定性性质。优选,X为具有良好溶解度性质的氨基酸。在一个实施方案中,X为丙氨酸或甘氨酸。在另一个实施方案中,X为丝氨酸、缬氨酸、脯氨酸、谷氨酸或天冬氨酸。
在一个实施方案中,小肽为具有两个氨基酸的二肽,并且本发明的一个或多个二肽选自X-酪氨酸、X-半胱氨酸、酪氨酸-X和半胱氨酸-X或其盐,其中X为任意氨基酸,并且其中二肽的N-末端氨基酸具有游离氨基。在一个实施方案中,X为丙氨酸或甘氨酸。在另一个实施方案中,X为任意氨基酸、氨基酸的衍生物、具有氨基的非氨基酸如乙醇胺。在本实施方案的方面,优选的氨基酸选自:丝氨酸、缬氨酸、脯氨酸、天冬氨酸、精氨酸、谷氨酰胺或谷氨酸。
在另一个实施方案中,小肽为具有3个氨基酸的三肽,包括下列三肽:X-X-酪氨酸、X-X-半胱氨酸、X-酪氨酸-X、X-半胱氨酸-X、酪氨酸-X-X、半胱氨酸-X-X或其盐,其中X为任意氨基酸。在一个实施方案中,三肽的N-末端氨基酸具有游离氨基。优选,X为具有良好溶解度性质的氨基酸。在一个实施方案中,X为丙氨酸或甘氨酸。在另一个实施方案中,X为丝氨酸、缬氨酸、脯氨酸、谷氨酸、谷氨酰胺、精氨酸或天冬氨酸。在本发明的某些方面,包含在小肽中的半胱氨酸和酪氨酸的上述组合物用于增加细胞系的蛋白质产量。在本发明的优选方面中,增加的蛋白质为抗体,其以比在无所述小肽的培养基中更高的滴度产生。更高的抗体产量意指,约0.1g/L至约10g/L、约0.1g/L至约5g/L、约0.1g/L至约2.5g/L、约0.1g/L至约1g/L,优选约1g/L至约10g/L,更优选约2g/L至约8g/L等。
取决于细胞和细胞的期望的用途,细胞培养基、给料、浓缩培养基或给料等的一种或多种小肽或二肽可最佳地以化学计量平衡的浓度存在以最优化细胞培养性能。例如,一些细胞培养基或浓缩给料中的一种或多种小肽或二肽的浓度可以为约0.5g/L至约30g/L、约0.5g/L至约25g/L、约0.5g/L至约20g/L、约0.5g/L至约16g/L、约0.5g/L至约10g/L、约0.5g/L至约5g/L、约0.5g/L至约4g/L、约1g/L至约30g/L、约1g/L至约20g/L、约1g/L至约16g/L、约1g/L至约10g/L、约1g/L至约5g/L、约2.5g/L至约30g/L、约2.5g/L至约20g/L、约2.5g/L至约16g/L、约2.5g/L至约10g/L、约2.5g/L至约5g/L、约2.5g/L至约4.5g/L、约5g/L至约30g/L、约5g/L至约25g/L、约5g/L至约20g/L、约5g/L至约16g/L、约5g/L至约10g/L、约5g/L至约5g/L、约5g/L至约4g/L等。在一些培养基制剂或原型培养基制剂中,一种或多种小肽和/或一种或多种二肽可以以约2.5g/L至约8.5g/L的浓度存在于培养基或原型培养基中。此外,本发明的一些实施方案提供了制备在用溶剂再水化/重建时自动地处于期望的pH上的“自动-pH(auto-pH)培养基”或给料粉的方法。根据本发明,此类培养基或给料可以以粉剂形式(干粉(DPM)、高级粉剂(advanced powder)(APM)或高级颗粒化技术(AGT))或以液体形式存在。
通过本发明的方法制备的动物细胞培养基或给料在重建后优选具有约6-8,或约7-8或约6.0-6.3(对于昆虫细胞),更优选约7-7.5或约7.2-7.4,最优选约7.0的pH;通过本发明的方法制备的植物细胞培养基或给料在重建后,优选具有约4-8,优选约4.5-7、5-6或5.5-6,或优选约6.0至6.3的pH。当然,待用于特定细胞类型的给定的培养基的最佳pH还可由本领域技术人员使用本领域已知的方法凭经验确定。
2.细胞培养基
细胞培养基包含许多成分,并且此类成分在不同培养基之间可发生变化。如上文中所指出的,细胞培养基可以为完全制剂,即不需要补充即可培养细胞的细胞培养基,可以为不完全制剂,即需要补充的细胞培养基,或可以为补充物,其可补充不完全制剂或在完全制剂的情况下可改善培养或培养结果。
通常,细胞培养基具有溶解在溶剂中的溶质。溶质提供了平衡跨细胞膜(或壁)的渗透压的渗透力。此外,溶质可给细胞提供营养物。一些营养物为细胞运行的化学燃料;一些营养物可以为细胞用于合成代谢的原料;一些营养物可以为促进细胞代谢的工具,例如酶或载体;一些营养物可以为结合剂,其结合和缓冲用于细胞使用的成分或结合或隔离有害细胞产物。
取决于细胞和细胞的期望的用途,细胞培养基的成分最佳地以经平衡以最优化细胞培养性能的浓度存在。可根据一个或多个期望的特征例如细胞数目、细胞质量、细胞密度、O2消耗、培养成分例如葡萄糖或核苷酸的消费、生物分子的产生、生物分子的分泌、废物或副产物例如代谢产物的形成、对指示剂或信号分子的活性等来测量性能。因此,每一种成分或选择的成分优选最优化至用于期望目的的工作浓度。
本发明的培养基或补料可以以仅需添加溶剂例如水的干燥形式获得。优选,通过选自下述的至少一种方法制备干燥形式的粉剂:研磨、撞击、挤出和切割或粉碎、湿法制粒、高剪力造粒、圆盘造粒和流化床团聚。干燥形式包括但不限于干粉形式(DPM)、团聚(AGTTM)形式、高级粉末培养基(APM)或其它适当的干燥形式。优选,加水后,溶解应当快速发生,并且可过滤所得的液体,并将其直接添加至细胞而不进行任何pH调整。重建的培养基或浓缩补充物可以以可变的大量的量制备,其易于灭菌,特别是通过离子化或紫外照射。
a.碳水化合物
细胞培养基成分通常包括碳水化合物、氨基酸、盐、痕量元素和维生素。对于哺乳动物细胞,细胞培养基中使用的主要碳水化合物为葡萄糖,常规地以5至25nM补充。参见Cell Culture Technology for Pharmaceutical and Cell-Based Therapies,51(Sadettin Ozturk和Wei-Shou Hu eds.,Taylor and Francis Group 2006)。除了葡萄糖外,还可使用任何己糖如半乳糖、果糖或甘露糖或此类糖的组合。此外,哺乳动物细胞还可将谷氨酰胺用作主要能源。通常以比其它氨基酸更高的浓度(2-8mM)包含谷氨酰胺。然而,如上文中所指出的,谷氨酰胺可自发地分解以形成氨,并且某些细胞系更快地产生氨,而氨是有毒的。因此,谷氨酸和谷氨酰胺二肽已被用作谷氨酰胺的替代物来减少有毒的氨在细胞培养基中的积累。
b.氨基酸
氨基酸在细胞培养基中对于维持培养的细胞的代谢功能是非常重要的。细胞培养基通常包含必需氨基酸(即,通常不能由哺乳动物在体内合成的那些氨基酸)以及某些非必需氨基酸。非必需氨基酸通常包含在细胞培养基中,如果细胞系不能合成该氨基酸或如果细胞系不能产生足够量的该氨基酸来支持最大生长的话。示例生氨基酸包括L-丙氨酸、L-精氨酸、L-天冬酰胺、L-天冬氨酸、L-半胱氨酸、L-谷氨酸、L-谷氨酰胺、甘氨酸、L-组氨酸、L-异亮氨酸、L-亮氨酸、L-赖氨酸、L-甲硫氨酸、L-苯丙氨酸、L-脯氨酸、L-羟脯氨酸、L-丝氨酸、L-苏氨酸、L-色氨酸、L-酪氨酸和L-缬氨酸。
c.盐
将盐添加至细胞培养基中以维持等渗条件和防止渗透不平衡。标准哺乳动物细胞培养基的重量摩尔渗透压浓度为约300mOsm/kg,虽然许多细胞系可耐受该值的约10%的变化。一些昆虫细胞培养物的重量摩尔渗透压浓度倾向于高于300mOsm/kg,其可以比300mOsm/kg高0.5%、1%、2-5%、5-10%、10-15%、15-20%、20-25%、25-30%。细胞培养基中最常用的盐包括Na+、K+、Mg2+、Ca2+、Cl-、SO42-、PO43-和HCO3-(例如,CaCl2、KCl、NaCl、NaHCO3、Na2HPO4)。因此,用于培养特定细胞类型的细胞培养基的期望的重量摩尔渗透压浓度还可由本领域技术人员使用本领域已知的方法凭经验来进行确定。
d.无机元素
以痕量存在于血清中的其它无机元素可包含在细胞培养基中,如US2005/0287666(其通过引用整体并入本文)中所描述的。它们包括Mn、Cu、Zn、Mo、Va、Se、Fe、Ca、Mg、Si和Ni。已被添加至细胞培养基的其它无机元素,虽然不经常,包括Al、Ag、Ba、Br、Cd、Co、Cr、F、Ge、J、Rb和Zr。此类元素中有许多参与酶促活性。它们可以以盐的形式例如CaCl2、Fe(N03)3、MgCl2、MgSO4、MnCl2、NaCl、NaHCO3、Na2HPO4,以及痕量元素例如硒、钒和锌的离子形式提供。此类痕量元素可以以多种形式,优选以盐的形式例如Na2SeO3、NH4VO3等提供。此类无机盐和痕量元素可以例如从Sigma(Saint Louis,Missouri)商购获得。
e.维生素
维生素通常被细胞用作辅因子。各种细胞系的维生素需求变化极大,然而,如果细胞培养基几乎不包含或不包含血清或如果细胞以高密度生长,则通常需要额外的维生素。示例性维生素包括生物素、氯化胆碱、叶酸、i-肌醇、烟酰胺、D-Ca++-泛酸盐、吡哆醛、核黄素、硫胺素、吡多辛、烟碱酰胺、A、B6、B12、C、D3、E、K和对-氨基苯甲酸(PABA)。
f.血清
血清,凝固的血液的上清液,可用于细胞培养基以提供促进细胞生长和/或生产率的组分。此类血清组分包括粘附因子、微量营养物(例如,痕量元素)、生长因子(例如,激素、蛋白酶)和保护性元素(例如,抗毒素、抗氧化剂、抗蛋白酶)。血清可从多种动物来源包括牛或猪获得。当被包含在细胞培养基中时,通常以5-10%的浓度添加血清。某些细胞培养基是不含血清的。
g.生长因子
为了在血清不存在或血清减少的培养基中促进细胞生长,可将下列多肽的一种或多种添加至细胞培养基:例如,成纤维细胞生长因子(FGF),包括酸性FGF和碱性FGF、胰岛素、胰岛素样生长因子(IGF)、表皮生长因子(EGF)、神经生长因子(NGF)、血小板衍生生长因子(PDGF)和转化生长因子(TGF),包括TGFα和TGFβ、任何细胞因子例如白细胞介素1、2、6、粒细胞刺激因子、白细胞抑制因子(LIF)等。
在某些实施方案中,细胞培养基不包含生长因子。在不含蛋白质的培养基中,可用锌或含锌化合物替代胰岛素,如WO 98/08934(其通过引用整体并入本文)中描述的。
h.脂质
还可将一种或多种脂质添加至细胞培养基中。血清通常包含脂质,例如脂肪酸(例如,亚油酸、亚麻酸、花生四烯酸、棕榈油酸、油酸、多烯酸和/或脂肪酸(具有12、14、16、18、20或24个碳原子,每一个碳原子是分支或不分支的))、磷脂、卵磷脂(磷脂酰胆碱)和胆固醇。或者,可将此类脂质的一种或多种作为补充物包含在无血清培养基中。磷脂酸和溶血磷脂酸刺激某些贴壁依赖性细胞例如MDCK、小鼠上皮细胞和其它肾细胞系的生长,然而磷脂酰胆碱、磷脂酰乙醇胺和磷脂酰肌醇刺激人成纤维细胞在无血清培养基中的生长。还已显示乙醇胺和胆固醇促进某些细胞系的生长。在某些实施方案中,细胞培养基不包含脂质。
i.载体蛋白质
还可将一种或多种载体蛋白质例如牛血清白蛋白(BSA)或转铁蛋白添加至细胞培养基。载体蛋白质可帮助某些营养物或痕量元素的转运。BSA通常用作脂质例如亚油酸和油酸(其在水溶液中是不溶性的)的载体。此外,BSA还可用作某些金属例如Fe、Cu和Ni的载体。在无蛋白质制剂中,可将非动物来源的BSA替代物例如环糊精用作脂质载体。转铁蛋白参与将铁运输穿过细胞膜。在某些情况下,人血清白蛋白可以是期望产生用于下游治疗用途的产物的细胞培养(例如无异物(XF)培养)所必需的。在其它情况下,重组人血清白蛋白可用于细胞培养基中用于培养细胞。在具体情况下,重组人血清白蛋白可来源于植物、藻类或真菌来源例如稻、玉米、马铃薯、小麦、甚至酵母等,以提供细胞的无动物源(animal-origin free,AOF)培养。在无蛋白质制剂中,可用高铁和/或亚铁盐(如WO 98/08934(其通过引用整体并入本文)中所描述的),或羟基吡啶衍生物(如US 2007/0254358(其通过引用整体并入本文)中所描述的)替代转铁蛋白。此外,在无蛋白质制剂中,胰岛素可用锌、钒或其它适当的二价盐替代。
j.粘附蛋白
还可将一种或多种粘附蛋白例如纤连蛋白、层粘连蛋白和pronectin添加至细胞培养基以帮助促进贴壁依赖性细胞至基底的附着。
k.缓冲剂
细胞培养基可任选地包括一种或多种缓冲剂。适当的缓冲剂包括但不限于N-[2-羟乙基]-哌嗪-N'-[2-乙磺酸](HEPES)、MOPS、MES、磷酸盐、碳酸氢盐及适用于细胞培养应用的其它缓冲剂。适当的缓冲剂为提供缓冲能力而无对培养的细胞的明显细胞毒性的缓冲剂。适当的缓冲剂的选择在细胞培养领域的技术人员的能力范围内。
l.聚阴离子或聚阳离子化合物
聚阴离子或聚阳离子化合物可阻止细胞团聚并且促进细胞悬浮生长。参见WO 98/08934,其通过引用整体并入本文。示例性聚阴离子化合物包括多磺化(polysulfonated)或多硫酸化(polysulfated)化合物例如肝素、硫酸葡聚糖、硫酸肝素、硫酸皮肤素、硫酸软骨素、多硫酸戊聚糖酯、蛋白聚糖等。
除了本文中描述的小肽或二肽外,细胞培养基还包含一种或多种成分,例如上文所列的成分。在一个实施方案中,细胞培养基包含一种或多种小肽或一种或多种二肽(如上文中描述的),且任选地包含下列成分的一种或多种:乙醇胺、D-葡萄糖、HEPES、胰岛素、细胞因子(例如,IL-6)、肝素、硫酸葡聚糖、亚油酸、硫辛酸、酚红、F68、腐胺、丙酮酸钠、转铁蛋白、L-丙氨酸、L-精氨酸、L-天冬酰胺、L-天冬氨酸、L-半胱氨酸、L-谷氨酸、L-谷氨酰胺、甘氨酸、L-组氨酸、L-异亮氨酸、L-亮氨酸、L-赖氨酸、L-甲硫氨酸、L-苯丙氨酸、L-脯氨酸、L-丝氨酸、L-苏氨酸、L-色氨酸、L-酪氨酸、L-缬氨酸、生物素、氯化胆碱、D-Ca++-泛酸盐、叶酸、i-肌醇、烟酰胺、吡多辛、核黄素、硫胺素、维生素B12、一种或多种钙盐、Fe(NO3)3、KCl、一种或多种镁盐、一种或多种锰盐、NaCl、NaHCO3、Na2HPO4、一种或多种硒盐、一种或多种钒盐以及一种或多种锌盐。在一个实施方案中,一种或多种二肽选自X-酪氨酸、X-半胱氨酸、酪氨酸-X和半胱氨酸-X或其盐,其中X为任意氨基酸,并且其中二肽的N-末端氨基酸具有游离氨基。在一个实施方案中,X为丙氨酸或甘氨酸。在另一个实施方案中,X为丝氨酸、缬氨酸、脯氨酸、天冬氨酸或谷氨酸。
本文中描述的培养基可以为1X制剂或可被浓缩为任何大于1X的制剂,例如2X、5X、10X、20X、50X、500X或1000X培养基制剂,只要单独的组分的溶解度允许。如果将单独的培养基成分制备为单独的浓缩液,则将适当(充足)量的每一种浓缩物与稀释剂组合以产生1X培养基制剂。通常,所使用的稀释剂为水,但也可使用其它溶液,包括含水缓冲液、含水盐溶液或其它水溶液。
还可以以不同的形式例如干粉培养基、颗粒制剂(其需要添加水,但不需要其它处理,例如调节pH)、液体培养基或以培养基浓缩物的形式来制备本文中描述的培养基。
3.无血清培养基
与血清相关的潜在问题,包括批次间的变化、高蛋白质含量、污染物(例如,病毒、支原体、朊病毒)的风险、有限的可获得性和高成本,已驱动无血清培养基的生产。此外,与在补充有血清的培养基中生长的细胞中观察到的表达水平相比,可从在无血清培养基中生长的细胞获得升高水平的重组蛋白质表达(Battista,P.J.等人,Am.Biotech Lab.12:64-68(1994))。
在此类无血清培养基中,血清可用确定的激素或激素混合物例如HITES或ITES(其包含氢化可的松、胰岛素、转铁蛋白、乙醇胺和亚硒酸盐)来替代。或者,无血清培养基可包含来自内分泌腺的生长因子提取物,例如表皮生长因子或成纤维细胞生长因子。无血清培养基还可包含其它组分作为血清的替代物,包括纯化的蛋白质(动物或重组的)、胨类、氨基酸、无机盐和动物或植物水解产物(或其级分)。
无血清培养基可以是化学成分明确的或不明确的。在化学成分明确的培养基中,组分的身份及其量是已知的,然而对于化学成分不明确的培养基而言,情况则相反。因此,化学成分确定的培养基部分被设计用于减少污染物的风险和减少批次间的变化。可被添加至细胞培养基中的化学成分确定的补充物包括生长因子、激素、载体蛋白质和/或粘附因子。在优选实施方案中,与包含小肽的培养基或给料一起使用的基础培养基为化学成分明确的培养基。在另一个优选实施方案中,包含小肽的本发明的浓缩细胞培养基或浓缩给料也为化学成分明确的组合物。在另一个优选实施方案中,包含含有半胱氨酸和酪氨酸的小肽的本发明的浓缩给料或培养基为单部分给料并且为化学成分明确的。在另一个方面,包含含有半胱氨酸和酪氨酸的小肽的所有上述组合物为自动-pH和自动-重量摩尔渗透压浓度平衡的。在另一个方面,包含含有半胱氨酸和酪氨酸的小肽的所有上述组合物是化学计量平衡的。
4.无蛋白质培养基
无血清培养基与含血清的细胞培养基相比,包含减少量的蛋白质。然而,无血清培养基可能仍然包含多种动物来源的组分(包括白蛋白、胎球蛋白、各种激素和其它蛋白质)中的一种或多种。蛋白质的存在使得重组蛋白质的纯化变得非常困难,耗时和昂贵,并且还可导致减少的产物得率和/或纯度。因此,在一个实施方案中,细胞培养基不含蛋白质。
可通过本领域已知的方法,例如通过从无血清培养基中除去任何残留的蛋白质来获得无蛋白质培养基。虽然从细胞培养基中除去此类蛋白质可削弱培养基支持细胞生长的能力,但可将其它组分添加至培养基以缓解从培养基中除去蛋白质的影响。例如,如上所论述的,环糊精可替代BSA,铁盐或羟基吡啶衍生物可替代转铁蛋白。在其它情况下,动物组织或植物水解产物(或其级分)已被用于补充无蛋白质培养基。
5.分批补料培养(Fed-Batch Cultivation)
细胞的分批补料培养通常用于生物分子例如蛋白质的工业生产,以增加细胞浓度和延长培养期限,获得高产物浓度和容积生产率(volumetric productivity)。分批补料培养包括,以可包含被细胞快速利用的营养物例如葡萄糖、氨基酸的给料的形式将一种或多种营养物受控地添加至基础培养基。营养物通过尝试防止营养物耗尽和副产物积累,使重要参数例如pH、重量摩尔渗透压浓度和CO2浓度在促进细胞生长或最小化细胞死亡(以进行最佳产物表达)的水平内来帮助控制细胞培养物的生长。参见Cell Culture Technology for Pharmaceutical and Cell-Based Therapies,349-386(Sadettin Ozturk和Wei-Shou Hu eds.,Taylor and Francis Group 2006)。尽管如此,分批补料培养通常导致最终与细胞生存不相容的高浓度的抑制性代谢产物和高重量摩尔渗透压浓度。
基础培养基通常用于细胞培养的维持,并且可包括许多成分,包括氨基酸、维生素、有机和无机盐、糖和其它组分,每一种成分以支持细胞体外培养的量存在。用于原核细胞培养包括细菌和古细菌(archebacterial)培养、病毒培养、植物细胞培养、昆虫细胞培养、哺乳动物细胞培养的基础培养基可与小肽一起使用。基础培养基的实例包括伊格尔基础培养基(BME)、伊格尔最小必需培养基(Eagle's minimal essential medium,EMEM)、达尔伯克改良伊格尔培养基(Dulbecco's modification of Eagle's medium,DMEM)、格拉斯哥改良伊格尔培养基(Glasgow's modification of Eagle's medium,GMEM)、Joklik's改良伊格尔培养基、阿尔法改良伊格尔培养基(Alpha modified Eagle's medium)、Roswell Park Memorial Institute(RPMI)培养基、Fischer's培养基、Leibovitz L-15培养基、Trowell's T-8培养基、Williams'培养基E、Biggers'培养基、Connaught Medical Research Laboratories(CMRL)1066培养基、Ham's F10培养基、Ham's F12培养基、Iscove'改良达尔伯克培养基(IMDM)、MCDB 104、MCDB 110、MCDB 153、培养基199、NCTC 135培养基和Waymouth's培养基MB 752/1。对于CHO细胞,优选的基础培养基包括CD CHO、CD OptiCHOTM和CD FortiCHOTM(全都来自Life Technologies,Corp.,Carlsbad,CA)。CHO细胞的优选浓缩补料包括但不限于CHO CD EfficientFeedTM A(Invitrogen Cat.No.A1023401)、CHO CD EfficientFeedTM B(Invitrogen Cat.No.A1024001)、CHO CD EfficientFeedTM试剂盒(Invitrogen Cat.No.A1024101)、CD EfficientFeedTM C AGTTM(Invitrogen Cat.No.A1327501,Life Technologies Corp.,Carlsbad,CA)。
在分批补料培养时,细胞通常使用基础培养基以分批模式生长至某个时间点。随后,添加包含单个或多个营养物的浓缩液的培养基补充物(浓缩给料)以提供营养物,同时使体积增加或培养物稀释减小至最小。当将培养基补充物添加至基础培养基时,其促进细胞培养,如例如通过更快速的细胞生长、减少的倍增时间、更高的细胞可达到的密度或更高的生物分子(例如蛋白质例如抗体或其它具有治疗益处的蛋白质)的产量或产率所显示的。
适用于补充基础培养基的本发明的细胞培养基或浓缩给料包含一种或多种小肽(包括一种或多种二肽),如本文中所描述的。包含半胱氨酸和酪氨酸的细胞培养基或浓缩给料可以任选地与另一种给料,比如说氨基酸的浓缩混合物结合使用,所述混合物可包含下列成分的一种或多种:腺嘌呤、乙醇胺、碳水化合物源(例如己糖如葡萄糖、甘露糖、半乳糖、果糖或甚至其组合)、肝素、缓冲剂、氢化可的松、硫辛酸、酚红、磷酸乙醇胺、腐胺、丙酮酸钠、三碘化甲腺氨酸(tri-iodothyronine)、胸苷、L-丙氨酸、L-精氨酸、L-天冬酰胺、L-天冬氨酸、L-半胱氨酸、L-谷氨酸、L-谷氨酰胺、甘氨酸、L-组氨酸、L-羟基脯氨酸、L-异亮氨酸、L-亮氨酸、L-赖氨酸、L-甲硫氨酸、L-苯丙氨酸、L-脯氨酸、L-丝氨酸、L-苏氨酸、L-色氨酸、L-酪氨酸、L-缬氨酸、N-乙酰基-半胱氨酸、生物素、氯化胆碱、D-Ca++-泛酸盐、叶酸、i-肌醇、烟酰胺、吡多辛、核黄素、硫胺素、维生素B12、Pluronic F68、重组胰岛素、钙盐、CuSO4、FeSO4、FeCl3、Fe(NO3)3、KCl、镁盐、锰盐、醋酸钠、NaCl、NaHCO3、Na2HPO4、Na2SO4、硒盐、硅盐、钼盐、钒盐、镍盐、锡盐、ZnCl2、ZnSO4或其它锌盐。
因此,用于补充基础培养基的氨基酸的浓缩混合物可由氨基酸的化学计量平衡的混合物组成,可以包含或可以不包含半胱氨酸和酪氨酸,并且可任选地包含如下物质的一种或多种:碳源、维生素、痕量元素,并且还可以是化学成分明确的,其不包含任何脂质、水解产物或生长因子。在一些情况下,氨基酸的浓缩混合物可包含非动物源水解产物或水解产物的级分,例如植物水解产物。可使用任何商购可得的氨基酸的浓缩混合物,例如,CHO CD EfficientFeedTM A(Invitrogen Cat.No.A1023401)、CHO CD EfficientFeedTM B(Invitrogen Cat.No.A1024001)、CHO CD EfficientFeedTM试剂盒(Invitrogen Cat.No.A1024101)、CD EfficientFeedTM C AGTTM(Invitrogen Cat.No.A1327501,Life Technologies Corp.,Carlsbad,CA)。
在一个实施方案中,适用于补充基础培养基的包含半胱氨酸和酪氨酸的本发明的细胞培养基或浓缩给料不含蛋白质。在另一个实施方案中,适用于补充基础培养基的本发明的细胞培养基或浓缩给料不含蛋白质,并且额外地不包含脂质、水解产物或其级分、或生长因子,从而被认为是化学成分明确的(CD)。在本实施方案的一个方面,包含半胱氨酸和酪氨酸的本发明的细胞培养基或浓缩给料可任选地包含如下物质的一种或多种:碳源、维生素、痕量元素,并且还可以是化学成分明确的,其不包含任何脂质、水解产物或生长因子。
6.细胞
还可将本文中描述的包含含有半胱氨酸和酪氨酸的小肽或二肽的培养基用于培养各种细胞。使用本文中描述的培养基和给料培养的细胞可来源于任何原核生物包括古细菌、藻类、酵母、真菌、植物、昆虫、动物,优选哺乳动物和最优选小鼠或人。在一个实施方案中,将培养基用于培养真核细胞,包括植物或动物细胞,例如哺乳动物细胞、鱼细胞、昆虫细胞、两栖动物细胞或禽类细胞。
可用本文中描述的培养基培养的哺乳动物细胞包括原代上皮细胞(例如,角质形成细胞、宫颈上皮细胞、支气管上皮细胞、气管上皮细胞、肾上皮细胞和视网膜上皮细胞)和已建立的细胞系及其株系(例如,293胚肾细胞、BHK细胞、HeLa宫颈上皮细胞和PER-C6视网膜细胞、MDBK(NBL-1)细胞、911细胞、CRFK细胞、MDCK细胞、CHO细胞、BeWo细胞、Chang细胞、Detroit 562细胞、HeLa 229细胞、HeLa S3细胞、Hep-2细胞、KB细胞、LS180细胞、LS174T细胞、NCI-H-548细胞、RPMI 2650细胞、SW-13细胞、T24细胞、WI-28VA13,2RA细胞、WISH细胞、BS-C-I细胞、LLC-MK2细胞、Clone M-3细胞、1-10细胞、RAG细胞、TCMK-1细胞、Y-1细胞、LLC-PK1细胞、PK(15)细胞、GH1细胞、GH3细胞、L2细胞、LLC-RC 256细胞、MH1C1细胞、XC细胞、MDOK细胞、VSW细胞和TH-I,B1细胞或其衍生物)、来自任何组织或器官的成纤维细胞(包括但不限于心脏、肝、肾、结肠、肠、食道、胃、神经组织(脑、脊髓)、肺、血管组织(动脉、静脉、毛细血管)、淋巴组织(淋巴腺、腺组织、扁桃体、骨髓和血液)、脾和成纤维细胞以及成纤维细胞样细胞系(例如,CHO细胞、TRG-2细胞、IMR-33细胞、Don细胞、GHK-21细胞、瓜氨酸血症细胞、Dempsey细胞、Detroit 551细胞、Detroit 510细胞、Detroit 525细胞、Detroit 529细胞、Detroit 532细胞、Detroit 539细胞、Detroit 548细胞、Detroit 573细胞、HEL 299细胞、IMR-90细胞、MRC-5细胞、WI-38细胞、WI-26细胞、MiCl1细胞、CHO细胞、CV-1细胞、COS-1细胞、COS-3细胞、COS-7细胞、Vero细胞、DBS-FrhL-2细胞、BALB/3T3细胞、F9细胞、SV-T2细胞、M-MSV-BALB/3T3细胞、K-BALB细胞、BLO-11细胞、NOR-10细胞、C3H/IOTI/2细胞、HSDM1C3细胞、KLN2O5细胞、McCoy细胞、小鼠L细胞、株系2071(小鼠L)细胞、L-M株(小鼠L)细胞、L-MTK-(小鼠L)细胞、NCTC克隆2472和2555、SCC-PSA1细胞、Swiss/3T3细胞、印度黄麂细胞、SIRC细胞、CII细胞和Jensen细胞、Sp2/0、NS0、NS1细胞或其衍生物)。
根据本文中公开的方法培养的细胞可以为正常细胞、患病细胞、转化的细胞、突变体细胞、体细胞、基因工程改造的细胞、生殖细胞、干细胞、前体细胞或胚胎细胞,任何所述细胞可以是已建立的或转化的细胞系或获自天然来源。细胞可用于实验目的或用于产生有用的组分。在某些情况下,培养的细胞本身为产物,细胞用于细胞疗法。还可培养细胞以进行蛋白质产生,包括抗体产生,小RNA产生(如miRNA或siRNA),病毒或VLP(病毒样颗粒)产生,DNA或病毒载体的产生和分离,核酸产生,维生素产生,期望的代谢产物,生物燃料合成等。在一个实施方案中,将本文中描述的培养基用于培养中国仓鼠卵巢(CHO)细胞。CHO细胞已被分类为来源于中国仓鼠卵巢的上皮和成纤维细胞。始于中国仓鼠卵巢的细胞系(CHO-K1)(Kao,F.-T.和Puck,T.T.,Proc.Natl.Acad.Sci.USA 60:1275-1281(1968)已培养多年。目前,大多数生物制药公司因为许多有利方面(细胞系具有精确的翻译后修饰例如人样糖基化模式和低风险的人病毒传播)而在CHO细胞中产生蛋白质。
7.细胞的培养
可按照研究者确定的实验条件培养由本文中描述的培养基支持的细胞。下文中的实施例显示,用于培养某些哺乳动物细胞的有功能的至少一组培养条件。然而,应理解,可由本领域技术人员仅使用常规实验来确定给定的动物细胞类型的最佳涂铺和培养条件。关于常规单层培养条件,可通过使用本文中描述的细胞培养基,将细胞涂铺在无粘附因子的培养容器的表面上。或者,可用天然的、重组的或合成的粘附因子或肽片段(例如,胶原、纤连蛋白、玻连蛋白、层粘连蛋白等,或其天然或合成的片段)预包被容器,所述粘附因子或肽片段可例如从LifeTechnologies,Corp.(Carlsbad,CA)、R&D Systems,Inc.(Rochester,Minnesota)、Genzyme(Cambridge,Massachusetts)和Sigma(St.Louis,Missouri)商购获得。还可将细胞接种至天然或合成的三维支持基质例如预制胶原凝胶或合成的生物聚合物材料中或其上。对于悬浮培养,通常将细胞悬浮于本文中描述的培养基中,并且导入促进细胞悬浮培养的培养容器例如旋转瓶、灌注器或生物反应器。参见Cell Culture Technology for Pharmaceutical and Cell-Based Therapies,156-174(Sadettin Ozturk和Wei-Shou Hu eds.,Taylor and Francis Group 2006)。在一些情况下,培养基和悬浮细胞的一定水平的搅拌是必需的。可将搅拌降至最低程度以避免培养基组分的变性和培养过程中细胞的剪切。
可针对所使用的特定培养条件最优化每一个实验条件的细胞接种密度。对于塑料培养容器中的常规单层培养,1-5x105个细胞/cm2的初始接种密度可以是优选的,然而对于悬浮培养,可使用更高的接种密度(例如,5-20x105个细胞/ml)。
通常将哺乳动物细胞培养在细胞培养箱中,优选在约37℃(但其可以是30℃与39℃之间的任何温度)下。非哺乳动物细胞可具有其它优选的培养温度。可逐步进行哺乳动物和非哺乳动物细胞的培养,例如在一个温度下进行最佳细胞生长,而在另一个温度下进行最佳蛋白质/肽/片段或病毒的产生。培养箱大气可以是潮湿的并且其可在空气中含约3-10%的二氧化碳,更优选在空气中包含约5-10%的二氧化碳,最优选在空气中包含约3-8%的二氧化碳,尽管某些细胞系的培养可能在空气中需要多至20%的二氧化碳来获得最佳结果。取决于细胞类型,细胞培养基pH可在例如约6-8.5,优选约7.1至7.6,或优选约7.1至7.4,或更优选约7.1至7.3或优选约6-6.3(对于昆虫细胞)的范围内。
当细胞达到约1.5-2.0x106个细胞/ml的密度时,闭合培养或分批培养中的细胞应当经历完全培养基更换(即,用新鲜培养基替代消耗的培养基)。灌注培养中(例如,生物反应器或发酵罐中)的细胞将以连续再循环的方式接受新鲜培养基。
8.病毒的产生
除了以悬浮或单层培养形式培养细胞外,本发明的培养基还可用于从哺乳动物细胞产生病毒的方法。此类方法包括(a)在适合于促进病毒感染细胞的条件下将细胞(例如,哺乳动物细胞)与病毒接触;和(b)在适合于促进细胞产生病毒的条件下在本文中描述的含有小肽或二肽的细胞培养基中培养细胞。可在培养基中培养细胞之前、期间或之后将细胞与病毒接触。用病毒感染哺乳动物细胞的最佳方法是本领域公知的,并且对于本领域技术人员来说是熟知的。与在除本文中描述的细胞培养基之外的细胞培养基中培养的细胞相比,在本文中描述的培养基中培养的病毒感染的哺乳动物细胞可预期产生更高的病毒滴度(例如,2、3、5、10、20、25、50、100、250、500或1000倍的滴度)。
此类方法可用于产生各种哺乳动物病毒或适合于感染哺乳动物细胞的病毒、病毒样颗粒和病毒载体,包括但不限于腺病毒及其衍生物、腺伴随病毒及其衍生物、逆转录病毒及其衍生物、慢病毒及其衍生物、昆虫病毒如杆状病毒及其衍生物、仙台病毒及其衍生物等。在本文中描述的培养基中培养被感染的细胞后,使用的包含病毒(其可以是重组病毒、病毒载体、病毒颗粒或其组分(蛋白质和/或核酸(DNA和/或RNA)))的培养基可用于各种目的,包括疫苗产生、抑制性RNA分子如miRNA、siRNA等的产生、用于细胞转染或基因疗法的病毒载体的产生、动物或细胞培养物的感染、病毒蛋白质和/或核酸的研究等。或者任选地,可按照本领域技术人员熟知的用于蛋白质和/或核酸分离的技术,从使用的培养基中分离病毒、病毒载体、病毒颗粒或其组分。
在一个实施方案中,细胞产生VLP。“VLP”或“病毒样颗粒”为用于将一种或多种化合物包括生物学材料例如脂质、碳水化合物、蛋白质和核酸递送至细胞内的载体。可利用VLP递送的其它化合物包括染料(例如,荧光染料)、标记(例如,荧光或放射性标记)和药物(例如,抗生素或抗病毒剂)。VLP通常包含至少一种病毒蛋白质。通常,病毒蛋白质包围化合物。然而,在具体情况下,除了包含在VLP中外,还可利用其它方法将待递送的化合物与VLP结合。例如,可将化合物连接(例如,共价地或非共价地连接)于病毒蛋白质,或可将其整合入包膜(当存在时)。在一个方面,可将VLP与各种类型的核酸(例如,异源核酸)例如DNA、RNA、RNA和DNA、或RNA/DNA杂交体或本领域已知的衍生物结合。VLP的实例包括,使用VIRAPOWERTM腺病毒和慢病毒载体试剂盒(参见,例如,Invitrogen Corporation,cat.nos.K4930-00、K4940-00、K4950-00、K4955-00、K4960-00、K4965-00、K4967-00和K4985-00)产生的病毒颗粒产物。
可用于制备VLP的病毒包括例如,噬菌体(例如,T偶噬菌体(例如,T4噬菌体等)、T奇噬菌体(例如,T7噬菌体等)、噬菌体phi29、λ噬菌体等)、杆状病毒、腺病毒、腺伴随病毒、慢病毒(例如,Moloney鼠白血病病毒、HIV1、HTLV-III等)、仙台病毒、痘病毒和甲病毒(例如,西门利克森林病毒(Semliki Forest Virus)、辛德比斯病毒(SindBisVirus)等)。可用于制备VLP的病毒的其它实例以及用于制备VLP的方法描述于本文中的其它地方。
9.重组蛋白质的产生
本培养基还可用于从上述细胞,优选哺乳动物细胞,特别地悬浮生长的哺乳动物细胞产生重组蛋白质的方法中。因为本发明的培养基提供哺乳动物细胞的快速高密度悬浮培养,因此本方法有利于增强重组蛋白质的产生。蛋白质意指全长蛋白质、蛋白质片段、肽、切割的蛋白质产物、交联的蛋白质产物、标记的肽或蛋白质等。蛋白质还指所有类型的天然和改变的蛋白质,包括重组蛋白质、突变体蛋白质、工程改造的蛋白质、嵌合蛋白质、糖蛋白、脂蛋白、活性蛋白质、加工的蛋白质等。蛋白质可由细胞或细胞系天然表达,或可使用本领域已知的标准基因工程方法对细胞系进行工程改造以表达其,所述方法包括但不限于转染、转导、电穿孔等。可将所得的蛋白质或肽纯化或分离至期望的纯度水平。可使用本发明的培养基和/或给料组合物产生或表达的蛋白质或肽或其片段包括但不限于,细胞外蛋白质如层粘连蛋白、纤连蛋白、整联蛋白等,酶如半胱氨酸天冬氨酸蛋白酶、蛋白酶、枯草杆菌蛋白酶、激酶、RNA酶、DNA酶等,肽激素如胰岛素、PTHrP等,细胞内蛋白质包括膜蛋白、受体、核蛋白、内质网蛋白等,抗体,任何抗体片段如抗体的重链或轻链、抗原结合位点或基序、嵌合抗体等。嵌合抗体可以是物种间嵌合抗体或类型间嵌合抗体。可使用本发明的组合物和培养基/给料产生的表达的蛋白质或多肽可以为人或哺乳动物来源的蛋白质序列,所述蛋白质序列在非动物细胞系如植物细胞中表达,以产生用于下游治疗用途的不含动物源的蛋白质,该蛋白质不含偶生试剂(adventitious agent)。
根据本发明的产生多肽的方法包括,在适合于细胞表达多肽的条件下在本文中描述的含有小肽或二肽的细胞培养基中培养已经历基因工程改造以产生多肽的细胞(例如,哺乳动物细胞)。用于基因工程改造哺乳动物细胞以表达目标多肽的最佳方法在本领域内是公知的并且从而是本领域技术人员熟知的。参见,例如,Cell Culture Technology for Pharmaceutical and Cell-Based Therapies,15-40(Sadettin Ozturk和Wei-Shou Hu eds.,Taylor and Francis Group 2006)。可在本发明的培养基中培养之前对细胞进行基因工程改造,或可在被置于所述培养基中培养之后用一种或多种外源核酸分子转染它们。可按照上述方法将基因工程改造的细胞在本发明的培养基中培养为单层培养物,或更优选培养为悬浮培养物。在培养细胞后,可任选地按照本领域技术人员熟知的蛋白质分离技术从细胞和/或使用的培养基中纯化目标多肽。
10.在培养基中或浓缩给料中检测小肽
可使用本领域已知的用于检测氨基酸和/或小肽的任何技术检测本文中描述的小肽和二肽,所述技术包括但不限于酸水解、液相色谱、毛细管电泳(Brown等人,J.Chrom.(1994)A,661:279-285)、HPLC(van Wandelen等人,J.Chrom.(1997)A,763:11-22)或质谱法。用于氨基酸组成和浓度的色谱分析的肽的酸水解在本领域是公知的。酸水解之前和之后的氨基酸峰的色谱图谱的比较可指示培养基、给料或补充物中氨基酸和从而小肽的组成和浓度。例如,如果酪氨酸存在于培养基中的小肽中,则与酸水解前的相同培养基样品的峰高度/面积相比,其浓度在培养基样品的酸水解产物中增加(例如,酪氨酸的峰高度和/或峰面积)。
例如,使用Wandelen等人,J.Chrom.(1997)A,763:11-22中描述的方法检测本文中描述的丙氨酰酪氨酸和丙氨酰半胱氨酸二肽,所述方法包括在AccQ-Tag UltraTM(Waters Corp.,Milford,MA)柱(2.1x100mm,1.7μm)上HPLC(高效液相色谱)分离6-氨基喹啉基-N-羟基琥珀酰亚胺基氨基甲酸酯(AQC)-衍生化的氨基酸混合物。如下设置检测器参数:波长模式:单波长;波长:260nm;取样速度:20(点/秒);时间常数:0.4000(秒)。通过使用这些参数,在示例性运行中,丙氨酰酪氨酸二肽样品具有约6.172分钟的峰洗脱时间(参见图2),正好在内部标准(AABA)之后;在另一个示例性运行中,丙氨酰半胱氨酸二肽样品具有6.631分钟的峰洗脱速率,在赖氨酸与酪氨酸之间(参见图3)。
因此,该利用超高效液相色谱(UPLC)法的AccQ-TagTM Ultra(Waters Corp.,Milford,MA)Pre-Column Derivatization提供了一种这样的方法,其测试任何样品培养基或补料以观察其是否包含含有半胱氨酸或酪氨酸的小肽,例如二肽丙氨酰酪氨酸或丙氨酰半胱氨酸。相同的方法还可用于检测其它小肽,包括其它目标二肽。
此外,本文中描述的二肽还可使用液相色谱伴质谱检测(LC/MS)进行定量。利用偶联至四极飞行时间质谱仪(SYNAPTTM HDMSTM System,Milford,MA)的反相液相色谱柱(AcquityHSS T3 1.8-μm,2.1-mm i.d x 150-mm,于40℃)进行分离。全氟化羧酸(例如,全氟戊酸)用作离子配对剂用于极性化合物的最佳分离(Jun Qu,Yiming Wang,Guan Luo,Zhuping Wu和Chengdui Yang,Anal.Chem.,2002,74,2034-2040;通过引用整体并入本文)。流动相-A为水中的0.1%甲酸和0.05%全氟戊酸,流动相-B为80%乙腈中的0.1%甲酸和0.05%全氟戊酸。所有试剂均为LC/MS级的。超高效液相色谱(UPLC)梯度在1-45%的流动相-B上为线性的,以0.4-mL/分钟的流速进行15分钟。以连续正电喷射(+ES)和V-模式在70-1000Da内每0.5秒收集质谱。从总离子色谱提取质子化的L-丙氨酰-L-半胱氨酸二聚体和质子化的L-丙氨酰-L-酪氨酸离子,其分别为383.105(±0.03)Da和253.118(±0.03)Da。质子化的L-丙氨酰-L-半胱氨酸二聚体和质子化的L-丙氨酰-L-酪氨酸离子的滞留时间分别为9.60(±0.03)分钟和8.75(±0.03)分钟(图4至7)。
除非另外定义,否则本文中使用的所有技术和科学术语具有与本领域技术人员通常理解的含义相同的含义。在矛盾的情况下,以本说明书(包括定义)为准。对于相关领域内的技术人员来说很显然的是,可对本文中描述的方法和应用进行其它适当的变动和改变,而不背离本发明或其任何实施方案的范围。此外,材料、方法和实例仅为示例性的而无意为限定性的。本文中提及的所有出版物、专利申请、专利和其它参考资料通过引用整体并入本文。
实施例1:包含二肽的培养基的产生
制备包含二肽丙氨酰酪氨酸(AlaTyr)和丙氨酰半胱氨酸(其形成二硫化物二聚体[AlaCys]2)的示例性细胞培养基。具体地,将二肽,丙氨酰酪氨酸和丙氨酰半胱氨酸作为干粉添加至包含葡萄糖和浓缩氨基酸混合物的含水基础细胞培养基中,将其混合直至溶解。将丙氨酰酪氨酸以约4.0g/L的浓度添加至细胞培养基。将丙氨酰半胱氨酸以约3.0g/L的浓度添加至细胞培养基。二肽在水中的观察的溶解度经测定为约15.4g/L(对于AlaTyr),大于100g/L(对于AlaCys)以及约8.7g/L(对于[AlaCys]2二聚体)。作为比较,L-酪氨酸在水中的溶解度在20℃为约0.38g/L。游离L-半胱氨酸易于被氧化成胱氨酸。盐酸L-半胱氨酸在酸性水溶液中稳定得多,但在中性或碱性水溶液中,其也通过需氧氧化转变成L-胱氨酸。L-胱氨酸在水中的溶解度在25℃为约0.11g/L。
实施例2:分批补料测试
使用产生IgG的CHO细胞进行综合分批补料测试,所述细胞生长在基础细胞培养基CD FortiCHOTM(Invitrogen Cat.No.A-1148301和Custom Stock A-11437DK;Life Technologies Corp.,Carlsbad,CA)中并且补充以葡萄糖(CD FortiCHOTM+葡萄糖;图1:具有实心方块的曲线和正斜杠-填充条块),或补充以具有低水平的半胱氨酸或酪氨酸的浓缩氨基酸混合物与葡萄糖+实施例1中描述的包含二肽(DP)的培养基或给料的混合物(CD FortiCHOTM+aa+DP给料FP2和FP3;参见图1:(FP2)具有实心圆的曲线和空心条块(FP3)具有实心菱形的曲线和反斜杠-填充的条块)。图1中的“aa”是指具有低水平的半胱氨酸或酪氨酸的浓缩氨基酸混合物与葡萄糖的混合物。
研究的其它基础细胞培养基为CD OptiCHOTM,CD CHO;全部来自Life Technologies Corp.,Carlsbad,CA(数据未显示)。所使用的优选培养基为CD FortiCHOTM。示例性浓缩氨基酸混合物为例如CHO CD EfficientFeedTM A(Invitrogen Cat.No.A1023401)、CHO CD EfficientFeedTM B(Invitrogen Cat.No.A1024001)、CHO CD Efficient FeedTM试剂盒(Invitrogen Cat.No.A1024101)、CD Efficient FeedTM C AGTTM(Custom Stock A-11525SA,Life Technologies Corp.,Carlsbad,CA)。本发明的细胞培养基或补料中的包含半胱氨酸和酪氨酸的小肽经设计用于与适合于生长期望的细胞类型的任何示例性基础细胞培养基一起使用,所述基础细胞培养基具有任何示例性化学计量平衡的浓缩氨基酸混合物(aa),任选地具有葡萄糖、维生素、痕量元素等,这可由本领域技术人员来断定。
将细胞生长在具有500mL工作体积的DasGip生物反应器中,使用7.0+/-0.05的pH控制设置点和30%的pO2控制设置点。每当葡萄糖水平达到2g/L时,就给补充有葡萄糖的CHO细胞自动饲喂3g/L的葡萄糖。将补充有二肽(DP)的CHO细胞经历两个给料方案。在第一给料方案中(参见图1,红色曲线和条块:FP2),从第4天至第13天每天给CHO细胞饲喂2%的含二肽的培养基。在第二方案中,(参见图1,绿色曲线和条块:FP3),从第5天至第14天每天给CHO细胞饲喂2%的含二肽的培养基。
与基于CD Opti CHOTM(Life Technologies,Corp.,Carlsbad,CA)或CD CHO(Life Technologies,Corp.,Carlsbad,CA Carlsbad,CA)的分批补料法(数据未显示)相比,生长在CD FortiCHOTM培养基中并且补充有葡萄糖的细胞具有相当的或更好的IgG生产率(1600mg/L)。与第15天时的CD FortiCHOTM+葡萄糖的约1600mg/L的IgG滴度相比,生长在CD FortiCHOTM中且补充有浓缩氨基酸和实施例1的包含二肽的培养基的CHO细胞在12天后具有增强的活力和倍增的生产率水平,到第15天时具有约3200mg/L的IgG滴度(图1)。在用于CD FortiCHOTM+aa+二肽(DP)给料的两个给料方案中,两者都运行良好并且显示相当的IgG生产水平。FP3方案与FP2相比,具有更好地维持的葡萄糖水平和更恒定的IgG生产水平,而FP2方案促进更高的峰细胞密度。值得注意的是,包含二肽的细胞培养基以显著减小的体积给料比例产生增加的细胞密度和生产率水平,从而提供了使用本文中描述的包含二肽的细胞培养基的另一个有利方面。
包含二肽丙氨酰酪氨酸和丙氨酰半胱氨酸的液体细胞培养基或给料溶液可于2-8℃下贮存,保持无沉淀10个月以上,从而对于这样的浓缩液显示了比预期显著更高的液体稳定性。
本文中引用的所有专利、专利申请和公开的参考资料通过引用整体并入本文。虽然已参考优选实施方案具体地显示和描述了本发明,但本领域技术人员理解,可对其中的形式和细节进行各种改变,而不背离由所附权利要求包括的本发明的范围。
本发明的实施方案如下:
1.包含至少一种小肽的细胞培养基,所述小肽包含至少2个氨基酸,其中至少一个氨基酸为半胱氨酸或酪氨酸。
2.实施方案1的细胞培养基,其中所述小肽的其余氨基酸中的至少一个选自丙氨酸、甘氨酸、丝氨酸、缬氨酸、脯氨酸、天冬氨酸和谷氨酸。
3.实施方案2的细胞培养基,其中所述小肽的其余氨基酸中的至少一个为丙氨酸或甘氨酸。
4.实施方案1的细胞培养基,其中至少一种所述小肽是选自X-酪氨酸、X-半胱氨酸、酪氨酸-X和半胱氨酸-X或其盐的二肽,并且其中X选自丙氨酸、甘氨酸、丝氨酸、缬氨酸、脯氨酸、天冬氨酸和谷氨酸,和/或,和其中一种或多种小肽的N-末端氨基酸具有游离氨基。
5.实施方案1的细胞培养基,其中X为丙氨酸或甘氨酸。
6.实施方案1-5的任一项的细胞培养基,其中所述细胞培养基为液体溶液。
7.实施方案1-5的任一项的细胞培养基,其中所述细胞培养基为干粉或颗粒性干粉。
8.实施方案1-7的任一项的细胞培养基,还包含碳水化合物和氨基酸或其盐。
9.实施方案8的细胞培养基,其中所述碳水化合物为己糖。
10.实施方案8或9的细胞培养基,其中所述氨基酸或其盐为精氨酸、天冬酰胺、天冬氨酸、半胱氨酸、谷氨酸、组氨酸、异亮氨酸、赖氨酸、甲硫氨酸、苯丙氨酸、脯氨酸、羟脯氨酸、丝氨酸、苏氨酸、色氨酸、酪氨酸和缬氨酸中的一种或多种。
11.实施方案1-10的任一项的细胞培养基,还包含维生素、盐、缓冲剂或无机元素。
12.实施方案1-11的任一项的细胞培养基,其中所述细胞培养基不包含脂质、水解产物或其级分、或生长因子。
13.实施方案1-12的任一项的细胞培养基,其中所述细胞培养基不包含蛋白质。
14.实施方案1-13的任一项的细胞培养基,其中所述细胞培养基被浓缩为2X或更浓的制剂。
15.实施方案4-14的任一项的细胞培养基,其中所述一种或多种二肽为丙氨酰酪氨酸,和/或丙氨酰半胱氨酸,和/或丙氨酰胱氨酸二聚体。
16.实施方案4-6或8-14的任一项的细胞培养基,其中所述一种或多种二肽以约1g/L至约16g/L的浓度存在。
17.实施方案4-6或8-14的任一项的细胞培养基,其中所述一种或多种二肽以约2.5g/L至约8.5g/L的浓度存在。
18.实施方案6或8-17的任一项的细胞培养基,其中于2-8℃下贮存的液体溶液保持无沉淀12个月以上。
19.一种培养细胞的方法,包括在支持细胞的培养的条件下将所述细胞与基础细胞培养基接触,和用实施方案1-18的任一项的浓缩给料或培养基补充所述基础细胞培养基。
20.实施方案19的方法,其中在超过一天上,用浓缩给料或培养基补充所述基础细胞培养基。
21.实施方案20的方法,其中从开始细胞培养后第0天、第1天、第2天、第3天、第4天或第5天开始,用浓缩给料或培养基补充所述基础细胞培养基,以及之后每天进行所述补充,直至第13或14天。
22.实施方案19-21的任一项的方法,其中对所述基础细胞培养基的补充为约1-10%或约5-20%的基础细胞培养基的总起始体积。
23.实施方案19-22的任一项的方法,其中所述细胞为动物、植物、昆虫、禽类、酵母、藻类或鱼类细胞。
24.实施方案22的方法,其中所述细胞产生免疫球蛋白或其片段。
25.实施方案24的方法,其中所述细胞产生超过3000mg/L的免疫球蛋白或其片段。
26.一种制备细胞培养基的方法,包括将一种或多种小肽与碳水化合物和至少一种氨基酸或其盐组合,其中所述一种或多种小肽的每一种包含半胱氨酸或酪氨酸。
27.实施方案26的方法,其中所述一种或多种小肽的除半胱氨酸或酪氨酸外的氨基酸,选自丙氨酸、甘氨酸、丝氨酸、缬氨酸、脯氨酸、天冬氨酸、精氨酸、谷氨酰胺或谷氨酸。
28.实施方案27的方法,其中所述一种或多种小肽的除半胱氨酸或酪氨酸外的氨基酸为丙氨酸或甘氨酸。
29.实施方案26的方法,其中所述一种或多种小肽为选自X-酪氨酸、X-半胱氨酸、酪氨酸-X,或半胱氨酸-X或其盐的一种或多种二肽,其中X选自丙氨酸、甘氨酸、丝氨酸、缬氨酸、脯氨酸、天冬氨酸、精氨酸或谷氨酸,并且其中所述一种或多种二肽的N-末端氨基酸具有游离氨基。
30.实施方案29的方法,其中X为丙氨酸或甘氨酸。
31.实施方案26-30的任一项的方法,其中所述碳水化合物为葡萄糖。
32.实施方案26-31的任一项的方法,其中所述至少一种氨基酸或其盐为精氨酸、天冬酰胺、天冬氨酸、半胱氨酸、谷氨酸、组氨酸、异亮氨酸、赖氨酸、甲硫氨酸、苯丙氨酸、脯氨酸、羟脯氨酸、丝氨酸、苏氨酸、色氨酸、酪氨酸和缬氨酸中的一种或多种。
33.实施方案26-32的任一项的方法,其中所述细胞培养基还包含维生素、盐、缓冲剂或无机元素。
34.实施方案26-33的任一项的方法,其中所述细胞培养基不包含脂质、水解产物或其级分、或生长因子。
35.实施方案26-34的任一项的方法,其中所述细胞培养基不包含蛋白质。
36.实施方案26-35的任一项的方法,其中所述细胞培养基被浓缩为2X或更浓的制剂。
37.实施方案29-36的任一项的方法,其中所述一种或多种二肽为丙氨酰酪氨酸和/或丙氨酰半胱氨酸。
38.实施方案29-37的任一项的方法,其中所述一种或多种二肽以约1g/L至约16g/L的浓度存在于细胞培养基中。
39.实施方案29-37的任一项的方法,其中所述一种或多种二肽以约2.5g/L至约8.5g/L的浓度存在。
40.实施方案29-39的任一项的方法,其中于2-8℃下贮存的细胞培养基保持无沉淀12个月以上。
41.一种用于分析细胞培养基、浓缩给料或重建的培养基的方法,所述方法包括测定包含半胱氨酸或酪氨酸的短肽在所述培养基中的存在或不存在。
42.实施方案41的方法,用于分析无血清、无蛋白质、无水解产物的细胞培养基、浓缩给料或重建的培养基,其中所述分析通过选自质谱法(LCMS)、毛细胞管电泳和HPLC的方法来进行。
43.实施方案41的方法,用于分析无血清、无蛋白质、无水解产物的细胞培养基、浓缩给料或重建的培养基,其中所述短肽包含2、3、4、5或6个氨基酸。
44.实施方案41的方法,用于分析培养基,其中所述短肽为二肽。
45.实施方案23的方法,其中CHO细胞产生病毒。
46.实施方案45的方法,其中所述病毒为重组病毒或病毒样颗粒(VLP)。
47.实施方案46的方法,其中所述病毒为腺病毒、慢病毒、杆状病毒、仙台病毒、痘苗病毒或其工程改造的病毒衍生物。
48.实施方案46的方法,其中所述VLP携带核酸。
49.实施方案48的方法,其中所述核酸为RNA。
50.实施方案9的细胞培养基,其中所述己糖选自葡萄糖、半乳糖、果糖和麦芽糖。
51.包含含有半胱氨酸或酪氨酸的小肽的细胞培养基、浓缩给料或重建的培养基,其中所述细胞培养基、浓缩给料或重建的培养基不含血清、不含蛋白质和/或不含水解产物。
52.实施方案51的细胞培养基、浓缩给料或重建的培养基,其中所述小肽包含2、3、4、5或6个氨基酸。
53.实施方案1的细胞培养基、浓缩给料或重建的培养基,其支持重组蛋白质的产生。
54.实施方案53的细胞培养基、浓缩给料或重建的培养基,其中所述重组蛋白质为免疫球蛋白或其片段。
55.包含实施方案1的细胞培养基、浓缩给料或重建的培养基以及细胞的组合物。
56.在细胞培养基中产生重组蛋白质的方法,包括:将细胞与实施方案1的细胞培养基、浓缩给料或重建的培养基接触;和在适合于生长所述细胞和/或表达所述重组蛋白质的条件下培养所述细胞。
57.用于体外培养细胞的试剂盒,所述试剂盒包括一个或多个容器,其中第一容器装有实施方案1的包含至少一种二肽的培养基,以及其中所述培养基支持培养中的细胞的生长和/或重组蛋白质的表达。
58.实施方案57的试剂盒,其中所述培养为悬浮培养或贴壁培养。
59.实施方案57的试剂盒,其中所述生长为高密度生长。
60.在实施方案1的细胞培养基、浓缩给料或重建的培养基中产生病毒或病毒颗粒的方法,包括:在实施方案1的细胞培养基中培养重组细胞,其中所述培养基在适合于所述病毒或病毒颗粒表达的条件下支持所述细胞的生长。
61.由实施方案56的方法产生的重组蛋白质。
62.由实施方案60的方法产生的病毒或病毒颗粒。
63.实施方案1的细胞培养基、浓缩给料或重建的培养基用于产生病毒或重组蛋白质的用途。
64.由实施方案26的方法产生的培养基、浓缩给料或重建的培养基。
65.实施方案1或64的细胞培养基,其中所述小肽为二肽、三肽、四肽、五肽、六肽、七肽、八肽、九肽或十肽。
66.实施方案1或64的细胞培养基,其中所述小肽在长度上为至少约2至10个氨基酸。
67.实施方案1或64的细胞培养基,其中所述小肽在长度上为至少约10个氨基酸。
68.实施方案22的方法,其中在分批补料培养期间进行所述补充。
- 还没有人留言评论。精彩留言会获得点赞!