利用黄绿蜜环菌菌丝体提取酚酸的方法与流程
本发明属于生物工程技术领域,涉及一种利用黄绿蜜环菌菌丝体提取酚酸的方法。
背景技术:
炎症是一种对于创伤、感染、组织损伤或者伤害性刺激所表现出的正常的生理性免疫应答。巨噬细胞是防御微生物感染的免疫系统的第一效应细胞,巨噬细胞受到革兰氏阴性细菌外膜主要组分脂多糖(LPS)的刺激会产生包括NO、PGE2、IL-6和肿瘤坏死因子-α(Tumor Necrosis Factor-α,TNF-α)等促炎介质,这些介质的过表达就会引起炎症反应。因此,抑制前炎症介质的产生有利于减少炎症疾病发生。
多种食用真菌的抗氧化活性都被证实与其总酚含量有关。酚类化合物含有至少一个苯环,上面连接着一个或多个羟基,可以分为类黄酮和非类黄酮,是一种非必要膳食组分,具有预防包括心血管疾病、神经退行性疾病、动脉粥样硬化和癌症的慢性疾病的作用。酚类化合物的生物活性可能是与它们可以螯合金属离子、抑制脂氧化酶和清除自由基等活性有关。研究表明,氧化应激与炎症反应相关,活性氧(Reactive oxygen species,ROS)可能参与调解脂多糖诱导的炎症因子。
黄绿蜜环菌(Armillaria luteo-rivens)的子实体中富含多种营养物质,具有抗氧化活性和抗肿瘤活性。但黄绿蜜环菌人工栽培成功报道不多,且人工栽培获得的子实体与野生黄绿蜜环菌子实体在形态上有明显的差异。而目前发酵技术应用于培养黄绿蜜环菌菌丝体,从菌丝中也分离出诸如多肽、多糖等有利用价值组分,另一方面黄绿蜜环菌也可以参与生物转化生成许多有价值的物质,如白桦脂酸和天麻素。但是未见黄绿蜜环菌菌丝抗炎活性方面的研究。
技术实现要素:
本发明的目的是提供一种利用黄绿蜜环菌菌丝体提取酚酸的方法,解决了现有技术中采用黄绿蜜环菌子实体提取,技术难度高,生产效率低,成本高的问题。
本发明的技术方案是,一种利用黄绿蜜环菌菌丝体提取酚酸的方法,按照以下步骤实施:
步骤1、菌种活化:将配置好的活化培养基进行高温高压灭菌,做好斜面并冷却,将黄绿蜜环菌的菌株接种至斜面,在25℃培养箱中,至斜面长好;
步骤2、发酵培养:在锥形瓶中注入100mL发酵培养基,高温高压灭菌后冷却,挖取步骤1活化后的菌块,接种到装有100mL发酵培养基的锥形瓶中,接种后发酵培养基的培养条件为15~28℃,将该锥形瓶放置在旋转式摇床上,保持转速180rmp,发酵天数为15~25天;
步骤3、收集菌体:将发酵培养后的液体培养基离心收集菌体,用无菌水清洗菌体3遍后得到菌体,-45℃冷冻干燥后研磨成粉末,得到黄绿蜜环菌的菌丝冻干粉;
步骤4、提取酚酸:将菌丝冻干粉与80%体积分数的甲醇按料液比1:18-22混合,-20℃~-25℃静置2-2.5小时,超声处理10-15分钟后在4000转/分钟离心10-12分钟,过滤后滤渣重复上述操作;合并滤液减压浓缩后,水相用乙醚和乙酸乙酯的混合物萃取两次,合并两次有机相后加入无水硫酸钠干燥;过滤除去硫酸钠,旋转蒸发至干,即成。
本发明有益效果是,以黄绿蜜环菌为发酵菌,进行发酵培养,至少20天后,离心获得菌体,冻干研磨得到干粉,最终提取得到酚酸,优点包括:
1)本发明方法提取得到的酚酸是从食用菌发酵菌丝中提取得到的,具有抗氧化、抗炎活性、安全、无毒副作用,有一定的预防癌症、动脉粥样硬化以及糖尿病、肝硬化等疾病的作用,对普通人亦可起到保健作用。
2)本发明方法无需栽培得到黄绿蜜环菌的子实体,生产技术难度低,效率高,成本低,对于利用现阶段难以人工培养子实体的食用菌有较大意思。
3)本发明方法得到的产品可以作为药品、保健食品、食品、食品添加剂、药物增效剂等,工艺科学合理,操作简单,具有较强的工业化实施性,便于推广。
附图说明
图1是不同LPS刺激浓度下RAW264.7细胞存活率柱形图;
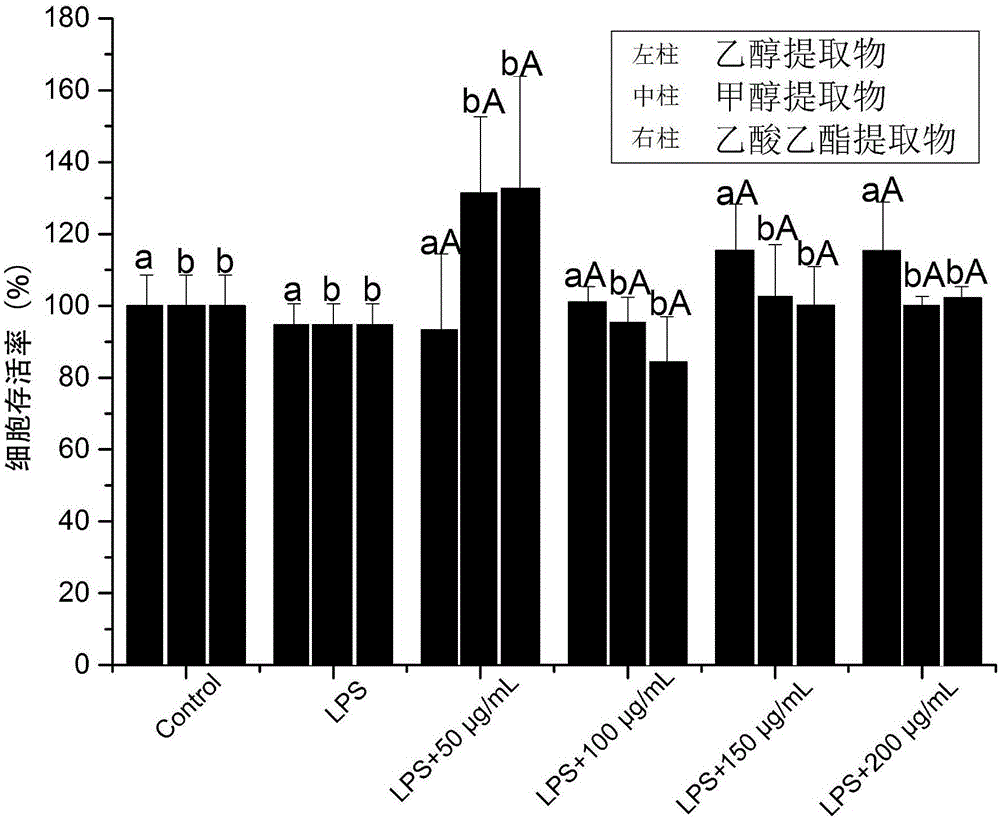
图2是不同浓度下RAW264.7细胞存活率柱形图;
图3是LPS刺激后RAW264.7细胞NO表达量变化柱形图;
图4是LPS刺激后RAW264.7细胞TNF-α表达量变化柱形图。
具体实施方式
下面结合附图和具体实施方式对本发明进行详细说明。
以下黄绿蜜环菌均是指(Armillaria luteo-virens)CGMCC 1884。
本发明利用黄绿蜜环菌菌丝体提取酚酸的方法,按照以下步骤实施:
步骤1、菌种活化:将配置好的活化培养基进行高温高压灭菌,做好斜面并冷却,将黄绿蜜环菌的菌株接种至斜面,在25℃培养箱中,至斜面长好;
按照质量百分数计,活化培养基各组分含量为:葡萄糖2~5%,酵母粉0.1~0.2%,磷酸氢二钾0.05~0.15%,磷酸二氢钾0.025~0.075%,硫酸镁0.02~0.08%,叶酸(VB11)5~20ppm,琼脂1.5~2.5%,其余为水,合计100%。
作为优选,以质量百分数计,活化培养基的组分含量为:葡萄糖3.126%,酵母粉0.106%,磷酸氢二钾0.1%,磷酸二氢钾0.05%,硫酸镁0.045%,叶酸为10ppm,琼脂2%,其余为水,合计100%。
步骤2、发酵培养:取500mL锥形瓶,在该锥形瓶中注入100mL发酵培养基,高温高压灭菌后冷却,挖取步骤1活化后的菌块,接种到装有100mL发酵培养基的锥形瓶中,接种后发酵培养基的培养条件为15~28℃,将该锥形瓶放置在旋转式摇床上,保持转速180rmp,发酵天数为15~25天;
作为优选,接种后发酵培养基的培养条件为25℃,发酵天数为20天;
按照质量百分数计,发酵培养基各组分含量为:葡萄糖2~5%,酵母粉0.1~0.2%,磷酸氢二钾0.05~0.15%,磷酸二氢钾0.025~0.075%,硫酸镁0.02~0.08%,叶酸为5~20ppm,其余为水,合计100%;
作为优选,以质量百分数计,发酵培养基组分含量为:葡萄糖3.126%,酵母粉0.106%,磷酸氢二钾0.1%,磷酸二氢钾0.05%,硫酸镁0.045%,叶酸为10ppm,其余为水,合计100%。
步骤3、收集菌体:将发酵培养后的液体培养基离心收集菌体,用无菌水清洗菌体3遍后得到菌体,-45℃冷冻干燥后研磨成粉末,得到黄绿蜜环菌的菌丝冻干粉;
作为优选,所述离心转速为3000~10000转/分钟,离心时间5~10分钟,离心后使用无菌生理盐水清洗,清洗后同样条件下再次离心,重复三次;
步骤4、提取酚酸:将菌丝冻干粉与80%(体积分数)的甲醇按料液比1:18-22混合,-20℃~-25℃静置2-2.5小时,超声处理10-15分钟后在4000转/分钟离心10-12分钟,过滤后滤渣重复上述操作;合并滤液减压浓缩后,水相用乙醚(1克菌丝冻干粉对应20mL乙醚)和乙酸乙酯(1克菌丝冻干粉对应20mL乙酸乙酯)的混合物萃取两次,合并两次有机相后加入无水硫酸钠干燥;过滤除去硫酸钠,旋转蒸发至干,即成。
实施例1
黄绿蜜环菌发酵和酚酸的提取鉴定
1)菌种活化:将配置好的活化培养基进行高温高压灭菌,做好斜面并冷却,将黄绿蜜环菌菌株接种至斜面,在25℃培养箱中,至斜面长好,备用。
活化培养基的组分为:葡萄糖3.126%,酵母粉0.106%,磷酸氢二钾0.1%,磷酸二氢钾0.05%,硫酸镁0.045%,叶酸为10ppm,琼脂2%,其余为水,合计100%。
2)发酵培养:取500mL的锥形瓶,在该锥形瓶中注入100mL发酵培养基,高温高压灭菌后冷却,挖取活化后的菌块,接种到装有100mL发酵培养基的锥形瓶中,放置在旋转式摇床上,在25℃、转速为180rmp的条件下,培养20天。
发酵培养基的组分是:葡萄糖3.126%,酵母粉0.106%,磷酸氢二钾0.1%,磷酸二氢钾0.05%,硫酸镁0.045%,叶酸为10ppm,其余为水,合计100%。
3)收集菌体:将培养后的液体培养基离心收集菌体,用无菌水清洗菌体3遍后收集菌体,-45℃冷冻干燥后研磨成粉末,得到黄绿蜜环菌的菌丝冻干粉。
4)酚酸的提取和鉴定:将菌丝冻干粉与80%(体积分数)的甲醇按料液比1:20混合,-20℃静置2小时,超声处理15分钟后4000转/分钟离心10分钟,过滤后滤渣重复上述操作。合并滤液减压浓缩后,水相用20mL乙醚和20mL乙酸乙酯的混合物萃取两次,合并两次有机相后加入无水硫酸钠干燥。过滤除去硫酸钠,旋转蒸发至干,重新溶入80%(体积分数)的甲醇中,得到含有酚酸的甲醇溶液,待后续检测。
鉴定酚酸采用高效液相色谱法检测,液相检测条件为:流动相A为0.1%甲酸,流动相B为乙腈,检测波长280nm,流速1mL/分钟,柱温40℃。液相程序为:从0-5分钟为10%-15%B;从5.01-10分钟为15%-25%B;从10.01-20分钟为25%-35%B。
实施例1在酚酸提取物中,检测到三种酚酸,分别为对香豆酸(0.75±0.18μg/g(菌丝干重))、没食子酸(28.16±0.66μg/g(菌丝干重))和对羟基苯甲酸(107.55±0.05μg/g(菌丝干重)),各个数据如表1所示。
表1、检出酚酸的种类、保留时间、标准曲线和以及在样品中的含量
实施例2
黄绿蜜环菌提取物的抗炎活性测定
1)菌种活化:将配置好的活化培养基进行高温高压灭菌,做好斜面并冷却,将黄绿蜜环菌菌株接种至斜面,在25℃培养箱中,至斜面长好,备用。
活化培养基的组分为:葡萄糖3.126%,酵母粉0.106%,磷酸氢二钾0.1%,磷酸二氢钾0.05%,硫酸镁0.045%,叶酸为10ppm,琼脂2%,其余为水,合计100%。
2)发酵培养:取500mL的锥形瓶,在该锥形瓶中注入100mL的发酵培养基,高温高压灭菌后冷却,挖取活化后的菌块,接种到装有100mL发酵培养基的锥形瓶中,放置在旋转式摇床上,在25℃、转速为180rmp的条件下,培养20天。
发酵培养基的组分是:葡萄糖3.126%,酵母粉0.106%,磷酸氢二钾0.1%,磷酸二氢钾0.05%,硫酸镁0.045%,叶酸为10ppm,其余为水,合计100%。
3)收集菌体:将培养后的液体培养基离心收集菌体,用无菌水清洗菌体3遍后收集菌体,-45℃冷冻干燥后研磨成粉末,得到黄绿蜜环菌的菌丝冻干粉。
4)黄绿蜜环菌菌丝体提取物制备:将菌丝冻干粉分别与甲醇、乙醇和乙酸乙酯按固液比1:25(W/V)的比例混匀,于室温下过夜搅拌提取,过滤。滤渣同上重复提取一次,合并两次滤液。滤液在40℃下减压旋蒸浓缩,得到甲醇提取物(Methanolic crude extract,MCE)、乙醇提取物(Ethanolic crude extract,ECE)和乙酸乙酯提取物(Ethyl acetate crude extract,ACE)。将上述的三种提取物(即MCE、ECE和ACE)用DMSO配置成40g/L的母液,-20℃保存备用。使用时MCE用甲醇,ECE和ACE用乙醇稀释到所需浓度,在4℃保存不得超过一周。
(5)细胞培养:RAW264.7细胞培养在含有10%胎牛血清,1%双抗的DMEM高糖培养基中,置于37℃、5%的CO2的培养箱内进行孵育。实验所有细胞均来自3-20代。
6)LPS毒性作用测定:收集指数生长期的RAW264.7细胞,以2×105/mL的密度接种于96孔板内,100μL/孔,分别加入终浓度为0mg/L、0.1mg/L、1mg/L、10mg/L和50mg/L的LPS,将LPS终浓度为0mg/L组作为对照组。每个浓度5个复孔,孵育20小时后每孔加入20μL的5mg/mL的MTT,37℃孵育4小时,弃上清,每孔加入150μL DMSO振荡2分钟,采用酶标仪490nm处测定各孔吸光度值。计算细胞存活率=(实验组吸光度/对照组吸光度)×100%。
7)细胞生存能力测定:收集对数生长期的RAW264.7细胞,以2×105/mL的密度接种于96孔板内,100μL/孔,孵育24小时。分别加入终浓度为0mg/L、50mg/L、100mg/L、150mg/L和200mg/L的用培养基稀释后过滤除菌的三种提取物,孵育1小时后,加入终浓度为1mg/L的LPS。每种提取物每个浓度设置五个复孔,设置空白细胞组和只加入了LPS的样品空白组。孵育20小时后,将上清液吸出,再向板内每孔加入20μL 5mg/mL MTT,37℃孵育4小时,弃上清,每孔加入150μL DMSO振荡2分钟,采用酶标仪490nm处测定各孔吸光度值。计算细胞存活率=(实验组吸光度/对照组吸光度)×100%。
8)一氧化氮(NO)含量分析:收集对数生长期的RAW264.7细胞,以2×105/mL的密度接种于96孔板内,100μL/孔,孵育24小时。分别加入终浓度为0mg/L、50mg/L、100mg/L、150mg/L和200mg/L的用培养基稀释的三种提取物,孵育1小时后,加入终浓度为1mg/L的LPS。每种提取物的每个浓度设置五个复孔,设置空白细胞组和加入LPS的样品空白组。孵育20小时后,每孔取60μL上清液加入另一新96孔培养板中,然后每孔加入等体积格里斯氏试剂,轻轻摇动培养板混匀,室温静置10分钟后用酶标仪检测540nm波长处的吸光光度值。NO浓度依据NaNO2标准曲线进行计算。
9)ELISA法检测TNF-α含量:TNF-α含量检测采用ELISA方法,按照试剂盒说明进行检测。
10)LPS刺激浓度摸索:当LPS浓度为0.1μg/mL时,RAW264.7细胞存活率为(104.67±1.78)%,与刺激浓度为0μg/mL时(存活率为100.00%)比较,未有明显升高(p>0.05)。当LPS浓度为1μg/mL和10μg/mL时,细胞存活率分别为(107.46±3.65)%、(108.40±1.49)%,与对照组相比,均有显著升高(p<0.05)。当LPS为50μg/mL时,细胞存活率为(80.60±1.10)%,显著降低了细胞存活率(p<0.05),见图1。
11)黄绿蜜环菌菌丝体提取物对LPS诱导RAW264.7细胞产生NO和TNF-α的抑制作用:在确定了LPS刺激浓度后,本实施例又鉴定了三种提取物(即MCE、ECE和ACE)对RAW264.7细胞的无毒性剂量范围。通过MTT法检测了不同浓度的提取物对RAW264.7细胞存活率的影响。结果显示,在受试浓度范围内(50μg/mL-200μg/mL)未见RAW264.7细胞存活率的显著降低(p>0.05),而且同一供试浓度下的三种提取物也未见显著性差异(p>0.05),见图2。
在三种提取物对RAW264.7细胞的无毒性剂量范围内,本实施例2分析了它们对LPS诱导RAW264.7细胞产生NO的抑制作用,见图3。用MCE、ECE和ACE(给药浓度均为50μg/mL、100μg/mL、150μg/mL和200μg/mL)与LPS同时处理细胞20小时,与LPS阳性对照组相比,三种提取物能使NO含量显著降低53.27%-87.17%(p<0.05)。当三种提取物浓度达到150μg/mL时,三种提取物的抑制效果均不再继续显著增强(p>0.05)。整体来说,三种提取物均能明显抑制LPS诱导的RAW264.7细胞NO的产生,且呈现明显的剂量相关性,随着剂量的增大,抑制效果显著增强,但200μg/mL处理浓度和150μg/mL处理浓度的抑制率间未见显著性差异(p>0.05)。而且三种提取物之间未见显著性差异。
本实施例2还检测黄绿蜜环菌菌丝体提取物对LPS诱导RAW264.7细胞产生的TNF-α抑制活性。图4中每组左中右立柱分别代表甲醇提取物、乙醇提取物、乙酸乙酯提取物,LPS能诱导RAW264.7细胞产生TNF-α,经提取物处理后,RAW264.7产生的TNF-α均显著减少,且呈现显著的剂量依赖性(p<0.05)。200μg/mL的乙醇提取物与LPS阳性对照相比可以将TNF-α减少16.54%。从整体来看,三种提取物中,乙醇提取物对于LPS诱导的RAW264.7细胞产生的TNF-α的抑制作用最显著。总而言之,三种提取物在受试浓度下均未对细胞存活率产生影响,可以明显抑制促炎因子NO和TNF-α的产生,且均呈现明显的剂量依赖性,三种提取物对RAW264.7细胞NO产生的抑制作用未见显著性差异(p>0.05),但乙醇提取物对TNF-α抑制作用整体上显著强于另外两种提取物(p<0.05)。
- 还没有人留言评论。精彩留言会获得点赞!