一种两阶段操作核酸反应检测管的制作方法
本实用新型与生物学领域有关,特别是关于一种免移转液体的先后进行核酸聚合酶连锁反应及检测核酸反应结果的两阶段操作检测管。
背景技术:
聚合酶锁链反应(Polymerase Chain Reaction,以下简称PCR)为一种快速放大DNA信号的技术,其原理及主要操作步骤为(a)变性(denature):利用高温(90℃~95℃)将双股DNA解离成单股DNA,再以单股DNA作为复制的模板;(b)引子黏合(primer annealing):温度降低到适当温度时,引子会粘附到正确的目标基因位置;(c)引子延长(primer extension):反应温度调整到72℃,并利用镁离子作为酵素辅因子,使得DNA聚合酶依照模板上的核苷酸组合将脱氧核糖核苷三磷酸(deoxy-ribonucleotide triphosphate,以下简称dNTPs)逐次粘附于引子之后,进而合成另一股新DNA片段。通过此三个步骤不断重复的升降温变化进行目的核酸信号放大,每重复一次三个步骤的操作,目的核酸的数目就可扩增一倍,若设定三个步骤操作共进行40次循环,目的核酸的数量就可以放大近109倍,目的核酸的信号也随之放大,因此PCR技术为目前临床诊断大量使用来作为分子诊断的技术,可应用于包含遗传疾病诊断、病原菌诊断、肿瘤癌症的诊断预后评估等。由PCR技术衍生而来的RT-PCR也具有相类似的应用原理,因此同样作为目前被临床诊断大量运用的技术。
目前常被使用来进行PCR或RT-PCR反应的装置多以耐热塑料作为置放反应试剂的试管,通过温控金属对试管进行反复升温降温的操作,以达到三个步骤的反应温度,来达成目的核酸信号放大的效果。以现行系统而言,因为利用温控金属作为反应系统,其反应体积较大,使得整个温控系统必须具有较大的体积及热容比;又依目前实际上的操作,一般试验所需的循环次数约为30次-35次左右,所需反应时间约介于二至三个小时之间,其中多数时间用于等待温控金属的升降温,因此反应时间较难缩减。
再者,前述PCR或RT-PCR通常利用胶体电泳(gel electrophoresis)方式来确认目标基因的信号是否有被成功放大,因此在完成PCR或RT-PCR后,尚须将含目标基因放大信号的产物(以下简称PCR或RT-PCR产物)从反应试管中取出一特定体积,注入预先制备完成的胶体井(well)中,通过核酸分子在中性或碱性溶液中带负电的特性,使得核酸分子在电场作用下会往正极方向移动,且移动的速度与其分子量大小成反比。通过此方法的操作,即可检测出目标基因核酸是否有成功放大,利用胶体电泳进行检测的正确率虽高,但从进行PCR或RT-PCR至完成胶体电泳,需要多个小时的反应时间,对于一些需要即时或在短时间内得知检测结果的测试项目来说,由于进行PCR或RT-PCR再加上电泳确认测试结果的时间太长,因此通常无法利用PCR或RT-PCR的方式来进行辅助诊断或检验。此外,利用胶体电泳的方式来进行结果判读时,因需将PCR或RT-PCR产物从反应管中移转至胶体井中,此过程容易被外部物质污染PCR或RT-PCR产物,从而造成误判。
为了能够缩短反应时间,一种利用热对流反应原理进行PCR的技术问世(以下简称热对流式PCR)。此技术最早是由Krishnan等人设计了Rayleigh-Benard cell的圆柱形管,配合上下两个不同加热源作为温度控制,一般而言,液面顶端温度约维持在60℃左右,而底部温度则约为95℃左右,通过该圆柱形腔体上下端温度不同产生的温差,驱动腔体内液体的流动,PCR反应亦随之进行,此方式同样可进行RT-PCR。其后陆续有应用相同原理的衍生技术开发并作为商业使用,如利用单点加热方式的隔绝式恒温反应(insulated isothermal polymerase chain reaction,iiPCR),其为一种在封闭毛细管内进行的聚合酶连锁反应,或利用三点加热源形式的封闭回路式流道的设计;抑或利用非接触式辐射的方式,其加热点位于圆柱管中央的封闭回路设计,来达到进行PCR或RT-PCR的效果等诸多不同设计。通过此种利用热对流反应原理进行PCR或RT-PCR的方法,将不再需要通过温控金属对试管进行反复升温降温的操作以达到三个步骤的反应温度,可节省许多反复升降温的时间,亦可以减少温控金属的使用量。
同时,为减少因外界物质污染PCR或RT-PCR产物,而造成检测结果的误判,近年亦陆续有可取代传统胶体电泳的判读技术开发,例如利用具有单一性荧光物质与目标基因序列结合,当检测仪器给予适当波长的光束激发该荧光物质,该荧光物质就会发出荧光,并被检测仪器侦测,该荧光亮度与PCR或RT-PCR产物数量成正比,因此可达到即时定性甚至定量的效果,节省反应时间。
又如通过对目标基因序列具有专一性标记的试纸来检测PCR或RT-PCR产物,亦是近年来常使用的检测方式之一。试纸法的检测原理是在PCR或RT-PCR试剂中加入至少两种不同专一性抗体的抗原,第一种抗原可为DIG或TexasR,第二类抗原可为Avidin或FITC,亦可用其他具有专一性的抗原取代前述抗原。当反应完成后,产物即带有两种不同抗原。同时,在试纸的一端喷涂胶体金、乳胶球或其他呈色物质,该呈色物质与前述第二种抗原的专一性抗体结合,此种抗体可为Biotin、anti-FITC或其他可对应的专一性抗体,而试纸的另一端则有粘附的吸水棉;此外,在试纸特定部位喷涂固着于另一对应前述第一类抗原的专一性抗体,如anti-DIG、anti-TexasR或其他可对应的专一性抗体;当反应结束后,将PCR或RT-PCR产物取出并滴放适当体积的试剂于试纸有喷涂呈色物质的一端,此时产物中第一种抗原将会与第一种抗体专一性结合,并形成第一种抗原-第一种抗体-呈色物质的复合物,这个复合物会因试剂的毛细现象从呈色端往吸水棉端移动,当移动到第二种抗体喷涂的位置时,第二种抗原将会与第二种抗体专一性结合后,会固定于该处并呈色,使用者得以通过呈色与否判读结果。利用试纸检测法所需时间约为多分钟不等,较传统胶体电泳检测法节省不少实验时间,因应不同的需求,前述专一性抗体亦可用核酸探针取代。
呈上所述,以热对流式PCR辅以试纸检测法进行和检测,比起传统PCR或RT-PCR及胶体电泳的检测方法节省许多反应时间,虽已广泛为研究及商业使用,但目前坊间并未成功开发出可直接进行热对流式PCR或RT-PCR反应及产品检测两种不同操作诉求的检测试管,因此在执行上仍需先在试管中完成热对流式PCR后,在将产物从试管中取出适当体积滴到试纸上,才能完成核酸检测,由于产物取出不易,使得操作相当不便,且仍无法确实避免外部物质造成的污染。
有鉴于此,本实用新型提供一种不需要进行试剂或液体移转,而可以在PCR或RT-PCR反应完成后,在同一装置中利用试纸进行核酸反应结果检测的两阶段操作检测管。
技术实现要素:
鉴于上述问题,本实用新型涉及一种两阶段操作检测管。此种检测管使用上不需要进行试剂或液体移转,仅需在热对流式PCR或RT-PCR反应完成后,与装有试纸的连接管、检测管连接,就可以直接在同一装置中利用试纸进行核酸反应结果检测。
为了达成前述目的,依据本实用新型提供的一较佳实施例,本装置包含一具有一第一连接部及一检测空间的第一管体,此检测空间可以容纳一端具有吸水棉的试纸;一具有第二连接部及一容置空间的第二管体,此容置空间可以容纳目标基因待测物及相关试剂;一具有一第一部位及一第二部位的连接体,可分别连接于第一管体的第一连接部及前述第二管体的第二连接部;此连接体的第一部位具有一导流单元及一集液空间,导流单元可将容置空间的液体引导至集液空间,此连接体的第二部位则具有一试纸置放空间供试纸置放,且前述试纸置放空间与前述集液空间连接。
在其中一种实施例中,第一管体的外周面概呈一圆管,检测空间则为一具有两个相对平面的长圆形空间。
在其中一种实施例中,第二管体更具有一毛细管部。
在其中一种实施例中,连接体的试纸置放空间为一具有一致管径的长形通道。
在其中一种实施例中,集液空间具有一出口,用于将液体导出,且出口的位置为于试纸置放空间的长边。
在其中一种实施例中,集液空间为一腔室,与试纸置放空间连接。
在其中一种实施例中,集液空间具有一邻近导流单元的入口及一邻近试纸置放空间的出口,且出口的开孔面积较入口大。
在其中一种实施例中,导流单元为一朝向集液空间的导流坡面,可引导位于第二管体内的液体流入集液空间。
在其中一种实施例中,第一连接部分、第二连接部分别具有一第一嵌合结构、第二嵌合结构,用于连接连接体。
在其中一种实施例中,第一嵌合结构、第二嵌合结构为至少一环状凸出单元,用以连接连接体。
热对流式PCR或RT-PCR反应完成后,组装第一管体、第二管体以及连接体,以形成一封闭式检测管,检测试纸则已先行置入第一管体与连接体中。待组装完成后,将检测管进行180度翻转,使试剂通过连接体的导流单元进入集液空间,于试纸置放空间与试纸接触。通过试纸一端附有吸水棉产生的毛细现象将PCR或RT-PCR产物从试纸喷涂有呈色物质的一端拉往吸水棉端,在此过程中,产物所携带的专一性抗原将会与预先喷涂于试纸上的专一性抗体结合而呈色,使用者可通过第一管体的观测部观察检测结果。通过本实用新型的上揭技术手段,可达到在同一装置中进行热对流式PCR或RT-PCR以及检测产物的目的。
附图说明
图1是本实用新型一较佳实施例的零件爆炸图及组合图。
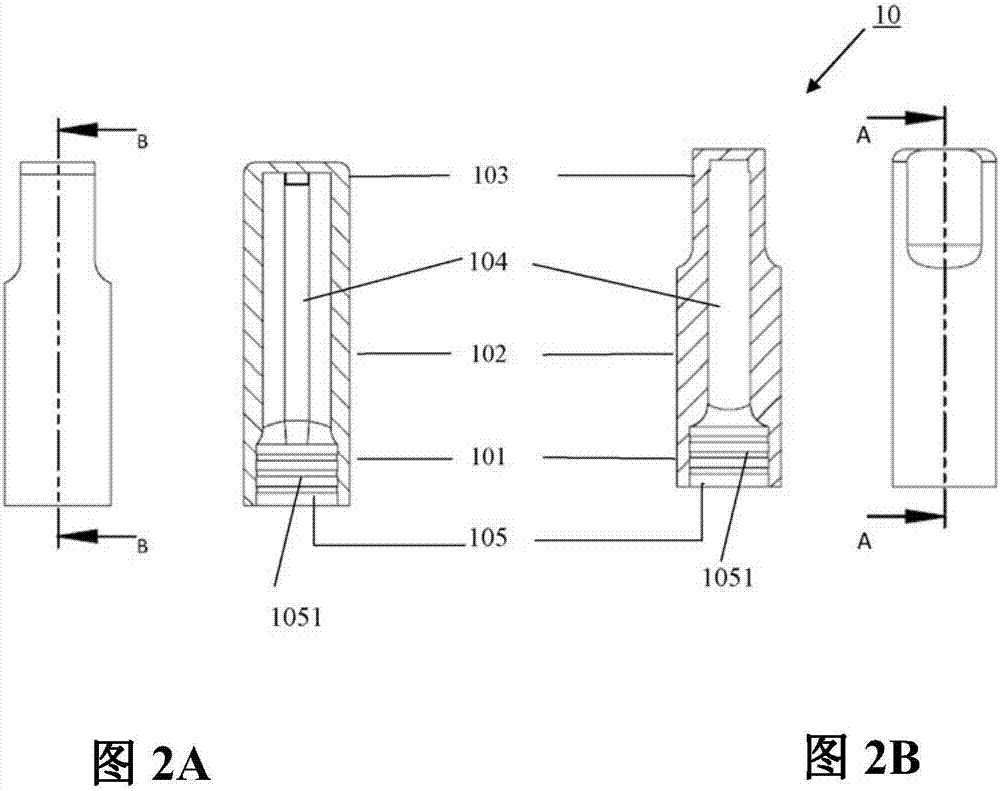
图2A是本实用新型第一管体10的B-B方向剖面图。
图2B是本实用新型第一管体10的A-A方向剖面图。
图3是本实用新型第一管体的俯视图。
图4是本实用新型第二管体的C-C方向剖面图。
图5是本实用新型连接体的D-D方向剖面图。
附图标号
1 检测管
10 第一管体
101 第一连接部
102 观测部
103 手持部
104 检测空间
105 第一嵌合结构
1051 环状凸出单元
20 连接体
201 第一部位
202 第二部位
203 第三嵌合结构
2031 环状凸出单元
204 导流单元
2041 导流坡面
205 集液空间
206 试纸置放空间
207 开口
30 第二管体
301 第二连接部
302 毛细管部
303 容置空间
304 第二嵌合结构
3041 环状凸出单元
具体实施方式
以下即配合附图详细说明本实用新型的一较佳实施例的结构及功效。另外,本说明书中对于机构或其部位在其位置描述上冠以“前”、“后”、“左”、“右”、“上”、“下”等,对应于使用者在操作本较佳实施例时的空间关系。
请参考图1,本实用新型一较佳实施例的检测管1主要包含一第一管体10、一第二管体30、及一连接于第一管体及第二管体之间的一连接体20。
请参考图1、图2A及图2B、及图3,在本实施例中,前述第一管体10为一由PC塑胶制成的透明管体,具有一第一连接部101、一手持部103、一位于第一连接部101及手持部103之间的观测部102、及一检测空间104。在本实施例中,第一管体10的观测部102外周概呈一圆形周面,表面光滑;此外,第一管体10的一端为前述手持部103,在管体外周具有相对两个平面,可供使用者以手指夹持,以利判读;位于前述手持部103相对一端的第一连接部101在管体内侧具有一第一嵌合结构105,在本实施例中,第一嵌合结构105具有至少一环状凸出单元1051,用于连接前述连接体20;第一管体10的内部为前述检测空间104,用于容纳一尾端附有吸水棉的试纸,为一横剖面呈长圆形的空间,亦即此空间具有两个平行的壁面,以及处于相对位置的两个曲面。因此,当使用者由观测部102观看第一管体10时,圆形外周面与内部平坦的壁面就构成一平凸透镜的结构,当前述试纸置于检测空间104时,即可放大试纸上的信息,以利判读。此外,该尾端附有吸水棉的试纸,于检测空间104的置放方向为附有吸水棉的一端位于第一嵌合结构105的另一端。
参考图1及图4,本实施例的第二管体30为一由PC塑胶制成的透明中空管体,一端内径较宽用以连接前述连接体20,相对一端则为内径较窄的毛细管部302,前述第二管体30具有一第二连接部301及一容置空间303。在本实施例中,第二连接部301与第一管体10的第一连接部101相似,管体内侧具有一第二嵌合机构304,且第二嵌合机构具有至少一环状凸出单元3041,用于连接前述连接体20;第二管体30内部的容置空间303用于容纳待检测液体,例如反应试剂。
参考图1及图5,本实施例的连接体20为一由硅胶制成、具有一硬度较第一管体10、第二管体30低的弹性体,前述连接体20具有一第一部位201及一第二部位202,可分别连接于第一管体10的第一连接部101及第二管体30的第二连接部301,具体而言,第一部位201及第二部位202分别具有一第三嵌合机构203,在本实施例中,即为外周面具有多个环状凸出单元2031,当连接体与第一管体10、第二管体30连接时,第一管体10的内管壁环状凸出单元1051或第二管体30的内管壁环状凸出单元3041可迫使连接体20的相应部位略微变形,而使得第一部位201、第二部位202的环状凸出单元与相应的第一管体10的连接部环状凸出单元1051、第二管体30的连接部环状凸出单元3041相互嵌合,而形成紧密连结、密封的状态。
参考图5,第一部位201具有一导流单元204及一集液空间205,第二部位202则具有一试纸置放空间206,为一具有一致管径的长形通道。试纸置放空间206具有一开口207,试纸置放空间用于将前述试纸推入前述试纸置放空间206,开口则位于邻近前述导流单元的入口及一邻近前述试纸置放空间的出口,该开口207的长度宽度约略等同于检测试纸的宽度及厚度,且前述出口的开孔面积较前述入口大,其目的在于防止反应试剂在未与试纸接触并通过毛细现象往试纸另一端移动而逐步与试纸上喷涂的专一性抗体进行反应下,直接通过缝隙直接流到第一管体10的检测空间104,造成检测结果的误判。
在本实施例中,导流单元204为一朝向前述集液空间205的导流坡面2041,当使用者将检测管1为180度倒置时,亦即将图1上下翻转,前述导流坡面2041可引导位于第二管体202内部的液体流向前述集液空间205,而集液空间205为一中空腔体,可容纳液体,且集液空间205与试纸置放空间206连通,当液体流入集液空间205时,就会与置放于试纸置放空间206的待测试纸接触,进而进行PCR或RT-PCR产物检测反应。此外,集液空间205的入口,也就是与导流单元204相邻的开孔面积,相较于集液空间205的出口,也就是与试纸置放空间206相邻的开孔面积,较为狭窄,可使液体顺畅地往固定方向流动。且为了加速反应进行,增加液体与试纸的接触面积,集液空间205的出口设于试纸置放空间206的长边,如此一来,当液体流出集液空间205时,即可直接与试纸大范围地接处,加快进行反应。
使用上,首先将包含待分析的目标基因片段、专一性抗原及其他试剂注入第二管体30中,并进行热对流式PCR或RT-PCR,当反应完成时,PCR或RT-PCR产物及同时带有DIG以及Avidin两种抗原;同时,将喷涂有呈色物质及专一性抗体且尾端附有吸水棉的试纸置放于连接体20的试纸置放空间206中,再将连接体20与第二管体30的第二连接部301连接组装,使得试纸被置入第二管体30的容置空间303并固定。在本实施例中,呈色物质为胶体金,一种专一性抗原为DIG,另一种专一性抗原为Avidin,两者对应的专一性抗体为Anti-DIG以及Biotin,且Biotin与胶体金结合为胶体金-Biotin复合物。
待热对流式PCR或RT-PCR反应完成后,不须移除第二管体30的反应试剂,而直接将连接体20以及第一管体10依图1所示的第一管体10-连接体20-第二管体30组合连接组装,使检测管1成为一完全封闭的管体。接着将检测管1进行180度倒置,亦即将图1上下翻转,此时原本位于第二管体30的包含热对流式PCR或RT-PCR产物的试剂,会顺着导流坡面2041流向集液空间205及试纸置放空间206,并在试纸置放空间206与待测试纸接触。由于试纸的一端附有吸水棉,因此带有PCR或RT-PCR产物的试剂将会从试纸置放空间206端因毛细现象的影响,而逐步往吸水棉端移动。在带有PCR或RT-PCR产物的试剂移动过程中,Avidin将会与Biotin专一性结合,并形成Avidin-Biotin-胶体金的复合物,此复合物会因毛细现象继续往吸水棉端移动,当移动到Anti-DIG喷涂的位置时,DIG将会与其专一性结合后,固定于该处并呈色,使用者得以通过呈色与否判读结果。
- 还没有人留言评论。精彩留言会获得点赞!