用于将细胞与微载体分离的方法和设备与流程
所描述的实施方案涉及用于将细胞与微载体分离的方法和设备。
发明背景
微载体技术用于在生物反应器中培养细胞。具体地,微载体充当支撑基质以允许贴壁依赖性细胞在培养物中生长。
将细胞与微载体分离的常规方法可能既昂贵又耗时,包括允许悬浮在培养基中的细胞和微载体朝向生物反应器的基部沉降、将酶引入到生物反应器、搅拌混合物以使得细胞从微载体脱离或释放以及随后使混合物穿过过滤器以将细胞与微载体分离。
因此,期望解决或改善此类现有技术方法的一个或多个缺点,或者至少为其提供有用的替代方法。
对本说明书中包括的文件、法令、材料、装置、物品等的任何讨论不应认为是承认任何或所有这些内容形成现有技术基础的一部分或者是本公开相关领域中的一般常识,因为其在本申请的每个权利要求的优先权日期之前已经存在。
在整篇本说明书中,词语“包括(comprise)”或诸如“comprises”或“comprising”的变化形式应理解为暗示包括所述要素、整数或步骤、或成组要素、整数或步骤,而非排除任何其他要素、整数或步骤、或成组要素、整数或步骤。
发明概述
一些实施方案涉及一种用于将细胞与微载体分离的设备,所述设备包括:具有主体和基部的腔室,腔室被构造来接收包含细胞和微载体的混合物;设置在腔室内并联接到主体的过滤元件,过滤元件被构造来从混合物中过滤微载体;以及联接到腔室的调节机构,调节机构被构造用于选择性地延伸和缩回腔室的主体的至少一部分,以使过滤元件相对于腔室的基部移动。
在一些实施方案中,腔室的主体的至少一部分响应于调节机构的选择性致动而发生的选择性延伸使得主体的至少一部分远离腔室的基部延伸,并且腔室的主体的至少一部分响应于调节机构的选择性致动而发生的选择性缩回使得主体的至少一部分朝向腔室的基部缩回。
在一些实施方案中,腔室的主体的至少一部分响应于调节机构的选择性致动而发生的选择性延伸可使得过滤元件远离腔室的基部移动,并且腔室的主体的至少一部分响应于调节机构的选择性致动而发生的选择性缩回可使得过滤元件朝向腔室的基部移动。
例如,腔室可被构造来响应于调节机构的选择性致动而在延伸状态与缩回状态之间转换。
过滤元件可包括过滤器,其被构造来允许细胞穿过过滤器并且阻止微载体穿过过滤器。过滤元件可包括过滤器基部,其被构造来与腔室的基部协作,以在设备处于缩回状态时允许过滤器基部与腔室的基部齐平。
主体可以是细长主体,并且基部可以是圆锥形基部。在一些实施方案中,主体可包括波纹管,以允许主体伸展和收缩。主体可由柔性材料构成。
调节机构可包括一个或多个致动器。例如,一个或多个致动器包括一个或多个电动汽缸。在一些实施方案中,一个或多个致动器联接到腔室的主体。在一些实施方案中,腔室包括联接到主体的第一端部的盖,并且一个或多个致动器联接到盖。
在一些实施方案中,所述设备还可包括搅拌机构,以引发对腔室内混合物的搅拌。例如,搅拌机构可包括振动台、下降凸轮和/或空气中的至少一种。
一些实施方案涉及一种包括上述设备和用于搅拌腔室内混合物的搅拌系统的生物反应器。搅拌系统可包括一个或多个叶轮。
一些实施方案涉及一种用于将细胞与微载体分离的方法,所述方法包括:当设备处于延伸状态时,将包含细胞和微载体的混合物引入到上述设备的过滤元件;将微载体和附着于微载体的细胞保留在过滤元件中;致动调节机构以使过滤元件朝向腔室的基部移动;引入用于促进细胞从微载体脱离到腔室的试剂;搅拌腔室中的混合物以使细胞的至少一些从微载体脱离;以及将微载体保留在过滤元件中并允许脱离的细胞和试剂穿过过滤元件。
在一些实施方案中,混合物还可包含培养基,并且将微载体和附着于微载体的细胞保留在过滤元件中还可包括将培养基从腔室输送出。
在一些实施方案中,用于促进细胞从微载体脱离到腔室的试剂可通过设置在腔室的基部中的端口引入到腔室。所述方法还可包括将空气输送到腔室以帮助促进试剂、细胞和微载体的混合。
在一些实施方案中,所述方法还可包括将试剂和脱离的细胞从腔室输送到第二设备的第二腔室。所述方法还可包括将输送空气输送到腔室以帮助促进试剂和脱离的细胞从腔室输送出。所述方法还可包括将缓冲液输送到腔室以帮助促进试剂和脱离的细胞从腔室输送出。在一些实施方案中,所述方法包括将试剂抑制剂引入到第二腔室以抑制试剂的活性。
在一些实施方案中,所述方法还可包括:致动调节机构以使过滤元件远离腔室的基部移动;以及将抑制剂引入到腔室以抑制试剂的活性。所述方法可包括将缓冲液输送到腔室以清洗过滤元件和腔室。
所述方法可包括将脱离的细胞输送到收集接受器。
一些实施方案涉及一种用于将细胞与微载体分离的方法,所述方法包括:将包含细胞和微载体的混合物引入到上述设备的过滤元件;将微载体和附着于微载体的细胞保留在过滤元件中;引入用于促进细胞从微载体脱离到腔室的试剂;搅拌腔室中的混合物以使细胞的至少一些从微载体脱离;将微载体保留在过滤元件中并允许脱离的细胞和试剂穿过过滤元件;致动调节机构以使过滤元件远离腔室的基部移动;以及将抑制剂引入到腔室以抑制试剂的活性。
一些实施方案涉及一种用于将细胞与微载体分离的方法,所述方法包括:将包含细胞和微载体的混合物引入到上述设备的过滤元件;将微载体和附着于微载体的细胞保留在过滤元件中;引入用于促进细胞从微载体脱离到腔室的试剂;搅拌腔室中的混合物以使细胞的至少一些从微载体脱离;以及将微载体保留在过滤元件中并允许脱离的细胞和试剂穿过过滤元件。
所述方法可包括:致动调节机构以使过滤元件远离腔室的基部移动;以及将抑制剂引入到腔室以抑制试剂的活性。
在一些实施方案中,当设备处于延伸状态时,可将混合物引入到设备,并且所述方法可包括在将试剂引入到腔室之前致动调节机构以使过滤元件朝向腔室的基部移动。
在一些实施方案中,混合物可包含培养基,并且将微载体和附着于微载体的细胞保留在过滤元件中还可包括将培养基从腔室输送出。
一些实施方案涉及上述设备用于将细胞与微载体分离的用途。
一些实施方案涉及上述生物反应器用于将细胞与微载体分离的用途。
一些实施方案涉及上述生物反应器用于在混合过程期间交换预设体积的培养基的用途。
附图简述
图1a是根据一些实施方案的用于将细胞与微载体分离的设备的前视图;
图1b是根据一些实施方案的处于延伸状态的图1a的设备的前视图;
图2a是根据一些实施方案的用于将细胞与微载体分离的设备的前视图;
图2b是根据一些实施方案的处于延伸状态的图2a的设备的前视图;
图3是根据一些实施方案的用于将细胞与微载体分离的组件(包括图1a和1b的设备)的示意图;
图4a和4b是根据一些实施方案的将细胞与微载体分离的方法的工艺流程图;
图5a至5f是与图4a和4b的将细胞与微载体分离的方法相关联的图1a和1b的设备的示意图;
图5g和5h是与图4a和4b的将细胞与微载体分离的方法相关联的第二设备的示意图;
图6a和6b是根据一些实施方案的将细胞与微载体分离的方法的工艺流程图;并且
图7a和7b是与图6a和6b的方法相关联的图1a和1b的设备的腔室的示意图。
实施方案的说明
所描述的实施方案涉及用于将细胞与微载体分离的方法和设备。在一些实施方案中,所述设备包括用于接收混合物(诸如培养基、细胞和微载体)的腔室和从混合物中过滤微载体的过滤元件。腔室可包括基部和能够延伸和缩回的可调节主体。过滤元件可直接或间接地附接或联接到主体。可设置调节机构,其被构造来在被致动时与腔室协作,以使得腔室的主体的至少一部分可选择地延伸和缩回并且使过滤元件分别远离和朝向腔室的基部移动。以这种方式,可选择性地调节腔室,使得腔室能够用于如下所述的各种过程。在一些实施方案中,所述设备可用于执行将细胞与微载体分离的方法。在一些实施方案中,所述设备可用作生物反应器。在一些实施方案中,所述设备可用作生物反应器,并且可用于执行将细胞与微载体分离的方法和/或包括灌注和洗涤的其他生物反应器过程。
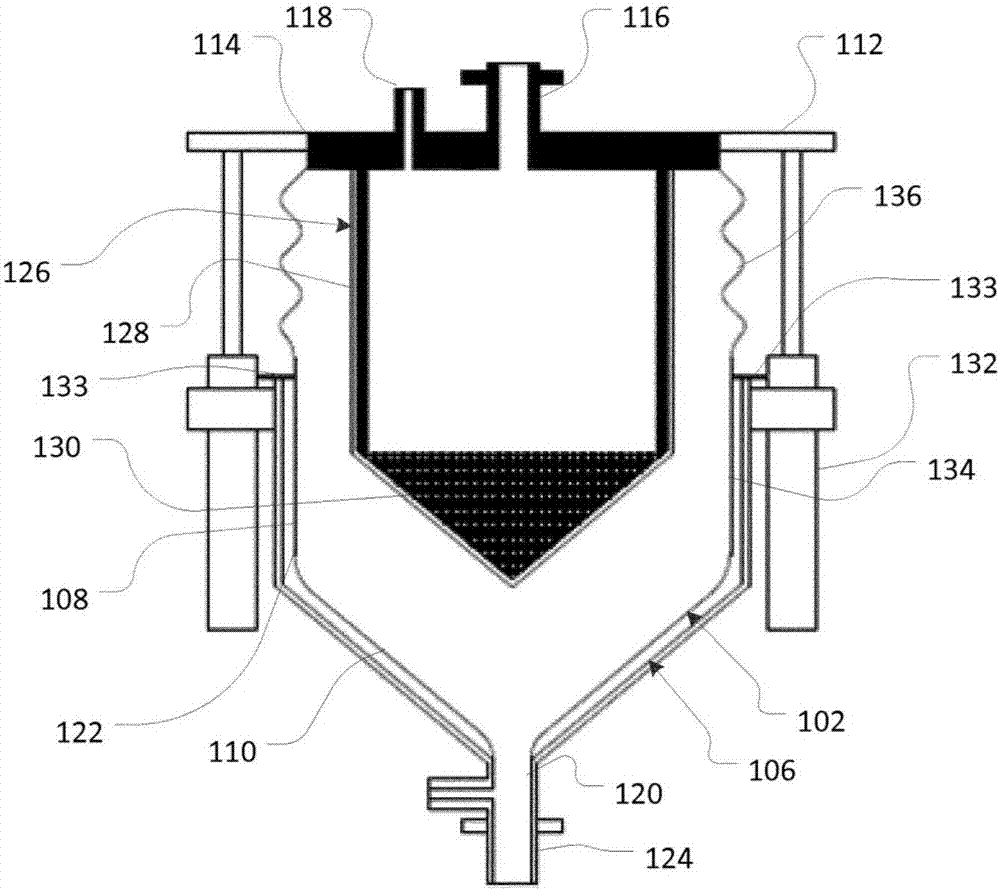
参考图1a和1b,示出根据一些实施方案的用于将细胞与微载体分离的设备100。设备100包括用于接收和容纳混合物的腔室102以及允许选择性地调节腔室102的调节机构104。在一些实施方案中,设备100可包括用于接收腔室102的外壳106。外壳106可以是被构造来协作地接收腔室102的容器或接受器。
腔室102可包括主体108和基部110。主体108可以是基本上细长的,并且基部110可从主体108逐渐变细。例如,主体108可以是基本上圆柱形的主体,并且基部110可以是基本上圆锥形的基部。在一些实施方案中,腔室102可包括联接或附接到腔室102的主体108的第一端部114的盖或盖子112。在一些实施方案中,盖112可包括圆盘。
主体108沿着其长度可以是可延伸的和可缩回的或可收缩的。例如,主体108可由柔韧的、可拉伸的或柔性的材料(诸如柔性材料)构成,以允许主体108延伸和缩回或压缩。在一些实施方案中,主体108可设置有波纹管或波纹(未示出),以允许主体108伸展和收缩。在一些实施方案中,调节机构104联接或附接到腔室102,并且主体108可响应于调节机构104的致动而相对于基部110延伸或缩回,如下文更详细讨论。
腔室102可包括入口/出口或端口116,以允许腔室102与待与其连接的导管(未示出)之间流体连通。例如,在一些实施方案中,入口/出口或端口116可朝向腔室102的第一端部114设置或设置在所述第一端部114处,并且可延伸穿过盖112。可设置入口/出口或端口116,以允许生物质被输送到腔室102。在一些实施方案中,还可设置入口118,以允许诸如空气和/或缓冲液的流体被输送到腔室102。例如,入口118可朝向腔室102的主体108的第一端部112设置或设置在所述第一端部112处,并且可延伸穿过盖112。
腔室102可包括入口/出口或端口120,以允许腔室102与待与其连接的导管(未示出)之间流体连通。例如,在一些实施方案中,入口/出口或端口120可设置在腔室102的基部110处,并且基部110可从主体108的第二端部122朝向端口120逐渐变细。在一些实施方案中,外壳106还可包括入口/出口或端口124,其被布置来与端口110协作,以允许腔室102与待与其连接的导管(未示出)之间流体连通。
如图1a和1b所示,设备100可包括诸如过滤袋的过滤元件126,其设置在腔室102内并且与端口116和入口118(如果存在)流体连通。过滤元件126可包括侧壁128和从侧壁128延伸的过滤器基部130,诸如锥形或圆锥形基部。过滤器基部130可包括筛网过滤器或由筛网过滤器构成。例如,筛网过滤器可被构造或设定尺寸以允许细胞穿过筛网过滤器并且过滤微载体或阻止微载体穿过筛网过滤器。
过滤元件126可直接联接或附接到腔室的主体108(例如,在主体108的第一端部114处)和/或腔室102的盖112。
如图1a和1b所示,在一些实施方案中,调节机构104可包括一个或多个致动器132。例如,一个或多个致动器132可包括电动汽缸或机械致动器,诸如凸轮。
一个或多个致动器132可直接或间接联接到腔室102的主体108。在一些实施方案中,一个或多个致动器132可联接到腔室102的主体的第一端部114和/或盖112,并且主体108可被构造来相对于腔室102的基部110移动,例如响应于一个或多个致动器132的选择性致动而远离或朝向腔室102的基部110移动。
在一些实施方案中,调节机构104可在位于主体108的第一端部114与第二端部122之间的区域处固定地联接或附接到腔室102的主体108,例如通过一个或多个凸缘133。因此,主体108可包括靠近主体108的第二端部122的相对固定区段134和靠近主体108的第一端部114的相对可调节区段136。例如,相对可调节区段136可被构造来响应于一个或多个致动器132的致动而延伸和缩回。
致动一个或多个致动器132以使得腔室102的主体108的第一端部114朝向基部110移动可使得腔室102的主体108的至少一部分(例如,相对可调节区段136)缩回或收缩,并且使得过滤元件126朝向腔室102的基部110移动,如图1a所示。类似地,致动致动器132以使得腔室102的主体108的第一端部114远离基部110移动可使得腔室102的主体108的至少一部分(例如,相对可调节区段136)延伸,并且使得过滤元件126远离腔室102的相对固定区段134和/或基部110移动,如图1b所示。
因此,响应于一个或多个致动器132的致动,腔室102可呈现至少部分或完全缩回或收缩的状态(如图1a所示),以及至少部分或完全延伸或伸展的状态(如图1b所示)。调节机构104使得腔室102能够在完全缩回状态、部分缩回状态、部分延伸状态与完全延伸状态之间转换,从而使过滤元件126朝向和远离腔室102的基部110移动。
过滤元件126的总体长度可小于腔室102的总体长度。在一些实施方案中,过滤元件126的侧壁128的长度小于腔室102的主体108的长度。在一些实施方案中,过滤器基部130被构造来与基部110协作,以在设备100处于缩回或压缩状态时允许过滤器基部130与腔室102的基部齐平或基本上齐平。
在一些实施方案中,设备100包括搅拌机构338(图3),以引发对腔室104内混合物的搅拌或混合。例如,搅拌机构338可包括振动台、下降凸轮和/或空气。
参考图2a和2b,示出根据一些实施方案的用于将细胞与微载体分离的设备200。设备200包括与图1a和1b所示的设备100的部件和元件类似的部件和元件,并且因此这些类似的部件和元件用相似的数字表示。
在一些实施方案中,设备200可以是生物反应器。例如,设备200可用作生物反应器并且可包括搅拌系统202,其包括叶轮204。在一些实施方案中,搅拌系统202可被构造来搅拌保留在腔室102的过滤元件126内的混合物206。例如,叶轮204可设置在腔室102的过滤元件126内。在一些实施方案中,叶轮204可联接到腔室212的主体108的第一端部114和/或盖112,并且可被构造来响应于调节机构104的致动而与过滤元件126一起相对于腔室102的基部110移动。设备200可包括或可不包括设备100的搅拌机构338。
在一些实施方案中,设备200可包括用于接收腔室102的支撑结构208。例如,支撑结构208可包括用于接收腔室102的基部110的座210(诸如圆锥形形状的座)和用于接收腔室102的主体部108的至少一部分的壁212。孔214可设置在座210中以容纳腔室102的端口120和外壳106的端口124。在一些实施方案中,支撑结构208还可包括支腿216,以允许座210升高并且相应地允许腔室102升高。
在一些实施方案中,腔室104的基部110可被构造来粘附到支撑结构208的座210。在一些实施方案中,粘合剂(未示出)设置在基部110的外表面和/或座210的内表面上。在一些实施方案中,真空端口(未示出)设置在支撑结构208中,并且可被构造来连接到真空泵,从而提供吸力以将基部110吸引或粘附到座210。
在一些实施方案中,外壳106可包括可调节基部(未示出),其能够在锥形或圆锥形形状的基部与可基本上平坦的平台基部之间选择性地转换。腔室102的基部110可被构造来与可调节基部协作,从而使得当外壳呈现平台基部或已经转换到平台基部时,基部110被压缩以贴合所述外壳。
参考图3,示出根据一些实施方案的用于将细胞与微载体分离的组件300的示意性概述。组件300包括设备100,其通过设置在生物反应器302与腔室102的端口116之间的生物反应器流体导管304来与生物反应器302流体连通。例如,生物反应器泵306可设置在流体导管304中,以将生物质从生物反应器302输送到设备100的腔室102。在一些实施方案中,腔室102被构造来将提供在其中的内容物保持在大约37℃的温度下。在一些实施方案中,腔室102可容纳在外壳(未示出)中,以促进腔室102的内容物保持在期望温度下和/或与其他流体导管连接。
组件300还可包括缓冲液罐310,其通过设置在缓冲液罐310与腔室102的端口116之间的缓冲液流体导管312来与设备100的腔室102流体连通。例如,缓冲液泵316可设置在缓冲液流体导管312中,以将缓冲液从缓冲液罐310输送到设备100的腔室102。在一些实施方案中,缓冲液罐310被构造来将缓冲液储存在例如大约37℃的设定温度下。
组件300还可包括空气罐318,其通过设置在空气罐318与腔室102的入口118之间的空气导管320来与设备100的腔室102流体连通。
组件300还可包括试剂罐324,其通过试剂流体导管326和导管332来与设备100的腔室102的端口120流体连通。试剂泵328可设置在试剂流体导管326中,以将试剂从试剂罐324输送到设备100的腔室102。在一些实施方案中,试剂罐324被构造来将试剂储存在例如大约37℃的设定温度下。例如,试剂可以是脱离剂。在一些实施方案中,脱离剂可包含酶,诸如胰蛋白酶。在一些实施方案中,脱离剂可包含非酶试剂,诸如阳离子螯合剂。
组件300还可包括抑制剂罐330。抑制剂罐330可通过设置在抑制剂罐330与腔室104的端口120之间的流体导管332来与设备100的腔室102流体连通。例如,抑制剂泵334可设置在流体导管332中,以将抑制剂从抑制剂罐330输送到腔室102。在一些实施方案中,抑制剂罐330被构造来将抑制剂储存在例如大约4℃的设定温度下。
在一些实施方案中,组件300还可包括具有第二腔室336的第二设备334。第二设备334还可包括搅拌机构338,其用于搅拌保持或容纳在第二腔室336中的混合物。第二腔室336可通过连接到第二腔室336的流入端口342的流体导管340来与设备100的腔室102的端口120流体连通。第二腔室336还可分别通过导管332、326和334以及320,并且例如通过流体导管340来与抑制剂罐324、试剂罐324和/或空气罐318流体连通。
可采用多个流量控制阀344来控制空气罐318、试剂罐324、抑制剂罐330、设备100的腔室102和/或第二设备334的第二腔室336之间的流体输送。
组件300还可包括收集接受器346,其用于接收来自设备100的腔室102的混合物和/或来自第二设备334的第二腔室336的混合物。例如,收集接受器346可通过收集导管348来与腔室102和/或第二腔室336流体连通,并且可与导管332流体连通。在一些实施方案中,收集接受器346可包括多个隔室350,其可被构造来接收用于循环利用、收集和/或废弃的混合物和/或物质。
导管304、312、320、326、332、340和348可各自包括适于输送流体的通道,并且可包括例如管件和/或管道。
参考图4a和4b,示出根据一些实施方案的将细胞与微载体分离的方法400的工艺流程。图5a至5f示出设备100的腔室102的示意图,并且图5g和5h示出与图4a和4b的工艺流程的将细胞与微载体分离的方法相关联的第二设备334的第二腔室336的示意图。
在402处,将包含培养基、细胞和微载体的混合物引入到设备100的腔室102中的过滤元件126中。如图1b所示,腔室102可呈现至少部分或完全延伸的状态,以允许更大的容量来接收混合物。将腔室102的内容物优选地保持在例如大约37℃的设定温度下。
在404处,将培养基通过设置在腔室102的基部110处的端口120从腔室102输送出,并且用过滤元件126过滤细胞及其附着的微载体,如图5a所示。在一些实施方案中,可打开设置在端口120处或其附近的流量控制阀344,以允许培养基从设备100的腔室102输送出。可将从第一腔室102输送出的培养基直接(例如,通过导管332)或间接(例如,通过第二设备334的第二腔室336和导管348)地输送到收集接受器346或收集接受器346的隔室350中的一个。可打开与第二设备334的第二腔室336相联的流量控制阀344,以允许培养基穿过第二腔室336通过导管348输送到收集接受器346或收集接受器346的隔室350中的一个。一旦将培养基输送到收集接受器346或输送到隔室350中的一个,就可关闭与第二腔室336相联的流量控制阀344。
在406处,来自空气罐318的空气可通过空气导管320输送到腔室102,以帮助促进培养基从腔室102输送出,如图5b所示。
在408处,致动调节机构104,以使得腔室102的主体108缩回或压缩以便减小设备的腔室102的容量,并且使得过滤元件126朝向腔室102的基部110移动。在410处,关闭设置在端口120处的流量控制阀344,以防止或阻止流体从腔室102流出,如图5c所示。
在412处,将试剂(例如,脱离剂)引入到腔室102,从而使得腔室102中的过滤元件126包括包含试剂、细胞和微载体的混合物。例如,可将试剂通过试剂导管326从试剂罐324输送出并且通过端口120引入到腔室102中。试剂可从基部108朝向腔室102的主体106蔓延或分散。在腔室的基部处将试剂引入到腔室102可改善混合物的渗透。采用试剂来促进细胞从微载体脱离或释放。在414处,使用搅拌机构136搅拌混合物以帮助细胞从微载体脱离或释放。
通过致动调节机构104,腔室102的主体106缩回,并且过滤元件126朝向腔室102的基部110移动。因此,细胞和细胞载体朝向腔室102的基部集中,并且可降低需要引入到腔室中以使得细胞从微载体脱离的脱离剂的量。
在416处,可将来自空气罐318的空气通过空气导管320输送到腔室102,以帮助促进试剂、细胞和微载体混合以及细胞从微载体脱离,如图5d所示。
在418处,打开设置在端口120处的流量控制阀344,以允许试剂和从微载体脱离的细胞从腔室102输送出,用过滤元件126过滤微载体并将其保留在所述过滤元件126中。在一些实施方案中,将试剂和脱离的细胞输送到第二设备334的腔室336。在一些实施方案中,可将空气输送到腔室102以促进来自腔室102的试剂和细胞混合,如图5e所示。例如,可将空气通过空气导管320从空气罐318输送到腔室102的入口118。
在420处,在一些实施方案中,可将缓冲液和空气输送到腔室102以清洗或冲洗掉来自腔室102的试剂和细胞,如图5f所示。例如,可将缓冲液通过导管312从缓冲液罐310输送到腔室102的端口116,并且可将空气通过空气导管320从空气罐318输送到腔室102的端口120。
在422处,将缓冲液、试剂和细胞混合物输送到第二设备334的第二腔室336。在一些实施方案中,如图5g所示,第二腔室336可包括阀或分流器元件352,以允许控制流体流入第二腔室336中。可关闭与第二腔室336相联的流量控制阀344,以禁止或防止缓冲液、试剂和细胞混合物从第二设备334的第二腔室336输送出。
在424处,将抑制剂(诸如试剂抑制剂)输送到第二腔室,以降低或抑制混合物中试剂的活性。在一些实施方案中,如图5g所示,可将抑制剂通过导管332从抑制剂罐330输送到第二腔室334。将第二腔室334的内容物优选地保持在例如大约4℃的设定温度下。
在426处,打开与第二腔室336相联的流量控制阀344,以允许将缓冲液、试剂、细胞和抑制剂混合物从第二设备334的第二腔室336输送到收集接受器346。可将空气引入到第二腔室336中,以帮助将缓冲液、试剂、细胞和抑制剂混合物从第二腔室336输送到收集接受器346。
参考图6a和6b,示出根据一些实施方案的将细胞与微载体分离的方法600的工艺流程。图5a至5d以及7a和7b示出与图6a和6b的工艺流程的将细胞与微载体分离的方法相关联的设备100的腔室102的示意图。
方法600的步骤602、604、606、608、610、612、614和616对应于方法400的步骤402、404、406、408、410、412、414和416。然而,与在引入抑制剂之前将试剂和从微载体脱离的细胞转移到另一个容器或腔室相反,方法600包括将抑制剂引入到设备100的腔室102。
如图7a所示,在618处,致动调节机构104以使得腔室102的主体108延伸,以便使得过滤元件126远离腔室102的基部110移动。例如,并且如图7a所示,升高过滤元件126或将其保持在离腔室102的基部110一定距离处。可将微载体保持在过滤元件126中或用所述过滤元件126过滤所述微载体,并且脱离的细胞和试剂可穿过过滤元件126并可朝向或保留在腔室102的基部110处。
在620处,在一些实施方案中,可将缓冲液和/或空气输送到腔室102,以清洗过滤元件126和腔室102并且使得试剂和细胞被冲洗通过过滤元件126。例如,可将缓冲液通过导管312从缓冲液罐310输送到腔室102,并且可将空气通过空气导管320从空气罐318输送到腔室102的入口118。
在622处,将试剂抑制剂引入到腔室102。将试剂抑制剂与包含细胞和试剂的混合物混合,以抑制混合物中试剂的活性。例如,在一些实施方式中,在脱离剂包含酶的情况下,试剂抑制剂是用于停止脱离剂反应的酶抑制剂。
如图7b所示,可将抑制剂通过端口120引入到设备100的腔室102,并且抑制剂可从基部110朝向腔室102的主体108蔓延或分散。在一些实施方案中,在腔室102的基部110处将抑制剂引入到腔室102可改善混合物的渗透。可将抑制剂通过抑制剂导管332从抑制剂罐330输送到腔室102。可降低腔室102的内容物的温度并且将其优选地保持在大约4℃的温度下。
在624处,打开流量控制阀344以允许将包含细胞、试剂、抑制剂和缓冲液(如果存在)的混合物从设备100的腔室102输送到收集接受器346。在一些实施方案中,可将空气和/或缓冲液引入到腔室102中以帮助将混合物从腔室102输送到收集接受器346。
如关于图2a和2b所讨论的,设备100可用作生物反应器设备200。上述方法400和600也可使用图2a和2b的生物反应器设备200而非设备100来执行。生物反应器设备200可用于执行细胞与微载体的分离以及包括灌注和洗涤的其他生物反应器过程。例如,生物反应器设备200可用于在混合过程期间交换预设体积的培养基。这将允许预设体积的培养基在不需要停止所述过程的情况下被交换,例如添加到生物反应器设备200和/或从其中去除。因此,所述过程可连续执行。此外,将不需要任何补充设备来交换预设体积的培养基。
本领域技术人员将理解,在不脱离本公开的广泛总体范围的情况下,可对上述实施方案进行多种变更和/或修改。因此,本实施方案视为在所有方面为说明性的而非限制性的。
- 还没有人留言评论。精彩留言会获得点赞!