重组分枝杆菌作为免疫治疗剂用于治疗癌症的制作方法
本发明涉及在癌症治疗中、特别是在实体肿瘤的治疗中用作免疫治疗试剂的重组分枝杆菌细胞。更具体而言,本发明涉及膀胱癌的免疫治疗。
泌尿道膀胱癌是第5种最常见的癌症。在美国,每年诊断大约75000例新病例,占所有新发癌症的4.5%,并且预计大约有15600例死亡。在德国,每年诊断大约16000个新病例。由于疾病的复发可能在膀胱癌中,所以患者必须经历长期监测。
大部分的膀胱癌开始于移行上皮细胞,该细胞构成了膀胱的内衬。随着这些肿瘤的生长,它们可以侵入周围的结缔组织和肌肉。在晚期疾病中,肿瘤扩散至膀胱以外,至附近的淋巴结或盆腔器官,或者转移至更远端的器官,例如肺、肝脏和骨骼。
膀胱癌的整体5年生存率为77%,并且在过去的10年中,该生存率尚未明显改变。当通过分期来考虑时,具有局限于膀胱内层的肿瘤的患者的5年相对生存率分别为96%和69%。对于疾病局部扩散至膀胱以外的那些患者而言,上述生存率下降至34%,具有远端转移的患者的生存率降至6%。
对于患有非肌层浸润性膀胱癌的患者而言,治疗通常涉及手术除去肿瘤,然后在膀胱内进行化疗,通常为丝裂霉素c(所谓的膀胱内化疗)。在由手术恢复后,具有较低的疾病进展风险的患者可以经历监测或进一步的膀胱内化疗。中度至重度疾病的患者通常接受减毒活菌(卡介苗(bcg))的膀胱内免疫治疗。bcg是首个fda批准的免疫治疗,其有助于通过刺激靶向细菌和任何膀胱癌细胞的免疫应答而降低膀胱癌复发的风险。但是,发现在一些患者中bcg治疗的有效性低,特别是在重复给予之后。
用于肌层浸润性膀胱癌患者的标准治疗包括基于顺铂的化疗,然后手术除去膀胱,或者放疗和联合化疗。复发的膀胱癌可以使用组合治疗方案进行治疗,包括吉西他滨加顺铂或甲氨蝶呤,长春碱,阿霉素加顺铂。
在膀胱癌的治疗中,肿瘤复发是主要关注的问题,甚至对于轻度疾病的患者也是如此,需要大量的随访。更好的治疗(例如新型免疫治疗)可能降低复发率并改善膀胱癌患者的生存。
表达吞噬溶酶体逃逸结构域(phagolysosomalescapedomain)的重组bcg菌株在wo99/101496中有描述,该文献的内容以引用方式并入本文。吞噬溶酶体逃逸结构域能够通过使吞噬小体的膜穿孔而使得菌株由被感染的宿主细胞的吞噬小体中逃逸。为了提供用于最佳吞噬溶酶体逃逸活性的酸性吞噬小体ph,研发出了一种脲酶缺陷型重组菌株。该菌株在wo2004/094469中公开,该文献的内容以引用方式并入本文。
wo2012/085101(该文献的内容以引用方式并入本文)公开了单核细胞增多性李斯特菌(listeriamonocytogenes)的表达膜穿孔李斯特菌溶血素(hly)的重组bcg菌株,并且在临床前模型中,与亲代bcg相比,脲酶c的缺乏会诱导更优异的对抗结核分枝杆菌(mycobacteriumtuberculosis(mtb))的产气攻击的保护。此外,已经显示重组的和亲代的菌株均诱导显著的th1免疫应答,而仅重组bcg菌株还激发强烈的th17应答。
在近来的研究中,发现在动物模型中,重组脲酶缺陷型且表达李斯特菌溶血素的重组bcg菌株与亲代bcg相比,会诱导优异的免疫应答。
本发明的主题是用作免疫治疗剂、用于实体肿瘤治疗的重组分枝杆菌细胞,其包含编码融合多肽的重组核酸分子,其中所述的融合多肽包含:
(a)能够激发免疫应答的结构域;以及
(b)吞噬溶酶体逃逸结构域。
本发明的另一个方面涉及在有此需要的受试对象中对实体肿瘤进行免疫治疗的方法,其包括向所述的受试对象给予重组的分枝杆菌细胞,所述的重组分枝杆菌细胞包含编码融合多肽的重组核酸分子,其中所述的融合多肽包含:
(a)能够激发免疫应答的结构域;以及
(b)吞噬溶酶体逃逸结构域。
根据本发明,发现将重组bcg细胞膀胱灌注(vesicularinstillation)至大鼠的膀胱中后惊人地导致了淋巴细胞对泌尿膀胱组织的浸润增加,特别是cd4-和cd8-阳性淋巴细胞,导致高发生率的局灶性和/或多局灶性淋巴细胞浸润。与其相反,使用标准的bcg处理的动物的泌尿膀胱组织显示仅在单细胞浸润水平(弥漫性浸润)的cd4-和cd8-阳性淋巴细胞。此外,给予重组bcg细胞不会产生任何安全问题。
近来实施了i/ii期临床试验,其对在标准bcg治疗后复发的非肌层浸润性膀胱癌人类患者中膀胱内灌注重组bcg的安全性和功效进行评估。
因此,本发明还涉及上文所述的重组分枝杆菌细胞,其在实体肿瘤的治疗中用作免疫治疗试剂从而获得局灶性和/或多局灶性淋巴细胞浸润,例如在给予位点具有cd4和cd8t细胞。本发明的重组分枝杆菌细胞特别适用于人类医疗。
免疫治疗试剂为活的重组分枝杆菌细胞,其包含编码融合多肽的重组核酸分子,所述的融合多肽包含(a)能够激发免疫应答的结构域;以及(b)吞噬溶酶体逃逸结构域。能够激发免疫应答的结构域优选为得自病原体或其免疫原性片段的免疫原性肽或多肽。
分枝杆菌细胞优选为牛分枝杆菌(m.bovis)细胞,结核分枝杆菌(m.tuberculosis)细胞,特别是减毒结核分枝杆菌细胞或其他的分枝杆菌,例如m.microti,耻垢分枝杆菌(m.smegmatis),m.canettii,m.marinum或偶发分枝杆菌(m.fortuitum)。更优选地,所述的细胞为减毒的重组牛分枝杆菌(bcg)细胞,特别是牛分枝杆菌bcg细胞,特别是得自丹麦株布拉格亚型的重组牛分枝杆菌bcg细胞(broschetal.,proc.natl.acad.sci.usa,104(2007),5396-5601)。在一个特别优选的实施方案中,分枝杆菌细胞为重组的脲酶缺陷型的。在一个特别优选的实施方案中,分枝杆菌的urec序列被灭活(δurec),例如通过构建包含urec基因的自杀载体,其中所述的urec基因被选择性标记基因(例如潮霉素基因)破坏;使用所述的载体转化靶细胞;以及筛选具有脲酶阴性表型的选择性标记阳性细胞。在一个甚至更优选的实施方案中,选择性标记基因(例如潮霉素基因)随后被灭活。在该实施方案中,所述的细胞为不含选择性标记的重组分枝杆菌细胞。更优选地,所述的细胞为不含选择性标记的重组bcg丹麦株布拉格亚型,其表征为重组bcgδurec::hly+。
能够激发免疫应答的结构域优选地选自得自牛分枝杆菌、结核分枝杆菌或m.leprae的免疫原性肽或多肽,或者它们的免疫原性片段,其长度为至少6个、优选为至少8个氨基酸,更优选为至少9个氨基酸,例如多达20个氨基酸。合适的抗原的具体实例为得自结核分枝杆菌的ag85b(p30),得自牛分枝杆菌bcg的ag85b(α-抗原),得自结核分枝杆菌的ag85a,得自结核分枝杆菌的esat-6,以及它们的片段。在其他的实施方案中,能够激发免疫应答的结构域选自非分枝杆菌多肽。
更优选地,所述免疫原性结构域衍生自抗原ag85b。最优选地,免疫原性结构域包含seqidno.2中aa.41至aa.51的序列。
重组核酸分子进一步包含吞噬溶酶体逃逸结构域,即提供融合多肽由吞噬溶酶体逃逸至哺乳动物细胞的细胞溶质中的多肽结构域。优选地,吞噬溶酶体逃逸结构域为李斯特菌吞噬溶酶体逃逸结构域,其在us5,733,151中描述,所述的文献以引用方式并入本文。更优选地,吞噬溶酶体逃逸结构域衍生自单核细胞增多性李斯特菌的李斯特菌溶血素基因(hly)。最优选地,吞噬溶酶体结构域由选自以下的核酸分子编码:(a)包含如seqidno.1所示核苷酸211-1722的核苷酸序列;(b)编码与得自(a)的序列相同的氨基酸序列的核苷酸序列;以及(c)在严谨条件下与得自(a)或(b)的序列杂交的核苷酸序列。
除了seqidno.1所述的核苷酸序列,本发明还包含与其杂交的核酸序列。在本发明中,术语“杂交”如sambrook等人(molecularcloning.alaboratorymanual,coldspringharborlaboratorypress(1989),1.101-1.104)中定义的使用。根据本发明,如果在55℃下使用1xssc和0.1%sds洗涤1小时(优选地在62℃下,更优选地在68℃下)后,特别是在55℃下在0.2xssc和0.1%sds中洗涤1小时(优选地在62℃下,更优选地在68℃下)后,可以观察到阳性杂交信号,则使用术语“杂交”。在此类洗涤条件下,与根据seqidno.1的核苷酸序列杂交的序列为编码题述发明中优选的核苷酸序列的吞噬溶酶体逃逸结构域。
上文所述的编码吞噬溶酶体逃逸结构域的核苷酸序列可以直接得自李斯特菌有机体或者任何重组来源,例如包含相应的利斯特菌核酸分子或者其上文所述的变体的重组大肠杆菌(e.coli)细胞。
优选地,编码融合多肽的所述重组核酸分子包含编码信号肽的序列。更优选地,信号序列为在分枝杆菌中、优选地在牛分枝杆菌中有活性的信号序列,例如天然的牛分枝杆菌信号序列。合适的信号序列的优选实例为编码ag85b信号肽的核苷酸序列,其如seqidno.1的核苷酸1至120所示。
此外,优选在免疫原性结构域和吞噬溶酶体逃逸结构域之间提供肽连接子。优选地,所述的肽连接子的长度为5至50个氨基酸。更优选地,所述的序列编码seqidno.1的核苷酸154至210所示的连接子,或者与其相应的序列(考虑到遗传密码的简并性)。
所述的核酸可以位于重组载体中。优选地,所述的重组载体为原核载体,即,包含原核细胞中用于复制和/或基因组整合的元件的载体。优选地,重组载体携带与表达控制序列可操作地连接的本发明的核酸分子。表达控制序列优选为在分枝杆菌(特别是牛分枝杆菌)中具有活性的表达控制序列。所述的载体可以为染色体外载体或适用于整合至染色体中的载体。此类载体的实例是本领域技术人员已知的,例如在上述sambrook等人给出的。
本发明的免疫治疗试剂适用于治疗实体肿瘤,例如膀胱、肺、肝脏、乳房、肾脏或前列腺肿瘤。具体而言,本发明适用于治疗非浸润性实体肿瘤。在一个特别优选的实施方案中,实体肿瘤为膀胱癌,例如非浸润性膀胱癌,例如非浸润性原位乳头状癌(ta),原位非浸润性癌(tcis),浸润至上皮下结缔组织的肿瘤(t1),浸润至表层肌的肿瘤(内侧一半)(t2a),浸润至深层肌的肿瘤(外侧一半)(t2b),浸润至膀胱周围组织的肿瘤(t3,包括t3a和t3b),浸润至前列腺、子宫或阴道的肿瘤(t4a),以及浸润至骨盆壁或腹壁的肿瘤(t4b)。具体而言,所述的肿瘤为原位浅表肿瘤或癌(tcis),非侵入性乳头状癌(ta),或浸润至上皮下结缔组织的肿瘤(t1)。所述免疫治疗法适用于治疗原发性肿瘤和/或治疗复发性肿瘤。
免疫治疗试剂优选地局部给予肿瘤位点,即,在手术之前或手术之后,以及可任选地在化疗之后,给予到原发性肿瘤的位点。对于泌尿道膀胱癌的治疗而言,所述的药剂优选地通过膀胱灌注至泌尿膀胱中而给予。对于其他肿瘤而言,所述的给予可以涉及局部注射,或者在肺部肿瘤的情况下,可以通过肺部给予。
本发明的免疫治疗试剂可以作为患者中的一线免疫治疗法给予,其中所述的患者之前未使用抗肿瘤免疫治疗试剂例如bcg治疗过;或者作为患者中的后续免疫治疗法给予,其中所述的患者之前已经使用抗肿瘤免疫治疗试剂例如标准的bcg治疗过。免疫治疗试剂可以给予新诊断的实体肿瘤,例如膀胱癌;或者给予患者,特别是患有复发性实体肿瘤、例如膀胱癌的患者。
免疫治疗试剂以有效剂量给予待治疗的受试对象。对于人类受试对象而言,给予剂量可以为大约106至1010活力单位(cfu),例如大约107至109,或者108至109活力单位。优选地,在治疗过程中在预定的时间多次给予所述免疫治疗试剂,例如至少3次或至少5次,至多达30次,特别地大约15次。
免疫治疗试剂通常作为药物制剂给予,该药物制剂中包含固体形式的重组分枝杆菌细胞,例如冻干的或低温保存的制剂,其在使用前用合适的液体载体重新构建。备选地,所述的制备物可以以液体形式提供,例如悬浮液。
在一个实施方案中,给予本发明的免疫治疗试剂用于治疗原位癌。标准的方案可以包括每周一次给予所述的试剂进行至少4周(例如4,5,6,7或8周),作为诱导治疗。直至原位肿瘤手术后的2-3周之后才开始诱导治疗。在例如4周的无治疗间隔期间后,可以使用维持疗法继续用药,进行至少6个月或至少1年。
在另一个实施方案中,在肿瘤复发的预防治疗中,在诱导治疗中给予所述免疫治疗试剂。在该实施方案中,可以在肿瘤位点的活组织检查后大约2-3周开始治疗,并且例如以每周一次的间隔重复治疗,进行至少4周,例如4,5,6,7或8周。在中等和高风险肿瘤中,上述治疗后可以接着进行维持治疗。
维持治疗可以包括长期治疗,例如6,9或12个月的治疗或者甚至更长时间,进行每月一次的治疗。备选地,维持治疗可以包括以每周一次的间隔,在第3,6,12,18,24,30和36个月给予2,3或4次。
在另一个实施方案中,免疫治疗试剂(特别是重组bcgδurec::hly+)用于在标准的bcg治疗后复发患者的非肌层浸润性膀胱癌的治疗。根据时间表将免疫治疗试剂给予膀胱,其中所述的时间表涉及在诱导期每周一次灌注,例如6次每周一次的灌注;在大约3个月后的第一维持期,采用例如3次每周一次的灌注;在大约6个月后的第二维持期,采用例如3次灌注;以及在大约12个月后的第三维持期,采用例如3次灌注。
如上文所述,关于重组分枝杆菌细胞的免疫治疗试剂向实体肿瘤位点的施用可以与其他的抗肿瘤治疗结合使用,例如放疗和/或化疗。此外,上文所述的免疫治疗可以与重组分枝杆菌细胞的非肿瘤位点特异性给予结合,从而提供免疫系统的一般刺激。这种非位点特异性给予可以如wo2012/085101中所述来实施,例如在原发性肿瘤手术之前。在这种情况下,所述的药剂优选地以大约1-10x105、优选地大约2-8x105个细胞的剂量给予人类受试对象。所述的药剂优选地以单一剂量给予,例如通过注射。皮下注射是优选的。此外,优选的是给予不具有佐剂的所述药剂。
此外,通过以下附图和实施例1-3更详细地描述本发明。
在这些实施例中使用的免疫治疗试剂“rbcg”为重组牛分枝杆菌(bcg)丹麦株布拉格亚型,其具有灭活的urec序列(δurec),而且不具有功能性的选择标记基因,其表达ag85b/hly融合蛋白质,如seqidno.2(hly+)所示。
实施例1.在膀胱内灌注后重组bcg(rbcg)在大鼠中的单剂量毒性研究
1.1研究的实施
测试项目冻干的rbcg(rbcg丹麦株布拉格亚型δurec::hly+w/o功能性选择标记基因)
大致的活菌数5.41×108cfu/小瓶
参照项目bcgmedac
大致的活菌数2×108至2×109cfu/小瓶
测试物种/菌株/原种大鼠/
饲养机构charlesriverlaboratories,researchmodels,and
services,germanygmbh
sandhoferweg7
97633sulzfeld,germany
动物的数量和性别23只雌性动物;
第1组3只动物;
第2至5组5只动物
剂量方案第1组:对照(稀释剂)
第2组:~2×106cfurbcg(冻干的)/动物
第3组:~2×108cfurbcg(冻干的)/动物
第4组:~2×106cfurbcg(冷冻的,无冷冻保护剂)/动物
第5组:~2×106cfubcgmedac/动物
给药途径膀胱的膀胱内灌注
给药频率在测试第1天单次剂量
给药体积500μl/动物
研究时间·12天适应
·4周活体测试
·28天温育
1.2结果
死亡率没有动物在成熟前死亡
临床迹象在任何处理中未观察到任何动物有行为、外观或粪便情况的改变
体重在整个研究的过程中,所有剂量组的所有动物的体重均在正常范围内
食物和饮水消耗在整个研究的过程中,所有剂量组的所有动物的食物摄取均在正常范围内
饮用水消耗的肉眼评定未显示任何与测试或参照项目相关的影响
il-2水平所有组的所有动物的尿和血清中的il-2水平均低于定量下限
宏观的尸检发现未观察到与测试或参照项目相关的改变
器官重量未观察到与测试或参照项目相关的改变
cfu计数rbcg(第2组至第4组)相比于对照(第1组)
对于使用2×106或2×108cfurbcg(冻干的)/动物,或者2×106cfurbcg(冷冻的)/动物通过膀胱内灌注处理一次的动物的检查器官和血液而言,未观察到与测试项目相关的cfu计数。具体而言在测试项目灌注后4周,对于泌尿膀胱而言,根本未记录到cfu计数,表明施用的分枝杆菌由灌注位点快速清除。在使用2x106或2x108cfurbcg(冻干的)/动物或使用2x106cfurbcg(冷冻的)/动物处理的动物与对照动物之间,未记录到差异。
bcgmedac(第5组)相比于对照(第1组)对于使用2×106bcgmedac/动物通过膀胱内灌注处理一次的动物的检查器官和血液而言,未记录到与参照项目相关的cfu计数。具体而言,在参照项目灌注后4周,对于泌尿膀胱而言,根本未记录到cfu计数,表明给予的分枝杆菌由灌注位点快速清除。
在使用2x106bcgmedac/动物处理的动物与对照动物之间,未记录到差异。
rbcg(第2组至第4组)相比于bcgmedac(第5组)
与使用2×106cfubcgmedac/动物以相同方式处理的参照组相比,对于使用2×106或2×108cfurbcg(冻干的)/动物,或者2×106cfurbcg(冷冻的)/动物通过膀胱内灌注处理一次的动物的检查器官和血液而言,未记录到cfu计数的差异。
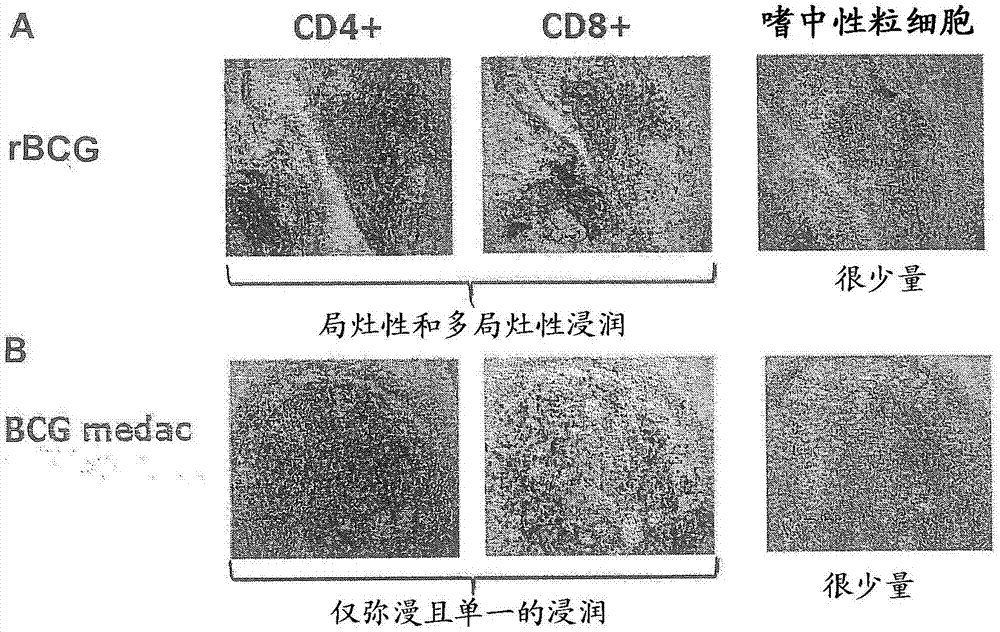
免疫组织化学泌尿膀胱组织中淋巴细胞亚型的免疫组织化学表明,在使用2×106或2×108cfurbcg(冻干的)/动物通过膀胱内灌注处理一次的第2组和第3组中,具有cd4和cd8阳性细胞的局灶性和/或多局灶性淋巴细胞浸润的发生率最高,而第1组(对照)、第4组和第5组中仅在单细胞浸润水平(弥漫性浸润)表达cd4和cd8阳性淋巴细胞。第1组(对照)、第4组和第5组的几乎所有动物(13只中的12只)仅在单细胞浸润水平(弥漫性浸润)表达cd4和cd8阳性淋巴细胞。相反,除了弥漫性浸润以外,第2组和第3组的几乎所有动物(10只中的9只)在局灶性和/或多局灶性淋巴细胞浸润中包含cd4和cd8阳性淋巴细胞。
在所检查的任何载片中,极少能检测到嗜中性粒细胞。
综上,对于使用测试项目、参照项目或稀释剂处理的动物,未观察到毒性迹象。对于通过膀胱内灌注的处理而言,在rbcg和bcgmedac之间,分枝杆菌在血液和器官中的系统性扩散没有差异。与对照动物相比,对于使用rbcg的膀胱内灌注处理一次的动物的检查器官和血液,未观察到与测试项目相关的cfu计数。具体而言,在测试项目灌注后4周,对于泌尿膀胱而言根本没有观察到cfu计数,表明给予的分枝杆菌由灌注位点快速清除。
泌尿膀胱组织中淋巴细胞亚型分析的免疫组织化学表明,在使用2×106或2×108cfurbcg/动物通过膀胱内灌注处理一次的第2组和第3组中,具有cd4和cd8阳性细胞的局灶性和/或多局灶性淋巴细胞浸润的发生率最高,而第1组(对照)、第4组和第5组仅在单细胞浸润水平(弥漫性浸润)表达cd4和cd8阳性淋巴细胞。第1组(对照)、第4组和第5组的几乎所有动物(13只中的12只)仅在单细胞浸润水平(弥漫性浸润)表达cd4和cd8阳性淋巴细胞。相反,除了弥漫性浸润以外,第2组和第3组的几乎所有动物(10只中的9只)在局灶性或多局灶性淋巴细胞浸润中包含cd4和cd8阳性淋巴细胞。图1a显示在给予rbcg后局灶性和/或多局灶性淋巴细胞浸润。图1b显示在给予bcgmedac后仅弥漫性的单浸润(200x放大)。
实施例2.膀胱内灌注后大鼠中重组bcg(rbcg)的重复剂量毒性研究
2.1研究的实施
测试项目冻干的rbcg(rbcg丹麦株布拉格亚型δurec::hly+w/o功能性选择标记基因)
大致的活菌数5.41×108cfu/小瓶
参照项目bcgmedac
大致的活菌数2×108至2×109cfu/小瓶
测试物种/菌株/原种大鼠/
饲养机构charlesriverlaboratories,researchmodels,and
services,germanygmbh
sandhoferweg7
97633sulzfeld,germany
动物的数量和性别23只雌性动物;
第1组3只动物;
第2至5组5只动物
剂量方案第1组:对照(稀释剂)
第2组:~2×106cfurbcg(冻干的)/动物
第3组:~2×108cfurbcg(冻干的)/动物
第4组:~2×106cfurbcg(冷冻的,无冷冻保护剂)/动物
第5组:~2×106cfubcgmedac/动物
给予途径膀胱的膀胱内灌注
给予频率重复给予;每周一次,在测试第1,8,15,22,29和36天给予
给予体积500μl/动物
研究时间·21天适应
·9周活体测试
·28天温育
1.2结果
死亡率没有动物在成熟前死亡
临床迹象在任何处理中未观察到任何动物有行为、外观或粪便情况的改变
体重在整个研究的过程中,所有剂量组的所有动物的体重均在正常范围内
食物和饮水消耗在整个研究的过程中,所有剂量组的所有动物的食物摄取均在正常范围内
饮用水消耗的肉眼评定未表明有任何测试或参照项目相关的影响
il-2水平所有组的所有动物的尿和血清中的il-2水平均低于定量下限
延迟型超敏反应(dth测试)未观察到延迟型超敏反应
宏观尸检发现未观察到与测试或参照项目相关的改变
器官重量未观察到与测试或参照项目相关的改变
cfu计数rbcg(第2组至第4组)相比于对照(第1组)
对于使用2×106或2×108cfurbcg(冻干的)/动物,或者2×106cfurbcg(冷冻的,无冷冻保护剂)/动物通过膀胱内灌注处理6次的动物的检查器官和血液而言,未观察到与测试项目相关的cfu计数。具体而言,在测试项目最后灌注后4周,对于泌尿膀胱而言,根本未记录到cfu计数,表明给予的分枝杆菌由灌注位点快速清除。
在使用2x106或2x108cfurbcg(冻干的)/动物或使用2x106cfurbcg(冷冻的)/动物处理的动物与对照动物之间,未观察到差异。
bcgmedac(第5组)相比于对照(第1组)
对于使用2×106bcgmedac/动物通过膀胱内灌注处理6次的动物的检查器官和血液而言,未记录到与参照项目相关的cfu计数。具体而言,在参照项目最后一次灌注后4周,对于泌尿膀胱而言,根本未记录到cfu计数,表明给予的分枝杆菌由灌注位点快速清除。在使用2x106bcgmedac/动物处理的动物与对照动物之间,未观察到差异。
rbcg(第2组至第4组)相比于bcgmedac(第5组)
与使用2×106cfubcgmedac/动物以相同方式处理的参照组相比,对于使用2×106或2×108cfurbcg(冻干的)/动物,或者2×106cfurbcg(冷冻的)/动物通过膀胱内灌注处理6次的动物的检查器官和血液而言,未记录到cfu计数的差异。
免疫组织化学泌尿膀胱组织中淋巴细胞亚型分析的免疫组织化学表明,在使用2×106cfurbcg/动物通过6次膀胱内灌注处理的第2组中,具有cd4和cd8阳性细胞的多局灶性淋巴细胞浸润的发生率最高,然后是使用2×108cfurbcg/动物通过6次膀胱内灌注处理的第3组,而第1组(对照)、第4组和第5组的动物仅在单细胞浸润水平(弥漫性浸润)表达cd4和cd8阳性淋巴细胞。
在所检查的任何载片中,极少检测到嗜中性粒细胞。
综上,对于使用测试项目、参照项目或稀释剂处理的动物,未记录到毒性迹象。对于通过膀胱内灌注的处理而言,在rbcg和bcgmedac之间,分枝杆菌在血液和器官中的系统性扩散没有差异。与对照动物相比,对于使用rbcg的膀胱内灌注处理6次的动物的检查器官和血液,未记录到与测试项目相关的cfu计数。具体而言,在测试项目最后一次灌注后4周,对于泌尿膀胱而言,根本未记录到cfu计数,表明给予的分枝杆菌由灌注位点快速清除。泌尿膀胱组织中淋巴细胞亚型分析的免疫组织化学表明,在使用2×106cfurbcg/动物通过6次膀胱内灌注处理的第2组中,具有cd4和cd8阳性细胞的多局灶性淋巴细胞浸润的发生率最高,然后是使用2×108cfurbcg/动物通过6次膀胱内灌注处理的第3组,而第1组(对照)、第4组和第5组的动物仅在单细胞浸润水平(弥漫性浸润)表达cd4和cd8阳性淋巴细胞。图2a显示在给予rbcg后局灶性和多局灶性淋巴细胞浸润。图2b显示在给予bcgmedac后仅有弥漫性的且单一的浸润(200x放大)。
实施例3.在标准的bcg治疗后具有复发非肌层浸润性膀胱癌的人类患者中,评估膀胱内灌注重组bcg(rbcg)的安全性和效力的i/ii期开放式标记临床试验
3.1临床方案
重组bcg(如上文定义)目前作为通过灌注至膀胱中的i/ii期临床试验的一部分应用于临床。临床试验i/ii期的目的在于评估在标准的bcg治疗后具有复发非肌层浸润性膀胱癌的人类患者中膀胱内灌注rbcg的安全性和效力。每周一次灌注将rbcg给予至膀胱中,共15次(诱导期:灌注1-6;维持3个月:灌注7-9,维持6个月:灌注10-12;维持12个月:灌注13-15)。
i期的主要终点是在非肌层浸润性膀胱癌中在标准bcg治疗后具有复发的患者中,膀胱内rbcg灌注的剂量限制性毒性(dlt)。dlt时期相当于3次灌注加1周,并且涵盖处理诱导的急性毒性。以2群(每群3人)处理患者,遵循3+3的设计规则(剂量递降规则:如果在剂量水平1下处理的患者显示dlt迹象,则灌注的rbcg剂量将降低至水平-1,其是水平1的十分之一)。
剂量水平如下:
·剂量水平1:1-19.2x108cfu的rbcg
·剂量水平-1:1-19.2x107cfu的rbcg
3.2目前的状态
临床试验目前为在i期时间框架内,在switzerland的试验地点(basel,geneva,chur,bern,bellinzona,st.gallen)招募患者。
最初的3名患者(群1)的dlt期在2016年2月23日结束。该群的安全性数据(包括dlt数据)由申办者收集,并传输至theindependentsafetydatacommittee(isdc)。由于未观察到dlt,所以使下一群3名患者(第2群)同时登记,并将重组bcg剂量保持在剂量水平1。收到isdc的批准,所有与试验有关的各方都由申办者在2016年3月9日这天通知上述情况。此外,在评价时期内,在该群患者中未观察到肿瘤复发。
目前第二群的募集正在进行,并且第一名患者已经登记在该群中。
序列表
<110>vakzineprojektmanagementgmbh
<120>重组分枝杆菌作为免疫治疗剂用于治疗癌症
<130>60182pep
<160>2
<170>bissap1.0
<210>1
<211>1881
<212>dna
<213>人工序列
<220>
<221>来源
<222>1..1881
<223>/分子类型="dna"
/备注="重组核酸分子"
/生物体="人工序列"
<220>
<221>来源
<222>1..1881
<223>/分子类型="dna"
/备注="包含吞噬溶酶体结构域(211-1722nt)和终止密码子(1879-1881)的cds"
/生物体="人工序列"
<400>1
atgacagacgtgagccgaaagattcgagcttggggacgccgattgatgatcggcacggca60
gcggctgtagtccttccgggcctggtggggcttgccggcggagcggcaaccgcgggcgcg120
ttctcccggccggggctgccggtcgagtacctgcagtctgcaaagcaatccgctgcaaat180
aaattgcactcagcaggacaaagcacgaaagatgcatctgcattcaataaagaaaattca240
atttcatccatggcaccaccagcatctccgcctgcaagtcctaagacgccaatcgaaaag300
aaacacgcggatgaaatcgataagtatatacaaggattggattacaataaaaacaatgta360
ttagtataccacggagatgcagtgacaaatgtgccgccaagaaaaggttacaaagatgga420
aatgaatatattgttgtggagaaaaagaagaaatccatcaatcaaaataatgcagacatt480
caagttgtgaatgcaatttcgagcctaacctatccaggtgctctcgtaaaagcgaattcg540
gaattagtagaaaatcaaccagatgttctccctgtaaaacgtgattcattaacactcagc600
attgatttgccaggtatgactaatcaagacaataaaatcgttgtaaaaaatgccactaaa660
tcaaacgttaacaacgcagtaaatacattagtggaaagatggaatgaaaaatatgctcaa720
gcttatccaaatgtaagtgcaaaaattgattatgatgacgaaatggcttacagtgaatca780
caattaattgcgaaatttggtacagcatttaaagctgtaaataatagcttgaatgtaaac840
ttcggcgcaatcagtgaagggaaaatgcaagaagaagtcattagttttaaacaaatttac900
tataacgtgaatgttaatgaacctacaagaccttccagatttttcggcaaagctgttact960
aaagagcagttgcaagcgcttggagtgaatgcagaaaatcctcctgcatatatctcaagt1020
gtggcgtatggccgtcaagtttatttgaaattatcaactaattcccatagtactaaagta1080
aaagctgcttttgatgctgccgtaagcggaaaatctgtctcaggtgatgtagaactaaca1140
aatatcatcaaaaattcttccttcaaagccgtaatttacggaggttccgcaaaagatgaa1200
gttcaaatcatcgacggcaacctcggagacttacgcgatattttgaaaaaaggcgctact1260
tttaatcgagaaacaccaggagttcccattgcttatacaacaaacttcctaaaagacaat1320
gaattagctgttattaaaaacaactcagaatatattgaaacaacttcaaaagcttataca1380
gatggaaaaattaacatcgatcactctggaggatacgttgctcaattcaacatttcttgg1440
gatgaagtaaattatgatcctgaaggtaacgaaattgttcaacataaaaactggagcgaa1500
aacaataaaagcaagctagctcatttcacatcgtccatctatttgccaggtaacgcgaga1560
aatattaatgtttacgctaaagaatgcactggtttagcttgggaatggtggagaacggta1620
attgatgaccggaacttaccacttgtgaaaaatagaaatatctccatctggggcaccacg1680
ctttatccgaaatatagtaataaagtagataatccaatcgaatatgcattagcctatgga1740
agtcagggtgatcttaatccattaattaatgaaatcagcaaaatcatttcagctgcagtt1800
ctttcctctttaacatcgaagctacctgcagagttcgttaggcgcggatccggaattcga1860
agcttatcgatgtcgacgtag1881
<210>2
<211>626
<212>prt
<213>人工序列
<220>
<221>来源
<222>1..626
<223>/分子类型="蛋白质"
/备注="对应于氨基酸序列seqidno:1"
/生物体="人工序列"
<400>2
metthraspvalserarglysileargalatrpglyargargleumet
151015
ileglythralaalaalavalvalleuproglyleuvalglyleuala
202530
glyglyalaalathralaglyalapheserargproglyleuproval
354045
glutyrleuglnseralalysglnseralaalaasnlysleuhisser
505560
alaglyglnserthrlysaspalaseralapheasnlysgluasnser
65707580
ilesersermetalaproproalaserproproalaserprolysthr
859095
proileglulyslyshisalaaspgluileasplystyrileglngly
100105110
leuasptyrasnlysasnasnvalleuvaltyrhisglyaspalaval
115120125
thrasnvalproproarglysglytyrlysaspglyasnglutyrile
130135140
valvalglulyslyslyslysserileasnglnasnasnalaaspile
145150155160
glnvalvalasnalaileserserleuthrtyrproglyalaleuval
165170175
lysalaasnsergluleuvalgluasnglnproaspvalleuproval
180185190
lysargaspserleuthrleuserileaspleuproglymetthrasn
195200205
glnaspasnlysilevalvallysasnalathrlysserasnvalasn
210215220
asnalavalasnthrleuvalgluargtrpasnglulystyralagln
225230235240
alatyrproasnvalseralalysileasptyraspaspglumetala
245250255
tyrsergluserglnleuilealalyspheglythralaphelysala
260265270
valasnasnserleuasnvalasnpheglyalailesergluglylys
275280285
metglnglugluvalileserphelysglniletyrtyrasnvalasn
290295300
valasngluprothrargproserargphepheglylysalavalthr
305310315320
lysgluglnleuglnalaleuglyvalasnalagluasnproproala
325330335
tyrileserservalalatyrglyargglnvaltyrleulysleuser
340345350
thrasnserhisserthrlysvallysalaalapheaspalaalaval
355360365
serglylysservalserglyaspvalgluleuthrasnileilelys
370375380
asnserserphelysalavaliletyrglyglyseralalysaspglu
385390395400
valglnileileaspglyasnleuglyaspleuargaspileleulys
405410415
lysglyalathrpheasnarggluthrproglyvalproilealatyr
420425430
thrthrasnpheleulysaspasngluleualavalilelysasnasn
435440445
serglutyrilegluthrthrserlysalatyrthraspglylysile
450455460
asnileasphisserglyglytyrvalalaglnpheasnilesertrp
465470475480
aspgluvalasntyraspprogluglyasngluilevalglnhislys
485490495
asntrpsergluasnasnlysserlysleualahisphethrserser
500505510
iletyrleuproglyasnalaargasnileasnvaltyralalysglu
515520525
cysthrglyleualatrpglutrptrpargthrvalileaspasparg
530535540
asnleuproleuvallysasnargasnileseriletrpglythrthr
545550555560
leutyrprolystyrserasnlysvalaspasnproileglutyrala
565570575
leualatyrglyserglnglyaspleuasnproleuileasngluile
580585590
serlysileileseralaalavalleuserserleuthrserlysleu
595600605
proalagluphevalargargglyserglyileargserleusermet
610615620
serthr
625
- 还没有人留言评论。精彩留言会获得点赞!