基于宫颈癌特异性甲基化检测的引物对、试剂盒及方法与流程
本发明涉及体外诊断
技术领域:
,特别的,涉及一种基于宫颈癌特异性甲基化检测的引物对、试剂盒及方法。
背景技术:
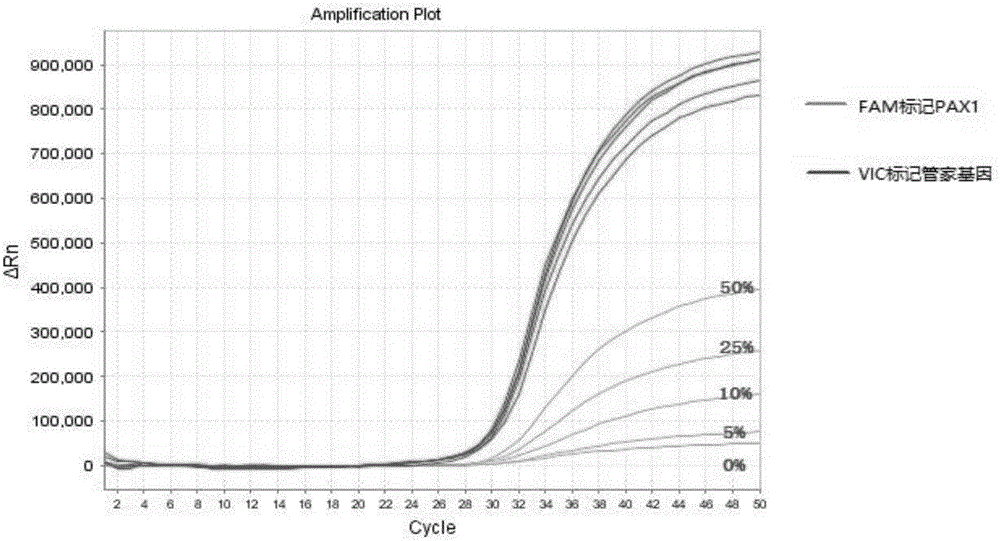
:宫颈癌是最为常见的妇科恶性肿瘤之一,是危害女性健康与生命的主要疾病。流行病学调查显示,每年全球有46.5万宫颈癌新发病例,其中中国每年约有13万新发病例。目前宫颈癌的发病年龄趋于年轻化,受宫颈癌侵害的女性多处于生儿育女及经营家庭的黄金时期。宫颈癌不同于其他肿瘤,疾病自然史明确,有一系列的癌前病变,它的发生和发展是由量变到质变、渐变到突变,要经历几年到十几年的过程。因此,宫颈癌的防治关键在于通过筛查及时发现和治疗宫颈病变,终止其向宫颈癌的发展。因而,早发现、早诊断及早治疗对于提高宫颈癌治疗效果具有重大意义。目前采用的宫颈癌常规筛查技术包括:巴氏涂片法:该技术灵敏度低,特异性一般,检测方法人为干扰因素较大,结果准确性有限及成本低;液基薄层细胞学检测(Thin-CytologicTest,TCT):该技术灵敏度低,特异性高,检测方法需要人工观察分析且易干扰,对非典型鳞状细胞诊断率不高,无法检查宫颈腺癌;HPV-DNA检测:该技术灵敏度高,特异性低,检测方法通量高,适用于大规模临床筛查,但是假阳性率高,只能预警而非早期发现;HPV-E6E7mRNA检测:该技术灵敏度高,特异性一般,检测方法分型体系复杂,RNA不稳定,检测的是病毒而非个体基因,也只能预警而非早期发现。上述这些方法均存在操作繁琐、假阳性率高、灵敏度低等缺点,限制了其在临床实验室的准确筛查。近期宫颈癌DNA甲基化研究表明,PAX1的DNA甲基化改变与宫颈癌的病情进展相关联。PAX1基因在宫颈癌变的发生机制中起到潜在的抑癌作用,PAX1基因的高甲基化可以促进宫颈癌的发生。因此检测宫颈癌PAX1基因启动子的甲基化状态,对宫颈癌的筛查具有重要的意义。目前,传统的甲基化检测方法包括:甲基化特异性PCR及亚硫酸氢盐测序法。然而这些方法存在操作繁琐、准确性低及敏感性不高的缺点,限制了其在临床实验室的广泛应用。因此,有必要提供一种新的宫颈癌PAX1基因的甲基化检测方法来克服上述缺陷。技术实现要素:为了解决上述传统甲基化检测方法存在操作繁琐、准确性低及敏感性不高的技术问题,本发明提供一种操作简单、准确性高及敏感性高且基于荧光PCR技术的基于宫颈癌特异性甲基化检测的引物对、试剂盒及其方法。本发明提供了一种基于宫颈癌特异性甲基化检测的引物对,包括针对PAX1基因和ACTB基因的启动子区的特异性引物及探针,如下:PAX1正向引物:5'-GTGGAGAGTGTTTTGGGAGGG-3'(SEQIDNO.1),PAX1反向引物:5'-CTACCRCCCRCTCCAAAACC-3'(SEQIDNO.2),PAX1检测探针:5'FAM-TAGTAGCGGCGGCGGT-3'MGB(SEQIDNO.3);ACTB正向引物:5'-GGTTAGGAAGGAGGTTGTTTGTTTT-3'(SEQIDNO.4),ACTB反向引物:5'-ATCATCTTTCCCACCAAACTATAACC-3'(SEQIDNO.5),ACTB检测探针:5'VIC-CCCATTAACTAAACACAACCT-3'MGB(SEQIDNO.6)。本发明还提供了一种基于宫颈癌特异性甲基化检测的试剂盒,包括含有如上述引物及探针的PCR反应液,所述PCR反应液包括:PAX1正向引物、PAX1反向引物、PAX1检测探针,ACTB正向引物、ACTB反向引物、ACTB检测探针,10×PCRbuffer,dNTP及无核酸酶水。在本发明提供的所述试剂盒的一种较佳实施例中,所述试剂盒还包括ExTaq酶。在本发明提供的所述试剂盒的一种较佳实施例中,所述PCR反应液的成分终浓度为:1×PCRbuffer,0.4μMPAX1正向引物、0.4μMPAX1反向引物、0.4μMPAX1检测探针,0.4μMACTB正向引物、0.4μMACTB反向引物、0.4μMACTB检测探针,0.25mMdNTP。在本发明提供的所述试剂盒的一种较佳实施例中,所述试剂盒还包括阳性对照品及阴性对照品,所述阳性对照品为甲基化标准品DNA,所述阴性对照品为非甲基化标准品DNA。其中所述甲基化标准品DNA如SEQIDNO.7所示:AAATTGATTttCGtACGtTGtAGttTttCGGTtAGACGAATTTtTtttAATCGGATGAAGTTtAtttTGGGttTGGGGTCGCGGGCGTGGAGAGTGTttTGGGAGGGGGtAGtAGCGGCGGCGGtAGGtttTGGAGCGGGCGGtAGCGCGtTtCGtTGtCGCGtAtAGCGCGTtTttAGttCGCGGtTGGGtCGtCGCGGtTtTCG;所述非甲基化标准品DNA如SEQIDNO.8所示:AAATTGATTtttGtAtGtTGtAGttTtttGGTtAGAtGAATTTtTtttAATtGGATGAAGTTtAtttTGGGttTGGGGTtGtGGGtGTGGAGAGTGTttTGGGAGGGGGtAGtAGtGGtGGtGGtAGGtttTGGAGtGGGtGGtAGtGtGtTttGtTGttGtGtAtAGtGtGTtTttAGtttGtGGtTGGGttGttGtGGtTtTtGGt。本发明还提供了一种基于宫颈癌特异性甲基化检测的方法,包括如下步骤:步骤一:取待检测样本抽提的DNA,对其进行转化处理,转化后的DNA作为PCR的模板;步骤二:提供上述基于宫颈癌特异性甲基化检测的试剂盒,对所述模板进行PCR扩增;步骤三:根据PAX1与ACTB基因PCR扩增结果的相对荧光CT值来确定待检测样本的甲基化率,即待检测样本中PAX1/ACTB的比值除以阳性对照品中PAX1/ACTB的比值。在本发明提供的所述方法的一种较佳实施例中,所述步骤一中转化处理所采用的试剂为亚硫酸氢盐或重亚硫酸盐。在本发明提供的所述方法的一种较佳实施例中,所述步骤二中PCR扩增反应程序为:95℃变性10min;50cycles,95℃15sec,60℃30sec。相较于现有技术,本发明提供的基于宫颈癌特异性甲基化检测的引物对、试剂盒及方法的有益效果在于:通过设计特异性高的引物及探针,并配置成使用方便且检测结果可靠的试剂盒,再设计出科学合理的PCR反应体系,使得本发明具有快速、高通量、灵敏及特异性好的特点,实现对宫颈癌PAX1基因的甲基化程度快速及准确测量,以便对宫颈癌间接进行及时、有效的诊断和治疗,降低医疗成本,节约社会资源。附图说明图1为针对不同甲基化率样本的PCR扩增曲线图;图2为利用本发明引物对及试剂盒所能检测出的最低检出限的PCR扩增曲线图。具体实施方式为了使本发明的目的、技术方案及优点更加清楚明白,下面结合附图及实施例,对本发明进行进一步的详细说明。应当理解,此处所描述的具体实施例仅用以解释本发明,并不用于限定本发明。实施例1:试剂盒的制备一、引物和探针的设计与合成针对人基因组中PAX1基因和内标基因ACTB(β-actin)的启动子区(序列参见NCBI数据库公开的人类全基因组序列),使用PrimerPremier3.0及MethylPrimerExpressv1.0软件,分别设计一对特异性引物及探针。特异性引物及探针序列,如下表所示:二、对照品选择使用甲基化标准品DNA为阳性对照品,其序列为:AAATTGATTttCGtACGtTGtAGttTttCGGTtAGACGAATTTtTtttAATCGGATGAAGTTtAtttTGGGttTGGGGTCGCGGGCGTGGAGAGTGTttTGGGAGGGGGtAGtAGCGGCGGCGGtAGGtttTGGAGCGGGCGGtAGCGCGtTtCGtTGtCGCGtAtAGCGCGTtTttAGttCGCGGtTGGGtCGtCGCGGtTtTCG;非甲基化标准品DNA为阴性对照品,其序列为:AAATTGATTtttGtAtGtTGtAGttTtttGGTtAGAtGAATTTtTtttAATtGGATGAAGTTtAtttTGGGttTGGGGTtGtGGGtGTGGAGAGTGTttTGGGAGGGGGtAGtAGtGGtGGtGGtAGGtttTGGAGtGGGtGGtAGtGtGtTttGtTGttGtGtAtAGtGtGTtTttAGtttGtGGtTGGGttGttGtGGtTtTtGGt。三、PCR反应液组成包括含有上述特异性引物及探针的PCR反应液,所述PCR反应液包括:PAX1正向引物:5'-GTGGAGAGTGTTTTGGGAGGG-3',PAX1反向引物:5'-CTACCRCCCRCTCCAAAACC-3',PAX1检测探针:5'FAM-TAGTAGCGGCGGCGGT-3'MGB,ACTB正向引物:5'-GGTTAGGAAGGAGGTTGTTTGTTTT-3',ACTB反向引物:5'-ATCATCTTTCCCACCAAACTATAACC-3',ACTB检测探针:5'VIC-CCCATTAACTAAACACAACCT-3'MGB;10×PCRbuffer,dNTP及无核酸酶水。其中,所述10×PCRbuffer、dNTP及无核酸酶水均购自大连宝生物(宝生物(大连)工程有限公司);所述无核酸酶水为(Nuclease-FreeWater)用DEPC(Diethylpyrocarbonate,焦碳酸二乙酯)处理过并经高温高压灭菌的超纯水。所述PCR反应液成分的终浓度为:1×PCRbuffer,0.4μM(μmol/L)PAX1正向引物,0.4μMPAX1反向引物,0.4μMPAX1检测探针;0.4μMACTB正向引物,0.4μMACTB反向引物,0.4μMACTB检测探针;0.25mM(mmol/L)dNTP。所述试剂盒还包括ExTaq酶,购自大连宝生物(宝生物(大连)工程有限公司);所述ExTaq酶的活性维持更好,相对于普通Taq可以有效扩增更长的片段。实施例2:利用上述试剂盒进行宫颈癌甲基化检测的方法一、技术原理在人基因组中PAX1基因和内标基因ACTB(b-actin)的启动子区分别设计一对特异性的甲基化检测的引物及探针。然后用该引物及探针去扩增经亚硫酸盐转化的样本DNA,根据PAX1与ACTB基因PCR扩增结果的相对荧光CT值来确定待测样本的甲基化率,根据甲基化率来评判宫颈癌变的风险。二、检测方法步骤一:取待检测样本抽提的DNA,对其进行转化处理,转化后的DNA作为PCR的模板;其中,转化处理所采用的试剂为亚硫酸氢盐或重亚硫酸盐,及其他辅助(相应试剂盒为购自德国QIAGEN公司的EpiTectFastDNABisuLfiteKit)。步骤二:提供上述基于宫颈癌特异性甲基化检测的试剂盒,对所述模板进行PCR扩增;其中,PCR扩增反应程序为:95℃变性10min;50cycles,95℃15sec、60℃30sec。步骤三:根据PAX1与ACTB基因PCR扩增结果的相对荧光CT值来确定待检测样本的甲基化率,即待检测样本中PAX1/ACTB的比值除以阳性对照品中PAX1/ACTB的比值。具体检测方法,如下:一)收集生物样本:选自2016年3-6月期间在湖南省肿瘤医院就诊的30例C1N1宫颈脱落细胞、30例C1N2患者宫颈脱落细胞、30例C1N3宫颈癌患者宫颈脱落细胞、90例正常人群的宫颈脱落细胞。二)提取组织DNA:以下提取样本组织DNA所用的试剂成分均选自湖南宏灏基因生物科技有限公司的《人外周血基因组DNA提取试剂盒(滤过柱法)》(备案号:湘长械备20150166)。1)将取回的样本充分震荡1min,取出宫颈刷。2)取无菌的1.5mLEP管,加入1.5ml样品,12000rpm离心1.5min;倒掉上部废液,收集管底沉淀。3)重复步骤2)将所有的样本处理完。4)依次加入20μL蛋白酶K、250μL裂解液ABL,涡旋振荡10s,65℃水浴15min,期间振荡混匀2-3次。5)取出后加入250μL无水乙醇,涡旋振荡10sec,短暂离心5sec。6)将吸附柱插入收集管中,将上一步所得混合液转移至吸附柱中。10,000rpm离心1min。7)弃收集管中废液,将吸附柱重新放入收集管;加入500μL洗液I,10,000rpm,离心1min。8)弃收集管中废液,加入700μL洗液II,10,000rpm,离心1min,。弃废液。(洗液II使用前需加入无水乙醇至80%)9)重复步骤8)一次。10)弃流出液,将吸附柱插回收集管,空转离心,13,000rpm,2min。11)将吸附柱插入到新的EP管中。加入30-100μLDNA溶解液(65℃预热可提高DNA获得率),室温静置5min。12)再次10,000rpm,离心1min。弃吸附柱,EP管内液体即为DNA溶液。2-8℃保存,若需长期保存则置于-20℃或更低温度。三)DNA转化流程:1)将提取的DNA配置亚硫酸盐转化体系配置:2)亚硫酸盐转化的运行体系:反应温度反应时间95℃5min60℃10min95℃5min60℃10min20℃∞3)亚硫酸盐转化后DNA纯化:以下对亚硫酸盐转化后DNA纯化所用的试剂成分均选自德国QIAGEN公司的EpiTectFastDNA亚硫酸氢钠试剂盒。a)将亚硫酸转化后的产物转移至1.5ml的EP管中;b)小于100ng/μLDNA需加1μLCarrierRNA到BufferBL中,若浓度大于100ng/μL则无需加CarrierRNA;c)加310μLBufferBL混匀;d)再加250μL无水乙醇,混匀15sec;e)将以上的混合物转移至过滤柱,10000rpm离心1min;f)弃滤液,加500μLBufferBW,10000rpm离心1min;g)弃滤液,加500μLBufferBD静止15min,10000rpm离心1min;h)弃滤液,加500μLBufferBW,10000rpm离心1min;i)重复步骤h);j)弃滤液,加250μL无水乙醇,10000rpm离心1min;k)弃滤液,再12000rpm空转1min;l)加15μLBufferEB室温静止1min,10000rpm离心1min;m)将收集的DNA保存于-20℃。四)PCR流程1、使用的PCR仪器为美国ABI7500型实时荧光定量PCR系统(购自LifeTech(appliedbiosystems公司),反应体系为20μL;2、PCR反应体系配制及条件,如下表所示:PCR反应体系:成分反应体积(μL)PCR反应液18.3μLExTaq酶0.2μL亚硫酸盐转化后的DNA模板1.5μLPCR反应程序:五)结果分析用待测样本中PAX1/ACTB的比值除以阳性对照(甲基化标准品DNA)中PAX1/ACTB的比值,来计算PAX1甲基化比例。甲基化率计算公式为借用相对定量的公式计算出待检测样本的甲基化率,公式如下所示。2-△△CT=2待测样本(PAX1CT-ACTBCT)-全甲基化样本(PAX1CT-ACTBCT)部分样本甲基化率数据,如下表所示:序号编号样本△CTMean△△CT甲基化率100%19.85717.7930115%9.9297.8640.0041215%4.8112.7470.1491335%3.4771.4130.37614100%2.06401基于本发明的具体实验数据参见图1和图2,其中图1为针对不同甲基化率样本的PCR扩增曲线图,可以得出不同甲基化率样本PAX1基因扩增曲线与ACTB管家基因的扩增曲线关系;图2为利用本发明引物对及试剂盒所能检测出的最低检出限的PCR扩增曲线图,本发明设计的引物及试剂盒可检测出最低检出限为10%的甲基化率样本,与非甲基化样本有显著区别。本发明提供的基于宫颈癌特异性甲基化检测的引物对、试剂盒及方法的有益效果在于:通过设计特异性高的引物及探针,并配置成使用方便且检测结果可靠的试剂盒,再设计出科学合理的PCR反应体系,使得本发明具有快速、高通量、灵敏及特异性好的特点,实现对宫颈癌PAX1基因的甲基化程度快速及准确测量,以便对宫颈癌间接进行及时、有效的诊断和治疗,降低医疗成本,节约社会资源。以上所述仅为本发明的实施例,并非因此限制本发明的专利范围,凡是利用本发明说明书内容所作的等效流程变换,或直接或间接运用在其它相关的
技术领域:
,均同理包括在本发明的专利保护范围内。SEQUENCELISTING<110>韩林志<120>基于宫颈癌特异性甲基化检测的引物对、试剂盒及方法<130>2017<160>8<170>PatentInversion3.5<210>1<211>21<212>DNA<213>人工序列<400>1gtggagagtgttttgggaggg21<210>2<211>20<212>DNA<213>人工序列<400>2ctaccrcccrctccaaaacc20<210>3<211>16<212>DNA<213>人工序列<400>3tagtagcggcggcggt16<210>4<211>25<212>DNA<213>人工序列<400>4ggttaggaaggaggttgtttgtttt25<210>5<211>26<212>DNA<213>人工序列<400>5atcatctttcccaccaaactataacc26<210>6<211>21<212>DNA<213>人工序列<400>6cccattaactaaacacaacct21<210>7<211>206<212>DNA<213>人工序列<400>7aaattgattttcgtacgttgtagtttttcggttagacgaattttttttaatcggatgaag60tttattttgggtttggggtcgcgggcgtggagagtgttttgggagggggtagtagcggcg120gcggtaggttttggagcgggcggtagcgcgtttcgttgtcgcgtatagcgcgtttttagt180tcgcggttgggtcgtcgcggttttcg206<210>8<211>208<212>DNA<213>人工序列<400>8aaattgatttttgtatgttgtagttttttggttagatgaattttttttaattggatgaag60tttattttgggtttggggttgtgggtgtggagagtgttttgggagggggtagtagtggtg120gtggtaggttttggagtgggtggtagtgtgttttgttgttgtgtatagtgtgtttttagt180ttgtggttgggttgttgtggtttttggt208当前第1页1 2 3
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1