岩藻黄质衍生物及其制备方法和应用与流程
本发明涉及化合物及其制备方法,具体涉及一种岩藻黄质衍生物及其制备方法和应用,尤其涉及岩藻黄质衍生物在制备治疗癌症的药物中应用。
背景技术:
岩藻黄质(fucoxanthin)亦称褐藻黄素,是自可食用褐藻中,如裙带菜(翅藻科,undariapinnatifida),海带(laminariajaponicaaresch)中提取出来的天然类胡萝卜素,在其刚性全反式长链的两端分别有一个化学性质活泼的5,6-环氧非饱和丙二烯键结构,因而又异于其他类胡萝卜素分子,具有很强的生物活性。近年来它的多种生物学活性已被证实,一些潜在的活性也正在被科学家们积极探求之中,目前己成为当今海洋药物研究与开发的主攻热点之一。
中药或天然药物在化合物类型、结构上表现出多样性和复杂性,是一个天然形成的“组合化学样品库”,已成为新药研发中发现先导化合物的重要来源。我国拥有丰富的中草药资源,从中提取分离得到的先导化合物,并对其进行结构修饰,增强药理活性、降低毒副作用,改善药代动力学性质,是实现中药现代化和创新新药的有效途径。
目前,国内外关于岩藻黄质衍生物的报道较少。岩藻黄醇是目前已知的岩藻黄质衍生物之一,是其脱去一个乙酰基的代谢产物,其结构与岩藻黄质的结构类似,具有很强的生物活性。近年来研究表明,小鼠口服岩藻黄质后可将其转化为岩藻黄质衍生物而得到利用。hayatomaeda等研究也发现3t3-l1细胞系中的岩藻黄质代谢产物岩藻黄质衍生物可以通过减少pparγ(过氧化物酶体增殖激活受体)从而达到抑制3t3-l1前成脂肪细胞系到脂肪细胞系分化的目的,从而达到减肥的效果。目前国内外尚未见到岩藻黄质系列衍生物批量制备研究的报道,不能对岩藻黄质系列衍生物产品进行高值化开发应用,因此,有必要发明一种高纯岩藻黄质系列衍生物的制备方法,研究系列岩藻黄质衍生物的生物活性,为系列衍生物功能性产品的开发应用提供重要基础。
技术实现要素:
本发明的目的在于提供一系列岩藻黄质衍生物及其制备方法和应用,通过半合成制备了五种岩藻黄质衍生物,并阐明其生物活性,证明其具有显著的抑制肿瘤细胞活性,在制备治疗癌症药物中具有广阔的应用前景。
具体而言,本发明一方面涉及岩藻黄质衍生物或其盐,其特征在于,结构如下式(ⅰ)-式(ⅴ)所示:
本发明中所述的衍生物的盐包括但不限于,无机酸盐,无机酸例如为盐酸、硫酸、磷酸、硝酸、碳酸、硼酸、氨基磺酸和氢溴酸,或有机酸的盐,有机酸例如为乙酸、丙酸、丁酸、酒石酸、马来酸、羟基马来酸、富马酸、苹果酸、柠檬酸、乳酸、粘酸、葡糖酸、苯甲酸、琥珀酸、草酸、苯乙酸、甲磺酸、甲苯磺酸、苯磺酸、水杨酸、对氨基苯磺酸、天门冬氨酸、谷氨酸、依地酸、硬脂酸、棕榈酸、油酸、月桂酸、泛酸、鞣酸、抗坏血酸和戊酸。
本发明第二方面在于提供一种药物组合物,其中包含上述岩藻黄质衍生物或其盐作为活性成分,以及可作为药用辅料。
所述可作为药用辅料为药学领域常规的稀释剂、赋形剂、填充剂、粘合剂、湿润剂、崩解剂、吸收促进剂、表面活性剂、吸附载体、润滑剂等。
优选地,剂型为注射剂、胶囊剂、片剂、散剂、口服液。
本发明第三方面涉及所述的岩藻黄质衍生物或其盐在制备治疗癌症的药物中的应用。
其中所述的癌症包括但不限于恶性黑色素瘤、胰腺癌、甲状腺未分化癌、转移性骨恶性肿瘤、白血病、淋巴癌、骨瘤、软骨肉瘤、前列腺癌、食道癌、胃癌、肝癌、胆囊癌、直肠癌、大肠癌、结肠癌、肺癌、鼻咽癌、神经系统癌、乳腺癌、卵巢癌、宫颈癌、子宫癌。
本发明第四方面在于提供所述岩藻黄质衍生物的制备方法,包括以下步骤:
1)、以岩藻黄质或者含岩藻黄质的提取物为原料;
2)、将原料用溶剂溶解,加入一定比例还原剂还原反应得含有岩藻黄质衍生物的反应液;
3)、将反应液浓缩至干,采用硅胶柱色谱进行初步分离,得到含不同岩藻黄质衍生物的组分;
4)、将各部分分离液浓缩至干,加入流动相溶解,采用半制备/制备型液相色谱分离纯化得到制备液相纯化液;
5)将各部分制备液相纯化液分别浓缩,后将浓缩液进行干燥,得到岩藻黄质衍生物各组分,进行结构解析,确定化合物分别为:式(ⅰ)、式(ⅱ)、式(ⅲ)、式(ⅳ)、式(ⅴ)所示。
优选地,步骤2)中所述的溶剂为有机溶剂,优选甲醇、乙醇、四氢呋喃。
优选地,步骤2)中所述原料与还原剂的重量比为50:1至1:1。可选自50:1,40:1,30:1,20:1,10:1,5:1,1:1。
优选地,还原剂为硼氢化钠、氢化铝锂、氯化亚锡、草酸、硼氢化钾、硫酸亚铁、亚硫酸钠等的一种或者几种组合;其中最优选氢化铝锂。
优选地,步骤2)中所述的反应温度为20-50℃,可选自25℃、30℃、35℃、40℃、45℃、50℃;反应时间为0.5-48h,可选自0.5h、1h、2h、4h、8h、10h、12h、16h、20h、24h、48h。
优选地,步骤3)中所述的硅胶柱色谱进行初步分离,硅胶柱可选择正相硅胶和反相硅胶。
优选地,步骤3)中所述的采用正相硅胶柱层析时,洗脱剂可选石油醚-乙酸乙酯或石油醚-丙酮为洗脱剂,比例为20:1-1:1,采用反相硅胶柱色谱柱层析时,洗脱剂可选甲醇-水或乙醇-水,比例为7:3至10:0。
优选地,步骤4)中所述的流动相为甲醇-水、乙腈-水、乙醇-水三种体系溶剂以及该三种体系溶剂以任意比例混合的溶剂。
优选地,所述的岩藻黄质衍生物的制备方法,步骤4)为,将步骤3)获得的岩藻黄质衍生物系列衍生物组分用流动相溶解,转入半制备/制备型高效液相色谱进样瓶中,启动半制备/制备型高效液相色谱进行分离纯化,通过紫外在线检测信号触发馏分收集器自动收集岩藻黄质衍生物纯化液。
优选地,步骤4)所述半制备/制备型高效液相色谱采用的半制备/制备柱填料为c8柱或c18柱。
优选地,步骤4)所述半制备/制备型高效液相色谱采用的半制备/制备柱的直径为10-50mm。
优选地,步骤4)所述的半制备/制备型高效液相色谱采用的进样量为100μl/次-20ml/次。
优选地,步骤4)所述的半制备/制备型高效液相色谱采用的流动相流速为5-200ml/min,优选5、6、10、20、28、50、80、100、120、150、180、200ml/min。
优选地,步骤4)所述的半制备/制备型高效液相色谱采用的检测器为紫外检测器或二极管阵列检测器,检测波长为400-500nm,优选450nm。
优选地,步骤5)中的系列岩藻黄质衍生物纯化液进行减压浓缩后,取浓缩液进行冷冻干燥,获得五种高纯岩藻黄质衍生物,分别为式(ⅰ)、式(ⅱ)、式(ⅲ)、式(ⅳ)、式(ⅴ)。
附图说明
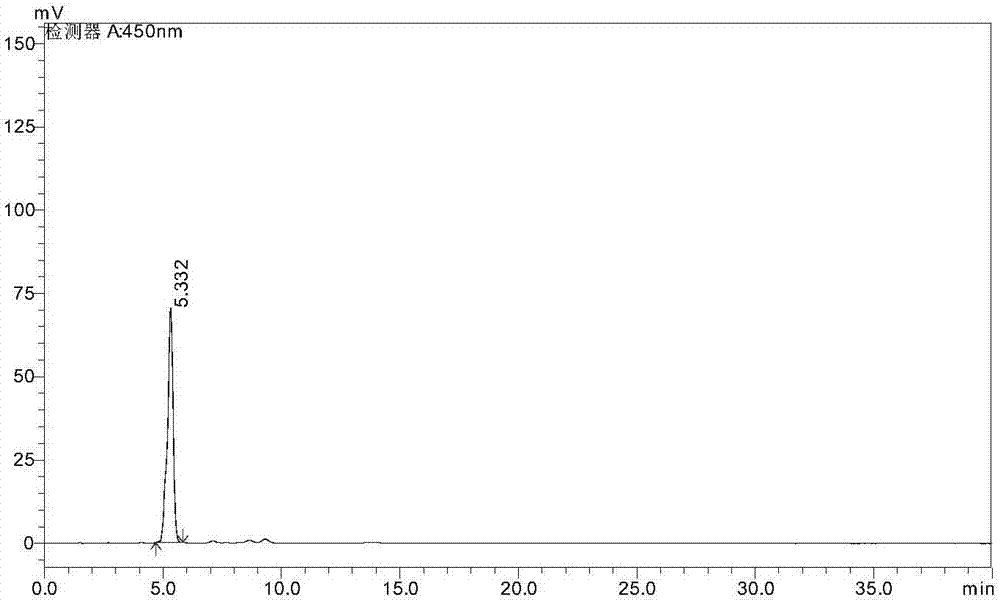
图1表示岩藻黄质衍生物混合物色谱图
图2表示表示式(ⅰ)化合物的图谱,其中图2-1表示式(ⅰ)化合物的液相色谱图,图2-2表示式(ⅰ)化合物的氢谱图,图2-3表示式(ⅰ)化合物的碳谱图;
图3表示式(ⅱ)化合物的图谱,其中图3-1表示式(ⅱ)化合物的液相色谱图,图3-2表示式(ⅱ)化合物的氢谱图,图3-3表示式(ⅱ)化合物的碳谱图;
图4表示式(ⅲ)化合物的图谱,其中图4-1表示式(ⅲ)化合物的液相色谱图,图4-2表示式(ⅲ)化合物的氢谱图,图4-3表示式(ⅲ)化合物的碳谱图;
图5表示式(ⅳ)化合物的图谱,其中图5-1表示式(ⅳ)化合物的液相色谱图,图5-2表示式(ⅳ)化合物的氢谱图,图5-3表示式(ⅳ)化合物的碳谱图;
图6表示式(ⅴ)化合物的图谱,其中图6-1表示式(ⅴ)化合物的液相色谱图,图6-2表示式(ⅴ)化合物的氢谱图,图6-3表示式(ⅴ)化合物的碳谱图;
具体实施方式
实施例1
1)岩藻黄质衍生物混合物的制备:取岩藻黄质(纯度为99%)500mg,用甲醇200ml溶解,加入氢化铝锂100mg,于37℃下反应10h后,液相色谱检测有多个岩藻黄质衍生物色谱峰,浓缩至近干,备用;
2)岩藻黄质衍生物混合物初步分离:取岩藻黄质衍生物浓缩物,采用硅胶柱色谱分离,洗脱剂为石油醚-乙酸乙酯(20:1-2:1),得到岩藻黄质衍生物硅胶柱层析分离物1-a、1-b、1-c、1-d、1-e、1-f,分别浓缩,备用;
3)岩藻黄质衍生物(ⅰ)分离制备:
a)原料的配置:将1-a岩藻黄质衍生物粗品配置成5mg/ml的溶液;
b)仪器:半制备型高效液相色谱;
c)色谱条件:半制备色谱柱为c8柱(250mm×10mm),流动相系统为85%
甲醇水溶液,流动相流速为3ml/min,检测波长为450nm;
d)进样体积:100μl;
通过运行半制备型高效液相色谱获得岩藻黄质衍生物制备液80ml,在30℃下减压浓缩,将浓缩液进行冷冻干燥,即得岩藻黄质衍生物23mg,经结构鉴定确定该化合物为式(ⅰ)。
4)岩藻黄质衍生物(ⅱ)分离制备:
a)原料的配置:将1-b岩藻黄质衍生物粗品配置成5mg/ml的溶液;
b)仪器:半制备型高效液相色谱;
c)色谱条件:半制备色谱柱为c8柱(250mm×10mm),流动相系统为85%
甲醇水溶液,流动相流速为3ml/min,检测波长为450nm;
d)进样体积:100μl;
通过运行半制备型高效液相色谱获得岩藻黄质衍生物制备液60ml,在30℃下减压浓缩,将浓缩液进行冷冻干燥,即得岩藻黄质衍生物18mg,经结构鉴定确定该化合物为式(ⅱ)。
5)岩藻黄质衍生物(ⅲ)分离制备:
a)原料的配置:将1-c岩藻黄质衍生物粗品配置成5mg/ml的溶液;
b)仪器:半制备型高效液相色谱;
c)色谱条件:半制备色谱柱为c8柱(250mm×10mm),流动相系统为85%甲醇水溶液,流动相流速为3ml/min,检测波长为450nm;
d)进样体积:100μl;
通过运行半制备型高效液相色谱获得岩藻黄质衍生物制备液80ml,在30℃下减压浓缩,将浓缩液进行冷冻干燥,即得岩藻黄质衍生物23mg,经结构鉴定确定该化合物为式(ⅲ)。
6)岩藻黄质衍生物(ⅳ)、(ⅴ)分离制备:
a)原料的配置:将1-b岩藻黄质衍生物粗品配置成5mg/ml的溶液;
b)仪器:半制备型高效液相色谱;
c)色谱条件:半制备色谱柱为c8柱(250mm×10mm),流动相系统为90%甲醇水溶液,流动相流速为3ml/min,检测波长为450nm;
d)进样体积:100μl;
通过运行半制备型高效液相色谱,分别获得岩藻黄质衍生物(ⅳ)、(ⅴ)制备液,在30℃下减压浓缩,将浓缩液进行冷冻干燥,分别即得岩藻黄质衍生物(ⅳ)、(ⅴ)25mg、29mg,经结构鉴定确定该化合物为式(ⅳ)、(ⅴ)。
实施例2
1)岩藻黄质衍生物混合物的制备:取岩藻黄质(纯度为90%)1000mg,用甲醇500ml溶解,加入氢化铝锂150mg,于37℃下反应10h后,液相色谱检测有多个岩藻黄质衍生物色谱峰,浓缩至近干,备用;
2)岩藻黄质衍生物混合物初步分离:取岩藻黄质衍生物浓缩物,采用反相硅胶柱色谱分离,洗脱剂为60%、70%、80%、90、100%甲醇水溶液,梯度洗脱,收集到得到岩藻黄质衍生物反相柱层析分离物2-a、2-b、2-c、2-d、2-e,分别浓缩,备用;
3)岩藻黄质衍生物(ⅰ)、(ⅱ)(ⅳ)分离制备:
a)原料的配置:将2-c岩藻黄质衍生物粗品配置成5mg/ml的溶液;
b)仪器:制备型高效液相色谱;
c)色谱条件:半制备色谱柱为c18柱(250mm×20mm),流动相系统为80%甲醇水溶液,流动相流速为10ml/min,检测波长为450nm;
d)进样体积:500μl;
通过运行制备型高效液相色谱获得岩藻黄质衍生物(ⅰ)、(ⅱ)(ⅳ)制备液分别为210ml、250ml、170ml,在30℃下减压浓缩,将浓缩液进行冷冻干燥,分别得岩藻黄质衍生物23mg、17mg、38mg,经结构鉴定确定化合物结构式分别为:(ⅰ)、(ⅱ)(ⅳ)。
4)岩藻黄质衍生物(ⅴ)分离制备:
a)原料的配置:将2-d岩藻黄质衍生物粗品配置成5mg/ml的溶液;
b)仪器:半制备型高效液相色谱;
c)色谱条件:制备色谱柱为c18柱(250mm×20mm),流动相系统为85%甲醇水溶液,流动相流速为10ml/min,检测波长为450nm;
d)进样体积:500μl;
通过运行半制备型高效液相色谱获得岩藻黄质衍生物制备液300ml,在30℃下减压浓缩,将浓缩液进行冷冻干燥,即得岩藻黄质衍生物78mg,经结构鉴定确定该化合物为式(ⅴ)。
5)岩藻黄质衍生物(ⅲ)分离制备:
a)原料的配置:将2-e岩藻黄质衍生物粗品配置成5mg/ml的溶液;
b)仪器:制备型高效液相色谱;
c)色谱条件:制备色谱柱为c18柱(250mm×20mm),流动相系统为90%甲醇水溶液,流动相流速为10ml/min,检测波长为450nm;
d)进样体积:500μl;
通过运行半制备型高效液相色谱获得岩藻黄质衍生物制备液330ml,在30℃下减压浓缩,将浓缩液进行冷冻干燥,即得岩藻黄质衍生物33mg,经结构鉴定确定该化合物为式(ⅲ)。
实施例3岩藻黄质衍生物抗肿瘤细胞活性筛选
1)五种岩藻黄质衍生物5个浓度梯度配制
将分别将五种岩藻黄质衍生物粉末加dmso配成20mg/ml作为母液,分装-20℃保存。用1640培养基将母液稀释成20μg/ml,并梯度稀释为10μg/ml、5μg/ml、2.5μg/ml、1.25μg/ml。
2)细胞培养分别按照相应细胞培养方法,培养h460、a549、mcf-7细胞;
3)铺板取正常培养的处于对数期的h460、a549、mcf-7细胞,用0.25%typsin+0.02%edta消化,1500rpm离心5min,计数板下计数,铺96孔板,每孔加入5×103个细胞,放入培养箱中静置24h。分别加入不同浓度的岩藻黄质衍生物溶液。
4)cck8检测细胞活力不同浓度岩藻黄醇溶液作用不同时间点后,吸走培养基,每孔加入含10μlcck8的1640检测液100μl,设置空白对照孔,37℃避光反应2h,450nm处读取各孔od值。
表1岩藻黄质衍生物对h460、a549、mcf-7的ic50值
- 还没有人留言评论。精彩留言会获得点赞!