氧杂螺环双膦配体及其在α,β-不饱和羧酸不对称氢化中的应用的制作方法
本发明涉及一种氧杂螺环双膦配体o-sdp及其在α,β-不饱和羧酸不对称氢化中的应用。
背景技术:
手性羧酸及其手性羧酸衍生物片段在具有生物活性的药物分子和天然产物中广泛存在,在不对称催化领域具有很高的潜在应用价值。α,β-不饱和羧酸的催化不对称氢化是构建手性羧酸化合物最直接和最有效的方法之一。在过去的几十年间,伴随着手性双膦配体的发展,该领域取得了飞速的发展。kagan小组合成的diop(参见dang,t.p.;kagan,h.b.j.chem.soc.d:chem.commun.1971,481.)、noyori小组发展的binap(参见miyashita,a.;yasuda,a.;takaya,h.;toriumi,k.;ito,t.;souchi,t.;noyorir.;j.am.chem.soc.,1980,102,7932;kitamura,masato;m.tokunaga;t.ohkuma;r.noyori.org.syn.1998,9,589)以及knowles小组发展的dipam(参见vineyard,b.d.;knowles,w.s.;sabacky,m.j.;bachman,g.l.;weinkauff,d.j.,j.am.chem.soc.1977,99,5946.)配体在双膦配体的发展历史中具有里程碑意义。它们在学术界和工业界得到了非常广泛的应用。随后各种各样的手性双膦配体被合成出来,例如segephos、difluophos、synphos、cn-tunephos、tangphos、duanphos、zhangphos、skp、sdp、sfdp等。2007年,周其林小组发现sfdp的钌络合物在惕格酸以及α-甲基肉桂酸的氢化中表现出优异的活性和对映选择性(参见x.cheng,q.zhang,j.-h.xie,l.-x.wang,q.-l.zhou,angew.chem.,int.ed.2005,44,1118-1121.),随后陈伟平小组发展的基于二茂铁骨架的chenphos和trifer在α-甲基肉桂酸以及α-氧代-α,β-不饱和酸的氢化表现出很好的催化效果(参见a)w.chen,p.j.mccormack,k.mohammed,w.mbafor,s.m.roberts,j.whittall,angew.chem.,int.ed.2007,46,4141-4144;b)w.chen,f.spindler,b.pugin,u.nettekoven,angew.chem.,int.ed.2013,52,8652-8656.),张绪穆小组也开发了基于二茂铁骨架的wudaphos,其在α-丙烯酸衍生的氢化中表现出优异的活性和对映选择性(参见chen,c.;wang,h.;zhang,z.,jin,s.;wen,s.,ji,j.,chung,l.w.dong,x.-q.;zhang,x.chem.sci.,2016,7,6669-6673.),但是这些配体的适用范围都很窄,为了取得优异的对映选择性,往往需要对配体进行复杂的结构修饰,仍然缺乏广泛适用于多种底物的手性双膦配体。周其林课题组发展的ir-siphox体系是一种底物适用范围广泛的催化体系(参见a)s.li,s.f.zhu,j.h.xie,s.song,c.m.zhang,q.l.zhou,j.am.chem.soc.2010,132,1172-1179;b)s.li,s.f.zhu,c.m.zhang,s.song,q.l.zhou,j.am.chem.soc.2008,130,8584-8585;c)s.song,s.f.zhu,l.y.pu,q.l.zhou,angew.chem.,int.ed.2013,52,6072-6075;d)s.song,s.f.zhu,y.b.yu,q.l.zhou,angew.chem.,int.ed.2013,52,1556-1559;e)q.wang,z.zhang,c.chen,h.yang,z.han,x.-q.dong,x.zhang,org.chem.front.2017,4,627-630;f)s.f.zhu,q.l.zhou,acc.chem.res.2017,50,988-1001.)但是该体系对于环状四取代羧酸没有反应活性(参见a)s.song,s.f.zhu,y.li,q.l.zhou,org.lett.2013,15,3722-3725;b)a.schumacher,m.g.schrems,a.pfaltz,chem.-asianj.2011,17,13502-13509.),同该体系需要外加的碱来促进反应的进行,在一定程度上限制了该体系的应用范围。因此发展新型的手性配体应用于α,β-不饱和羧酸的不对称氢化具有非常重要的意义。
技术实现要素:
鉴于现有技术需要改善的问题,本发明要解决的问题是提供了一种氧杂螺环双磷配体,其与钌的络合物在多种类型的α,β-不饱和羧酸的不对称氢化中都表现出优异的活性和对映选择性,能够以高达99%的对映选择性得到手性羧酸产物。
为了实现上述技术目的,本发明采用下述技术方案:
本发明提供的一种氧杂螺环双磷配体,具有以下通式(i)的结构:
其中,通式(i)中:
r1、r2、r3和r4相同,均为烷基、烷氧基、芳基、芳氧基或氢原子,所述r1、r2、r3和r4包括成环、不成环、任意两个成环或两两之间形成多环的形式;r5、r6为烷基、芳基或者氢原子;r7、r8为烷基、苄基或者芳基。
作为本发明进一步的改进,所述氧杂螺环双磷配体是(±)-氧杂螺环双膦配体、(+)-氧杂螺环双膦配体或(-)-氧杂螺环双膦配体。
作为本发明进一步的改进,所述氧杂螺环双磷配体包括下式化合物:
其中,r1、r2、r3、r4和r5为相同或不同的取代基,其包括氢基、烷基、氟代烷基、芳基或烷氧基;ar为烷基、苄基或芳基。
作为本发明进一步的改进,其中ar为苯基、烷基或烷氧基取代的苯基:
本发明的另一目的还包括提供了一种氧杂螺环双磷配体在α,β-不饱和羧酸不对称氢化中的应用,所述氧杂螺环双磷配体首先制成双膦醋酸钌络合物,所述双膦醋酸钌络合物在有机溶剂中实现α,β-不饱和羧酸不对称氢化,所述有机溶剂为甲醇、乙醇、三氟乙醇、六氟异丙醇、四氢呋喃、二氧六环、甲苯、苯、二氯甲烷、二氯乙烷、甲基叔丁基醚、乙醚或四氯化碳。
作为本发明进一步的改进,所述双膦醋酸钌络合物是下式化合物:
r=alkyl,fluoroalkyloraryl,其中,r=烷基、氟代烷基或芳基。
作为本发明进一步的改进,所述双膦醋酸钌络合物包括经下述合成路线得到的产物:
或为
作为本发明进一步的改进,所述双膦醋酸钌络合物应用于沙库必曲中间体的不对称还原:
其中,r1为boc、ts、ns、bn、pmb、pmp或bz保护基,r2为h、烷基、取代烷基或芳基基团,其中所采用的配体为化合物1
该反应所采用的溶剂,温度以及氢气压力不仅仅局限于甲醇,室温以及6个大气压,溶剂甲醇采用乙醇替代或采用与上述有机溶剂性质类似的其他有机溶剂;根据气候条件的变化,温度条件除采用室温条件外,在室温条件下的上下波动1-100摄氏度均可;气压条件同样根据气候变化情况,在6个大气压的上下波动1-100atm均可。
作为本发明进一步的改进,所述双膦醋酸钌络合物应用于抗抑郁药物paroxetine以及femoxetine中间体的不对称还原:
其中r1为boc、ts、ns、bn、pmb、pmp或bz保护基,r2为h、烷基、取代烷基或芳基基团,其中所采用的配体为1
该反应所采用的溶剂,温度以及氢气压力不仅仅局限于甲醇,室温以及60个大气压。溶剂甲醇采用乙醇替代或采用与上述有机溶剂性质类似的其他有机溶剂;根据气候条件的变化,温度条件除采用室温条件外,在室温条件下的上下波动1-100摄氏度均可;气压条件同样根据气候变化情况,在60个大气压的上下波动1-100atm均可。
作为本发明进一步的改进,使用氧杂螺环双磷配体作为催化剂,反应路线如下:
该反应所采用的溶剂,温度以及氢气压力不仅仅局限于甲醇及室温条件。这些溶剂还包括但不局限于乙醇、三氟乙醇、六氟异丙醇、四氢呋喃、二氧六环、甲苯、苯、二氯甲烷、二氯乙烷、甲基叔丁基醚、乙醚、四氯化碳等;根据气候条件的变化,温度条件除采用室温条件外,在室温条件下的上下波动1-100摄氏度均可;气压条件同样根据气候变化情况,在60个大气压的上下波动1-100atm均可。
o-sdp尽管和sdp结构比较相似,但其具有十分独特的结构,它的咬合角是99.2度,大于已知的常见手性双膦配体如binap、meo-biphep、segphos等。其与钌的络合物在多种类型的α,β-不饱和羧酸的不对称氢化中都表现出优异的活性和对映选择性,能够以高达99%的对映选择性得到手性羧酸产物。该合成方法可以应用与paroxetine、femoxetine、nipecoticacid以及sacubitril等具有重要生物活性的化学分子的核心骨架的构建中。
本发明提供的一种氧杂螺环双膦配体o-sdp及其在α,β-不饱和羧酸不对称氢化中的应用,相对于现有技术的有益效果包括:
(1)该氧杂螺环化合物具有中心手性,因此有左旋氧杂螺环双膦配体和右旋氧杂螺环双膦配体,消旋的螺环双膦配体可以通过消旋的氧杂螺环二酚为原料合成得到。
(2)本发明可以作为手性配体用于不饱和羧酸的不对称氢化中,其与钌的络合物在甲基-肉桂酸的不对称氢化中可以得到大于99%的对映选择性即该化合物制成的双膦醋酸钌络合物在有机溶剂中对多种不饱和羧酸的氢化具有很高的活性和对映选择性,大于99%。
附图说明
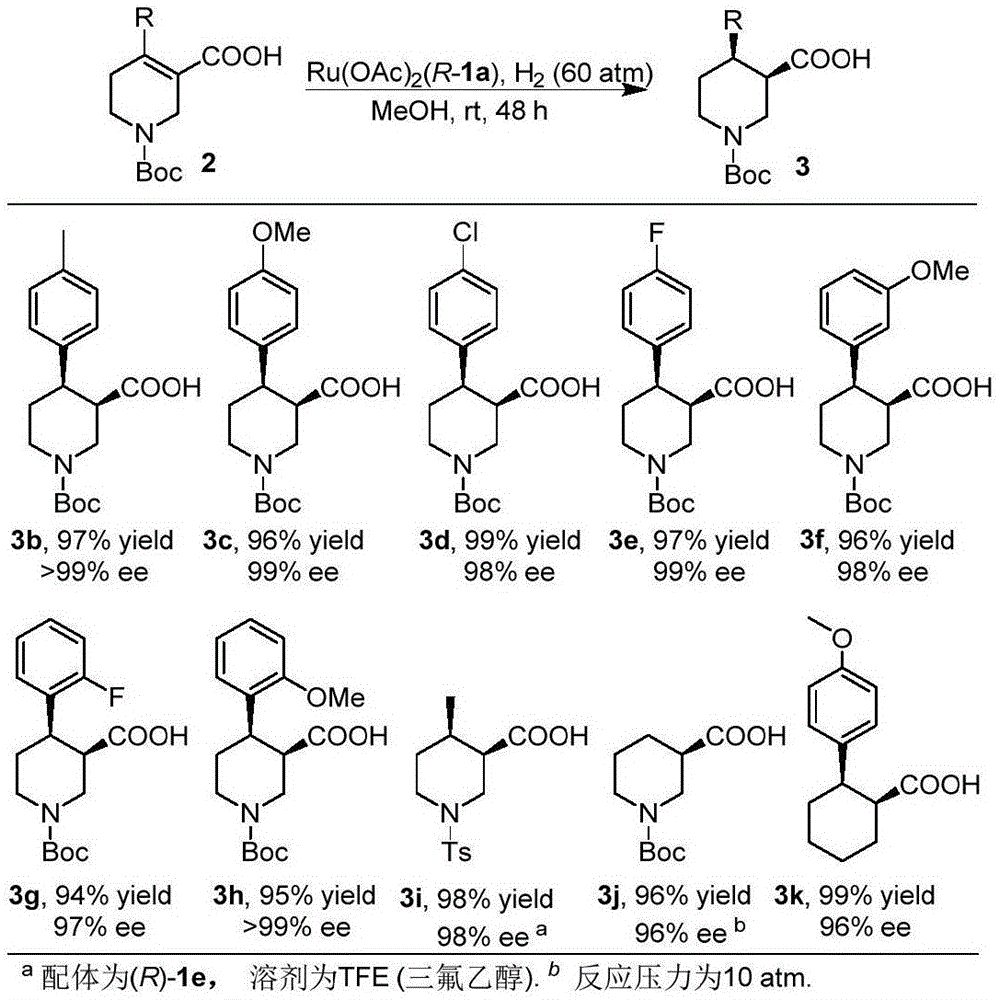
图1是:本发明提供的一种氧杂螺环双膦配体o-sdp及其在α,β-不饱和羧酸不对称氢化中的应用的多种不同手性化合物的制备示意图、以及对应的转化率和对映选择性ee值。
图2是:本发明提供的一种氧杂螺环双膦配体o-sdp及其在α,β-不饱和羧酸不对称氢化中的应用的多种不同手性化合物的制备示意图、以及对应的转化率和对映选择性ee值。
图3是:本发明提供的一种氧杂螺环双膦配体o-sdp及其在α,β-不饱和羧酸不对称氢化中的应用中所制备的手性化合物在具有生物活性分子合成中的应用。
具体实施方式
下面通过实施例和附图对本发明加以说明,但本发明提供的一种氧杂螺环双膦配体o-sdp及其在α,β-不饱和羧酸不对称氢化中的应用并不仅限于以下实施例。
在手性合成技术领域,尽管o-sdp和sdp结构比较相似,但o-sdp具有十分独特的结构,它的咬合角是99.2度,大于已知的常见手性双膦配体如binap、meo-biphep、segphos等。其与钌的络合物在多种类型的α,β-不饱和羧酸的不对称氢化中都表现出优异的活性和对映选择性,能够以高达99%的对映选择性得到手性羧酸产物,通过该途径的合成方法能够应用与paroxetine、femoxetine、nipecoticacid以及sacubitril等具有重要生物活性的化学分子的核心骨架的构建中。
反应原理如下:
a(r)-1ewasusedasligandandtfeassolvent.tfe:trifluoroethanol.bthereactionwasconductedat10atm.
a(r)-1e作为配位体,tfe作为溶剂,反应10小时。
上述yield表示产物。
实施例1:
催化剂rh(1a)oac2的制备:
在n2氛围下,向一个10ml单口瓶中加入[ruphcl2]2(25mg,0.05mmol)、配体1a(61mg,0.103mmol),然后加入2mldmf。100℃条件下反应3h。冷却至室温,然后加入1.5ml无水醋酸钠(0.111g,1.3mmol)的甲醇溶液。20min后加入脱氧的去离子水。有灰色固体从反应体系中析出,过滤,减压除去溶剂和水即得到催化剂rh(1a)oac2(57mg,产率=71%)。
实施例2:
催化剂rh(1a)(cf3co)2的制备:
在n2氛围下,向一个10ml单口瓶中加入双-(2-甲基烯丙基)环辛-1,5-二烯钌(32mg,0.05mmol)、配体1a(61mg,0.103mmol),然后加入2ml丙酮。40℃条件下反应0.5h。然后加入三氟乙酸(33mg,0.3mmol),40℃条件下搅拌过夜,减压除去溶剂,然后加入1ml石油醚,过滤得到目标产物rh(1a)(cf3co)2(81mg,产率=88%)。
实施例3
(3r,4r)-1-(叔丁氧羰基)-4-苯基-3-羧酸3a的合成:
在n2氛围下,向氢化小瓶中加入2a(0.1mmol)、催化剂ru(1a)oac2(0.8mg,0.001mmol)以及1ml的甲醇。在60atm的氢气氛围下进行24h后,原料全部转化为产物。29.0mg,产物yield=95%,>99%ee,[α]25d=+38.0(c=0.5,chcl3),yellowoil.1hnmr(400mhz,cdcl3)δ7.29-7.24(m,2h,ar),7.23-7.17(m,3h,ar),4.44(d,j=12.7hz,1h,ch2),4.26(d,j=9.0hz,1h,ch2),3.16(d,j=11.1hz,1h,ch),3.01-2.82(m,3h,ch2),2.55(dt,j=12.0,8.6hz,1h,ch),1.68(dd,j=13.0,2.8hz,1h,ch2),1.39(s,9h,ch3).13cnmr(101mhz,cdcl3)δ176.9,154.7,142.1,128.3,127.4,126.6,79.8,46.1,45.2,43.8,43.0,28.2,25.6.hrms(esi)calcd.forc17h22no4[m-h]-:304.1554,found:304.1556.hplc条件:daicelad-3,进样量2μl(c=1mg/ml),hexane/ipa=97/3,1.0ml/min,208nm,tr(major)=29.6min,tr(minor)=31.4min。
实施例4
(3r,4r)-1-(叔丁氧羰基)-4-对甲基苯基-3-羧酸3b的合成:
在n2氛围下,向氢化小瓶中加入2b(0.1mmol)、催化剂ru(1a)oac2(0.8mg,0.001mmol)以及1ml的甲醇。在60atm的氢气氛围下进行24h后,原料全部转化为产物。31.0mg,产物yield=97%,>99%ee,[α]25d=+47.1(c=0.5,chcl3),yellowoil.1hnmr(400mhz,cdcl3)δ7.09(q,j=8.2hz,4h,ar),4.42(d,j=13.2hz,1h,ch2),4.24(d,j=10.5hz,1h,ch2),3.15(d,j=11.8hz,1h,ch),3.00-2.78(m,3h,ch2),2.61-2.42(m,1h,ch),2.30(s,3h,ch3),1.67(dd,j=13.1,2.9hz,1h,ch2),1.40(s,9h,ch3).13cnmr(101mhz,cdcl3)δ177.0,154.7,139.1,136.1,129.0,127.2,79.8,46.0,45.3,43.9,42.6,28.2,25.8,20.9.hrms(esi)calcd.forc18h24no4[m-h]-:318.1711,found:318.1713.hplc条件:daicelad-3,进样量2μl(c=1mg/ml),hexane/ipa=97/3,1.0ml/min,220nm,tr(major)=18.9min,tr(minor)=21.9min。
实施例5
(3r,4r)-1-(叔丁氧羰基)-4-对甲氧基苯基-3-羧酸3c的合成:
在n2氛围下,向氢化小瓶中加入2c(0.1mmol)、催化剂ru(1a)oac2(0.8mg,0.001mmol)以及1ml的甲醇。在60atm的氢气氛围下进行24h后,原料全部转化为产物。32.2mg,产物yield=96%,99%ee,[α]25d=+29.5(c=0.5,chcl3),yellowsolid.1hnmr(400mhz,cdcl3)δ7.14(d,j=8.7hz,2h,ar),6.84-6.78(m,2h,ar),4.41(d,j=13.6hz,1h,ch2),4.24(d,j=10.7hz,1h,ch2),3.77(s,3h,ch3),3.14(d,j=11.4hz,1h,ch),2.97-2.79(m,3h,ch2),2.51(qd,j=12.2,3.8hz,1h,ch),1.66(dd,j=13.1,2.9hz,1h,ch2),1.40(s,9h,ch3).13cnmr(101mhz,cdcl3)δ176.9,158.2,154.7,134.2,128.4,113.7,79.8,55.1,45.9,45.4,43.9,42.2,28.2,25.9.hrms(esi)calcd.forc18h24no5[m-h]-:334.1660,found:334.1662.hplc条件:daicelas-3,进样量2μl(c=1mg/ml),hexane/ipa=97/3,1.0ml/min,230nm,tr(major)=16.5min,tr(minor)=19.2min。
实施例6
(3r,4r)-1-(叔丁氧羰基)-4-对氯苯基-3-羧酸3d的合成:
在n2氛围下,向氢化小瓶中加入2d(0.1mmol)、催化剂ru(1a)oac2(0.8mg,0.001mmol)以及1ml的甲醇。在60atm的氢气氛围下进行24h后,原料全部转化为产物。33.6mg,产物yield=99%,98%ee,[α]25d=+47.9(c=0.5,chcl3),whitesolid.1hnmr(500mhz,cdcl3)δ7.26(d,j=8.3hz,2h,ar),7.16(d,j=8.3hz,2h,ar),4.48(d,j=12.0hz,1h,ch2),4.29(d,j=9.8hz,1h,ch2),3.14(d,j=11.6hz,1h,ch),2.93(ddd,j=42.0,23.0,10.6hz,3h,ch2),2.53(dd,j=20.9,11.7hz,1h),1.68(d,j=11.0hz,1h,ch2),1.40(s,9h,ch3).13cnmr(126mhz,cdcl3)δ175.9,154.7,140.6,132.5,128.8,128.5,80.0,46.1,45.1,43.8,42.4,28.3,25.5.hrms(esi)calcd.forc17h21clno4[m-h]-:338.1165,found:338.1169.hplc条件:daicelas-3,进样量2μl(c=1mg/ml),hexane/ipa=97/3,1.0ml/min,208nm,tr(major)=9.0min,tr(minor)=10.0min。
实施例7
(3r,4r)-1-(叔丁氧羰基)-4-对氟苯基-3-羧酸3e的合成:
在n2氛围下,向氢化小瓶中加入2e(0.1mmol)、催化剂ru(1a)oac2(0.8mg,0.001mmol)以及1ml的甲醇。在60atm的氢气氛围下进行24h后,原料全部转化为产物。31.4mg,产物yield=97%,99%ee,[α]25d=+35.2(c=0.5,chcl3),yellowsolid.1hnmr(400mhz,cdcl3)δ7.18(dd,j=8.4,5.4hz,2h,ar),6.96(t,j=8.7hz,2h,ar),4.45(d,j=12.9hz,1h,ch2),4.28(d,j=9.3hz,1h,ch2),3.14(d,j=10.9hz,1h,ch),2.99-2.80(m,3h,ch2),2.53(dd,j=20.9,12.0hz,1h,ch),1.66(dd,j=13.0,2.5hz,1h,ch2),1.39(s,9h,ch3).13cnmr(101mhz,cdcl3)δ176.8,161.6(d,j=243.5hz),154.7,137.8(d,j=2.9hz),128.9(d,j=7.9hz),115.1(d,j=20.9hz),79.9,46.0,45.4,43.8,42.3,28.2,25.7.19fnmr(376mhz,cdcl3)δ-116.3.hrms(esi)calcd.forc17h21fno4[m-h]-:322.1460,found:322.1464.hplc条件:daicelas-3,进样量2μl(c=1mg/ml),hexane/ipa=98/2,0.8ml/min,208nm,tr(major)=15.0min,tr(minor)=19.6min。
实施例8
(3r,4r)-1-(叔丁氧羰基)-4-间甲氧基苯基-3-羧酸3f的合成:
在n2氛围下,向氢化小瓶中加入2f(0.1mmol)、催化剂ru(1a)oac2(0.8mg,0.001mmol)以及1ml的甲醇。在60atm的氢气氛围下进行24h后,原料全部转化为产物。32.2mg,产物yield=96%,98%ee,[α]25d=+50.3(c=0.5,chcl3),yellowsolid.1hnmr(400mhz,cdcl3)δ7.18(t,j=7.9hz,1h,ar),6.84-6.72(m,3h,ar),4.43(d,j=12.9hz,1h,ch2),4.24(d,j=11.1hz,1h,ch2),3.74(s,3h,ch3),3.15(d,j=11.0hz,1h,ch3),3.00-2.82(m,3h,ch2),2.53(dt,j=20.7,10.2hz,1h,ch),1.68(dd,j=12.9,2.5hz,1h,ch2),1.40(s,9h,ch3).13cnmr(101mhz,cdcl3)δ176.6,159.5,154.7,143.8,129.3,119.7,113.3,112.0,79.8,55.0,46.0,45.2,44.0,43.1,28.2,25.8.hrms(esi)calcd.forc18h24no5[m-h]-:334.1660,found:334.1664.hplc条件:daiceloj-3,进样量2μl(c=1mg/ml),hexane/ipa=95/5,1.0ml/min,208nm,tr(major)=15.1min,tr(minor)=17.9min。
实施例9
(3r,4r)-1-(叔丁氧羰基)-4-邻氟苯基-3-羧酸3g的合成:
在n2氛围下,向氢化小瓶中加入2g(0.1mmol)、催化剂ru(1a)oac2(0.8mg,0.001mmol)以及1ml的甲醇。在60atm的氢气氛围下进行24h后,原料全部转化为产物。30.4mg,产物yield=94%,97%ee,[α]25d=+16.9(c=0.5,chcl3),yellowsolid.1hnmr(400mhz,cdcl3)δ7.29-7.23(m,1h,ar),7.19(tdd,j=7.3,5.4,1.6hz,1h,ar),7.08-6.97(m,2h,ar),4.50(d,j=14.1hz,1h,ch2),4.33(d,j=11.3hz,1h,ch2),3.29(dt,j=12.7,3.9hz,1h,ch2),3.15(d,j=12.9hz,1h,ch),2.96(s,1h,ch2),2.87(t,j=11.8hz,1h,ch2),2.62(tt,j=12.6,6.4hz,1h,ch),1.59(dd,j=13.0,2.6hz,1h,ch2),1.41(s,9h,ch3).13cnmr(101mhz,cdcl3)δ176.0,160.7(d,j=243.4hz),154.7,128.9(d,j=13.7hz),128.7(d,j=3.7hz),128.2(d,j=8.6hz),124.0(d,j=3.6hz),115.0(d,j=22.4hz),79.9,46.3,44.1,43.3,36.0,36.0,28.3,24.7.19fnmr(376mhz,cdcl3)δ-119.0.hrms(esi)calcd.forc17h21fno4[m-h]-:322.1460,found:322.1463.hplc条件:daicelad-3,进样量2μl(c=1mg/ml),hexane/ipa=97/3,1.0ml/min,208nm,tr(major)=15.2min,tr(minor)=20.8min。
实施例10
(3r,4r)-1-(叔丁氧羰基)-4-邻甲氧基苯基-3-羧酸3h的合成:
在n2氛围下,向氢化小瓶中加入2h(0.1mmol)、催化剂ru(1a)oac2(0.8mg,0.001mmol)以及1ml的甲醇。在60atm的氢气氛围下进行24h后,原料全部转化为产物。31.8mg,产物yield=95%,>99%ee,[α]25d=+84.8(c=0.5,chcl3),whitesolid.1hnmr(400mhz,cdcl3)δ7.29-7.23(m,1h),7.19(tdd,j=7.3,5.4,1.6hz,1h),7.08-6.97(m,2h),4.50(d,j=14.1hz,1h),4.33(d,j=11.3hz,1h),3.74(s,3h,ch3),3.29(dt,j=12.7,3.9hz,1h),3.15(d,j=12.9hz,1h),2.96(s,1h),2.87(t,j=11.8hz,1h),2.62(tt,j=12.6,6.4hz,1h),1.59(dd,j=13.0,2.6hz,1h),1.41(s,9h).13cnmr(101mhz,cdcl3)δ176.0,161.9,159.5,154.7,129.0,128.9,128.7,128.7,128.2,128.1,124.0,124.0,115.1,114.8,79.9,46.3,44.1,43.3,36.0,36.0,28.3,24.7.hrms(esi)calcd.forc18h24no5[m-h]-:334.1660,found:334.1664.hplc条件:daicelad-3,进样量2μl(c=1mg/ml),hexane/ipa=97/3,1.0ml/min,220nm,tr(major)=23.4min,tr(minor)=24.9min。
实施例11
(3r,4r)-4-甲基-1-对甲苯磺酰基哌啶-3-羧酸3i的合成:
在n2氛围下,向氢化小瓶中加入2i(0.1mmol)、催化剂ru(1a)oac2(0.8mg,0.001mmol)以及1ml的甲醇。在60atm的氢气氛围下进行24h后,原料全部转化为产物。29.1mg,产物yield=98%,98%ee,[α]25d=+23.3(c=0.5,chcl3),whitesolid.1hnmr(400mhz,cdcl3)δ7.66(d,j=8.2hz,2h,ar),7.34(d,j=8.0hz,2h,ar),3.49(dd,j=11.4,2.3hz,1h,ch2),3.35-3.26(m,1h,ch2),2.83(ddd,j=15.5,13.6,6.9hz,2h,ch),2.72(td,j=11.4,3.0hz,1h,ch),2.44(s,3h,ch3),1.84(qd,j=9.0,4.3hz,1h,ch2),1.74-1.65(m,1h,ch2),0.86(d,j=7.1hz,3h,ch3).13cnmr(101mhz,cdcl3)δ177.2,143.6,133.1,129.7,127.6,44.4,43.2,42.1,30.4,28.6,21.5,13.9.hrms(esi)calcd.forc14h18no4s[m-h]-:296.0962,found:296.0963.hplc条件:daiceloj-3,进样量2μl(c=1mg/ml),hexane/ipa=95/5,1.0ml/min,208nm,tr(major)=41.0min,tr(minor)=43.9min。
实施例12
(3r)-1-(叔丁氧羰基)哌啶-3-羧酸3j的合成:
在n2氛围下,向氢化小瓶中加入2j(0.1mmol)、催化剂ru(1a)oac2(0.8mg,0.001mmol)以及1ml的甲醇。在60atm的氢气氛围下进行24h后,原料全部转化为产物。22.0mg,产物yield=96%,96%ee,[α]25d=-43.2(c=0.5,chcl3),whitesolid.1hnmr(400mhz,cdcl3)δ4.10(s,1h),3.95-3.83(m,1h),3.04(s,1h),2.92-2.78(m,1h),2.55-2.41(m,1h),2.07(dd,j=12.6,3.6hz,1h),1.78-1.57(m,2h),1.46(s,10h).13cnmr(101mhz,cdcl3)δ178.9,154.7,79.9,45.4,43.6,41.1,28.3,27.1,24.1.hplc条件:daicelad-3,进样量2μl(c=1mg/ml),hexane/ipa=97/3,1.0ml/min,210nm,tr(major)=13.3min,tr(minor)=13.9min。
实施例13
(1s,2r)-2-对甲氧基苯基环己烷-1-羧酸3k的合成:
在n2氛围下,向氢化小瓶中加入2k(0.1mmol)、催化剂ru(1a)oac2(0.8mg,0.001mmol)以及1ml的甲醇。在60atm的氢气氛围下进行24h后,原料全部转化为产物。22.0mg,产物yield=96%,96%ee,[α]25d=-43.2(c=0.5,chcl3),白色固体whitesolid.1hnmr(400mhz,cdcl3)δ4.10(s,1h),3.95-3.83(m,1h),3.04(s,1h),2.92-2.78(m,1h),2.55-2.41(m,1h),2.07(dd,j=12.6,3.6hz,1h),1.78-1.57(m,2h),1.46(s,10h).13cnmr(101mhz,cdcl3)δ178.9,154.7,79.9,45.4,43.6,41.1,28.3,27.1,24.1.hplc条件:daicelad-3,进样量2μl(c=1mg/ml),hexane/ipa=97/3,1.0ml/min,208nm,tr(major)=17.5min,tr(minor)=19.6min。
实施例14
(s)-2-苯氧基丁酸5a的合成:
在n2氛围下,向氢化小瓶中加入4a(0.1mmol)、催化剂ru(1a)oac2(0.8mg,0.001mmol)以及1ml的甲醇。在60atm的氢气氛围下进行24h后,原料全部转化为产物。22.0mg,产物yield=96%,96%ee,[α]25d=-43.2(c=0.5,chcl3),白色固体whitesolid.1hnmr(400mhz,cdcl3)δ4.10(s,1h),3.95-3.83(m,1h),3.04(s,1h),2.92-2.78(m,1h),2.55-2.41(m,1h),2.07(dd,j=12.6,3.6hz,1h),1.78-1.57(m,2h),1.46(s,10h).13cnmr(101mhz,cdcl3)δ178.9,154.7,79.9,45.4,43.6,41.1,28.3,27.1,24.1.hplc条件:daicelad-3,进样量2μl(c=1mg/ml),hexane/ipa=97/3,1.0ml/min,220nm,tr(minor)=12.1min,tr(major)=13.9min。
实施例15
sacubitril中间体6的氢化:
在n2氛围下,分别向两个氢化小瓶中加入6(1mmol)、催化剂ru(1a)oac2(0.16mg,0.0002mmol),最后分别加入5ml的二氯乙烷和三氟乙醇。在氢气氛围下进行24h后,原料全部转化为产物。通过hplc确定化合物7的非对映异构体体比例为98/2,化合物8的非对映异构体比例为>99/1。hplc条件:daicelas-3,进样量2μl(c=1mg/ml),hexane/ipa=92/8,1.0ml/min,220nm,tr(7)=8.253min,tr(8)=10.281min。
应当理解,这些实施例的用途仅用于说明本发明而非意欲限制本发明的保护范围。此外,也应理解,在阅读了本发明的技术内容之后,本领域技术人员可以对本发明作各种改动、修改和/或变型,所有的这些等价形式同样落于本申请所附权利要求书所限定的保护范围之内。
由技术常识可知,本发明可以通过其它的不脱离其精神实质或必要特征的实施方案来实现。因此,上述公开的实施方案,就各方面而言,都只是举例说明,并不是仅有的。所有在本发明范围内或在等同于本发明的范围内的改变均被本发明包含。
- 还没有人留言评论。精彩留言会获得点赞!