凝结芽孢杆菌产细菌素TK1、其制备方法及应用与流程
本发明涉及生物技术领域,特别涉及一种凝结芽孢杆菌TK1产细菌素、其制备方法及应用。
背景技术:
当机体出现炎症反应时,通常需要使用抗炎消炎药物。炎症是一个病理过程,典型特征是红、肿、热、痛和功能障碍。感染和非感染都能造成炎症反应。一般用抗生素和消炎药物等药物来达到抗炎目的。抗炎是非甾体类药物在对抗体内无菌性的变态类炎症,通过调节炎症因子的分泌,使炎症得以减轻至消退。目前畜牧业生产中普遍使用的抗炎消炎药物仍为抗生素。而在畜牧业生产中长期大量地滥用抗生素已造成了严重的危害:由于抗生素在体内的残留的残留,加速了大量耐药菌株的产生,导致动物机体免疫力下降,诱发各种疫病的发生与流行细菌不断的代谢。
细菌素是细菌在代谢过程中通过核糖体合成机制产生的一类具有抑菌活性的多肽或前体多肽。细菌素不仅对许多致病菌具有很强的抑制作用,而且对已经产生耐药性的细菌仍能有抑杀效果,而且,细菌素能溶于多种蛋白酶,在体内基本上可以被完全分解,不会残留,不会导致耐药菌株的产生。另外,细菌素结构稳定,在高温,酸性等极端环境下也能生存,因此细菌素在动物疾病防治中潜力巨大。由于抗炎消炎作用与抑菌杀菌作用存在本质上的区别:抗炎消炎药物作用于致炎因子,而抑菌抗菌药作用于病原微生物,目前所发现的细菌素仅有抑菌作用,尚未发现具有可治疗炎性疾病或具有炎性调节作用的细菌素。
在实现本发明的过程中,发明人发现现有技术中至少存在以下问题:普遍用于治疗炎性疾病的抗生素存在药物残留问题。
技术实现要素:
鉴于此,本发明提供一种凝结芽孢杆菌TK1产细菌素、其制备方法及应用,所述细菌素具备良好的抑菌作用和炎性调节作用,当替代用于治疗炎性疾病的抗生素时,可以解决药物残留问题。
具体而言,根据本发明的第一方面,本发明实施例提供了一种凝结芽孢杆菌TK1产细菌素,所述凝结芽孢杆菌TK1产细菌素分子量为11207Da。根据中国公开专利文献CN108342340A记载,所述凝结芽孢杆菌TK1于2017年12月19日保藏于中国典型培养物保藏中心,保藏编号为CCTCC NO:M 2017811。所述细菌素命名为Bacillocin TK1。
进一步的,所述细菌素的N-末端序列为GGAGMNPIDYDR(如序列表中SEQ ID NO.1所示)。
根据本发明的第二方面,本发明实施例提供了所述细菌素在制备治疗炎性疾病和/或调节炎性的药物中的应用。
具体的,所述炎性疾病为炎性肠道疾病。优选所述细菌素的使用浓度为25-75μg/mL。优选所述细菌素在炎性疾病感染前对被感染细胞进行预处理,即以预防治疗的方式进行应用。
根据本发明的第三方面,本发明实施例提供了所述细菌素在制备抑菌药物中的应用。
根据本发明的第四方面,本发明实施例提供了所述细菌素的制备方法,包括以下步骤:
(1)将所述凝结芽孢杆菌接种在MRS液体培养基中发酵,离心去除菌体,上清液用硫酸铵溶液沉淀,沉淀溶于ddH20水中得到细菌素粗提液;
(2)用琼脂糖快速流动阳离子交换柱(SP Sepharose Fast Flow阳离子交换柱)纯化,收集具有抑菌活性的部分(Sephadex G50凝胶柱)纯化步骤(2)所得滤液,收集具有抑菌活性的部分,冷冻干燥后用去离子水复溶、微孔滤膜过滤,得到纯化后的细菌素溶液。
所述琼脂糖快速流动阳离子交换柱、葡聚糖凝胶G50凝胶柱可商购。
优选的,步骤(1)中将所述凝结芽孢杆菌接种在MRS液体培养基中发酵,离心去除菌体,上清液用0.22μm滤菌膜过滤后用80%饱和度硫酸铵溶液沉淀,收集沉淀透析,沉淀冷冻干燥后溶于ddH20水中得到细菌素粗提液。
优选的,步骤(1)中所述凝结芽孢杆菌按1%接种量接种在MRS液体培养基中发酵。
优选的,步骤(2)中用琼脂糖快速流动阳离子交换柱纯化的具体步骤为:
用缓冲液A平衡预装柱、上样、用缓冲液A漂洗、用缓冲液A和缓冲液B梯度洗脱,收集具有抑菌活性的部分,
所述缓冲液A为20mmol·L-1柠檬酸-柠檬酸三钠、pH 6.0的缓冲溶液;
所述缓冲液B为含20mmol·L-1柠檬酸-柠檬酸三钠和1mol·L-1NaCl、pH 6.0的缓冲溶液。
优选的,步骤(3)中用葡聚糖凝胶G50凝胶柱纯化步骤(2)所得滤液的具体步骤为:
用缓冲液C平衡预装柱、上样、用缓冲液C洗脱,收集具有抑菌活性的部分,
所述缓冲液C为含20mmol·L-1柠檬酸-柠檬酸三钠和0.15mol·L-1NaCl、pH 6.0的缓冲溶液。
优选的,步骤(2)和(3)中所用微孔滤膜为0.22μm滤膜。
本发明实施例提供的技术方案的有益效果至少包括:
(1)本发明实施例制备、纯化了凝结芽孢杆菌TK1产细菌素BacillocinTK1,所述细菌素与其他报道的蛋白质序列没有同源性,且具有良好的抑菌作用。
(2)将本发明实施例所述细菌素用于大肠杆菌刺激的肠上皮细胞,有助于维持肠上皮细胞完整性,并可对炎性作用进行调节。作为公知技术,细菌素在体内基本上可以被完全分解,不会残留,不会导致耐药菌株的产生,因此替代抗生素用于治疗炎性疾病时,可以解决药物残留问题。
附图说明
为了更清楚地说明本发明实施例中的技术方案,下面将对实施例描述中所需要使用的附图作简单地介绍,显而易见地,下面描述中的附图仅仅是本发明的一些实施例,对于本领域普通技术人员来讲,在不付出创造性劳动的前提下,还可以根据这些附图获得其他的附图。
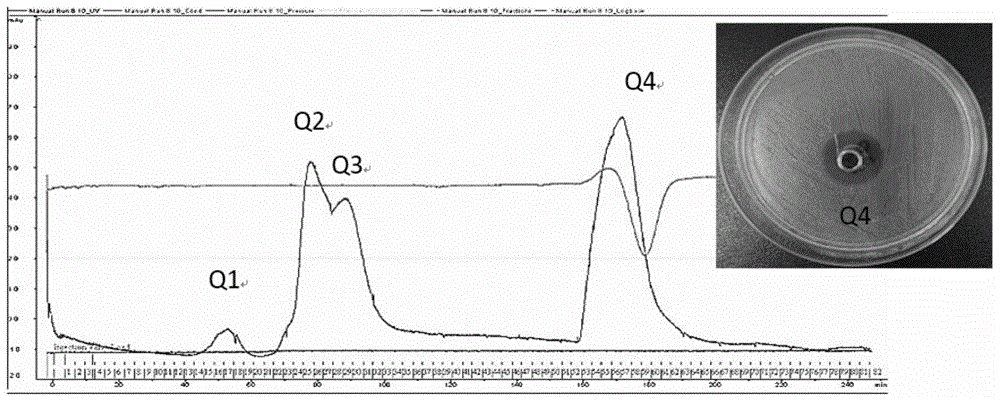
图1为实施例1中纯化细菌素的SP Sepharose Fast Flow层析图及具抑菌活性成分的抑菌结果图;
图2为实施例1中纯化细菌素的Sephadex G50层析图及具抑菌活性成分的抑菌结果图;
图3为实施例所得细菌素Bacillucin TK1的Tricine-SDS-PAGE(甘氨酸聚丙烯酰胺凝胶电泳)分析图,其中,M:Marker;A:样2;
图4为BSA标准曲线;
图5为细菌素Bacillucin TK1的二级质谱分析;
图6为不同浓度细菌素Bacillucin TK1抑制K88ac黏附细胞效果对比图;
图7为不同添加顺序对细菌素Bacillucin TK1抑制K88ac黏附细胞效果的影响图,图6和图7中,TK1代表Bacillocin TK1,K代表K88ac;
图8为IPEC细胞炎性因子IL8的分泌对照图;
图9为IPEC细胞炎性因子TNF-α的分泌对照图;
图10为IPEC细胞炎性因子IL10的分泌对照图;
图11为IPEC细胞炎性因子TGF-β1的分泌对照图;图8-11中,TK1代表Bacillocin TK1,K代表K88ac,*表示T检验K组vs.对照组,或TK1组vs.对照组;#表示K组vs.K+TK1组;
图12为Western Blot检测结果图,其中GAPDH为内参基因;
图13为紧密连接蛋白OCLN表达量对比图;
图14为紧密连接蛋白OLDN1表达量对比图;
图15为紧密连接蛋白ZO-1表达量对比图;
图12-15中,
1.空白对照组:IPEC-J2细胞紧密连接蛋白表达的情况;2.K88ac对细胞紧密连接蛋白表达的影响;3.50μg/mL Bacillocin TK1对细胞紧密连接蛋白表达的影响;4.75μg/mL Bacillocin TK1对细胞紧密连接蛋白表达的影响;
5.K88ac+50μg/mL Bacillocin TK1(即50μg/mL Bacillocin TK1预处理组)对细胞紧密连接蛋白表达的影响;6.K88ac+75μg/mL Bacillocin TK1(即75μg/mL Bacillocin TK1预处理组)对细胞紧密连接蛋白表达的影响。
具体实施方式
为使本发明的技术方案和优点更加清楚,下面将结合附图对本发明实施方式作进一步地详细描述。
根据本发明的第一方面,本发明实施例提供了一种凝结芽孢杆菌TK1产细菌素,所述凝结芽孢杆菌TK1产细菌素分子量为11207Da。根据中国公开专利文献CN108342340A记载,所述凝结芽孢杆菌TK1于2017年12月19日保藏于中国典型培养物保藏中心,保藏编号为CCTCC NO:M 2017811。所述细菌素命名为Bacillocin TK1。
进一步的,所述细菌素的N-末端序列为GGAGMNPIDYDR。
根据本发明的第二方面,本发明实施例提供了所述细菌素在制备治疗炎性疾病和/或调节炎性的药物中的应用。
具体的,所述炎性疾病为炎性肠道疾病。
根据本发明的第三方面,本发明实施例提供了所述细菌素在制备抑菌药物中的应用。
根据本发明的第四方面,本发明实施例提供了所述细菌素的制备方法,包括以下步骤:
(1)将所述凝结芽孢杆菌接种在MRS液体培养基中发酵,离心去除菌体,上清液用硫酸铵溶液沉淀,沉淀溶于ddH20水中得到细菌素粗提液;
(2)用SP Sepharose Fast Flow阳离子交换柱纯化,收集具有抑菌活性的部分,用截留分子量3.5kDa的透析袋透析,冷冻干燥后用去离子水复溶、微孔滤膜过滤;
(3)用Sephadex G50凝胶柱纯化步骤(2)所得滤液,收集具有抑菌活性的部分,冷冻干燥后用去离子水复溶、微孔滤膜过滤,得到纯化后的细菌素溶液。
优选的,步骤(1)中将所述凝结芽孢杆菌接种在MRS液体培养基中发酵,离心去除菌体,上清液用0.22μm滤菌膜过滤后用80%饱和度硫酸铵溶液沉淀,收集沉淀透析,沉淀冷冻干燥后溶于ddH20水中得到细菌素粗提液。
优选的,步骤(1)中所述凝结芽孢杆菌按1%接种量接种在MRS液体培养基中发酵。
优选的,步骤(2)中用SP Sepharose Fast Flow阳离子交换柱纯化的具体步骤为:
用缓冲液A平衡预装柱、上样、用缓冲液A漂洗、用缓冲液A和缓冲液B梯度洗脱,收集具有抑菌活性的部分,
所述缓冲液A为20mmol·L-1柠檬酸-柠檬酸三钠、pH 6.0的缓冲溶液;
所述缓冲液B为含20mmol·L-1柠檬酸-柠檬酸三钠和1mol·L-1NaCl、pH 6.0的缓冲溶液。
优选的,步骤(3)中用Sephadex G50凝胶柱纯化步骤(2)所得滤液的具体步骤为:
用缓冲液C平衡预装柱、上样、用缓冲液C洗脱,收集具有抑菌活性的部分,
所述缓冲液C为含20mmol·L-1柠檬酸-柠檬酸三钠和0.15mol·L-1NaCl、pH 6.0的缓冲溶液。
优选的,步骤(2)和(3)中所用微孔滤膜为0.22μm滤膜。
以下实施例中涉及的菌株和细胞如下:
凝结芽孢杆菌TK1(Bacillus coagulans TK1)、产肠毒素大肠杆菌ETECK88ac、猪的肠上皮细胞(IPEC-J2细胞)、金黄色葡萄球菌ATCC25923、产肠毒素大肠杆菌K88ac、猪霍乱沙门氏菌C78-1、单增李斯特菌1598、产气荚膜梭菌C型由华中农业大学微生物与免疫实验室提供。其中凝结芽孢杆菌TK1(Bacillus coagulans TK1)的制备方法由中国专利文献CN108342340A公开。
以下实施例中涉及的生化试剂如下
(1)乙醇、硫酸铵、盐酸、氯化钠等均为国产分析纯,二甲基亚砜(DMSO)购自AMRESCO(阿姆雷斯科)公司;
(2)考马斯亮蓝G250、超低分子量蛋白Marker(1.7-40KDa)购自美国Thermo公司,Tricine-SDS-PAGE甘氨酸聚丙烯酰胺凝胶电泳凝胶制备试剂盒购自北京索莱宝科技有限公司;猪细胞因子芯片购自RayBiotech(雷博生物技术公司),Tfitonx-100购自Sigma(西格玛)公司,台盼蓝染色购自碧云天生物技术有限公司;
(3)SP Sepharose Fast Flow填料、Sephadex G50凝胶购自美国GE公司;
(4)透析袋(分子截留量3.5kDa)购自上海蓝鸟科技发展有限公司;
(5)细胞培养基:DMEM/F-12 1:1培养基购自Gibco(吉布科)公司;PBS溶液购自HyClone公司;胎牛血清25%胰酶(0.02%EDTA)购自Gibco公司;青霉素/链霉素双抗购自Sigma公司,Western blot细胞裂解液、2xSDS-PAGE上样缓冲液购自碧云天生物技术有限公司;GADPH、OCLN、ZO-1、Claudin一抗多克隆抗体、辣根过氧化物酶(horseradish peroxidase,HRP)标记的羊抗兔IgG购自ABclonal(爱博泰克)公司;Mitomycin(丝裂霉素)购自Sigma公司;牛血清白蛋白(BSA)购自Sigma公司。
以下实施例中涉及的试剂配制如下:
饱和硫酸铵溶液:在50-60℃的超纯水中添加过量的硫酸铵,过滤后于室温下放置24h,待有晶体析出时即为100%饱和度。
阳极缓冲液:0.1mol·L-1Tris,用1mol·L-1HCl调节至PH8.9
阴极缓冲液:0.1mol·L-1Tris,0.1mol·L-1Tricine,0.1%SDS,用1mol·L-1HCl调节至PH8.25
染色液:甲醇∶水∶乙酸=9∶9∶2(V:V:V),0.25%考马斯亮蓝G250;
脱色液:甲醇∶水∶乙酸=9∶9∶2(V:V:V);
缓冲液A:20mmol·L-1柠檬酸-柠檬酸三钠,pH 6.0;
缓冲液B:20mmol·L-1柠檬酸-柠檬酸三钠,1mol·L-1NaCl,pH 6.0;
缓冲液C:20mmol·L-1柠檬酸-柠檬酸三钠,0.15mol·L-1NaCl,pH 6.0;
储存液D:20%(V·V-1)乙醇,0.2mol·L-1NaAC;
储存液E:20%(V·V-1)乙醇。
以下实施例采用以下数据的统计方法:
均以平均值±标准差(x±s)表示。采用SPASS进行分析,组间的差异显著性分析采用双样本等方差T检验进行处理,不同的星号(*,**,***,#,##,###)分别代表统计学显著性差异水平:*(#)P<0.05,**(##)P<0.01,***(###)P<0.001。
以下实施例中涉及的主要仪器设备如下:
紫外分光光度计(日立U-2900型紫外-可见分光光度仪);真空冷冻干燥(Labconco公司,美国);超纯水仪(Millipore(密理博)公司,美国);数显恒温水浴锅(常州朗越仪器制造有限公司);蛋白纯化仪AKTA avant 25(GE Healthcare公司,瑞典);高效液相色谱仪Agilent 1260(Agilent(安捷伦)公司,美国)。
实施例1制备凝结芽孢杆菌产细菌素Bacillocin TK1
(1)硫酸铵粗提细菌素
凝结芽孢杆菌菌液活化后按1%接种在MRS液体培养基培养基中发酵至最佳条件(37℃,18h),经10000r/min、4℃离心15min去除菌体,上清液用0.22μm滤菌膜处理后分装在6个锥形瓶中,用饱和度分别为30%、40%、50%、60%、70%、80%的硫酸铵溶液处理,冰浴条件下磁力搅拌12h。12000r/min、4℃离心20min,收集沉淀。用透析袋对沉淀复溶液在4℃下透析48h后冷冻干燥,然后溶于ddH20水中得到细菌素粗提液。以大肠杆菌K88ac为指示菌,牛津杯法检测同时检测复溶后的沉淀和上清液的抑菌活性。
沉淀和上清液抑菌活性检测结果如表1所示:在硫酸铵的饱和度为30%、40%、50%、60%时,沉淀复溶后均未检测到抑菌活性,上清中检测到抑菌活性物质,表明蛋白质没有被沉淀下来,细菌素还保留在发酵液中。当用饱和度为70%和80%的硫酸铵沉淀抑菌物质时,沉淀复溶后有抑菌圈出现,且80%饱和度的硫酸铵提取的沉淀物抑菌圈最大。所以取80%饱和度硫酸铵溶液处理后的沉淀物经透析、冷冻干燥后备用。
表1发酵上清液硫酸铵沉淀后抑菌活性
(2)SP Sepharose Fast Flow纯化细菌素
(2.1)平衡预装柱:将35mL保存于储存液D中的阳离子交换层析填料SPSepharose Fast Flow装入1.6×20cm层析柱中。先用100mL去离子水清洗,打开紫外检测器,检测波长调至280nm档,再用350mL缓冲液A平衡至基线平稳并调零;
(2.2)上样:将处理好的粗提细菌素用恒流泵以1mL·min-1流速泵入层析柱中,收集穿透峰,检测其抑菌活力。在40~200min时共有4个洗脱峰出现,其中70~100min时的2个洗脱峰没有分离开来(如图1),分别用Q1、Q2、Q3和Q4峰的洗脱液,以大肠杆菌K88ac为指示菌做抑菌试验,检测纯化效果,发现只有Q4峰有抑菌圈产生。
(2.3)漂洗:用100mL缓冲液A流经柱子,洗去未结合到填料上的杂蛋白,直至基线平稳;
(2.4)洗脱:用100mL缓冲液A和100mL缓冲液B以1.5mL·min-1流速线性梯度洗脱。收集洗脱液,并用牛津杯法检测每部分抑菌活力;
(2.5)填料的再生、清洗和保存:用100mL缓冲液B对填料再生,再用350mL缓冲液A进行平衡。长期不用时先用100mL去离子水清洗,保存在储存液D中。
将具有抑菌活性的部分(Q4馏分)收集,装入截留分子量3.5kDa的透析袋中,置于2L缓冲液C中过夜透析,透析好的样品进行冷冻干燥,然后用去离子水按需复溶,用0.22μm滤膜过滤得到样1,做抑菌试验检测纯化效果,结果如图2所示。
(3)Sephadex G50凝胶过滤层析细菌素
(3.1)平衡预装柱:将150mL保存于储存液E中的凝胶过滤层析填料Sephadex G50装入1.6×80cm层析柱中。先用500mL去离子水清洗,打开紫外检测器,检测波长调至280nm档,再用500mL缓冲液C平衡至基线平稳并调零;
(3.2)上样:用胶头滴管将5mL的样1小心加到柱子上;
(3.3)洗脱:用200mL缓冲液C以1mL·min-1流速洗脱。每管收集3min分部洗脱液,并用牛津杯法检测每部分抑菌活力。样1经Sephadex G50凝胶过滤层析,在140~220min时出现3个洗脱峰(如图2所示)。分别用S1、S2、S3峰的洗脱液,以大肠杆菌K88ac为指示菌做抑菌试验检测层析效果。结果显示S2峰有抑菌圈产生。
(3.4)填料的清洗和保存:用500m L蒸馏水清洗后,保存于储存液E中。
将具有抑菌活性的部分(S2馏分)收集,冷冻干燥后,用去离子水复溶,用0.22μm滤膜过滤后得到样2。
用Tricine-SDS-PAGE蛋白电泳进一步检测细菌素经SP Sepharose Fast Flow、Sephadex G50纯化后的效果。
凝胶的配制及电泳(Schagger 2006):
(1)配制16.5%的分离胶4.5ml(配方见表2),充分混匀后注到制胶板中直至玻璃板的中上部,然后再沿板壁轻轻加入1cm超纯水,使凝胶表面保持平整。待出现分界线后把水吸干;
(2)配制10%夹层胶(配方见表2),充分混匀后注到制胶板中,至距玻璃板顶部约2cm,同样加超纯水压平胶面。约30min后,夹层胶和水层之间出现清晰界面后把水吸干;
(3)配制4%浓缩胶(配方见表2),充分混匀后将胶液直接加到夹层胶上,并注满玻璃板;
(4)插入制胶梳,避免产生气泡,静置1h,使胶充分聚合;
(5)将制胶梳拔出,把凝胶转移至垂直电泳槽中。内槽中加入约125ml阴极电泳缓冲液,外槽中加入约500ml阳极电泳缓冲液。
(6)细菌素样品预处理:将细菌素样品与等体积的2×SDS凝胶上样缓冲液混合,95℃水浴5min,3500rpm离心10min;
(7)将Marker和预处理过的细菌素样品依次加入上样孔中,每孔10μL;
(8)将电压调至30v,电泳,待样品跑到浓缩胶与夹层胶的界面上,调电压至100v,恒压至溴酚蓝到达离分离胶底部后停止电泳。把胶取出,置于固定缓冲液中固定30min,将胶放在考马斯亮蓝G-250染色液中,摇床(70r/min)染色6h。将胶块转移至脱色液中,摇床(70r/min)脱色6h,每2小时换一次脱色液。
(9)将胶块转移至凝胶成像仪中拍照、分析。
表2分离胶、夹层胶和浓缩胶配方
结果如图3所示,样2分子量大小在4.6~10kDa左右。结果表明:经硫酸铵粗提、阳离子交换柱纯化和凝胶层析后的得到的样2相对较纯。
蛋白含量测定
使用Thermo Pierce BCA Protein Assay Kit试剂盒检测细菌素经过纯化后的蛋白浓度,其步骤如下:
(1)配制工作液,该试剂盒由3部分构成,分别为Reagent A,Reagent B,Albumin Standard Ampules。工作液体积配比为A:B=50:1,样品与工作液体积配比为1:8;(2)吸取25μL各标准品和待测样品加入微孔板(浓度20-2000μg/mL);若获得的蛋白量不足,可吸取10μL(样品与工作液配比为1:20,浓度范围为125-2000μg/mL);
(3)每孔加入工作液体积为200μL,震荡30s,使其充分混匀;
(4)将微孔板密封,37℃孵育30min;
(5)将微孔板冷却到室温,测量其在562nm处的吸光值;
(6)将2mg/ml BSA标准品稀释成1.75、1.5、1.25、1.0、0.75、0.5、0.25mg/ml的标准工作液。将各个标准工作液和待测蛋白样品在562nm处的吸光值减去空白样品在562nm处的平均吸光值;
(7)将BSA标准工作液在562nm处经过空白校正的平均吸光值对浓度作图,绘制标准曲线(图4);
(8)根据标准曲线,求出待测样品的浓度。根据回归方程得出经纯化后细菌素(样2)的蛋白质浓度为0.956mg/mL。
液相色谱-质谱联用(LC-MS/MS)鉴定细菌素结构
用LC-MS/MS测定纯化后细菌素的分子量和氨基酸序列。将样2经冷冻干燥的细菌素粉末溶解于0.2%甲酸(Formic acid,FA)中,以0.3ml/min的流速注入C18色谱柱(1.7μm,2.1×150mm,柱温45℃),用5%-35%乙腈(Acetonitrile,ACN)进行梯度洗脱,用LC-MS/MS进行质谱分析。
结果显示所述细菌素分子质量为11207Da。二级质谱图如图5所示,根据多肽片段离子的强度,用Peaks 7.0软件推导出细菌素的N-末端序列应为GGAGMNPIDYDR,与其他报道的蛋白质序列没有同源性。所以这可能是一种新型细菌素,将此细菌素命名为Bacillucin TK1。
实施例2细菌素Bacillucin TK1的抑菌活性
抑菌活性测定采用牛津杯法:用麦氏比浊管调整指示菌菌液浓度为108CFU/mL,再将菌液稀释至107CFU/mL备用。待培养皿的营养琼脂培养基凝固后,吸取200μL指示菌菌悬液于培养皿上,用涂布棒涂布均勾,倒置培养1h后放置牛津杯,并在杯中加入220μL细菌素Bacillucin TK1,在4℃冰箱中扩散6h,将培养皿在37℃下恒温培养24h,测定抑菌圈直径。每组均设定三个重复,用抑菌圈平均直径(mm)来评价抑菌活性。
结果如表3所示。
表3细菌素Bacillucin TK1的抑菌活性
实施例3细菌素Bacillocin TK1对肠上皮细胞完整性及炎性调节的作用
(1)细胞复苏和培养
将液氮中冻存的IPEC-J2细胞迅速取出,置于37℃水浴中,不断搅动使其在1min内融化。细胞解冻后,迅速从水浴槽中拿出,用75%酒精擦拭外壁,迅速转入无菌操作台。无菌打开冻存管,将细胞转移至离心管中,加10倍培养基,1000rpm离心5min,弃去上清液,加入DMEM/F-12 1:1完全培养基重悬细胞,接种培养瓶,37℃培养箱培养,次日更换培养基。当细胞融合至80%左右时,用0.25%胰酶消化传代。
(2)细菌培养和处理
K88ac冻干粉接种于LB培养基,37℃摇床培养过夜,转接2代。取K88ac菌液离心(8000r/min,4℃,10min)收集菌体,用无菌PBS洗涤2次,用不含抗生素的DMEM/F-12 1:1培养基悬浮菌体,调节细菌的浓度为1×107CFU/mL。
(3)Bacillocin TK1抑制K88ac黏附IPEC-J2细胞试验
肠道致病菌粘附于肠道上皮细胞,随后细菌释放的酶和毒素直接侵入靶细胞,造成肠道感染,引起机体发病。本实验室前期研究发现,屎肠球菌HDRsEf1细胞培养上清液降低了大肠杆菌对IPEC-J2细胞的粘附作用,这可能与HDRsEf1菌株具有产细菌素的能力有关。Souza等研究发现,干酪乳杆菌BL23产生的酪蛋白BL23可以抑制金黄色葡萄球菌(乳腺炎的主要病因)黏附于牛乳腺上皮细胞(Souza et al 2017)。
(3.1)Bacillocin TK1不同浓度对黏附抑制的影响
IPEC-J2细胞在培养瓶中贴壁生长,待长到瓶底面积的80%~90%时,用胰酶消化细胞,台盼蓝染色计数。将细胞以l×105cell/mL的浓度加入到12孔组织细胞培养板中,每孔l mL,在37℃的5%CO2培养箱恒温培养10天,之后进行粘附试验。首先,细胞用无菌PBS清洗2次,之后处理孔中加入细菌素Bacillocin TK1(5、25、50、75μg/mL)和K88ac悬液(1×107CFU/mL)各0.5mL,在CO2培养箱中37℃培养3h,吸弃培养液,用无菌PBS洗涤3次,除去未粘附的细菌,然后每孔加入lmL 1%(V/V)Triton×100,轻轻吹打混匀,梯度稀释平板计数K88ac细菌数。
结果表明5、25、50、75μg/mL浓度的Bacillocin TK1能够抑制K88ac对IPEC-J2的粘附,以单独加入K88ac悬液(1×107CFU/mL)0.5mL的K88ac单独处理组作为参照,分别抑制了16(P<0.05),38%(P<0.05),58%(P<0.05),32%(P<0.05)(图6)。
(3.2)Bacillocin TK1不同添加顺序对黏附抑制的影响
①Bacillocin TK1+K88ac:处理组孔中同时加入Bacillocin TK1(50μg/mL)和K88ac悬液(1×107CFU/mL)各0.5mL,在37℃的5%CO2培养箱中孵育3h。吸弃培养液,用PBS温和洗涤3次,去除未粘附细菌。细胞裂解和细菌稀释培养及计数方法同3.1。
②Bacillocin TK1-K88ac:处理组孔中先加入Bacillocin TK1(50μg/mL)lmL,在37℃的5%CO2培养箱中孵育3h。吸弃培养液,用无菌的PBS温和洗涤3次。再加入K88ac悬液(1×107CFU/mL)l mL,在37℃的5%CO2的细胞培养箱中孵育3h。吸弃培养液,用PBS温和洗涤3次,去除未粘附的细菌。细胞裂解和细菌稀释培养及计数方法同3.1。
③K88ac-Bacillocin TK1:处理组孔中先加入K88ac悬液(1×107CFU/mL)lmL,在37℃的5%CO2的细胞培养箱中孵育3h。吸弃培养液,用PBS温和洗涤3次,去除未粘附的细菌。再加入Bacillocin TK1(50μg/mL)l mL,在37℃的CO2培养箱中孵育3h。吸弃培养液,用PBS温和洗涤3次,去除未粘附细菌。细胞裂解和细菌稀释培养及计数方法同3.1。
试验结果(图7)表明:TK1-K组、TK1+K组及K-TK1抑制K88ac的粘附效果不同,与K88ac单独组相比分别抑制了60%(P<0.05),46(P<0.05),18%(P<0.05)。所以用50μg/mL Bacillocin TK1提前处理IPEC-J2细胞,其抑制K88ac黏附细胞效果最好。
(4)Bacillocin TK1对IPEC-J2分泌炎性因子的影响
(4.1)样品制备:
(4.1.1)收集培养至第10d的IPEC-J2,接种于24孔板,每孔1×106个,每孔0.5m L。
(4.1.2)设置空白对照组、K88ac处理组、Bacillocin TK1处理组和Bacillocin TK1+K88ac处理组。空白对照组:每孔加入DMEM/F-12 1:1完全培养基,并孵育至18h。1200r/min离心5min,收集上清置于-80℃冻存备用;K88ac处理组:每孔分别加入K88ac悬液(1×107CFU/mL)刺激3h,PBS洗3次,更换DMEM/F-12 1:1完全培养基,并孵育至18h。1200r/min离心5min,收集上清置于-80℃冻存备用;Bacillocin TK1处理组:每孔分别加入5、25、50、75μg/mL的Bacillocin TK1孵育3h,PBS洗3次,更换DMEM/F-12 1:1完全培养基,并孵育至18h。1200r/min离心5min,收集上清置于-80℃冻存备用;Bacillocin TK1+K88ac处理组:每孔分别加入5、25、50、75μg/mL的Bacillocin TK1孵育3h,PBS洗3次。每孔再加入K88ac悬液(1×107CFU/mL)刺激3h,PBS洗3次,更换DMEM/F-12 1:1完全培养基,并孵育至18h。1200r/min离心5min,收集上清置于-80℃冻存备用。
(4.2)蛋白芯片检测
将上述冻存于-80℃的空白对照组、K88ac处理组、Bacillocin TK1处理组和Bacillocin TK1+K88ac处理组的细胞培养上清,用猪细胞因子芯片(Porcine Cytokine Array,RayBiotech,Inc)检测试剂盒,按照以下步骤检测上清中细胞因子:
(4.2.1)玻璃芯片的干燥
将玻璃芯片取出,室温平衡20-30min,将包装袋打开,揭开密封条,室温干燥1-2h(环境要尽量干净无尘)。
(4.2.2)细胞因子标准品的准备
将500μL Sample Diluent(样品稀释剂)加入到cytokine standard mix(细胞因子标准混合物)样品管,充分混匀,记为Std1。准备6个1.5mL EP管,分别标记为Std2-Std7,每管加入200μL Sample Diluent。吸取100μL Std1中的cytokine standard mix加入到Std2中,混匀后,再一次吸取100μL Std2中的样品到Std3中,依次梯度稀释直至Std7。另取一个1.5mL EP管,加入100μL的Sample Diluent,设为阴性对照CNTRL。
(4.2.3)封闭和孵育
将干燥后的芯片所有孔加入100μL Sample Diluent,室温封闭30min。弃去每孔Sample Diluent,按提前设计好的加样方案,每孔加入100μL梯度稀释的标准样细胞因子或试验样品,4℃孵育过夜。用三蒸水将20×Wash Buffer(洗涤缓冲液)I和II稀释为1×。小心沿孔的角落吸弃每孔样品(注意防止相邻孔之间的交叉污染),每孔加入150μL Wash Buffer I洗涤5次,每次5min。再加入150μL Wash Buffer II洗涤2次,每次5min(每次洗涤液体尽量吸弃干净,可适当室温摇晃,也可多洗涤几次)。
(4.2.4)生物素标记的检测抗体的孵育
生物素标记的检测抗体样品管使用前瞬离,加入1.4mLSample Diluent混匀。每孔加入80μL检测抗体,室温孵育1-2h。孵育完成后,吸弃每孔检测抗体,用150μL Wash Buffer I洗涤5次,150μLWash Buffer II洗涤2次,每次5min。
(4.2.5)荧光标记的链霉亲和素的孵育(需全程避光)
荧光标记的链霉亲和素样品管使用前瞬离,加入1.4mL Sample Diluent混匀。每孔加入80μL荧光标记的链霉亲和素,密封条封好,用锡箔纸包裹整个玻璃芯片,正面向上,置于摇床孵育1h。拆掉芯片的塑料挡板(小心不要触碰芯片孔内检测表面),置于Waser/Dryer(洗脱)离心管中。在Waser/Dryer离心管中洗涤,加入30mL Wash Buffer I洗涤5次,加入30mL Wash Buffer II洗涤2次,每次5min(可放于摇床上,Buffer要覆盖整个芯片)。洗涤完成后,将Waser/Dryer离心管离心,1000r/min,3min,去除剩余缓冲液体,干燥芯片。
(4.2.6)准备扫描
用锡箔纸包裹Waser/Dryer离心管,4℃保存,准备上机扫描。
为了验证Bacillocin TK1的炎症调节能力,我们用K88ac(1×107CFU/mL)刺激IPEC-J2细胞3h,然后检测IPEC-J2细胞炎性因子的表达量。试验结果表明:(1)如图8所示,与空白对照组比,K88ac感染组显著上调IL-8的分泌;50μg/mL和75μg/mL TK1处理组显著下调细胞IL-8的分泌,其中50μg/mL TK1处理组下调IL-8分泌最明显,与对照组相比,下调了约26%(P<0.05)。与K88ac单独处理组相比,TK1+K88ac处理组显著下调IPEC-J2细胞IL-8的分泌,其中50μg/mL TK1+K88ac处理组下调最明显,下调了约50%(P<0.01)。(2)如图9所示,与对照组相比,K88ac感染组显著上调的TNF-α的分泌,而四个浓度的TK1处理组都可以下调TNF-α的分泌,但下调结果不显著。与K88ac单独处理组相比,25、50、75μg/mL TK1+K88ac处理组显著下调细胞TNF-α的分泌,其中50μg/mL TK1处理组下调最明显,下调约42%(P<0.01)。(3)如图10所示,对照组中细胞IL-10的分泌量为138pg/mL。与对照组相比,K88ac处理组和5μg/mL的TK1处理组均不能刺激细胞分泌IL-10。而25μg/mL、50μg/mL和75μg/mL浓度的TK1处理组均可以使细胞中IL-10的分泌量显著增加,其中75μg/mL的处理组IL-10分泌量达到3547pg/mL。与K88ac单独处理组相比,25μg/mL、50μg/mL、75μg/mL TK1+K88ac处理组均显著上调细胞IL-10的分泌,其中75μg/mL提前处理组上调最明显,IL-10分泌量达到2321pg/mL。(4)如图11所示,与对照组相比,K88ac感染组显著下调细胞TGF-β1的分泌,而25μg/mL、50μg/mL和75μg/mL浓度的TK1处理组能显著上调细胞TGF-β1的分泌,其中50μg/mL处理组上调TGF-β1的分泌最明显,上调约63%(P<0.01)。与K88ac单独处理组相比,25μg/mL,50μg/mL和75μg/mL TK1+K88ac处理组均能显著上调TGF-β1分泌,其中25μg/mL处理组上调最明显,上调约57%(P<0.01)。
(5)Bacillocin TK1对IPEC-J2细胞紧密连接蛋白表达的影晌
(5.1)样品制备及细胞总蛋白提取
(5.1.1)IPEC-J2细胞培养于6孔板,每孔加lxl06个细胞,1ml/孔。空白对照组:每孔加入DMEM/F-12 1:1完全培养基,并孵育至12h;K88ac处理组:每孔分别加入K88ac悬液(1×107CFU/mL)刺激3h,PBS洗3次,更换DMEM/F-12 1:1完全培养基,并孵育至12h;Bacillocin TK1处理组:每孔分别加入50、75μg/mL的Bacillocin TK1孵育18h,PBS洗3次,更换DMEM/F-12 1:1完全培养基,并孵育至12h。Bacillocin TK1预处理组:每孔分别加入50、75μg/mL的Bacillocin TK1孵育18h,PBS洗3次;每孔再加入K88ac悬液(1×107CFU/mL)刺激3h,PBS洗3次,更换DMEM/F-12 1:1完全培养基,并孵育至12h。吸出培养液,用预冷的PBS洗3次,用滤纸尽可能吸干培养皿里的PBS;
(5.1.2)每个孔加200μL裂解液(含PMSF),让细胞与裂解液充分接触,用细胞刮刀将细胞刮下,转入1.5mL离心管,冰浴裂解10min;
(5.1.3)40℃15000rpm离心10min,取上清至新的离心管中;
(5.1.4)采用BCA法对蛋白质定量,按比例加入5xSDS-PAGE蛋白上样缓冲液,95℃煮沸5min,分装,-20℃保存。
(5.2)Western Blot检测
(5.2.1)配置相应浓度的分离胶,迅速倒入安装好的玻璃夹板中,用水封液面;
(5.2.2)分离胶凝固后,弃去上层水,滤纸吸干剩余水分,倒入5%浓缩胶,插入梳子;
(5.2.3)浓缩胶凝固后,小心垂直拔掉梳子,将胶板装入电泳槽,加入电泳液;
(5.2.4)上样,80V低电压电泳30min,120V高电压电泳1h,待样品中的溴酚蓝移动至凝胶最下端时,停止电泳;
(5.2.5)小心取出凝胶,根据试验需要切胶,从负极到正极依次摆放滤纸,凝胶,PVDF膜,滤纸,小心驱走每层之间的气泡,100V电泳50min转膜;
(5.2.6)将膜做好标记后用TBST溶液洗10min以洗掉转移缓冲液;
(5.2.7)用封闭液封闭膜2.5h;
(5.2.8)TBST溶液洗膜4次,每次10min,以洗掉封闭液;
(5.2.9)将一抗按相应比例稀释后孵育膜,4℃过夜;
(5.2.10)TBST溶液洗膜4次,每次10min,洗掉一抗:
(5.2.11)将二抗按相应比例稀释后室温避光孵育膜1h;
(5.2.12)TBST溶液洗膜3次,每次10min,洗掉二抗;
(5.2.13)TBS溶液洗膜10min以洗掉吐温;
(5.2.14)将ECL发光液滴加在膜上进行曝光,用ImageJ软件进行分析。
结果如图12-15所示。Western blot检测紧密连接蛋白表达发现,与空白对照组相比,K88ac组IPEC-J2细胞的紧密连接蛋白OCLN、CLDN1和ZO-1表达量显著下降;50μg/mL Bacillocin TK1组OCLN表达量下降,CLDN1和ZO-1表达量显著上升;75μg/mL Bacillocin TK1组OCLN、CLDN1和ZO-1表达量均显著上升;而50和75μg/mL Bacillocin TK1预处理可以显著缓解K88ac引起的OCLN、CLDN1和ZO-1表达量下降。75μg/mL浓度的Bacillocin TK1预处理缓解K88ac导致的紧密连接蛋白表达下降效果最明显。
以上所述仅是为了便于本领域的技术人员理解本发明的技术方案,并不用以限制本发明。凡在本发明的精神和原则之内,所作的任何修改、等同替换、改进等,均应包含在本发明的保护范围之内。
序列表
<110> 华中农业大学
<120> 凝结芽孢杆菌产细菌素、其制备方法及应用
<160> 1
<170> SIPOSequenceListing 1.0
<210> 1
<211> 12
<212> PRT
<213> 凝结芽孢杆菌TK1(Bacillus coagulans TK1)
<400> 1
Gly Gly Ala Gly Met Asn Pro Ile Asp Tyr Asp Arg
1 5 10
- 还没有人留言评论。精彩留言会获得点赞!