基因甲基化分析方法、产品和用途与流程
本发明属于基因分析领域。具体而言,本发明涉及基因甲基化检测方法、产品和用途。
背景技术:
dna甲基化是基因转录调控中最重要的表观遗传学修饰之一。这种修饰在与发育和疾病相关的生物学过程中起着重要作用。基因甲基化作为早癌诊断和监测疾病进展的分子标记物,近年来已经设计了多种方法来检测和区分正常和癌症样本中的甲基化序列。这些方法基本都基于核酸提取、亚硫酸氢盐转化、回收后得到的bisdna(亚硫酸氢盐转化后的dna)进行检测。
当前市面上已出现了多种多样的商业化产品,包括凯杰公司的提取试剂盒、zymo公司的转化纯化试剂盒等。当前提取试剂盒主要包括以下几个步骤:样本的前处理;表面活性剂、蛋白酶k等裂解细胞消化蛋白,将dna从核蛋白上释放出来;采用离心柱或磁珠的方法富集dna;多次淋洗去除蛋白、多糖等杂质;最后将dna从固相载体上洗脱下来。转化纯化试剂盒主要包括以下几个步骤:上述提取得到的dna进行亚硫酸氢盐转化;采用强碱(如氢氧化钠)脱磺酸基;多次淋洗;最后将dna从固相载体上洗脱下来进行检测。整个过程需要多次淋洗、更换反应管,操作繁琐,且dna损耗大、污染概率高。
商业化试剂盒的上述两个过程相比传统方法有了很大的改进,然而仍需近8个小时的时间才能获得上机检测模板;此外,对于一些肿瘤特异性循环dna相对稀缺性的样本复杂的操作过程会大大提高核酸的损耗。这对现有的dna提取和转化处理技术提出了挑战。
技术实现要素:
发明人通过大量研究,提出一种样品裂解及dna在有核酸吸附能力的载体上进行富集同步进行、有核酸吸附能力的载体上直接进行dna转化、再富集及回收检测的单管处理的方法和试剂盒。本发明的方法和试剂盒允许在3小时内完成从生物样品到获得上机检测样品的全过程;简化了操作过程,最大程度减少了前处理、漂洗、洗脱、转化、再洗脱等繁琐步骤,减少了过程中dna的降解和丢失,达到优于传统的甲基化检测处理方法的检测效果。此外,本发明的试剂稳定性更高,且更易实现自动化操作。
在一些实施方案中,本发明提供一种dna甲基化分析方法,包括1)使含有dna的生物样品与有核酸吸附能力的载体、裂解液同时接触,将dna富集于载体上;2)直接使步骤1)获得的吸附有dna的载体与转化试剂接触从而将载体上富集的dna的至少一个未甲基化的胞嘧啶碱基转化为尿嘧啶或在杂交上可检测的不同于胞嘧啶的其它碱基,3)再用结合液处理步骤2)得到的混合液,使转化后的dna再富集于载体上。
在一些实施方案中,本发明的步骤2)紧接步骤1)进行,即步骤1)和步骤2)之间可以不进行任何其他处理,如洗涤处理等。在一些实施方案中,所述方法的步骤1)还包括添加核酸结合促进剂,使得含有甲基化dna的生物样品与有核酸吸附能力的载体、核酸结合促进剂和裂解液同时接触,将含有甲基化dna的核酸富集于载体上。
在一些实施方案中,本发明的方法中的核酸结合促进剂包括促进裂解液中的核酸与有核酸吸附能力的载体结合的任何试剂,例如其可以是适当的有机溶剂和/或润湿剂。在一些实施方案中,所述核酸结合促进剂包括例如异丙醇、异丁醇、正丁醇、丙酮、吡啶、乙腈、甲酸甲酯、乙酸乙酯、丙二醇、甘油、二甲亚砜、聚乙二醇、烷基硫酸盐、磺酸盐或酯、多元醇表面活性剂(例如司盘类、吐温类表面活性剂)、聚氧乙烯表面活性剂中的一种或多种。
在一些实施方案中,可以在本发明的方法中使用的裂解液没有特别限制,可以使用本领域中已经采用的适当裂解液。在一些实施方案中,所述裂解液包含胍盐,如盐酸胍、异硫氰酸胍。在一些实施方案中,所述裂解液还可以包含去垢剂如sds,金属离子螯合剂如edta,金属盐如nacl等中的一种或多种。在一些实施方案中,所述裂解液可以配制成缓冲溶液,如三羟甲基氨基甲烷缓冲液、柠檬酸缓冲液。在一些实施方案中,本发明的裂解步骤中还可以包括适当的促进核酸从样品释放和分离的试剂,例如本发明的方法的1)可以进一步包括使所述含有甲基化dna的生物样品与蛋白酶如蛋白酶k接触。
在一些实施方案中,转化dna的试剂没有特别限制,可以使用本领域任何使dna中至少一个未甲基化的胞嘧啶碱基转化为尿嘧啶或在杂交上可检测的不同于胞嘧啶的其它碱基的适当的试剂。在一些实施方案中,所述转化试剂可以包括亚硫酸氢盐、焦亚硫酸盐或其组合,例如亚硫酸氢钠、亚硫酸氢镁、亚硫酸氢铵、焦亚硫酸钾、亚硫酸钠、焦亚硫酸钠中的一种或多种。在一些实施方案中,所述转化试剂可以包括亚硫酸氢钠、亚硫酸钠的混合溶液。
在一些实施方案中,本发明的方法的转化过程中可以添加任何促进dna转化的试剂和/或dna保护剂,例如有dna保护作用的自由基阱,包括但不限于:氢醌、6-羟基-2,5,7,8-四甲基苯并二氢吡喃-2-羧酸、6-羟基-2,5,7,8-四甲基色满-2-甲酸中的一种或多种的有机溶液,如二乙二醇二甲醚溶液、氯仿溶液或四氢呋喃溶液。
在一些实施方案中,本发明的方法中可以采用任何适当的有核酸吸附能力的载体,包括但不限于:磁珠、非磁性的微球、吸附膜等。在一些实施方案中,有核酸吸附能力的载体包括但不限于:羟基磁珠、羧基磁珠、链霉亲和素免疫磁珠、离子交换树脂等。在一些实施方案中,磁珠的壳层优选氧化硅或琼脂糖。在一些实施方案中,所述磁珠优选超顺磁珠。在一些实施方案中,磁珠粒径可以为100nm~3μm,优选500-1μm。
在一些实施方案中,本发明方法的步骤2)的转化过程还包括转化后处理步骤,从而制备适于直接进行后续甲基化检测的样品,所述转化后处理步骤包括使用清洗液对转化后的富集于磁珠上的核酸进行清洗的步骤,任选地所述清洗液包括三羟甲基氨基甲烷溶液、三羟甲基氨基甲烷-盐酸溶液、乙醇溶液,任选地所述清洗液的ph在6~10范围内,优选ph为8~10,优选地所述转化后处理不包括脱磺处理。在一些实施方案中,发明人已经发现本发明的方法制备的转化样品不需要进行脱磺处理,由此大大节省了实验时间,例如本发明的方法中清洗后的样品可以直接进行后续甲基化检测,例如pcr检测、测序检测等。在一些实施方案中,本发明的方法制备的转化样品不进行脱磺处理时,可以在pcr检测过程中的预变性阶段增加一段时间的高温处理,例如10-20分钟(例如15分钟)90-98℃(例如95℃)高温处理进行脱磺。
在一些实施方案中,本发明方法中的生物样品的来源没有特别限制,例如所述生物样品选自任何含有dna的样品,包括但不限于:无细胞来源的样品或细胞来源的样品;任选的包括但不限于:血液、尿液、粪便、细胞培养液、组织、痰液、胸水、腹水、脑脊液以及这些样品的处理品,任选地所述生物样品可以来自健康受试者和/或患者,例如癌症患者。
在一些实施方案中,本发明的dna甲基化分析方法包括对基因组中dna甲基化的有无和/或模式进行分析的方法。在一些实施方案中,本发明的dna甲基化分析方法包括对基因组中天然存在的和/或异常的dna甲基化(例如是否存在dna甲基化和/或dna甲基化状态是否发生改变)进行分析,可以用于研究dna甲基化对基因表达的影响等。在一些实施方案中,本发明的dna甲基化分析方法包括制备适合dna甲基化检测的样品的方法,例如包括对甲基化dna进行提取、富集和转化和再富集、检测的步骤。在一些实施方案中,本发明的dna甲基化分析方法包括对dna甲基化状态检测的方法,其包括将制备的样品进行dna甲基化检测的步骤。在一些实施方案中,dna甲基化检测可以采用任何适当的方法进行,例如pcr分析,探针分析,测序分析等。在一些实施方案中,将本发明的方法制备的转化后样品直接进行后续分析,而不需要另外的处理步骤,例如转化后的结合在磁珠上的样品可以不进行洗脱,而直接进行后续pcr分析。
在一些实施方案中,本发明的方法中采用的结合液可以包括离液序列高的盐(chaotropicsalt),如胍盐,例如盐酸胍、异硫氰酸胍,任选地所述结合液可以加入缓冲溶液,如柠檬酸缓冲液。
在一些实施方案中,本发明提供一种适于本发明方法的dna甲基化分析试剂盒,其使用说明中包含本发明描述的方法,其包含一个或多个容器,所述容器中包含本发明描述的方法中使用的试剂。在一些实施方案中,所述试剂盒包括有核酸吸附能力的载体和裂解液,以及任选地核酸结合促进剂。在一些实施方案中,所述试剂盒进一步包括转化试剂。在一些实施方案中,所述试剂盒包含适当的缓冲液。在一些实施方案中,试剂盒中进一步包括对转化后处理的甲基化dna进行检测的试剂,例如pcr试剂,探针,测序试剂。
本发明提供的方法和试剂盒可以用于dna甲基化的各种分析。在一些实施方案中,本发明提供的方法和试剂盒可以用于研究dna甲基化的各种生物功能,例如调节基因表达等。
本发明提供一种简单、高效,可将dna富集、转化、再富集在同一套磁珠上顺序一次性完成的dna简便处理方法和相应的试剂盒。
在一些实施方案中,本发明提供一种dna甲基化分析方法中的dna处理方法,该方法包括裂解液释放生物样品中dna的同时用具有核酸吸附功能的载体如磁珠同步富集核酸;dna在载体上直接进行转化、再富集处理后dna到同一套磁珠上的步骤。
在一些实施方案中,在本发明的方法中,裂解液包括但不限于盐酸胍、异硫氰酸胍等盐类溶液,包括但不限于异丙醇等有机溶剂,加或不加蛋白酶k试剂均可。
在一些实施方案中,在本发明的方法中,磁珠表面可以修饰有羟基或羧基。
在一些实施方案中,在本发明的方法中,转化试剂是亚硫酸氢盐、焦亚硫酸盐和/或dna保护剂的混合物。在一些实施方案中,转化试剂优选为:亚硫酸氢钠、焦亚硫酸钠的混合溶液,或者进一步的添加dna保护剂。在一些实施方案中,所述dna保护剂为有dna保护作用的自由基阱,包括但不限于:氢醌、6-羟基-2,5,7,8-四甲基苯并二氢吡喃-2-羧酸、6-羟基-2,5,7,8-四甲基色满-2-甲酸中的一种或多种的有机溶液,如二乙二醇二甲醚溶液、氯仿溶液或四氢呋喃溶液。
在一些实施方案中,磁珠壳层优选氧化硅、琼脂糖等。在一些实施方案中,亚硫酸氢盐是亚硫酸氢铵时,磁珠壳层优选琼脂糖。
在一些实施方案中,本发明的方法还包括样本裂解与磁珠吸附核酸同步进行的过程。
在一些实施方案中,本发明的方法还包括磁珠携带富集的dna直接进行亚硫酸氢盐转化的过程。
在一些实施方案中,本发明的方法还包括转化的dna无需脱磺步骤即可进行pcr检测的过程。
在一些实施方案中,本发明还提供dna甲基化分析的试剂盒,该试剂盒包括裂解液、磁珠、转化试剂、结合液、清洗液和缓冲液等。
在一些实施方案中,在本发明的试剂盒中,裂解液是胍盐和/或三羟甲基氨基甲烷和/或乙二胺四乙酸和/或氢氧化钠和/或吐温和/或异丙醇和/或蛋白酶k的混合物。
在一些实施方案中,在本发明的试剂盒中,载体例如磁珠表面可以修饰有硅烷醇基团,例如磁珠的壳层可以选自氧化硅、琼脂糖等,磁珠粒径最好选择但不限于100nm~2μm。
在一些实施方案中,在本发明的试剂盒中,转化试剂是亚硫酸氢盐、焦亚硫酸盐和/或dna保护剂的混合物。在一些实施方案中,转化试剂优选为:亚硫酸氢钠、焦亚硫酸钠的混合溶液,或者进一步的添加dna保护剂。在一些实施方案中,所述dna保护剂为有dna保护作用的自由基阱,包括但不限于:氢醌、6-羟基-2,5,7,8-四甲基苯并二氢吡喃-2-羧酸、6-羟基-2,5,7,8-四甲基色满-2-甲酸中的一种或多种的有机溶液,如二乙二醇二甲醚溶液、氯仿溶液或四氢呋喃溶液。在一些实施方案中,转化温度为80~100℃,转化时间为40~60min。
在一些实施方案中,在本发明的试剂盒中,结合液包括但不限于离液序列高的盐如盐酸胍、异硫氰酸胍等盐类溶液。
在一些实施方案中,在本发明的试剂盒中,清洗液的ph在6~10范围内均可,但优选8~10。
在一些实施方案中,在本发明的试剂盒中,缓冲液包括但不限于纯化水、te缓冲液、氢氧化钠弱碱溶液。
在一些实施方案中,本发明提供一种dna甲基化检测方法,该方法包括以下步骤:
浓缩:生物样品在裂解液作用下细胞裂解、核酸释放,磁珠在裂解液高浓度高离液盐环境下与核酸接触,形成磁珠-核酸复合物,样本裂解与磁珠吸附核酸同步进行;
转化:使用转化试剂处理步骤(1)浓缩得到的磁珠-核酸复合物,得到转化后dna;
再浓缩:在结合液作用下,磁珠与转化后dna重新接触,形成磁珠-核酸复合物,清洗液淋洗后再经缓冲液洗脱得到转化后dna;
检测:测定步骤(3)得到的转化后dna。
在一些实施方案中,根据上述检测方法得到的dna甲基化信息可以直接用于实验室和临床研究。
在本发明的方法中,步骤(1)中样本裂解与磁珠吸附核酸同步进行;
在本发明的方法中,步骤(2)中的转化后dna无需脱磺处理即可进行检测;
在本发明的方法中,步骤(4)中的pcr检测只需在预变性阶段增加15分钟处理即可省去试剂脱磺过程。
在本发明的方法中,步骤(4)中的方法可以是染料法也可以是探针法,可以进行pcr定性检测也可以进行pcr定量检测,所得pcr产物也可以进行测序分析。
在一些实施方案中,生物样品可以选自任何含有dna的样品,包括但不限于:无细胞来源的样品或细胞来源的样品;任选的包括但不限于:血液、尿液、粪便、细胞培养液、组织、痰液、胸水、腹水、脑脊液以及这些样品的处理品,任选地所述生物样品可以来自健康受试者和/或患者,例如癌症患者。
本发明所提供的方法的整个技术过程实现单管反应,操作简便,核酸回收率高,降低污染和出错概率。基于本发明所提供的上述方法而制备的试剂盒使得上述方法的实施更加简便快捷。
本发明已经发现,在裂解步骤中可以同时添加磁珠和裂解液实现同步裂解和磁珠结合,不会影响裂解的效果。另外,可以添加核酸结合促进剂,增强裂解液中的核酸与磁珠表面的疏水作用。通过这样处理,本发明可以在极大程度上简化核酸提取的步骤。还发现,通过使含有dna的生物样品与有核酸吸附能力的载体、裂解液同时接触,将dna富集于载体上后,能够不进行任何其他处理(如洗涤处理),直接使用上述处理获得的吸附有dna的载体与转化试剂接触,将载体上富集的dna的至少一个未甲基化的胞嘧啶碱基转化为尿嘧啶或在杂交上可检测的不同于胞嘧啶的其它碱基。在转化步骤后,可以再用结合液处理前步得到的混合液,使转化后的dna再富集于载体上。在进行pcr检测时,可以采用洗脱液将转化后的dna从载体上洗脱后检测,也可以使用pcr缓冲液直接重悬富含dna的载体直接进行pcr扩增。由此,dna的富集、转化、回收、检测等均可以在含有磁珠的单个试剂管中完成,省去了繁琐的洗脱和/或漂洗过程(例如裂解后和/或转化后的洗脱和/或漂洗步骤,以及转化后脱磺处理步骤等),降低了dna的损耗,提高了核酸回收效率。
本发明的方法和产品的操作简便。例如,生物样本可加或不加蛋白酶k加热孵育;提取得到的dna无需从磁珠上分离即可直接进行甲二基化处理;省去了多次漂洗和氢氧化钠脱磺过程。从样本到获得上机的模板整个过程在1个试剂管中即可完成。
本发明的方法和产品节省时间。例如,本发明的方法和产品仅需3h即可完成从生物样品获得上机检测样品的全过程。
附图说明
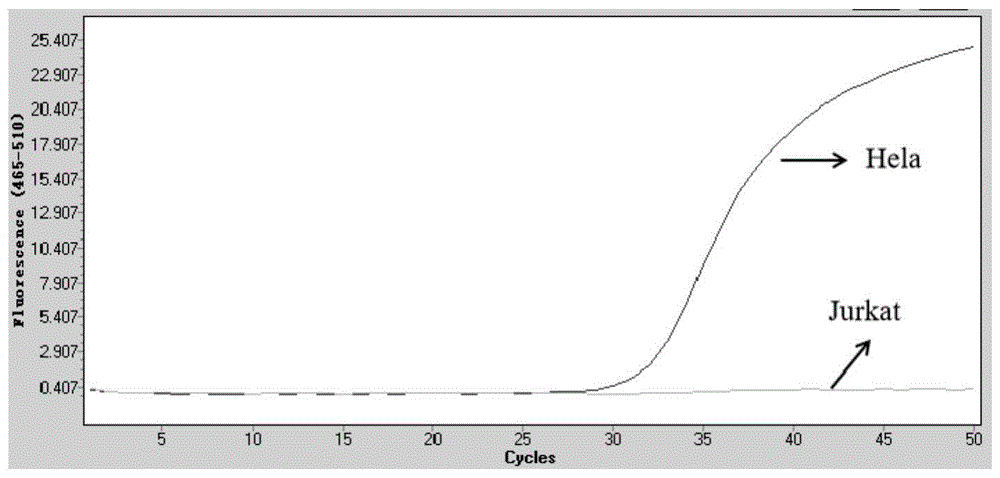
图1本发明的方法用于区分septin9基因的甲基化和未甲基化:septin9基因中的cpg在hela细胞中是甲基化的,在jurkat细胞中是未甲基化的。
图2显示裂解与结合同步进行对对核酸浓缩效果影响;
图3显示本发明dna可在磁珠上直接转化。
图4显示转化前dna序列。
图5显示dna80℃转化40min后序列。
图6显示dna100℃转化60min后序列。
图7显示dna从磁珠上洗脱后进行转化的检测限。
图8显示dna在磁珠上直接转化的检测限。
图9显示本发明适于尿液dna甲基化的检测。
图10显示本发明适于粪便dna甲基化的检测。
具体实施方式
下面通过实施例对本发明所提供的甲基化dna的浓缩和检测方法进行详细说明。
实施例1:
septin9基因甲基化的检测
样品的预处理:在2毫升健康人血浆样本中分别投入等量的打断的hela和jurkat细胞dna;
浓缩:加入4毫升裂解液(所述裂解液由5.22m异硫氰酸胍、0.42m的te缓冲液和17%的曲拉通组成)和40微升磁珠(海狸,羟基磁珠),室温振摇10分钟,磁力架吸附磁珠后弃上清。
转化:加入320微升转化试剂(所述转化试剂为5.34m的亚硫酸氢铵、0.53m的亚硫酸钠、0.05m保护剂(保护剂组分6-羟基-2,5,7,8-四甲基苯并二氢吡喃-2-羧酸的四氢呋喃溶液的混合液))重悬磁珠,上述混合物在85℃恒温孵育40分钟。
再浓缩:在混合物中加入1毫升的结合液(7m盐酸胍),室温振摇10分钟。磁珠经清洗液漂洗2次,再经60微升缓冲液洗脱。
检测:设计特异性的pcr引物和探针参考文献:warren,jorjad,etal.,septin9methylateddnaisasensitiveandspecificbloodtestforcolorectalcancer,bmcmedicine,2011,9:133中设计的引物、探针及pcr扩增程序方法。
septin9基因的检测区域在hela细胞中是异常甲基化的,在jurkat细胞中是甲基化状态是正常的。在上述处理过的样本中,区分出该基因靶区域的甲基状态差异,如图1所示。该结果表明,利用本发明提供的方法可以实现dna的提取及同步富集到载体磁珠上,后续直接在磁珠上转化,进而再富集后用于检测。图1显示本发明的方法进行基因甲基化检测的结果。
实施例2:
在本实施例中,比较了裂解液与磁珠同步加入和裂解液与磁珠依次加入的效果。磁珠依次加入方法的其余步骤与实施例1步骤相同,对同一批次样本进行核酸浓缩。得到dna采用实时荧光pcr进行甲基化检测,检测结果见图2。该结果表明,样本中加入裂解液的同时可以同步加入磁珠,不会影响裂解、结合的效果,使结合的步骤与裂解的步骤同时完成,从而极大程度上简化了核酸提取的步骤。图2显示裂解与结合同步进行对对核酸浓缩效果影响。
实施例3:
dna被磁珠富集后直接进行转化
在2ml健康人血浆样本中投入打断的hela细胞dna。1份完全按照实施例1进行处理,1份步骤(1)按照下述步骤处理:
浓缩:加入4毫升裂解液和40微升磁珠,室温振摇10分钟,磁力架吸附磁珠后弃上清,再经淋洗和100微升缓冲液(te缓冲液,ph=8.0)洗脱。
转化:加入220微升的转化试剂(所述转化试剂为7.8m的亚硫酸氢铵、0.78m的亚硫酸钠、0.07m的dna保护剂(保护剂组分6-羟基-2,5,7,8-四甲基苯并二氢吡喃-2-羧酸的二乙二醇二甲醚溶液的混合液),上述混合物在85℃保温40分钟。
再浓缩:在混合物中加入1毫升的结合液(7m盐酸胍)和40微升磁珠,室温振摇10分钟。
磁珠经清洗液漂洗2次,再经60微升缓冲液(te缓冲液,ph=8.0)洗脱最后,pcr检测两种方式差异。
如图3所示,dna不从磁珠上分离下来可以直接进行转化,而且减少中间dna洗脱步骤后,核酸回收效率得到提高,表明磁珠富集核酸后无需进行中间dna洗脱环节即可直接进行转化过程,且纯化时无需再加入新的磁珠。图3显示本发明dna在磁珠上直接转化的结果。
实施例4:
dna转化温度及转化时间
本实施例采用不同组别的转化温度及转化时间,其余步骤均采用实施例1的使用方法,对同一批次样本进行核酸提取转化。通过不同转化温度及转化时间方法得到dna采用实时荧光pcr进行甲基化检测,检测结果见表1:
表1:经不同转化条件处理后的甲基化dna检测结果
可以看出,采用实时荧光pcr方法检测甲基化情况,本转化试剂在80~100℃下均正常进行转化,各温度检测cp值相当;同时,通过对相同温度条件下不同孵育时间对转化效果的影响分析可知,采用本发明的转化试剂进行恒温转化,仅需40分钟即可得到很好的效果,大大节省了转化时间。相对于传统的变温方法而言,本发明采用恒温的方法更简单,易操作,能使用便宜、简便恒温仪器进行相关实验研究。
此外,我们对优化得出的转化温度、转化时间下的dna转化效率进行评价。
参考文献(emilyevaholmes,mariajung,sebastianmeller,etal.performanceevaluationofkitsforbisulfite-conversionofdnafromtissues,celllines,ffpetissues,aspiraes,lavages,effusions,plasma,serumandurine.plosone,2014,9(4):e93933.)报道中的测定转化效率的方法:以上述人基因组dna为研究对象,使用不含“c”的通用引物,对转化前和转化后的dna进行扩增,扩增区域内含有30个“c”。其中,转化前dna扩增后进行测序,以确认dna原始序列中“c”的状态。转化后dna的扩增产物进行ta克隆,每个ta克隆产物随机挑20个转化子,对其进行测序,其中20个转化子中,共含有“c”600个,统计“c”转化成“t”的个数,若为n,则转化效率为:(n/600)×100%。
转化前后测序结果如图4-6所示:图4显示转化前dna序列。图5显示dna80℃转化40min后序列。图6显示dna100℃转化60min后序列。
从中可以看出,转化前的c基本转化为t;统计测序结果,计算转化效率。(1)样品转化前状态:模板中30个“c”的状态:均为“c”。(2)样品转化后状态(80℃转化40min):20个转化子:600个“c”中共有598个“c”在转化后转化成“t”,转化效率=99.7%。(3)样品转化后状态(100℃转化60min):20个转化子:600个“c”在转化后全部转化为“t”,转化效率=100%;综上所述,在本试剂盒的转化效率≥99.7%。
实施例5:
在1ml健康人血浆样本中投入10ng/ml的打断的hela和jurkat细胞dna,其中hela细胞dna与jurkat细胞掺比分别为10%、1%、0.5%、0.1%、0.05%、0%。分别按照实施例1和实施例2进行处理。对比检测下限,结果如图7-8所示。图7显示dna从磁珠上洗脱后进行转化的检测限。图8显示dna在磁珠上直接转化的检测限。
从图中我们可以看出,传统的dna从磁珠上洗脱后再进行转化处理过程检测下限到0.5%,而本发明提供的方法检测下限达到0.05%,具有显著效果。
实施例6:肠血浆样本中septin9基因甲基化的检测
检测30例结直肠癌、30例健康人血浆样本。分别采用对照试剂盒(epi公司试剂盒)和本发明的方法进行样本前处理,采用epi试剂盒中pcr试剂、程序进行septin9三孔检测。检测结果统计如下表:
表2本发明的方法和对照方法的比较结果
表3:本发明方法和对照方法的血浆dna甲基化检测结果
从上表可以看出,本发明在结直肠癌样本的阳性检出孔数上具有较大优势,同时检测特异性仍得以保持。
实施例7:尿液样本中nid2基因甲基化的检测
检测10例膀胱癌和10例泌尿系统良性疾病全尿样本。本实施例采用方法的具体步骤同实施例1,不同之处在于,相应的检测引物不同,裂解液组分不同,(所述裂解液由2.75m异硫氰酸胍、0.22m的te缓冲液、9%的曲拉通和47%异丙醇组成)。最终得到的转化的dna直接用methylate方法(weisenbergerdj,campanm,longti,kimm,woodsc,etal.(2005)analysisofrepetitiveelementdnamethylationbymethylight.nucleicacidsres33:6823-6836)进行nid2甲基化检测,显示均具有较好的区分度。图9显示本发明方法尿液dna甲基化的检测结果。
实施例8:粪便样本中bmp3基因甲基化的检测
检测10例结直肠癌(crc)、10例进展期腺瘤(aa)和10例非进展期腺瘤(naa)粪便样本bmp3基因甲基化情况,采用δδct方法评价。本实施例采用方法的具体步骤同实施例1,最终得到的转化的dna直接用methylate方法(weisenbergerdj,campanm,longti,kimm,woodsc,etal.(2005)analysisofrepetitiveelementdnamethylationbymethylight.nucleicacidsres33:6823-6836)进行甲基化检测,显示均具有较好的区分度。图10显示本发明方法粪便dna甲基化的检测结果。
- 还没有人留言评论。精彩留言会获得点赞!