希瓦氏菌GZ-7及其产右旋糖酐酶的方法与流程
本发明涉及一种微生物,特别是一种分离筛选自种植甘蔗土壤中的希瓦氏菌(shewanellasp.)gz-7,cgmccno.17008;本发明还涉及该菌株产右旋糖酐酶的方法和产品。
背景技术:
右旋糖酐酶(dextranase,α-d-1,6-glucan-6-d-glucanohydrolase,ec3.2.1.11),是一种专一性水解右旋糖酐内部的α-1,6糖苷键的水解酶。按照右旋糖酐酶对葡聚糖的作用位点不同,可将右旋糖酐酶分为内切型和外切型两种。通过了解一种右旋糖酐酶的水解产物,内切型右旋糖酐酶通常从右旋糖酐内部水解产生寡聚低分子糖或中分子量右旋糖酐,而外切型右旋糖酐酶一般从右旋糖酐分子水解获得单糖。
右旋糖酐并不是蔗糖中的天然成分,是甘蔗在收割、运输、贮藏或者是压榨过程中由于环境中各种微生物的污染,最主要是细菌肠膜状串珠菌菌株利用蔗糖大量繁殖,从而将蔗糖糖转化而成一种相对分子质量较高的粘性多糖,这就是制糖工业中称之的“蔗饭”。粘性多糖的产生在甘蔗经冻害而裂开,或者是温度的暂时回升的情况变得尤为严重。此外,经过腐败变质的甘蔗,葡聚糖的含量也会相应的增高。
在澳大利亚等国,用右旋糖酐酶来处理已经腐败的甘蔗,已经成为了一种常规的行之有效的方法,并且该方法不含有任何技术问题,而对于蔗糖制造业中的ph值可以用ph计来进行直接的检测,当甘蔗汁的ph低于5时再加入右旋糖酐酶是最经济有效的办法。除此之外,右旋糖酐酶还可以应用于粗糖的制备工艺或者是甜菜糖的生产过程中,日本已经就右旋糖酐酶在制糖工艺的应用这方面已申请了专利。我国在2012年将右旋糖酐酶作为食品添加剂。
所以,研究新的可以产右旋糖酐酶的新菌种具有重要的意义。
技术实现要素:
本发明所要解决的技术问题是针对现有技术的不足,提供一种新的能产右旋糖酐酶的希瓦氏菌gz-7。
本发明所要解决的另一个技术问题是提供上述希瓦氏菌gz-7菌株产右旋糖酐酶的方法。
本发明的特征包括希瓦氏菌(shewanellasp.)gz-7菌株本身。本发明所涉及的菌株gz-7是在中国广东省种植甘蔗的土壤中分离到的希瓦氏菌(shewanellasp.)gz-7。该菌株已于2018年12月19日保藏在中国微生物菌种保藏管理委员会普通微生物中心cgmcc,保藏号是cgmccno.17008。保藏单位地址:北京市朝阳区北辰西路1号院3号,中国科学院微生物研究所,联系电话:010-64807355。
本发明还公开了利用菌株gz-7发酵生产右旋糖酐酶的方法。该方法步骤如下:将希瓦氏菌gz-7菌株斜面种子接种到lb培养基中,30℃,180r/min,装液量20%,培养18h,得种子液;将种子液以2.5%的接种量接种于产酶培养基中,180r/min,35℃培养48h,10000r/min离心5min,取上清液即为右旋糖酐酶粗酶;所述的产酶培养基为:硫酸钠1%,可溶性淀粉0.5%,右旋糖酐t401%,ph7.5。
本发明还公开了一种利用上述方法所产右旋糖酐酶水解右旋糖酐的方法,其特点是:将该右旋糖酐酶与右旋糖酐在40℃反应1-5h,使用具有葡萄糖和麦芽低聚糖的样品作为标准,点样后将硅胶板板浸入含有10ml正丁醇,6ml乙醇和4ml水的溶液中,然后在120℃加热,在tlc板上观察水解产物;水解产物为葡萄糖、麦芽糖、麦芽三糖、麦芽四糖、麦芽五糖。
与现有技术相比,本发明具有以下有益效果:本发明提供了一种新的分离筛选自种植甘蔗土壤中的希瓦氏菌(shewanellasp.)gz-7。该菌株具有优良的特性,可以产右旋糖酐酶,有效地拓展了右旋糖酐酶的来源。
附图说明
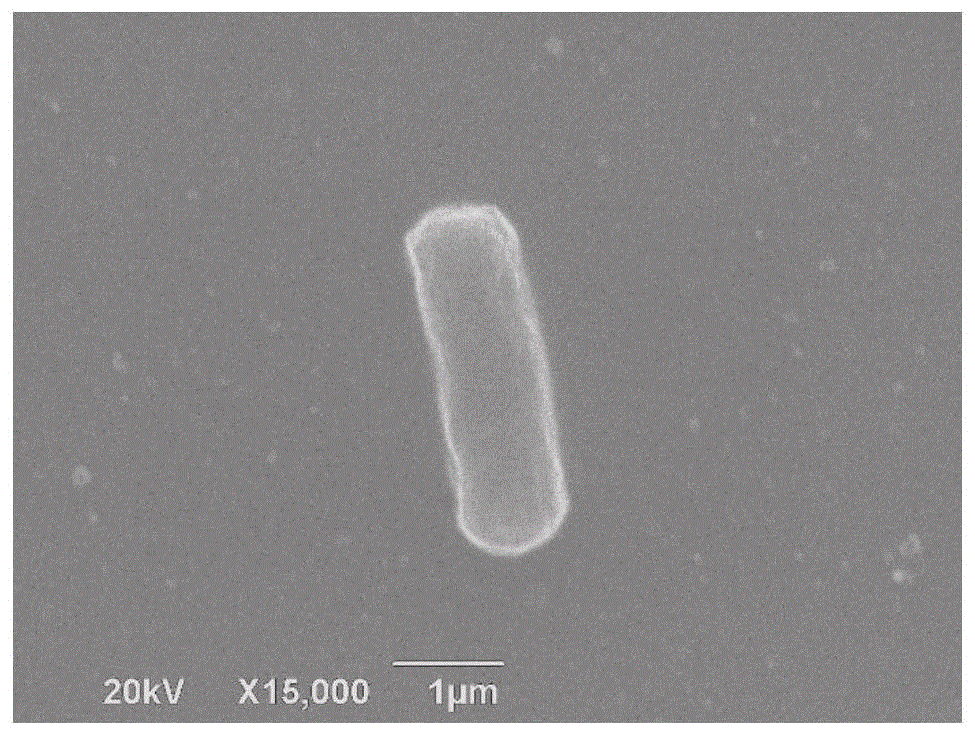
图1为菌株gz-7的电镜照片形态(15000×)图;
图2为菌株gz-7在初筛平板上形成的透明圈图;
图3为菌株gz-7系统进化树;
图4为温度对菌株gz-7生长的影响图;
图5为ph对菌株gz-7生长的影响图;
图6为接种量对菌株gz-7生长的影响图;
图7为转速对菌株gz-7生长的影响图;
图8为装液量对菌株gz-7生长的影响图;
图9为碳源对菌株gz-7产酶的影响图;
图10为氮源对菌株gz-7产酶的影响图;
图11为温度对菌株gz-7产酶的影响图;
图12为ph对菌株gz-7产酶的影响图;
图13为时间对菌株gz-7产酶的影响图;
图14为装液量对菌株gz-7产酶的影响图;
图15为菌株gz-7右旋糖酐酶的最适作用温度图;
图16为菌株gz-7右旋糖酐酶的最适作用ph图;
图17为菌株gz-7右旋糖酐酶的热稳定性图;
图18为菌株gz-7右旋糖酐酶的ph稳定性图;
图19为菌株gz-7右旋糖酐酶水解右旋糖酐图。
具体实施方式
以下进一步描述本发明的具体技术方案,以便于本领域的技术人员进一步地理解本发明,而不构成对其权利的限制。
实施例1,一种分离筛选自种植甘蔗土壤中的希瓦氏菌(shewanellasp.)gz-7,cgmccno.17008。该菌株具有以下特征:菌株gz-7为革兰氏阴性杆菌、无荚膜。菌株vp实验为阴性、不能发酵葡萄糖,能利用果糖、蔗糖、木糖、葡萄糖、阿拉伯糖,不能利用乳糖、纤维二糖。不能反硝化不产生赖氨酸脱羧酶、鸟氨酸脱羧酶,有运动能力,不产生硫化氢,不产生吲哚。菌株gz-7生长温度范围为20-40℃,最适生长温度为30℃;生长ph范围为5-9,最适生长ph为7.5。
一、菌株的筛选方法
1.1中涉及的培养基:
lb培养基:胰蛋白胨1%,酵母粉0.5%,nacl1%ph7.5
筛选培养基:胰蛋白胨1%,酵母粉0.5%,蓝色葡聚糖20000.2%,右旋糖酐t201%,琼脂2%,蒸馏水配制,ph7.5。
种子培养基:胰蛋白胨1%,酵母粉0.5%,nacl1%ph7.5
产酶培养基:胰蛋白胨1%,酵母粉0.5%,右旋糖酐t401%,蒸馏水配制,ph7.5。
1.2菌株的筛选方法:
取种植甘蔗土壤1g放入50mllb培养基中,30℃、180r/min培养12h。选取合适的培养液的稀释液涂布至筛选培养基,30℃培养3-4d,菌落长出后观察菌落周围是否出现透明圈。挑取有透明圈的单菌落菌株接入产酶培养基,30℃、180r/min培养2d,10000r/min离心15min取上清液测定酶活力大小。选出透明圈较大和酶活力较高的菌株。
二、菌株gz-7的形态特征与生理生化特征。
2.1形态特征:
菌株gz-7为革兰氏阴性杆菌,0.3-0.5μm×1.5-2μm(见图1),菌株gz-7无芽孢,能运动,在固体培养基中培养48h后,菌落呈灰白色、湿润、边缘光滑、中间突起、易挑取,在筛选平板上能形成透明圈(见图2)。
2.2生理生化特征:
菌株gz-7的生理生化反应结果见表1,菌株vp实验为阴性、不能发酵葡萄糖,能利用果糖、蔗糖、木糖、葡萄糖、阿拉伯糖,不能利用乳糖、纤维二糖。不能反硝化不产生赖氨酸脱羧酶、鸟氨酸脱羧酶,有运动能力,不产生硫化氢,不产生吲哚。
表1菌株gz-7的部分生理生化特征
注:+:阳性;-:阴性.
2.3菌株gz-7的分子生物学鉴定:
利用takara试剂盒提取菌株基因组进行pcr,引物选用原核微生物16srdna通用引物,上游引物:5′-agagtttgatcctggctcag-3′,下游引物:5′-ggttaccttgttacgctt-3′,反应体系50μl,taq酶,反应条件为94℃预变性2min,94℃变性30s,55℃退火30s,72℃延伸90s,72℃延伸10min,送至上海生工生物公司测序。扩增菌株gz-7的16srdna,将测的序列互补反向拼接后,获得1451bp。将该序列与ncbi数据库中的序列进行同源性比较,用mega5软件进行16srdna序列的比对分析,并构建系统发育树(见图3),发现gz-7与shewanella最接近。结合菌株的生理生化特征,将该菌株命名为shewanellasp.gz-7。
三、菌株gz-7的生长特性
本发明提供的菌株gz-7对其生长特性进行了细致的研究,了解了不同条件下该菌的生长情况。
3.1种子液的制备:将菌株gz-7斜面种子接种到lb培养基中,30℃,180r/min,装液量20%,培养18h。
3.2温度对菌株gz-7生长的影响:
将种子液以2%接种量于lb培养基,ph7.4,转速180r/min,装液量20%,分别在不同温度下培养8h,选择在600nm波长下测定od值,其生长温度范围为20-40℃,最适生长温度为30℃,见图4。
3.3ph对菌株gz-7生长的影响:
在lb培养基加入终浓度为10mmol/l的不同ph的缓冲液(mes、pipes、hepes),使培养基ph分别为4.0-10.0之间,30℃培养8h,其余条件同3.2,生长ph范围为5.0-9.0,最适生长ph为7.5,见图5。
3.4接种量对菌株gz-7生长的影响:
接种量范围0.5-3.5%,在最适温度和ph下培养,其余条件同3.2,最适生长的接种量为2.5%,见图6。
3.5转速对菌株生长的影响:
转速范围90-200r/min,在最适温度、ph和接种量下培养,其余条件同3.2,最适生长的转速为180r/min,见图7。
3.6装液量对菌株生长的影响:
装液量范围10-50%,在最适温度、ph、接种量和转速下培养,最适生长的装液量为20%,见图8。
实施例2,一种如实施例1所述的希瓦氏菌gz-7发酵产生右旋糖酐酶的方法,其步骤如下:将希瓦氏菌gz-7菌株斜面种子接种到lb培养基中,30℃,180r/min,装液量20%,培养18h,得种子液;将种子液以2.5%的接种量接种于产酶培养基(硫酸钠1%,可溶性淀粉0.5%,右旋糖酐t401%,ph7.5)中,180r/min,35℃培养48h,10000r/min离心15min,取上清液即为右旋糖酐酶粗酶。
四、菌株gz-7产右旋糖酐酶的方法
4.1发酵碳源对菌株gz-7产酶影响:
将接种培养18h的种子培养基以2.5%接种量接种至不同碳源发酵培养基中,于35℃,180rpm摇床中培养48h后分别测酶活,结果见图9。gz-7最佳产酶碳源为可溶性淀粉,其次是乳糖和绿豆淀粉。
4.2发酵氮源对菌株gz-7产酶影响:
将接种培养18h的种子培养基以2.5%接种量接种至不同氮源发酵培养基中,于35℃,180rpm摇床中培养48h后分别测酶活,结果见图10。gz-7最佳产酶氮源为硫酸钠,其次是胰蛋白胨。
4.3发酵温度对菌株gz-7产酶影响:
将接种培养18h的种子培养基以2.5%接种量接种至发酵培养基,于15-60℃培养48h后分别测酶液的活力,结果见图11。gz-7最佳产酶温度为35℃,低于30℃或高于40℃,产酶量均有大幅度下降。
4.4培养基初始ph对菌株gz-7产酶的影响:
以2.5%接种量接种至不同初始ph的发酵培养基,于35℃培养48h后分别测酶液的活力,结果表明,培养48h,该菌株产酶的最适初始ph为7.5,见图12。
4.5发酵时间对菌株gz-7产酶的影响:
将菌株gz-7发酵48h且每隔6h取样测酶活力,结果表明48h为产酶高峰,在48h之前菌株随着发酵时间延长产酶逐渐升高,而继续监控酶活力发现开始逐渐下降,结果如图13所示。
4.6装液量对菌株gz-7产酶的影响:
以2.5%接种量分别接种至装液量为15%-45%的发酵培养基,于35℃,180rpm摇床中培养48h后分别测酶液的活力。通过控制锥形瓶中培养基的体积来控制发酵液的溶氧,进而研究其对菌株产酶的影响,图14显示最适装液量为20%,当250ml锥形瓶中装入超过100ml培养基时,相对酶活力只有30%。
4.7不同右旋糖酐对产酶的影响:
将不同分子量右旋糖酐(t20,t40,t70和t500)以1%浓度加入发酵培养基中,接种培养后分别测酶液的活力。如表2所示,右旋糖酐t40为最佳产右旋糖酐酶诱导剂,使用右旋糖酐t20,右旋糖酐t70和右旋糖酐t500作为诱导剂时酶活力下降,不添加右旋糖酐则检测不到酶活力。
表2不同分子量右旋糖酐对产酶的影响
实施例3,一种如实施例2所述的方法所产右旋糖酐酶,该右旋糖酐酶具有以下特征:该右旋糖酐酶的最适作用温度为40℃,在20℃~55℃范围时有催化活力,在50℃下保温2h后酶活能保持50%以上;该酶在ph5.0~9.0的范围内稳定,最适作用ph为7.5。金属离子ca2+、ba2+、mg2+、cd2+、sr2+、na+、k+对该酶的酶活力均有不同程度的抑制作用,co2+、li+对酶有一定的激活作用。
五、菌株gz-7所产右旋糖酐酶的性质
5.1粗酶液的制备
将gz-7菌株斜面种子接种到lb培养基中,30℃,180r/min,装液量20%,培养18h,得种子液;将种子液以2.5%的接种量接种于产酶培养基(胰蛋白胨1%,酵母粉0.5%,nacl1%、右旋糖酐t401%,ph7.5)中,180r/min,35℃培养48h,10000r/min离心15min,取上清液,使用分子量为10000的超滤管对其超滤,超滤液即为粗酶液。
5.2酶作用温度对酶活性的影响:
将右旋糖酐酶置于不同温度下与底物发生反应,测定酶活力,结果见图15,酶的最适作用温度为40℃,在25℃-50℃温度范围时有较高的催化活力。
5.3酶的作用ph对酶活性的影响:
将酶液与在不同ph的右旋糖酐溶液中在40℃下进行酶活力测定,不同ph的缓冲液为:50mm乙酸钠缓冲液(ph4.0-6.0)、50mm磷酸钠缓冲液(ph6.0-7.5)和50mmtris-hcl缓冲液(ph7.5-9.0)。结果见图16,ph7.5该酶的活性最高。在ph5-9范围时有较高的催化活力。
5.4酶的热稳定性:
将酶液分别置于30℃、40℃、50℃的水浴锅中保温1-6小时,每隔1小时取出样品迅速冷却保藏,待温育结束后统一进行酶活力测定,以未处理酶液作对照,计算相对酶活。该菌株产的右旋糖酐酶在40℃保温6h后酶活力还能保持60%以上的酶活力,50℃保温2h后还能保持50%以上的酶活力,见图17。
5.5酶的ph稳定性:
将菌株gz-7右旋糖酐酶酶液与各种不同ph缓冲液混合,并在25℃的水浴锅中保温1h,取50μl温育的酶液在40℃和ph7.5底物中测定残余酶活,计算相对酶活力。该菌株产的右旋糖酐酶在ph6.0-8.0范围内有相对好的稳定性,见图18。
5.6金属离子对gz-7右旋糖酐酶酶活的影响
将菌株gz-7右旋糖酐酶酶液与不同的氯化金属离子混合,并使金属离子的终浓度分别为1mmol/l和2mmol/l,然后在30℃水浴锅中保温1h后取出测定酶活力,并以不含金属离子的酶液对照计算相对酶活力。结果见表2,从图中可知co2+、li+对酶有一定的激活作用。
表2金属离子对gz-7右旋糖酐酶酶活的影响
5.7右旋糖酐酶活力测定
将50μl酶液与150μl3%的右旋糖酐t40(50mmol/l,ph7.5磷酸钠缓冲液配制),40℃水浴15min后,dns法测定还原糖含量。
酶活力单位定义(u/ml):上述反应条件下,每分钟催化释放1μmol葡萄糖所需的酶量为一个活力单位。
实施例4,一种利用如实施例2所述的方法产右旋糖酐酶水解右旋糖酐的方法,具体步骤如下:将该酶与右旋糖酐在40℃反应1-5h,使用具有葡萄糖和麦芽低聚糖(麦芽三糖至麦芽五糖)的样品作为标准,点样后将硅胶板板浸入含有10ml正丁醇,6ml乙醇和4ml水的溶液中,然后在120℃加热,在tlc板上观察水解产物。所述的右旋糖酐酶水解右旋糖酐后,其产物为葡萄糖、麦芽糖、麦芽三糖、麦芽四糖、麦芽五糖,见图19.1:标准品(从上到下,葡萄糖,麦芽糖,麦芽三糖,麦芽四糖,麦芽五糖)2:右旋糖酐酶水解右旋糖酐1h。3:右旋糖酐酶水解右旋糖酐3h。4:右旋糖酐酶水解右旋糖酐5h。5:右旋糖酐t20。6:菌株gz-7右旋糖酐酶粗酶。
- 还没有人留言评论。精彩留言会获得点赞!