一种血清淀粉样蛋白A测定试剂盒及其制备方法与流程
本发明涉及医学免疫诊断领域,具体地,涉及一种血清淀粉样蛋白a测定试剂盒及其制备方法。
背景技术:
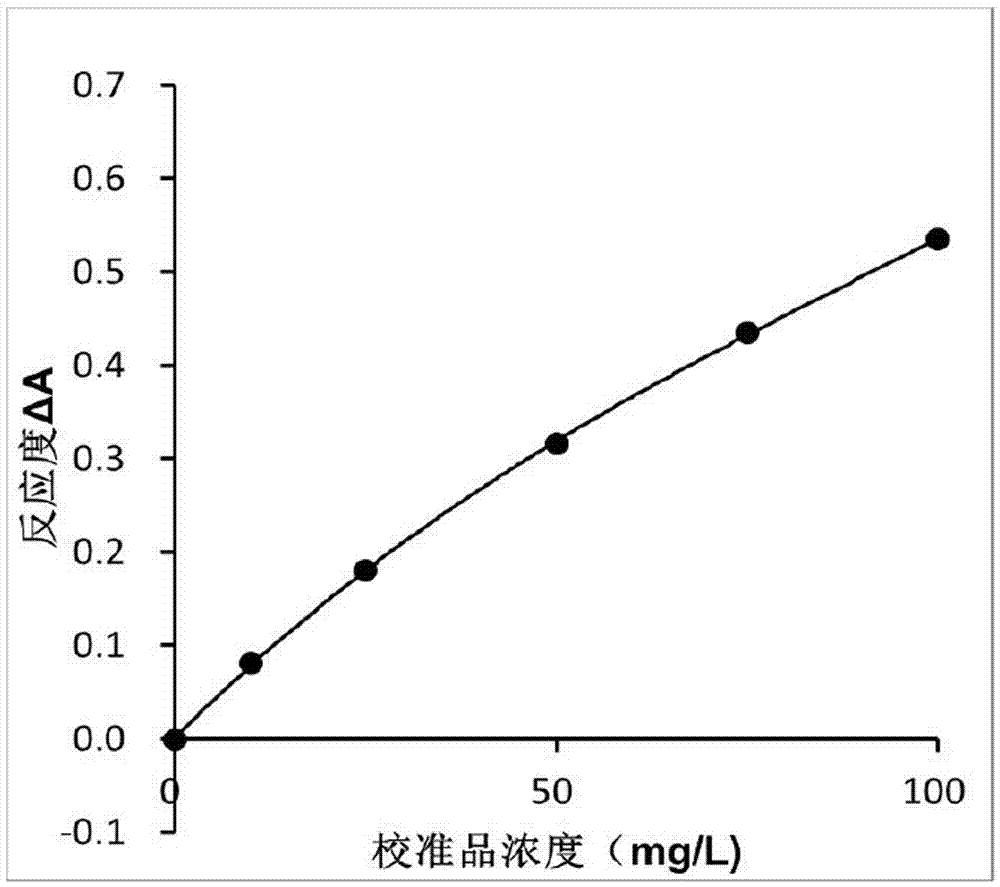
:1976年rosenthal等人从血清中分离出一种相对分子量约12000且与组织淀粉样蛋白a具有相似的免疫原性的高度异质性蛋白,研究表明该物质是组织淀粉样蛋白a的前体,因此该类蛋白称为血清淀粉样蛋白a(serumamyloida,简称saa)。saa的合成基因位于第11号染色11p15.1的短臂上,跨度为150kd。saa主要由肝细胞产生,同是肝外细胞也有体质性表达。在机体发生炎症反应或感染急性期时,在48~72小时内由巨噬细胞释放的白细胞介素(il)-1和肿瘤坏死因子(tnf)协同作用增加il-6的分泌,进一步刺激肝细胞大量表达saa,同时受到糖皮质激素的调控,当saa进入血浆后迅速与高密度脂蛋白(hdl)结合,代替apoa-i成为急性期hdl的主要载脂蛋白。与crp类似,saa是一种急性时相反应蛋白,用以评估急性相反应进程;当机体受到感染、炎症、外伤和肿瘤的刺激后,肝细胞大量分泌saa并释放入血液中,随着机体的炎性反应发展,在5~6小时内血清中的saa浓度迅速升高约1000倍,绝对高于同期的crp浓度;由于crp的正常水平的中位数值与参考范围上限的差距约有10倍,而在saa中仅有5倍,故在敏感性上saa要高于crp;同时saa的半衰期仅50min,当机体的炎性反应得到控制后,saa迅速恢复到正常水平,从而使saa成为目前最敏感的急性炎症新标志物之一。透射免疫比浊法,是基于分光光度法原理,测定在反应液中检测样本的抗原与特异性抗体免疫结合产生的浊度,依据朗伯比尔定律计算样本中检测物的含量。当一定波长的光沿着水平轴照射,遇到抗原抗体结合的免疫份子,光源的透射强度减弱,透射光的强度变化与抗原抗体的免疫分子含量成正比。但由于免疫比浊法的测定灵敏度达不到临床要求,故使用胶乳增强免疫比浊法。其原理是首先将抗体与胶乳微球交联,当遇到相应的抗原时,因抗原抗体结合遭遇出现胶乳凝集;因单个胶乳微球的大小在入射光波长内,可以使光线透过;当两个或两个以上的胶乳微球凝集在一块时,使透射光减弱且减弱的程度与胶乳微球凝集的程度成正比,亦与抗原含量成正比。在我国兽医临床应用上,对动物的炎性感染的诊断仅有crp的测定试剂盒,但由于crp在动物中浓度极低,当crp升高并被检测时,机体受到炎性反应或感染的时间较长,而saa作为新的炎症标志物之一,无论检测窗口期比crp要早,还是敏感性上在优于crp,因此检测saa可以快速诊断动物的感染程度,辅助并指导兽医用药。目前已知测定的血清淀粉样蛋白a的试剂盒极少,尚未得到推广及应用,同时由于其他方法上也存在操作繁琐、产品灵敏度低和产品不稳定等特点。技术实现要素:本发明的目的是为了提供一种操作简单、反应快速、灵敏度高、特异性好的用于血清淀粉样蛋白a测定试剂盒及其制备方法。本发明第一方面提供一种血清淀粉样蛋白a测定试剂盒,包括彼此独立的试剂r1和试剂r2双液体组分,其中,试剂r1组分包括缓冲液1;试剂r2组分包括缓冲液2和saa抗体纳米胶乳微球。在本发明的一个优选实施方式中,所述saa抗体包括多克隆抗体或单克隆抗体,优选地,所述胶乳微球的表面经过-cooh修饰,更优选地,所述胶乳微球的颗粒直径在80~300nm之间,更优选地,所述saa抗体胶乳微球浓度为0.5~2%w/v。在本发明的一个优选实施方式中,所述缓冲液1和缓冲液2为本领域常见的各种缓冲液,其中缓冲液1和缓冲液2可以相同,也可以不同;优选地,所述的缓冲液1和缓冲液2各自独立选用pbs缓冲液、tris-hcl缓冲液、mopso缓冲液、甘氨酸缓冲液、2-吗啉乙磺酸(mes)缓冲液、甘氨酸-磷酸盐缓冲液和hepes缓冲液以及其他具有相似性质的缓冲液中的一种或多种;更优选地,所述缓冲液1和缓冲液2的浓度分别为10~50mmol/l;更优选地,所述的缓冲液1和缓冲液2的ph值各自为6.0~8.0。在本发明的一个优选实施方式中,所述试剂r1组分还包括促凝剂和表面活性剂的至少一种。在本发明的一个优选实施方式中,所述促凝剂为不同聚合度的聚乙二醇(peg)或聚乙烯吡咯烷酮(pvp)中的一种或两种。在本发明的一个优选实施方式中,所述聚乙二醇为peg-4000、peg-6000、peg-8000、peg-10000、peg-20000的一种或多种。在本发明的一个优选实施方式中,所述聚乙烯吡咯烷酮为pvpk-17、pvpk-30、pvpk-60和pvpk-90的一种或多种。在本发明的一个优选实施方式中,所述促凝剂的浓度为0.2%~2.5%w/v。在本发明的一个优选实施方式中,所述表面活性剂为阳离子型表面活性性剂、阴离子型表面活性剂、两性离子型表面活性剂和非离子型表面活性剂中的一种或多种。在本发明的一个优选实施方式中,所述阳离子表面活性剂为胺盐阳离子表面活性剂、季铵盐阳离子表面活性剂和杂环型阳离子表面活性剂中的一种或多种,优选地,所述胺盐阳离子表面活性剂为脂肪胺盐、乙醇胺盐和聚乙烯多胺盐中的一种或多种;所述季铵盐阳离子表面活性剂的通式如式(i)所示:式中rl、r2、r3、r4是甲基、乙基、苄基或长链烷基,x-是cl-、br-、i-、hso4-,rcoo-及oh-或其他阴离子基团;所述杂环型阳离子表面活性剂为咪唑啉、吗啉胍类、三嗪类衍生物中的一种或多种。在本发明的一个优选实施方式中,所述阴离子表面活性剂为具有酰胺基或酯基的磺酸盐阴离子表面活性剂、羧酸盐类阴离子表面活性剂和磷酸盐类阴离子表面活性剂的一种或多种,优选地,所述阴离子表面活剂性选自下列化合物的碱金属盐、铵盐、胺盐、氨基醇盐或碱土金属盐:烷基硫酸盐、烷基醚硫酸盐、烷基酰胺基醚硫酸盐、烷基芳基聚醚硫酸盐、甘油—硫酸酯盐;烷基磺酸盐、烷基磷酸盐、烷基酰胺磺酸盐、烷基芳基磺酸盐、a-烯烃磺酸盐、链烷烃磺酸盐;烷基磺基琥珀酸盐、烷基醚磺基琥珀酸盐、烷基酰胺磺基琥珀酸盐;烷基磺基乙酸盐;酰基肌氨酸盐;和酰基谷氨酸盐,所有这些化合物的烷基和酰基含有8至22个碳原子,且所述的芳基表示苯基或苄基;聚葡糖苷羧酸的c6-c24烷基酯;烷基磺化琥珀酰胺酸酯,酰基羟乙磺酸盐和n-酰基牛磺酸酯,所有这些化合物的烷基或酰基含有12至20个碳原子。在本发明的一个优选实施方式中,所述两性离子表面活性剂为(c8-c24)烷基酰胺基(c3-c8)烷基甜菜碱、磺基三甲铵乙内酯、(c8-c24)烷基酰胺基(c6-c8)烷基磺基三甲铵乙内酯、(c8-c24)烷基两性一乙酸酯、(c8-c24)烷基两性二乙酸酯、(c8-c24)烷基两性一丙酸酯、(c8-c24)烷基两性二丙酸酯和磷甜菜碱(请确认或补充)中的一种或多种。在本发明的一个优选实施方式中,所述非离子型表面活性剂为的聚氧乙烯型非离子型表面活性剂和多元醇型非离子型表面活性剂中的一种或多种,优选地,所述聚氧乙烯型非离子型表面活性剂为烷基酚聚氧乙烯醚、高碳脂肪醇聚氧乙烯醚、脂肪酸聚氧乙烯酯、脂肪酸甲酯乙氧基化物、聚丙二醇的环氧乙烷加成物的一种或多种,所述多元醇型非离子型表面活性剂为失水山梨醇酯、蔗糖酯、烷基醇酰胺中的一种或多种。在本发明的一个优选实施方式中,所述表面活性剂为吐温-20、吐温-80、brij35、十二烷基硫酸钠、tritonx-100中的一种或几种。在本发明的一个优选实施方式中,所述表面活性剂的浓度为0.1~2%w/v在本发明的一个优选实施方式中,所述表面活性剂的亲水亲油平衡值大于8.0。在本发明的一个优选实施方式中,所述试剂r2组分还包括稳定剂。在本发明的一个优选实施方式中,所述稳定剂为蛋白质、糖或无机盐中的一种或多种。在本发明的一个优选实施方式中,所述蛋白质为小牛血清白蛋白(bsa)、新生小牛血清(nbs)、酪蛋白或明胶中的一种或多种;在本发明的一个优选实施方式中,所述糖为蔗糖、海藻糖或甘露糖中的一种或多种;在本发明的一个优选实施方式中,所述无机盐为氯化钠、氯化钾、碳酸钠中的一种或多种。在本发明的一个优选实施方式中,所述稳定剂的浓度为0.2~2%w/v在本发明的一个优选实施方式中,所述试剂r2组分和/或试剂r2组分还包括防腐剂。在本发明的一个优选实施方式中,所述防腐剂可以相同,也可以不同;优选地,所述防腐剂为山梨酸钠、苯酚、苯甲酸钠、叠氮钠、proclin-300、硫柳汞中的一种或多种。在本发明的一个优选实施方式中,所述防腐剂的浓度为0.01~0.1%w/v。在本发明的一个优选实施方式中,所述试剂r1组分包括:所述试剂r2组分包括:在本发明的一个优选实施方式中,所述试剂rl与所述试剂r2的体积比为1:1、2:1、3:1、4:1或5:1。在本发明的一个优选实施方式中,所述的血清淀粉样蛋白a测定试剂盒进一步包括校准品。在本发明的一个优选实施方式中,所述校准品中含有血清淀粉样蛋白a抗原和稀释液,优选地,所述稀释液中含有10mmol/l磷酸盐缓冲液、0.01~0.1%w/v的叠氮钠和0.5~3%w/v的bsa。在本发明的一个优选实施方式中,所述校准品包括若干支不同浓度的血清淀粉样蛋白a抗原。在本发明的一个优选实施方式中,所述校准品的浓度水平数量为5~11个。在本发明的一个优选实施方式中,所述校准品的系列浓度覆盖0~100mg/l范围并呈梯度。在本发明的一个优选实施方式中,所述不同浓度的血清淀粉样蛋白a校准品中血清淀粉样蛋白a抗原的浓度依次为0mg/l、6.3mg/l、12.6mg/l、25.2mg/l、50.3mg/l、100.6mg/l,或者依次为0mg/l、10mg/l、25mg/l、50mg/l、75mg/l、100mg/l。在本发明的一个优选实施方式中,所述校准品与试剂rl和试剂r2的总体积的体积比在1:5到1:100之间,优选地,所述待测样品与试剂rl和试剂r2的总体积的体积比为1:5、1:20、1:30、1:35、1:50、1:80、1:100中的一种,优选地,所述待测样品与试剂rl和试剂r2的总体积的体积比为1:48。在本发明的一个优选实施方式中,所述血清淀粉样蛋白a测定试剂盒用于测定动物样品中的血清淀粉样蛋白a的浓度。在本发明的一个优选实施方式中,所述样品为血清、血浆或全血.在本发明的一个优选实施方式中,所述动物为猫科动物。本发明第二方面提供一种血清淀粉样蛋白a的测定试剂盒的制备方法,包括如下步骤:(a)制备r1试剂各组分,制得r1试剂;(b)制备saa抗体胶乳微球及r2试剂其他各组分,制得r2试剂。其中,所述saa抗体胶乳微球通过以下的步骤制备得到:(a)将经过功能基团修饰的胶乳微球加入活化缓冲液中;(b)加入活化交联剂进行活化;(c)加入saa抗体进行交联;(d)加入胶乳封闭液封闭残留活化位点。在本发明的一个优选实施方式中,所述saa抗体包括多克隆抗体或单克隆抗体,优选地,所述胶乳微球的表面经过-cooh修饰,更优选地,所述胶乳微球的颗粒直径在80~300nm之间。在本发明的一个优选实施方式中,所述活化缓冲液为1~10mmol/l、ph=4~6的2-吗啉乙磺酸缓冲液;在本发明的一个优选实施方式中,所述活化交联剂中含有0.01~0.1%w/v的1-乙基-(3-二甲基氨基丙基)碳二亚胺盐酸盐和0.01~0.1%w/vn羟基琥珀酰胺;在本发明的一个优选实施方式中,所述的胶乳封闭液中包括但不限于:0.2~2%w/v的稳定剂2、10~50mmol/l的缓冲液3、0.01~0.1%w/v的防腐剂,优选地,所述的缓冲液3选自pbs缓冲液、甘氨酸缓冲液、2-吗啉乙磺酸(mes)缓冲液甘氨酸-磷酸盐缓冲液、tris-盐酸盐缓冲液和hepes缓冲液以及其他具有相似性质的缓冲液中的一种或多种,更优选地,所述的缓冲液3的ph值为6.0~8.0。在本发明的一个优选实施方式中,按照上述步骤制备所述saa单克隆抗体纳米胶乳微球标记液时,所述活化时间为1~2小时;所述的交联反应时间为2~4小时;优选地,所述活化和交联的步骤均在37℃下进行。在本发明的一个优选实施方式中,在加入活化交联剂进行活化完成后,在加入血清淀粉样蛋白a单克隆抗体进行交联的步骤前,还需要先通过离心分离的步骤去掉胶乳微球液中残留的活化交联剂。在本发明的一个优选实施方式中,进一步包括校准品的制备方法。在本发明的一个优选实施方式中,本领域技术人员可以自行配制校准品,其中校准品的配制方法没有特殊要求,对于校准品的具体数量和浓度设置可采用本领域常规设计。在本发明的一个优选实施方式中,所述校准品包括若干支不同浓度的血清淀粉样蛋白a校准品;所述血清淀粉样蛋白a校准品中含有血清淀粉样蛋白a抗原和稀释液;所述稀释液中含有10mmol/l磷酸盐缓冲液、0.01~0.1%w/v的叠氮钠和0.5~3%w/v的bsa。在本发明的一个优选实施方式中,所述校准品可包括6支不同浓度的血清淀粉样蛋白a校准品,优选地,6支不同浓度的血清淀粉样蛋白a校准品中血清淀粉样蛋白a抗原浓度可以自行设定。优选地,所述6支不同浓度的血清淀粉样蛋白a校准品中血清淀粉样蛋白a抗原浓度的浓度依次为0mg/l、6.3mg/l、12.6mg/l、25.2mg/l、50.3mg/l、100.6mg/l。优选地,所述6支不同浓度的血清淀粉样蛋白a校准品中血清淀粉样蛋白a抗原浓度的浓度依次为0mg/l、10mg/l、25mg/l、50mg/l、75mg/l、100mg/l。附图说明图1显示了利用实施1的血清淀粉样蛋白a测定试剂盒测定saa校准品得到的浓度-反应度校准曲线。图2显示了利用实施2的血清淀粉样蛋白a测定试剂盒测定saa校准品得到的浓度-反应度校准曲线。具体实施方式经过深入广泛的研究,发明人意外的发现了一种血清淀粉样蛋白a测定试剂盒,能够方便、快速、精确测定血清淀粉样蛋白a的浓度。此外,本发明还意外的发现了该试剂盒的制备方法。在此基础上,本发明人完成了本发明。血清淀粉样蛋白a测定试剂盒在本发明中,血清淀粉样蛋白a测定试剂盒包括彼此独立的试剂r1和试剂r2双液体组分,其中,所述试剂r1组分包括:所述试剂r2组分包括:血清淀粉样蛋白a测定试剂盒的制备方法在本发明中,血清淀粉样蛋白a的测定试剂盒的制备方法包括如下步骤:(a)制备r1试剂各组分,制得r1试剂;(b)制备saa抗体胶乳微球及r2试剂其他各组分,制得r2试剂。其中,所述saa抗体胶乳微球通过以下的步骤制备得到:(a)将经过功能基团修饰的胶乳微球加入活化缓冲液中;(b)加入活化交联剂进行活化;(c)加入saa抗体进行交联;(d)加入胶乳封闭液封闭残留活化位点。血清淀粉样蛋白a的测定方法在本发明中,血清淀粉样蛋白a的测定方法包括以下步骤:(a)使用本发明提供的血清淀粉样蛋白a测定试剂盒测定校准品:先将r1试剂加入比色杯中,再加入校准品后放置于测定仪中搅拌均匀,然后加入r2试剂,搅拌均匀后测定吸光度a1,继续反应后再次测定吸光度a2,计算反应度δa:δa=a2-a1;根据校准品各个浓度水平的δa绘制浓度-反应度的校准曲线,并拟合得到回归方程;(b)使用本发明提供的血清淀粉样蛋白a测定试剂盒测定待测样品,利用步骤(a)的方法测量得到相应的反应度,根据步骤a得到的校准品的浓度-反应度数据,计算待测样品中的血清淀粉样蛋白a的浓度。在本发明中,本领域技术人员可以自行配制校准品,其中校准品的配制方法没有特殊要求,对于校准品的具体数量和浓度设置可采用本领域常规设计。在本发明中,所述校准品包括若干支不同浓度的血清淀粉样蛋白a抗原;所述血清淀粉样蛋白a校准品中含有血清淀粉样蛋白a抗原和稀释液;所述稀释液中含有10mmol/l磷酸盐缓冲液、0.01~0.1%w/v的叠氮钠和0.5~3%w/v的bsa。在本发明中,所述校准品可包括6支不同浓度的血清淀粉样蛋白a校准品,优选地,6支不同浓度的血清淀粉样蛋白a校准品中血清淀粉样蛋白a抗原浓度可以自行设定。优选地,所述6支不同浓度的血清淀粉样蛋白a校准品中血清淀粉样蛋白a抗原浓度的浓度依次为0mg/l、6.3mg/l、12.6mg/l、25.2mg/l、50.3mg/l、100.6mg/l。优选地,所述6支不同浓度的血清淀粉样蛋白a校准品中血清淀粉样蛋白a抗原浓度的浓度依次为0mg/l、10mg/l、25mg/l、50mg/l、75mg/l、100mg/l。在本发明中,步骤a中测量分析得到校准曲线中的反应度是采用透射比浊法或散射比浊法蛋白分析仪测量得到。在本发明中,所述计算待测样品中的血清淀粉样蛋白a的浓度浓度-反应度,是指利用回归分析方法或插值分析方法计算,优选地,所述浓度-反应度校准曲线是利用线性回归方法计算。在本发明中,所述试剂rl与与所述试剂r2的体积比为1:1、2:1、3:1、4:1或5:1。在本发明中,所述待测样品与试剂rl和试剂r2的总体积的体积比在1:5到1:100之间,优选地,所述待测样品与试剂rl和试剂r2的总体积的体积比为1:5、1:20、1:30、1:35、1:50、1:80、1:100中的一种,优选地,所述待测样品与试剂rl和试剂r2的总体积的体积比为1:48。在本发明中,所述继续反应时间为1min、2min、3min、4min或5min。在本发明中,所述待测品为动物的血清、血浆或全血,优选地,所述动物为猫科动物。本发明的主要优点包括:本发明具有以下优点和有益效果:(1)本发明的血清淀粉样蛋白a测定试剂盒填补了目前市面上用于胶乳增强免疫比浊法测定猫科动物血清淀粉样蛋白a的测定试剂的空白,弥补现在国内兽医临床测定的不足。(2)本发明的血清淀粉样蛋白a测定试剂盒采用结合均相免疫的透射比浊法或散射比浊法进行测定,具有操作简单、反应快速、灵敏度高、特异性好的优点。(3)本发明的血清淀粉样蛋白a测定试剂盒中r2试剂组分saa单克隆抗体纳米胶乳微球标记液的制备中,所述纳米胶乳微球通过表面的-cooh与血清淀粉样蛋白a单克隆抗体的-nh3共价结合。在此情况下,-cooh纳米胶乳微球与抗体的结合是通过其表面的-cooh与抗体的-nh3共价结合,在微球与抗体之间有1个桥联化学臂,降低了位阻效应,不但提高了抗体的结合率,还为抗体提供合适的三维空间立方体结构,有效地保护抗体与抗原结合的活性区域,提高反应的灵敏度。为了使本发明所解决的技术问题、技术方案及有益效果更加清楚明白,结合实施例,对本发明进行进一步详细说明。应当理解,此处所描述的具体实施例仅用以解释本发明,并不用于限定本发明。下列实施例中未注明具体条件的实验方法,通常按照常规条件如sambrook等人,分子克隆:实验室手册(newyork:coldspringharborlaboratorypress,1989)中所述的条件,或按照制造厂商所建议的条件。实施例中未注明的试剂的配制方法,通常按照本领域常规配制方法。除非另外说明,否则百分比和份数按重量计算。本发明中所涉及的实验材料和试剂如无特殊说明均可从市售渠道获得。实施例1本发明的血清淀粉样蛋白a测定试剂盒包括彼此独立的试剂r1和试剂r2双液体组分,其中:试剂r1组分包括:试剂r2组分包括:实施例2本发明的血清淀粉样蛋白a测定试剂盒包括彼此独立的试剂r1和试剂r2双液体组分,其中:试剂r1组分包括:试剂r2组分包括:实施例3本发明的血清淀粉样蛋白a测定试剂盒包括彼此独立的试剂r1和试剂r2双液体组分,其中:试剂r1组分包括:试剂r2组分包括:实施例4本发明的血清淀粉样蛋白a测定试剂盒包括彼此独立的试剂r1和试剂r2双液体组分,其中:试剂r1组分包括:试剂r2组分包括:实施例5一、实施例1提供的试剂盒的制备方法1、取2ml聚苯乙烯胶乳微球(颗粒直径150nm,5%w/v)用10mmol/l的ph=4.5的2-吗啉乙磺酸缓冲液稀释至10ml。2、再加入0.1%w/v的1-乙基-(3-二甲基氨基丙基)碳二亚胺盐酸盐和0.1%w/vn羟基琥珀酰胺进行活化胶乳,37℃孵育1小时。3、离心活化后的胶乳,并弃去上清(含残留活化交联剂),加入10ml含有10mmol/l、ph=7.0磷酸盐缓冲液、0.05%w/v叠氮钠和2%w/vbsa的溶液溶解,再加入1mg血清淀粉样蛋白a单克隆抗体进行交联反应,37℃孵育3小时。4、最后加入1ml含有1%w/v蛋白质bsa、1%casein、0.05%w/v叠氮钠和10mmol/l、ph=7.0磷酸盐缓冲液的胶乳封闭液,封闭胶乳表面残留活化位点,离心并弃去上清,将沉淀溶于20ml含有10mmol/l、ph=7.0磷酸盐缓冲液、0.05%w/v叠氮钠和2%w/vbsa的溶液,使胶乳的终浓度为0.5%w/v,得到r2试剂。5、制备10mmol/l、ph=7.0磷酸盐缓冲液1000ml,加入1%w/v的peg-20000、1%w/vtritonx-100、0.05%w/v叠氮钠,混匀制得r1试剂。二、试剂盒在蛋白分析仪上的应用1、将血清淀粉样蛋白a抗原溶于含10mmol/l、ph=7.0磷酸盐缓冲液、0.05%w/v叠氮钠和2%w/vbsa中,按不同稀释倍数配制得到不同浓度的校准品,分别为0mg/l、6.3mg/l、12.6mg/l、25.2mg/l、50.3mg/l、100.6mg/l。2、待测样品来源于小猫1和小猫2,抽取小猫的血液,离心分离血清备用检测。3、首先将r1试剂按标准的量加入比色杯中,再加入上述标准的量的saa校准品搅拌均匀,再加入标准量的r2试剂进行搅拌后立即读取第一点吸光度a1,继续放置至反应时间结束后再次读取第二点的吸光度a2,计算测量的反应度;反应度的计算由采用透射比浊法原理的特定蛋白分析仪进行测量得到,每个浓度检测5次。测定步骤:先将400μlr1试剂加入比色杯中,再加入10μl校准品后放置于测定仪中搅拌均匀,然后加入80μlr2试剂,搅拌均匀后测定吸光度a1,继续反应2min后再次测定吸光度a2,计算反应度δa:δa=a2-a1。检测5次的结果分别如下所示。校准品浓度0mg/l6.3mg/l12.6mg/l25.2mg/l50.3mg/l100.6mg/lδa1-0.00230.04140.0860.18380.33160.5291δa2-0.00080.04180.08760.18250.30940.5485δa3-0.00040.04240.08990.1760.31830.5207δa4-0.0010.04120.09020.18480.32170.5318δa5-0.00140.04230.09370.17720.30680.5415平均值δa-0.001180.041820.089480.180860.317560.534324、将上表1中各校准品的浓度作横坐标,相应的δa平均值作纵坐标,以logit-4p四参数拟合,绘制浓度-反应度校准曲线,如图1所示。5、同上述测定步骤测量待测品1得到反应度δa=0.4086,然后根据上述浓度-反应度校准曲线的回归方程计算,待测品1的saa浓度为68.72mg/l。6、同上述测定步骤测量待测品2得到反应度δa=0.0169,然后根据上述浓度-反应度校准曲线的回归方程计算,待测品2的saa浓度为2.62mg/l。实施例6一、实施例2提供的试剂盒的制备方法1、取5ml聚苯乙烯胶乳微球(millipore,颗粒直径300nm,3%w/v)用10mmol/l的ph=5.5的2-吗啉乙磺酸缓冲液稀释至20ml。2、再加入0.05%w/v的1-乙基-(3-二甲基氨基丙基)碳二亚胺盐酸盐和0.05%w/vn羟基琥珀酰胺进行活化胶乳,37℃孵育2小时。3、离心活化后的胶乳,并弃去上清(含残留活化交联剂),加入10ml含有10mmol/l、ph=7.0磷酸盐缓冲液、0.05%w/v叠氮钠和2%w/v的bsa溶解,再加入1.5mg血清淀粉样蛋白a单克隆抗体进行交联反应,37℃孵育4小时。4、最后加入1ml含有1%w/v海藻糖、0.05%w/vproclin-300和20mmol/l、ph=7.5甘氨酸-磷酸盐缓冲液的胶乳封闭液,封闭胶乳表面残留活化位点,离心并弃去上清,将沉淀溶于20ml含有10mmol/l、ph=7.0磷酸盐缓冲液、0.05%w/v叠氮钠和2%w/v的bsa,使胶乳的终浓度为0.7%,得到r2试剂。5、制备10mmol/l、ph=8.0tris-盐酸盐缓冲液5000ml,加入1%w/v的pvp-k30、0.5%w/v十二烷基硫酸钠、0.5%w/v吐温-20、0.05%w/v叠氮钠,混匀制得r1试剂。二、试剂盒在蛋白分析仪上的应用1、将血清淀粉样蛋白a抗原溶于含10mmol/l、ph=7.0磷酸盐缓冲液、0.05%w/v叠氮钠和2%w/vnbs中,按不同稀释倍数配制得到不同浓度的校准品,分别为0mg/l、10mg/l、25mg/l、50mg/l、75mg/l、100mg/l。2、待测样品来源于小猫1和小猫2抽取小猫的血液,离心分离血清备用检测。3、首先将r1试剂按标准的量加入比色杯中,再加入上述标准的量的saa校准品搅拌均匀,再加入标准量的r2试剂进行搅拌后立即读取第一点吸光度a1,继续放置至反应时间结束后再次读取第二点的吸光度a2,计算测量的反应度;反应度的计算由采用透射比浊法原理的特定蛋白分析仪进行测量得到,每个浓度检测5次。测定步骤:先将400μlr1试剂加入比色杯中,再加入10μl校准品后放置于测定仪中搅拌均匀,然后加入80μlr2试剂,搅拌均匀后测定吸光度a1,继续反应2min后再次测定吸光度a2,计算反应度δa:δa=a2-a1。检测5次的结果分别如下所示。校准品浓度0mg/l10mg/l25mg/l50mg/l75mg/l100mg/lδa1-0.00170.07970.17960.31300.42470.5307δa2-0.00090.08030.18050.30730.44080.5418δa3-0.00010.08100.17890.31590.43710.5379δa4-0.00150.07990.18130.31960.43800.5295δa5-0.00070.08370.18200.32400.43290.5361平均值δa-0.00100.08090.18050.31600.43470.53524、将上表2中各校准品的浓度作横坐标,相应的δa平均值作纵坐标,以logit-4p四参数拟合,绘制浓度-反应度校准曲线,如图2所示。5、同上述测定步骤测量待测品1得到反应度δa=0.3925然后根据上述浓度-反应度校准曲线的回归方程计算,待测品1的saa浓度为65.73mg/l。6、同上述测定步骤测量待测品2得到反应度δa=0.0237,然后根据上述浓度-反应度校准曲线的回归方程计算,待测品2的saa浓度为2.57mg/l。在本发明提及的所有文献都在本申请中引用作为参考,就如同每一篇文献被单独引用作为参考那样。此外应理解,在阅读了本发明的上述讲授内容之后,本领域技术人员可以对本发明作各种改动或修改,这些等价形式同样落于本申请所附权利要求书所限定的范围。当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1