一种牛奶中双酚A残留的表面增强拉曼检测方法与流程
本发明涉及牛奶中双酚a残留的检测方法。
背景技术:
双酚a(bpa)是一种重要的有机化工原料,广泛用于环氧树脂、聚碳酸酯等塑料制品的生产。在塑料制品中,添加双酚a可以使其具有无色透明、耐用、抗氧化、轻巧和抗冲击等特性,因此被广泛用于制造塑料(奶)瓶、食品和饮料(尤其是奶制品)包装的内侧涂层。食品包装材料中bpa的使用,不可避免地会导致食品中bpa的残留。动物实验表明,双酚a是一种主要的内分泌干扰物之一,它能够模仿雌激素样的作用,扰乱正常雌激素的内分泌功能,引起性早熟和代谢紊乱,诱发乳房肿瘤,降低免疫功能,损害生殖系统,甚至导致癌症和人的死亡。而且,摄入痕量的bpa就会对人体造成严重的伤害。为了确保食品安全,开展食品(特别是牛奶)中痕量双酚a残留的检测研究是十分必要的。从传统意义上讲,牛奶中双酚a残留的分析方法主要有电化学法、质谱分析法、气相色谱法、液相色谱法及酶联吸附免疫测定法等。但是这些方法却存在一些局限性。
在2007年第1-2期的《色谱b》(journalofchromatographyb)的文章《一种基于基质固相分散萃取和液相色谱串联质谱技术分析鸡蛋和牛奶中的烷基酚和双酚a》(analysisofalkylphenolandbisphenolaineggsandmilkbymatrixsolidphasedispersionextractionandliquidchromatographywithtandemmassspectrometry)公开了一种检测鸡蛋和牛奶中的烷基酚和双酚a的方法。该方法利用的是液相色谱串联质谱技术同时检测鸡蛋和牛奶中的烷基酚(壬基苯酚和辛基酚)及双酚a。他们采用c18作为分散剂的固相分散萃取(spe)对鸡蛋和牛奶样品进行提取处理,从而实现使用液相色谱串联质谱法作为分析技术对鸡蛋和牛奶中的烷基酚和双酚a进行同步检测。通过这一技术,鸡蛋中壬基苯酚和辛基酚以及双酚a的检出限分别可以达到0.25、0.10和0.10μg/kg-1;牛奶中壬基苯酚和辛基酚以及双酚a的检出限分别可以达到0.05、0.10和0.10μg/kg-1。这种检测方法的缺点在于不仅生物样品提取过程复杂且不易保存,而且样品前处理成本高且检测时间过长。
2011年第3期的《食品化学》(foodchemistry)报道了一种基于玻璃碳电极修饰的fe3o4磁性纳米粒子测定牛奶中的双酚a的电流测定方法(amperometricdeterminationofbisphenolainmilkusingpamam-fe3o4modifiedglassycarbonelectrode),其中双酚a残留的提取操作是通过玻璃碳电极修饰的fe3o4磁性纳米粒子对牛奶样品中的双酚a进行纯化和提取实现的。双酚a的检出限可以低至5×10-9mol/l。这种检测方法的缺点在于实验操作过程复杂,样品前处理过程耗时且检测成本高,大大限制了它在实际分析领域中的应用。
2015年第10期的《食品分析方法》(foodanal.methods)文章《利用超灵敏荧光免疫方法以功能化的金纳米粒子作为探针检测奶制品中的双酚a的方法》(ultrasensitivefluorescenceimmunoassayfordetectionofbisphenolainmilkproductsusingfunctionalizedgoldnanoparticlesasprobe)报道了一种基于功能化的金纳米粒子作为探针进行定性和定量检测牛奶中痕量双酚a的荧光免疫分析法。他们利用金纳米粒子作为探针,使用巯基修饰的单链dna(sh-ssdnas)作为牛奶中双酚a特异性识别的抗体。该文献所提出的荧光免疫分析方法可以直接用于牛奶中双酚a的检测而不受牛奶中其他物质的干扰。通过这种方法,其检出限可以达到3.4×10-13ng/l,这要比欧盟(eu)规定的最大残留量0.6mg/kg少。这种检测方法利用巯基修饰的单链dna(sh-ssdnas)作为牛奶中双酚a特异性识别的抗体和金纳米粒子探针构建载体,实验成本大大增加。
到目前为止,基于表面增强拉曼散射(sers)技术对牛奶中双酚a残留进行检测的研究尚未见报道。
技术实现要素:
本发明是要解决现有的检测牛奶中双酚a残留的方法前处理复杂、成本高的技术问题,而提供一种牛奶中双酚a残留的表面增强拉曼检测方法。
本发明的牛奶中双酚a残留的表面增强拉曼检测方法,按以下步骤进行:
一、制备金纳米粒子(aunps)溶胶,然后利用卤化物水溶液修饰aunps,得到卤化物修饰的具有sers活性的aunps改性基底;
二、向待测牛奶样品中添加体积比为3:1的甲醇/水混合溶剂,超声处理1~3min,再离心分离处理8~15min,移出上清液在室温下自然蒸发至干得到残余物;再向残余物中加入体积比为3:1的甲醇/水混合溶剂并超声处理1~3min,再离心分离处理5~8min,移出上清液,依次用0.45μm和0.22μm的水系膜对上清液进行过滤,得到待测牛奶样品上清液;
三、将卤化物修饰的具有sers活性的aunps改性基底与待测牛奶样品上清液混合,然后再向混合物中添加硫酸盐水溶液作为聚集剂,之后再将其加载到玻璃点样毛细管中,得到待测牛奶样品检测管;
四、用拉曼光谱仪测试步骤三得到的待测牛奶样品检测管的表面增强拉曼光谱,将该光谱与双酚a标准品的拉曼图谱比对,如果待测牛奶样品的表面增强拉曼光谱中出现双酚a标准品的特征信号峰,则说明待测牛奶样品存在双酚a。
利用标准曲线法可实现对待测牛奶样品中双酚a残留的定量检测。
本发明将待测牛奶样品通过水辅助溶剂两步分离技术进行前处理,然后用卤化物水溶液修饰的aunps改性基底与牛奶样品上清液进行混合,得到混合物,再向混合物中加入硫酸盐水溶液作为聚集剂,如果待测牛奶样品中有残留的双酚a分子存在,双酚a分子则吸附在具有sers活性的aunps改性基底上,产生可识别的拉曼光谱信号,通过与双酚a标准品的本体拉曼光谱比对,若牛奶样品中出现双酚a的特征sers信号峰,即认定牛奶样品中有双酚a的存在,从而实现牛奶样品中双酚a残留的定性鉴别和定量检测;采用本方法不仅可以检测牛奶中残留的双酚a分子,通过与标准品的光谱比对,也可以实现对双酚衍生物(如双酚b、双酚f等)进行定性鉴别。
本发明首次将sers技术应用于牛奶中双酚a分子残留的检测,采用卤化物水溶液和硫酸盐水溶液修饰和改性aunpssers活性基底;其中,硫酸盐水溶液作为聚集剂,大大提高了sers检测的灵敏度,并获得了极低的检出限,其检出限可以达到4.3×10-9mol/l,远低于欧盟规定的最大残留限量(0.6mg/kg)。检测无需标记,操作简单;检测快速,需要样品量少而且易得,试剂水不产生干扰,是一种无损检测方法,这种成本低廉、环境友好、方便快速的sers检测方法易于商业化应用,填补sers技术在牛奶中双酚a分子检测方面的空白,为牛奶中双酚a分子及其衍生物的分析检测提供新的思路。
附图说明
图1是试验1中双酚a浓度为1×10-3mol/l的加标牛奶样品在1×10-3mol/l氟化钾水溶液和1×10-2mol/l硫酸锌水溶液修饰的aunps改性基底上的sers光谱及双酚a浓度为1×10-3mol/l的甲醇水溶液和双酚a固体粉末本体的拉曼光谱图;
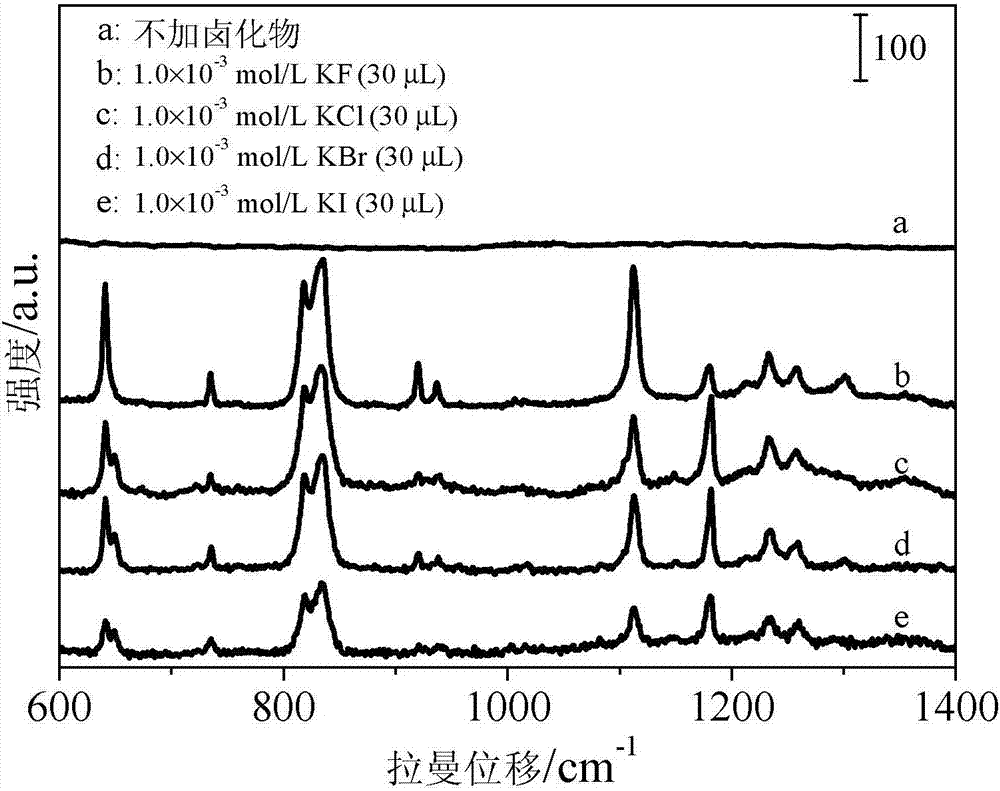
图2是试验2中双酚a浓度为1×10-3mol/l的加标牛奶样品在不同卤化物水溶液修饰的aunps改性基底上的sers光谱;
图3是试验3中双酚a浓度为1×10-3mol/l的加标牛奶样品在1×10-3mol/l氟化钾水溶液和不同硫酸盐水溶液修饰的aunps改性基底上的sers光谱;
图4是试验4中不同浓度双酚a加标牛奶样品的sers光谱;
图5是试验4中加标牛奶样品的双酚a浓度与641cm-1处峰强度标准曲线。
具体实施方式
具体实施方式一:本实施方式的牛奶中双酚a残留的表面增强拉曼检测方法,按以下步骤进行:
一、制备金纳米粒子(aunps)溶胶,然后利用卤化物水溶液修饰aunps,得到卤化物修饰的具有sers活性的aunps改性基底;
二、向待测牛奶样品中添加体积比为3:1的甲醇/水混合溶剂,超声处理1~3min,再离心分离处理8~15min,移出上清液在室温下自然蒸发至干得到残余物;再向残余物中加入体积比为3:1的甲醇/水混合溶剂并超声处理1~3min,再离心分离处理5~8min,移出上清液,依次用0.45μm和0.22μm的水系膜对上清液进行过滤,得到待测牛奶样品上清液;
三、将卤化物修饰的具有sers活性的aunps改性基底与待测牛奶样品上清液混合,然后再向混合物中添加硫酸盐水溶液作为聚集剂,之后再将其加载到玻璃点样毛细管中,得到待测牛奶样品检测管;
四、用拉曼光谱仪测试步骤三得到的待测牛奶样品检测管的表面增强拉曼光谱,将该光谱与双酚a标准品的拉曼图谱比对,如果待测牛奶样品的表面增强拉曼光谱中出现双酚a标准品的特征信号峰,则说明待测牛奶样品存在双酚a。
具体实施方式二:本实施方式与具体实施方式一不同的是:步骤一中,制备金纳米粒子(aunps)溶胶,然后利用卤化物水溶液修饰aunps,制备卤化物修饰的具有sers活性的aunps改性基底的具体步骤如下:
a、将1ml1%的haucl4加入到装有99ml去离子水的三口烧瓶中,在磁力搅拌下加热使其溶解;当溶液加热至94℃的沸腾状态时加入4ml质量百分浓度为1%的柠檬酸钠水溶液,三口烧瓶中溶液由无色透明逐渐转变成淡紫色、紫色,最终生成酒红色的透明溶胶;透明溶胶在96℃的微沸状态下保持15min,然后停止加热,自然冷却至室温,得到金溶胶;
b、将aunps溶胶离心,得到aunps浓缩物;将卤化物水溶液与aunps浓缩物进行充分混合,静止,得到卤化物修饰的aunps改性基底。其它与具体实施方式一相同。
具体实施方式三:本实施方式与具体实施方式二不同的是:步骤b中,离心时间为5~10min,离心速度为5000~10000转/秒;aunps浓缩物与卤化物水溶液混合的体积比为1:1。其它与具体实施方式二相同。
具体实施方式四:本实施方式与具体实施方式二或三不同的是:步骤b中卤化物为氟化钾、氯化钾、溴化钾或者碘化钾;其它与具体实施方式二或三相同。
具体实施方式五:本实施方式与具体实施方式二至四之一不同的是:步骤b中,卤化物水溶液的浓度为1×10-2~1×10-4mol/l;其它与具体实施方式二至四之一相同。
具体实施方式六:本实施方式与具体实施方式二至五之一不同的是:步骤b中,卤化物水溶液与aunps浓缩物混合后的静止时间为5~10min。其它与具体实施方式二至五之一相同。
具体实施方式七:本实施方式与具体实施方式一至六之一不同的是:步骤三中,卤化物修饰的具有sers活性的aunps改性基底与待测牛奶样品上清液的体积比为1:1。其它与具体实施方式一至六之一相同。
具体实施方式八:本实施方式与具体实施方式一至七之一不同的是:步骤三中,硫酸盐水溶液为硫酸钠、硫酸锌或硫酸铝。其它与具体实施方式一至七之一相同。
具体实施方式九:本实施方式与具体实施方式一至八之一不同的是:步骤三中,硫酸盐水溶液的浓度为1×10-2~1×10-4mol/l。其它与具体实施方式一至八之一相同。
具体实施方式十:本实施方式与具体实施方式一至九之一不同的是:步骤三中,硫酸盐水溶液的添加体积为10μl。其它与具体实施方式二至九之一相同。
用以下的试验验证本发明的有益效果:
试验1:牛奶中双酚a残留的表面增强拉曼检测方法,按以下步骤进行:
一、将0.2283g双酚a(bpa)分子直接添加到无双酚a分子的牛奶中并定容至10ml,获得浓度为1×10-1mol/l的bpa加标牛奶母液,然后以无双酚a分子的空白液态牛奶作为溶剂将加标牛奶母液稀释成1×10-3mol/l,得到双酚a浓度为1×10-3mol/l的加标牛奶样品,将制备好的加标牛奶样品在4摄氏度的冷藏条件下储存7天;该操作的目的是使待测样品更接近于含有双酚a分子残留的真实牛奶样品;
二、制备金纳米粒子(aunps)溶胶,然后利用氟化钾水溶液修饰aunps,制备氟化钾修饰的具有sers活性的aunps改性基底。具体的操作步骤如下:a、将1ml1%的haucl4加入到装有99ml去离子水的三口烧瓶中,在磁力搅拌下加热使其溶解;当溶液加热至94℃的沸腾状态时快速加入4ml浓度为1%的柠檬酸钠水溶液,三口烧瓶中溶液由无色透明逐渐转变成淡紫色、紫色,最终生成酒红色的透明溶胶;透明溶胶在96℃的微沸状态下保持15min,然后停止加热,自然冷却至室温,得到金溶胶;b、取10ml的aunps溶胶,在7000转/秒下离心10min,得到aunps浓缩物;将30μl浓度为1×10-3mol/l的氟化钾水溶液与30μl的aunps浓缩物进行充分混合,静止10min,得到氟化钾修饰的aunps改性基底;
三、向待测加标牛奶样品中添加体积比为3:1的甲醇/水混合溶剂,超声处理1~3min,再离心分离处理8~15min,移出上清液在室温下自然蒸发至干得到残余物;再向残余物中加入体积比为3:1的甲醇/水混合溶剂并超声处理1~3min,再离心分离处理5~8min,移出上清液,依次用0.45μm和0.22μm的水系膜对上清液进行过滤,得到待测加标牛奶样品上清液;
四、将30μl的浓度为1×10-3mol/l的氟化钾水溶液修饰的aunps改性基底与30μl加标牛奶样品上清液进行充分混合,然后再向混合物中添加10μl浓度为1×10-2mol/l的硫酸锌水溶液作为聚集剂,之后再将其加载到玻璃点样毛细管中,得到待测加标牛奶样品检测管;同时将未加硫酸锌水溶液处理的样品、未加氟化钾水溶液修饰的样品、氟化钾水溶液与硫酸锌水溶液均未加的样品、双酚a甲醇水溶液、氟化钾水溶液和硫酸锌水溶液双重修饰的aunps改性基底空白溶液也加载到玻璃点样毛细管中,制成对比的检测管;
五、用激发光源的波长为633nm的horibalabramaramis型拉曼光谱仪测试步骤四得到的待测加标牛奶样品检测管及对比检测管的拉曼光谱,拉曼光谱仪采集信号的时间为2min,将该光谱与双酚a标准品的拉曼图谱比对,实现对待测牛奶样品中双酚a残留的定性鉴别和定量检测。
在本试验中,30μl双酚a加标牛奶样品上清液与30μl浓度为1×10-3mol/l氟化钾水溶液修饰的aunps改性基底混合后,再添加10μl浓度为1×10-2mol/l硫酸锌水溶液的sers光谱图如图1a中的曲线a所示,图1a中的曲线b是30μl浓度为1×10-3mol/l氟化钾水溶液修饰的aunps改性基底与30μl双酚a加标牛奶样品上清液混合后的sers光谱图;c是将10μl浓度为1×10-2mol/l硫酸锌水溶液修饰的aunps改性基底与30μl双酚a加标牛奶样品上清液混合后的sers光谱图;d是30μl未修饰aunps基底与30μl双酚a加标牛奶样品上清液混合后的sers光谱图;e是双酚a浓度为1×10-3mol/l的甲醇水溶液的本体拉曼光谱图;f是空白1×10-3mol/l氟化钾水溶液和1×10-2mol/l硫酸锌水溶液双重修饰的aunps改性基底的拉曼光谱图;图1b中的曲线是双酚a固体粉末本体的拉曼光谱图。从图1b可以看出,双酚a的特征拉曼信号峰出现在641cm-1和1112cm-1处,归属于两苯环的特征振动。从图1可以看出,1×10-3mol/l加标牛奶样品上清液在未经任何修饰的aunps基底上不产生拉曼信号;而在经过卤化物水溶液和硫酸盐水溶液修饰的aunps改性基底上则表现出很强的拉曼信号强度。并且,通过与双酚a固体粉末本体的拉曼光谱比对,可以指认加标牛奶样品中双酚a在aunps改性基底上的sers光谱,证明本试验能够定性鉴别牛奶中残留的双酚a分子的存在。
试验2:本试验与试验1不同的是:
步骤二中的氟化钾分别用氯化钾、溴化钾、碘化钾替代,得到不同卤化物修饰的aunps改性基底;
步骤四中的操作用以下操作代替:分别将30μl的浓度为1×10-3mol/l氟化钾、氯化钾、溴化钾或碘化钾水溶液修饰的aunps改性基底与30μl加标牛奶样品上清液进行充分混合,之后再将其加载到玻璃点样毛细管中,得到待测加标牛奶样品检测管;
其它步骤与参数与试验1相同。
本试验中,30μl双酚a加标牛奶样品上清液分别与30μl浓度为1×10-3mol/l不同卤化物水溶液修饰的aunps改性基底和未经修饰的aunps基底混合后的sers光谱如图2中的曲线a~e所示。从图2a可以看出,1×10-3mol/l加标牛奶样品上清液在未经卤化物水溶液修饰的aunps基底上不产生任何拉曼信号。而1×10-3mol/l加标牛奶样品在经浓度为1×10-3mol/l的不同卤化物水溶液修饰的aunps改性基底上则表现出了很强的拉曼信号强度。可见,卤化物水溶液在一定程度上对加标牛奶中双酚a的拉曼信号增强有重要的贡献。而且,从图2中可以看出,与其他卤化物水溶液修饰的aunps改性基底相比,双酚a加标牛奶样品在1×10-3mol/l氟化钾水溶液修饰的aunps改性基底上表现出更强的拉曼信号。因此,选择1×10-3mol/l氟化钾水溶液修饰的aunps改性基底进行下一步试验操作。
试验3:本试验与试验1不同的是:步骤四中的操作用以下操作代替:将30μl的浓度为1×10-3mol/l氟化钾水溶液修饰的aunps改性基底与30μl加标牛奶样品上清液进行充分混合,然后再向混合物中不添加硫酸盐溶液、或添加10μl浓度为1×10-2mol/l的硫酸钠水溶液作为聚集剂、或添加10μl浓度为1×10-2mol/l的硫酸锌水溶液作为聚集剂、或添加10μl浓度为1×10-2mol/l的硫酸铝水溶液作为聚集剂,然后再将它们加载到玻璃点样毛细管中,得到待测加标牛奶样品检测管;其它与试验1相同。
本试验中,30μl双酚a加标牛奶样品上清液与30μl浓度为1×10-3mol/l氟化钾水溶液修饰的aunps改性基底进行混合,不加或再加入10μl浓度为1×10-2mol/l不同硫酸盐水溶液作为聚集剂的sers光谱图如图3中的曲线a~d所示。从图3a可以看出,1×10-3mol/l加标牛奶样品上清液在只经浓度为1×10-3mol/l氟化钾水溶液修饰的aunp改性基底上产生了一定强度的拉曼信号,但却不能满足牛奶中双酚a残留的痕量检测需求。然而,当再加入浓度为1×10-2mol/l的不同硫酸盐水溶液作为聚集剂时,加标牛奶样品上清液在aunps改性基底上则表现出了非常强的拉曼信号强度,可以实现对牛奶中双酚a残留的痕量检测。可见,浓度为1×10-2mol/l的硫酸盐水溶液,包括硫酸钠、硫酸锌、硫酸铝在一定程度上都对加标牛奶中双酚a的拉曼信号增强有巨大的贡献。而且,从图3中还可以看出,与其他硫酸盐水溶液和1×10-3mol/l氟化钾水溶液修饰的aunps改性基底相比,双酚a加标牛奶样品在经1×10-3mol/l氟化钾水溶液和1×10-2mol/l硫化锌水溶液同时修饰的aunps改性基底上表现出更强的拉曼信号。因此选择1×10-2mol/l硫酸锌水溶液和1×10-3mol/l氟化钾水溶液修饰的aunps改性基底进行下一步试验操作。
试验4:本试验的牛奶中双酚a残留的表面增强拉曼检测方法,按以下步骤进行:
一、将0.2283g双酚a(bpa)分子直接添加到无双酚a分子的牛奶中并定容至10ml,获得浓度为1×10-1mol/l的bpa加标牛奶母液,然后以无双酚a分子的空白液态牛奶作为溶剂将加标牛奶母液分别稀释成一系列的所需浓度:1×10-1、1×10-2、1×10-3、1×10-4、1×10-5、1×10-6、1×10-7、1×10-8和1×10-9mol/l,得到加标牛奶样品,将制备好的加标牛奶样品在4摄氏度的冷藏条件下储存7天使待测样品更接近于含有bpa残留的真实牛奶;
二、制备金纳米粒子(aunps)溶胶,然后利用氟化钾水溶液修饰aunps,制备氟化钾修饰的具有sers活性的aunps改性基底。具体的操作步骤如下:a、将1ml1%的haucl4加入到装有99ml去离子水的三口烧瓶中,在磁力搅拌下加热使其溶解;当溶液加热至94℃的沸腾状态时快速加入4ml浓度为1%的柠檬酸钠水溶液,三口烧瓶中溶液由无色透明逐渐转变成淡紫色、紫色,最终生成酒红色的透明溶胶;透明溶胶在96℃的微沸状态下保持15min,然后停止加热,自然冷却至室温,得到金溶胶;b、取10ml的aunps溶胶,在7000转/秒下离心10min,得到aunps浓缩物;将30μl浓度为1×10-3mol/l的氟化钾水溶液与30μl的aunps浓缩物进行充分混合,静止10min,得到氟化钾修饰的aunps改性基底;
三、向待测加标牛奶样品中添加体积比为3:1的甲醇/水混合溶剂,超声处理3min,再离心分离处理10min,移出上清液在室温下自然蒸发至干得到残余物;再向残余物中加入体积比为3:1的甲醇/水混合溶剂并超声处理3min,再离心分离处理5min,移出上清液,依次用0.45μm和0.22μm的水系膜对上清液进行过滤,得到待测加标牛奶样品上清液;
四、将30μl的浓度为1×10-3mol/l氟化钾水溶液修饰的aunps改性基底分别与30μl不同浓度的加标牛奶样品上清液进行充分混合,然后再向混合物中分别添加10μl的1×10-2mol/l硫酸锌水溶液作为聚集剂,之后再将其加载到玻璃点样毛细管中,得到待测加标牛奶样品检测管;
五、用拉曼光谱仪测试步骤四得到的待测加标牛奶样品检测管的表面增强拉曼光谱,将该光谱与双酚a标准品的拉曼图谱比对,实现对待测牛奶样品中双酚a残留的定性鉴别和定量检测。
本试验中,双酚a浓度分别为1×10-1、1×10-2、1×10-3、1×10-4、1×10-5、1×10-6、1×10-7、1×10-8和1×10-9mol/l的加标牛奶样品的sers光谱如图4所示。图4中曲线由上到下对应着浓度为1×10-1、1×10-2、1×10-3、1×10-4、1×10-5、1×10-6、1×10-7、1×10-8和1×10-9mol/l的样品。从图中可以看出,双酚a在1×10-2mol/l硫酸锌水溶液和1×10-3mol/l氟化钾水溶液修饰的aunps改性基底上展现了浓度依赖的sers增强,证明本试验可定性和定量检测牛奶中残留的痕量双酚a分子的存在,牛奶中双酚a残留的最低检测浓度可以达到1×10-8mol/l。另外,在双酚a浓度为1×10-3~1×10-8mol/l范围内,以拉曼位移641cm-1处的峰强度为纵坐标,以加标牛奶中双酚a浓度为横坐标作图,可以得到标准曲线如图5所示;利用标准曲线可以实现对待测加标牛奶样品中双酚a浓度的定量检测,牛奶中双酚a残留的检出限可以达到4.3×10-9mol/l(相对于3倍信噪比)。
- 还没有人留言评论。精彩留言会获得点赞!
- 一种便携式智能拉曼光谱采集设备的制造方法与工艺
- 用于改善基底表面硬度及耐磨性的Ni‑WC复合涂层及其制备的制造方法与工艺
- 一种具有SERS活性的金/银/聚合物/银核壳纳米蘑菇材料及其制备方法和应用与制造工艺
- 用于增强使用无执照射频谱带进行的传输的帧结构和先听后讲规程(LBT)的技术的制造方法与工艺
- 一种基于近邻协同增强的高光谱混合像元分类方法与制造工艺
- 一种单分散银壳磁性微球的制备方法及其SERS应用与制造工艺
- 一种大口径材料表面散射的高速测量装置和方法与制造工艺
- 纳米金比色探针的制备方法及其检测碘离子的方法与制造工艺
- 一种复合型纳米结构拉曼增强基底、制备方法及应用与制造工艺
- 一种CaF2光学基底表面和亚表面损伤探测方法与制造工艺