一种叶酸功能化二氧化硅靶向纳米药物载体的定量检测方法与流程
本发明涉及纳米材料的定量检测,具体涉及一种叶酸功能化二氧化硅(sio2-fo)靶向纳米药物载体的定量检测方法。
背景技术:
恶性肿瘤严重威胁着人类的健康。在癌症的治疗中,药物治疗是一个很重要的环节,抗癌药物的有效使用可以帮助患者获得更长的生存时间。抗癌药物的研发一直是科学家关注的焦点之一,但是许多抗癌药物的溶解性低、稳定性差、易被快速代谢和清除、有副作用、缺少靶向功能等,在治疗的过程中很难充分发挥药效,已逐渐不能满足临床用药的需求。因此,无论是从人类健康,还是从社会发展的角度,发展新的技术和手段实现肿瘤有效治疗具有十分重要的意义。
随着纳米技术的发展,以及各学科间的交叉融合,具有特殊物理化学性质的纳米材料在肿瘤的治疗方面显示出广阔的应用前景。近年来,肿瘤靶向药物载体系统成为众多学者研究的热点。靶向纳米药物载体的突出优点在于:①控制药物进入特定的靶器官或靶细胞,靶向输送药物;②缓释药物,延长药物作用时间;③提高制剂的稳定性及口服生物利用度;④载体材料可生物降解,无毒或毒性较低。理想的药物载体还应具有载药量大、在体内有一定的循环时间等特点。
无机纳米材料作为药物载体具有更高的药物包载率,更好的化学稳定性和生物相容性,因而更适合作为药物载体。在众多的无机纳米材料中,介孔二氧化硅(sio2)纳米颗粒具有大的比表面积、大的介孔体积、良好的生物相容性,并且表面易修饰等特点,因而将其作为药物载体具有诱人的应用潜力和广阔的应用前景。叶酸(fa)是一种小分子维生素,与其他靶向分子如单克隆抗体相比,fa相对分子质量小、无免疫原性、价廉易得、稳定性好、与药物或载体之间的化学键合简单易行,且fa受体在多数肿瘤细胞膜表面过度表达,通常比正常细胞系高出20~200倍。利用fa的靶向性及其与fa受体的特异性,将fa修饰到sio2纳米材料上作为靶向纳米药物载体,与fa复合物相比,fa修饰的纳米递药系统具有易于解离释放药物,可穿过生物屏障发挥药效等优点,尤其fa分子暴露在最外面,从而能最充分地接触肿瘤细胞。因此叶酸功能化二氧化硅(sio2-fo)作为靶向药物载体在医药领域具有广阔的应用前景。
纳米生物技术是生物技术领域的前沿和热点问题,从现有研究结果来看,对于纳米材料应用于医学领域通常局限于考察其在体内的分布、降解、药物释放效率以及毒性研究等方面。众所周知,纳米材料因其特殊的效应对人体可能有一定的影响,不同的剂量可能对机体产生不同的功效或副作用。因此,纳米药物载体的剂量检测对于考察该材料是否可以应用于临床显得尤为重要。而目前对于纳米材料的表征方法主要集中在其结构、成分、粒度、形貌以及界面等分析。而对于纳米材料的定量分析还不是很多,目前常用的方法有电感耦合等离子体质谱法(icp-ms)、高效液相色谱-电感耦合等离子体质谱法(hplc-icp-ms)以及气相色谱-电感耦合等离子体质谱法(gc-icp-ms),然而这些方法不仅操作繁琐,仪器昂贵,而且稳定性和灵敏度都不高,检测技术仍不够成熟。因此,对于纳米载体本身在生物体内的定量检测仍是一项十分必要且具有挑战性的工作。
技术实现要素:
为解决上述技术问题,本发明提供一种叶酸功能化二氧化硅(sio2-fo)靶向纳米药物载体的定量检测方法。利用抗原抗体的特异性结合采用间接竞争酶联免疫法从而实现了对sio2-fo含量的快速检测。该方法具有快速准确、操作简单、检测限低、可进行高通量测定等特点。
一种叶酸功能化二氧化硅靶向纳米药物载体的定量检测方法,所述方法包括以下步骤:
a、sio2-fo包被抗原和免疫原的制备;
b、抗sio2-fo抗体的制备;
c、将sio2-fo包被抗原经包被液稀释后包被于酶标板中,封闭、加入不同浓度的sio2-fo标准品,以抗sio2-fo抗体作为一抗,辣根过氧化物酶标记的羊抗兔抗体作为二抗,建立间接竞争酶联免疫分析法定量检测sio2-fo;
d、以sio2-fo标准品浓度的对数为横坐标,吸光度值为纵坐标绘制标准曲线,从而定量检测出sio2-fo的浓度。
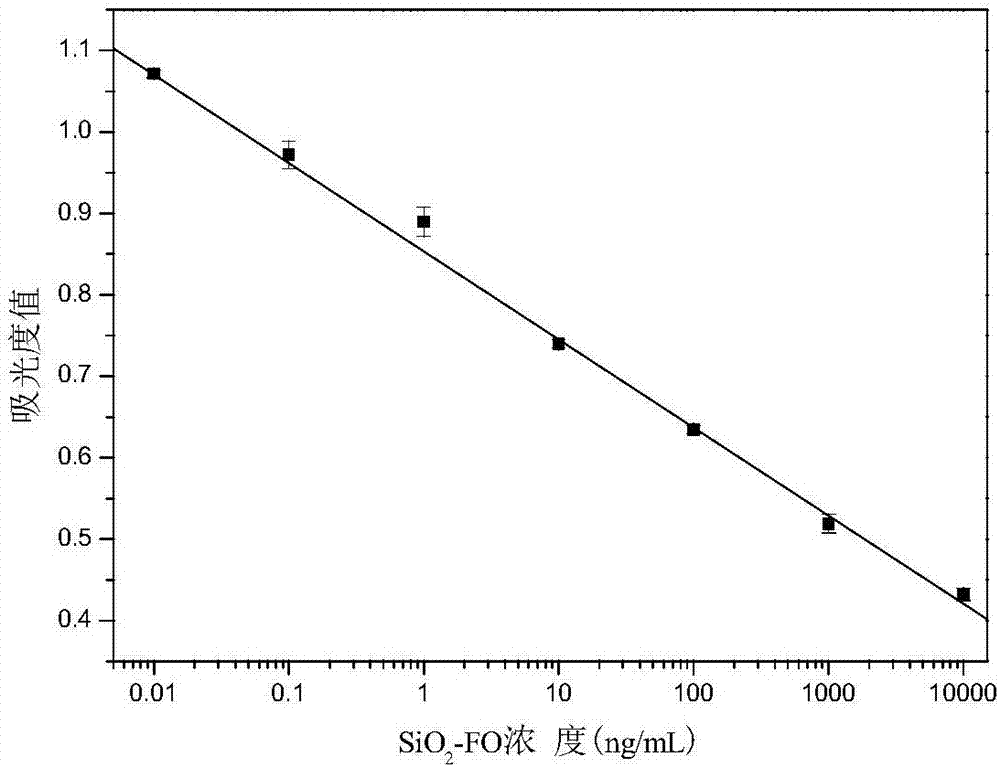
所述标准曲线的线性方程为a=0.8535-0.1083logc,其中a为490nm处的吸光度值,c为sio2-fo浓度。其相关系数r=-0.9994,线性范围为10-2-104ng/ml,检出限为0.006ng/ml。
所述过程a具体包括以下步骤:
a-1、将sio2-fo溶于pbs溶液中,得到水溶性的sio2-fo溶液;
a-2、将ova溶于pbs溶液中,然后加入步骤a-1得到的sio2-fo溶液和戊二醛溶液,25~28℃下避光搅拌2~5h;将反应液置于透析袋中透析24h即可得到sio2-fo包被抗原;
a-3、将bsa溶于pbs溶液中,然后加入步骤a-1得到的sio2-fo溶液和戊二醛溶液,25~28℃下避光搅拌2~5h;将反应液置于透析袋中透析24h即可得到sio2-fo免疫原。
进一步地,所述步骤a具体包括以下步骤:
a-1、称取10~20mgsio2-fo溶于1~2mlpbs溶液中,磁力搅拌1~2h即得到水溶性的sio2-fo溶液;
a-2、称取10~20mgova溶于2~4mlpbs溶液中,并在搅拌下加入步骤a-1得到的sio2-fo溶液,混合均匀后再滴加80~200μl25%戊二醛溶液,25~28℃下避光搅拌2~5h;将反应液置于透析袋中,用pbs透析24h后收集即可得到sio2-fo包被抗原,其浓度为2~4mg/ml;
a-3、称取10~20mgbsa溶于2~4mlpbs溶液中,并在搅拌下加入步骤a-1得到的sio2-fo溶液,混合均匀后再滴加80~200μl25%戊二醛溶液,25~28℃下避光搅拌2~5h;将反应液置于透析袋中,用pbs透析24h后收集即可得到sio2-fo免疫原,其浓度为2~4mg/ml。
所述步骤a-2和a-3中,透析袋的截留分子量为8000~14000da。
水溶性的sio2-fo溶液浓度为5~15mg/ml。
所述步骤b具体包括以下步骤:
b-1、首次免疫:将sio2-fo免疫原与弗氏完全佐剂等体积比混合后,采用背部皮下多点注射的方式注射到大白兔体内,注射8~10个点,注射量为1~2ml/只;首次免疫三周后进行加强免疫;
b-2、加强免疫:将sio2-fo免疫原与弗氏不完全佐剂等体积比混合后,采取同样的方式注射到大白兔体内,注射8~10个点,注射量为1~2ml/只;此后每两周进行再次加强免疫,中间周进行耳静脉采血测血清效价,直到效价达到1:64000,再进行最后一次加强免疫,并在免疫一周后从动物颈动脉采血,静置析出抗血清并进行纯化,得到抗sio2-fo抗体,其浓度为5~10mg/ml。
所述步骤c具体包括以下步骤:
c-1、包被:用包被缓冲液将sio2-fo包被抗原稀释1000倍,包被96孔酶标板,每孔100μl,4℃冰箱过夜;
c-2、封闭:甩干,pbst溶液洗涤3次,每次3~5min,洗去未被结合上的sio2-fo包被抗原,加入1wt%酪蛋白,每孔200μl进行封闭,37℃烘箱温育1~2h;
c-3、加样竞争:甩干,pbst溶液洗涤3次,每次3~5min,洗去多余的封闭液,然后将50μl不同浓度的sio2-fo标准品和50μl抗sio2-fo抗体分梯度加入各孔中,使之发生竞争反应,37℃烘箱温育2~4h;
c-4、加酶:甩干,pbst溶液洗涤3次,每次3~5min,每孔加入100μlpbs稀释的稀释比为1/5000的辣根过氧化物酶标记的羊抗兔抗体,37℃烘箱温育2~4h;
c-5、显色:甩干,pbst溶液洗涤3次,每次3~5min,洗去未被结合的二抗,每孔加入100μl邻苯二胺底物液进行显色反应,37℃烘箱温育0.5~1h;
c-6、终止:每孔加入50μl2mol/lh2so4终止反应,用多功能酶标仪测定各孔在490nm处的吸光度值。
本发明提供了一种基于间接竞争酶联免疫法定量检测叶酸功能化二氧化硅(sio2-fo)靶向纳米药物载体的方法,利用抗原抗体的特异性结合实现了该免疫方法对sio2-fo的定量检测。
与现有技术相比,本发明具有以下几个特点:
(1)利用机体的免疫应答效应,成功制备且筛选出了高效价的抗sio2-fo抗体,为建立高特异性的免疫分析定量检测sio2-fo奠定了基础;
(2)基于抗原抗体的特异性结合建立了一种基于间接竞争酶联免疫分析法定量检测sio2-fo的新方法,为今后纳米材料的定量检测提供了一种可行性较高的方法;
(3)该方法操作简单,可行性高,检出限低,可实现高通量检测。
附图说明
图1为以sio2-fo标准品浓度的对数为横坐标,吸光度值为纵坐标建立的标准曲线图。
具体实施方式
弗氏完全佐剂、辣根过氧化物酶标记的羊抗兔抗体(hrp标记的羊抗兔igg)、牛血清白蛋白(bsa)和鸡卵清白蛋白(ova)购买自生工生物工程(上海)股份有限公司。
其他试剂均可从市场上的销售厂家购买得到。
本发明涉及到的各溶液的制备方法为:
pbs溶液(0.01mol/lph=7.4):称取nacl8.0g、kcl0.1g、nah2po4·2h200.29g、na2hpo4·12h2o2.96g溶解于蒸馏水中并定容至1000ml。
pbst溶液(0.01mol/lph=7.4):在1000mlpbs中加入500μltween-20,混合均匀。
包被缓冲液cb(0.05mol/lph=9.6):称取na2co31.59g、nahco32.94g溶解于蒸馏水中并定容至1000ml。
1wt%酪蛋白溶液:其为封闭液,称取0.01g酪蛋白溶解于1mlpbs中,混合均匀。
邻苯二胺底物液:称取1.85gna2hpo4·12h2o、0.51gc6h8o7溶解于蒸馏水中并定容至50ml,称取4mg邻苯二胺溶于10ml上述溶液中,临用前加入15μl30%h2o2;
终止液:2mol/lh2so4。
mes缓冲液(0.1m,ph=5.5):称0.1921gmes溶解于10ml蒸馏水中,用naoh溶液调节其ph至5.5。
实施例1
一种叶酸功能化二氧化硅(sio2-fo)靶向纳米药物载体的定量检测方法,所述方法包括以下步骤:
a、sio2-fo包被抗原和免疫原的制备
a-1、称取10mgsio2-fo溶于1mlpbs溶液中,磁力搅拌1h即得到浓度为10mg/ml的sio2-fo溶液;
a-2、称取10mgova溶于2mlpbs中,并在搅拌下加入步骤a-1得到的sio2-fo溶液,混合均匀后再滴加90μl25%戊二醛溶液,25℃下避光搅拌4h;将反应液置于截留分子量为8000-12000da的透析袋中,用pbs透析24h后收集即可得到sio2-fo包被抗原,其浓度为3.33mg/ml,4℃储存待用;
a-3、称取10mgbsa溶于2mlpbs中,并在搅拌下加入步骤a-1得到的sio2-fo溶液,混合均匀后再滴加90μl25%戊二醛溶液,25℃下避光搅拌4h;将反应液置于截留分子量为8000-12000da透析袋中,用pbs透析24h后收集即可得到sio2-fo免疫原,其浓度为3.33mg/ml,4℃储存待用。
所述步骤a-1中的sio2-fo(叶酸功能化二氧化硅)的制备方法为:
a-1-1、氨基功能化二氧化硅(sio2–nh2)的制备
将380μl正硅酸乙酯和12ml无水乙醇混合搅拌0.5h;加入570μl26%氨水,25℃下搅拌24h;再加入400μl3-氨丙基三乙氧基硅烷,25℃下持续搅拌24h;将反应液10000rpm/min离心分离20min,取沉淀用无水乙醇洗涤,并在25℃下干燥24h即可得到氨基功能化二氧化硅;
a-1-2、叶酸功能化二氧化硅(sio2–fo)的制备
称取57.5mg叶酸溶于2mlmes缓冲液,再加入40.3mg1-乙基-(3-二甲基氨基丙基)碳酰二亚胺盐酸盐(edc)和17.25mgn-羟基琥珀酰亚胺,室温下搅拌1h;
称取100mgsio2–nh2溶于5mlmes缓冲液后加入到上述混合液中,25℃下避光搅拌24h;将反应液10000rpm/min离心分离10min,取沉淀用蒸馏水和无水乙醇洗涤,并在25℃下干燥24h即可得到叶酸功能化二氧化硅。
b、抗sio2-fo抗体的制备
选用4只体重为2~2.5kg的雄性新西兰大白兔为免疫对象,实验之前首先将购买的新西兰大白兔饲养2周左右,维持其健康状态,其中3只作为免疫对象,第4只作为空白对照,空白对照组不进行任何免疫。
b-1、首次免疫:将sio2-fo免疫原与弗氏完全佐剂等体积比混合后,采用背部皮下多点注射的方式注射到3只实验兔体内,注射8~10个点,注射量为1ml/只;免疫接种的方式有注射免疫、口服免疫、气雾免疫等,其中注射免疫又有皮下注射、皮内注射、肌肉注射静脉注射等方式,背部皮下注射操作方便,药物扩散较慢,有利于刺激机体产生免疫应答,继而产生抗体;而雄兔作为免疫对象可以避免其生理周期对实验产生影响。
b-2、加强免疫:首次免疫三周后进行加强免疫。将sio2-fo免疫原与弗氏不完全佐剂等体积比混合后,采取同样的方式注射到3只实验兔体内,注射8~10个点,注射量为1ml/只;此后每两周进行再次加强免疫,中间周进行耳静脉采血测血清效价,直到效价达到1:64000,再进行最后一次加强免疫,并在免疫一周后从动物颈动脉采血,静置析出抗血清并进行纯化,得到抗sio2-fo抗体,其浓度为8.50mg/ml。
弗氏不完全佐剂的制备方法为:称取50g的无水羊毛脂,量取100ml的液体石蜡混合,超声仪多次超声,每次不超过20min,防止超声过程中温度过高,不能及时散热,超声使之混合均匀,直到将该混合液体滴到水中并且半分钟内不扩散为止,得到的油状液体即为弗氏不完全佐剂,4℃冰箱储存待用。
抗体效价鉴定的具体方法为:用包被缓冲液cb将包被抗原稀释400倍,包被在96孔酶标板上,4℃冰箱过夜;甩干,用pbst溶液洗3次,每次3min,每孔加200μl1wt%酪蛋白封闭液,37℃封闭1h;甩干,pbst洗3次,每次3min,每孔加入100μl用pbs稀释成不同浓度的抗血清,其稀释比为1/1000~1/128000,37℃温育2h;甩干,pbst洗3次,每次3min,每孔加入100μl用pbs稀释的稀释比为1/5000的hrp标记的羊抗兔igg,37℃温育2h;甩干,pbst洗3次,每次3min,每孔加入100μl邻苯二胺底物液进行显色反应,37℃温育0.5h;每孔再加入50μl2mol/lh2so4终止反应;最后用多功能酶标仪测定各孔在490nm处的吸光度值a。比较实验组与空白对照组在同一抗血清稀释倍数下的吸光值a,当a实验组≥2倍a空白组时对应的最大稀释倍数即抗血清的效价。
c、利用纯化好的抗sio2-fo抗体和sio2-fo包被抗原进行间接竞争酶联免疫分析实验,在最优条件下建立标准曲线从而达到定量检测sio2-fo的目的。
c-1、包被:用包被缓冲液将sio2-fo包被抗原稀释1000倍,包被96孔酶标板。每孔100μl,4℃冰箱过夜;
c-2、封闭:甩干,pbst洗涤3次,每次3min,洗去未被结合上的sio2-fo包被抗原,加入1wt%酪蛋白,每孔200μl进行封闭(减少非特异性吸附),37℃烘箱温育1h;
c-3、加样竞争:甩干,pbst溶液洗涤3次,每次3min,洗去多余的封闭液。将50μl浓度分别为0.01ng/ml、0.1ng/ml、1ng/ml、10ng/ml、102ng/ml、103ng/ml、104ng/ml的sio2-fo标准品依次加入到酶标板的各行中,即每个浓度梯度重复三次,然后向各孔中加入50μl抗sio2-fo抗体使之发生竞争反应,37℃烘箱温育3h;
不同浓度的sio2-fo标准品的制备方法为:用0.01mol/lph=7.4的pbs缓冲溶液将sio2-fo稀释到指定的浓度。
c-4、加酶:甩干,pbst溶液洗涤3次,每次3min。每孔加入100μlpbs稀释的稀释比为1/5000的辣根过氧化物酶标记的羊抗兔抗体,37℃烘箱温育3.5h;
c-5、显色:甩干,pbst洗涤3次,每次3min,洗去未被结合的二抗。每孔加入100μl邻苯二胺底物液进行显色反应,37℃烘箱温育0.5h;
c-6、终止:每孔加入50μl2mol/lh2so4终止反应,用多功能酶标仪测定各孔在490nm处的吸光度值,同一浓度梯度的取平均值计算吸光度值。
d、以sio2-fo标准品浓度的对数为横坐标,吸光度值为纵坐标绘制标准曲线。制得的标准曲线如图1所示,标准曲线的线性方程为a=0.8535-0.1083logc,其中a为490nm处的吸光度值,c为sio2-fo浓度。其相关系数r=-0.9994,线性范围为10-2-104ng/ml,检出限为0.006ng/ml。
e、重复以上各步骤,只是将步骤(3)中的不同浓度的sio2-fo标准品替换为未知浓度的sio2-fo待测液,然后用多功能酶标仪测定各孔在490nm处的吸光度值,求取平均吸光度值。根据上述标准曲线的线性方程a=0.8535-0.1083logc,即可计算出sio2-fo待测液的浓度。
以上方法为多次实验验证后的最优的实验方法,此方法所得到的标准曲线的线性关系最好,线性范围最宽。
上述参照实施例对一种叶酸功能化二氧化硅靶向纳米药物载体的定量检测方法进行的详细描述,是说明性的而不是限定性的,可按照所限定范围列举出若干个实施例,因此在不脱离本发明总体构思下的变化和修改,应属本发明的保护范围之内。
- 还没有人留言评论。精彩留言会获得点赞!