用于先进的金属‑空气蓄电池的催化剂体系的制作方法
相关申请的交叉引用
本申请要求2014年12月14日提交的美国临时专利申请号62/091,585的优先权益,该美国临时专利申请在此以引用的方式整体并入本文。
本公开大体上涉及蓄电池(battery)。本公开更确切地说涉及用于金属-空气蓄电池的改进的催化剂体系。
背景技术:
金属-空气蓄电池(例如锂-空气蓄电池)由于它们的高能量密度而被认为是用于未来储能系统的先进的解决方案。举例来说,锂-空气(li-空气)蓄电池可以具有约11680wh/kg的能量密度,这接近于汽油的能量密度(约13000wh/kg)并且比li-离子蓄电池的能量密度(<200wh/kg)要高得多。这样的高能量密度大部分是因为使用来自空气的氧气而不是依赖于内部储存的氧化剂。在根本上,li-空气蓄电池的能量密度和可再充电性取决于阴极处的氧还原反应(orr)和析氧反应(oer)的速率以及它们相应的过电位。许多催化剂,如碳纳米材料、贵金属、以及金属氧化物已经被用作用于蓄电池应用的催化剂。在这些当中,掺杂碳纳米材料(例如石墨烯、碳纳米管)已经表现出显著的用于氧还原反应(orr)的性能,但是在充电过程期间的降解和对析氧反应(oer)不良的催化活性妨碍了它们的orr特征的益处。不含碳的催化剂,如贵金属和金属氧化物(例如co3o4)已经显示出高稳定性和优越的orr性能或oer性能,但是通常不是两者兼有,并且此外是一种相当高成本的解决方案。最近,包含不同贵金属的复合催化剂已经被用于开发同时增强orr和oer这两者的高效的双功能催化剂,但是这些也是一种高成本的替代方案。
改进金属-空气蓄电池以提高能量密度和可再充电性能并且降低成本在本领域仍是一项挑战。
技术实现要素:
本公开提供了改进的金属-空气蓄电池,所述蓄电池以降低的成本具有提高的能量密度和可再充电性能。在某些方面,本公开改进了使用包括至少一种过渡金属二硫属化物的阴极操作的金属-空气蓄电池。在某些方面,本公开的方法可以降低操作和资本成本,同时维持或甚至提高能量密度和可再充电性。不受具体理论所束缚,认为在tmdc封端的边缘(如mo封端的边缘)上可用的高密度的d电子可以参与orr电化学还原反应,在一些实施方案中,与贵金属相比,产生优越的催化性能。此外,不受具体理论所束缚,认为过渡金属二硫属化物和离子液体充当双功能助催化剂体系,从而表现出强协同作用。在某些实施方案中,本公开的金属-空气蓄电池与现有的贵金属催化剂相比表现出显著更高的氧还原反应(orr)和析氧反应(oer)性能。
因此,在一个方面,本公开提供了一种金属-空气蓄电池,所述金属-空气蓄电池包括:
包含金属的阳极;
包含至少一种过渡金属二硫属化物的阴极;以及
电解质,所述电解质与所述阴极的过渡金属二硫属化物接触,并且任选地与所述阳极的金属接触,
其中所述电解质包含至少1%(例如至少10%、至少20%、至少30%或至少50%)的离子液体。
本公开还提供了产生电位的方法,所述方法包括:
提供如本文所述的金属-空气蓄电池;
使氧气接触所述阴极;
使所述阳极的金属氧化成金属离子;以及
使所述氧气在所述过渡金属二硫属化物的表面还原以与所述金属离子形成一种或多种金属氧化物,
从而在所述阳极与所述阴极之间产生电位。
本公开还提供了一种电子材料,所述电子材料包含至少一种过渡金属二硫属化物和与所述过渡金属二硫属化物接触(例如直接接触)的电解质,所述电解质包含至少1%(例如至少10%、至少20%、至少30%或至少50%)的离子液体。
根据结合所附权利要求书的以下详细说明,将更充分地理解本发明的这些和其它特征和优势。应当指出的是,权利要求书的范围是由其中的表述所限定的而不是由在本说明书中所阐述的特征和优势的具体论述所限定。
附图说明
图1是根据本公开的一个实施方案的金属-空气蓄电池的(a)充电和(b)放电循环的示意图。
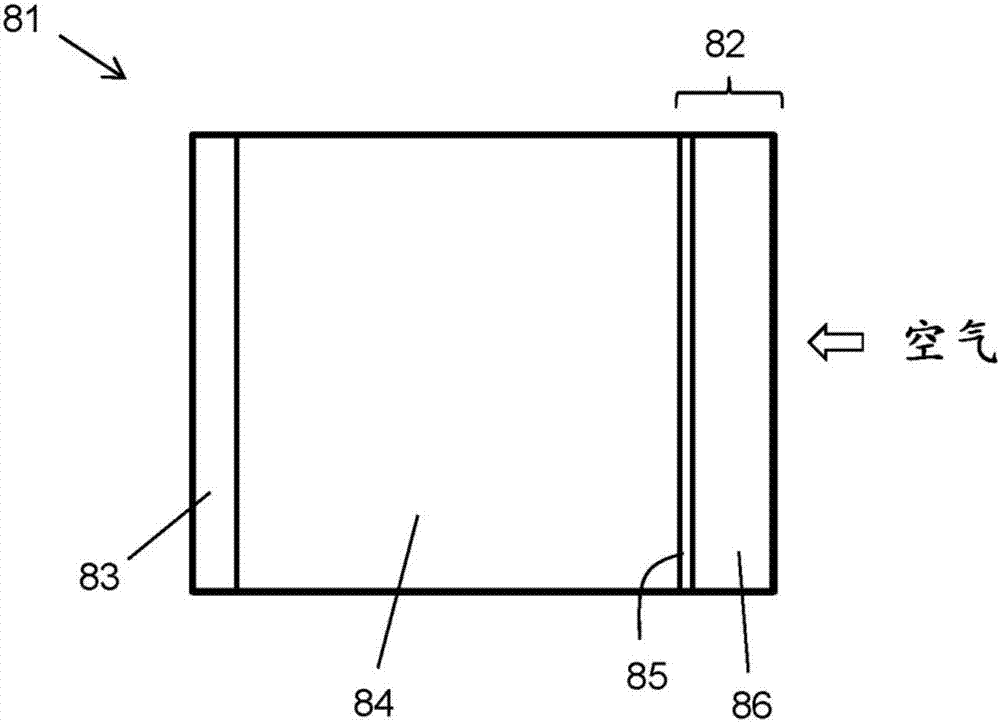
图2是根据本公开的另一个实施方案的金属-空气蓄电池的示意图。
图3是用于实施例实验中的三电极电化学电池的示意图。
图4是用于实施例实验中的世伟洛克(swagelok)式蓄电池单元(batterycell)的示意图。
图5呈现了合成的mos2纳米片的结构和元素分析。(a)沉积在气体扩散层(gdl)上的mos2纳米片的sem图像(插图比例尺:100nm);(b)沉积在气体扩散层(gdl)上的mos2纳米片的动态光散射(dls)粒度测量结果和拉曼光谱(ramanspectrum)。(c)蕾丝碳膜(laceycarbonfilm)上支撑的具有约200nm×150nm尺寸的mos2纳米片的低放大倍率低角度环形暗场(laadf)扫描透射电子显微镜术(stem)图像(比例尺:50nm),所述纳米片具有沿红色虚线的相应谱线轮廓(底部插图)和选区电子衍射(saed)图(右上角插图)。(d)mos2纳米片边缘的高分辨率stem图像(比例尺:2nm);mos2纳米片的边缘沿着(100)和(010)晶面被封端,其中mo原子构成mos2单层的边缘。(e)平面上的硫l-边缘(顶部)和单层mos2的边缘(底部)的电子能量损失谱(eels)。(f)作为mos2的层数的函数以及单层mos2的边缘处的归一化的预峰强度。
图6图示了mos2纳米片的循环伏安法(cv)研究。(a)在o2饱和离子液体和ar饱和离子液体中所获得的cv曲线;较浅的曲线是关于ar饱和情况。(b)在2.0v和4.2v(相对于li/li+)下的电流密度与扫描速率的平方根的关系图。(c)在o2饱和二甲亚砜(dmso)和四甘醇二甲醚(tegdme)中mos2纳米片的orr和oer性能;较浅的曲线是关于tegdme情况。(d)mos2纳米片性能与mos2纳米颗粒(mos2np)性能的比较。
图7图示了在离子液体中mos2纳米片和贵金属(au和pt)的催化性能。(a)裸气体扩散层、au纳米颗粒(aunp)、pt纳米颗粒(ptnp)以及mos2纳米片的orr的比较。图左侧的迹线的从上到下的顺序与图例说明中的顺序相同。(b)裸气体扩散层、au纳米颗粒(aunp)、pt纳米颗粒(ptnp)以及mos2纳米片(mos2nf)的oer的比较。迹线的从上到下的顺序是mos2纳米片、ptnp、aunp、gdl。(c)在离子液体电解质中在小范围的过电位(<200mv)下铂纳米颗粒、金纳米颗粒、以及mos2纳米片的转换频率。(d)在不同的电解质,即dmso、tgdme以及il中,在小范围的过电位(<200mv)下mos2纳米片的转换频率。(e)在离子液体中mos2纳米片的长期性能。在750次循环之后观测到电流密度仅损失6.8%。插图提供了在750次cv循环之后通过x射线光电子分析对mos2纳米片进行的元素分析。
图8示出了在世伟洛克型蓄电池中双功能催化剂的性能。(a)使用不含碳的mos2纳米片和用0.1mlitfsi作为li盐饱和的离子液体电解质的蓄电池的充电和放电电压曲线。基于2.7v截止电位与循环次数的关系图(插图)相同助催化剂的放电容量保持率在2次循环至50次循环之间表现出约8%的衰减。(b)放电阴极的sem图像;以及(c)原始阴极的sem图像。这两个图像显示膜状以及li2o2的一定的纳米颗粒形态。比例尺是1μm。(d)在第1次、第20次以及第50次循环之后电池的dems曲线。dems数据是在将电池放电之后直到500mah/g的充电过程期间所收集的。dems实验表明o2气体是在整个充电过程期间唯一析出的气体。(e)在放电之前(底部)和之后(顶部)阴极表面的拉曼光谱。(f)在放电过程之前(底部)和之后(顶部)放电阴极的xrd分析。
图9提供了基于密度泛函理论(dft)计算,在两种不同的电解质(离子液体([emim+][bf4-])和dmso)中mos2纳米片上氧还原反应(orr)的示意图。在离子液体电解质中,emim+离子强烈地结合到带负电荷的mo边缘(状态1)并且形成emim+覆盖的mo边缘,从而使得单原子mo位点暴露于溶剂(状态2)。然后,o2结合到单原子mo位点上并且在电荷转移的情况下形成o2-(状态3)。然而,在dmso电解质中,中性dmso分子仅微弱地结合到mo边缘(状态4),并且使得多原子mo位点暴露于溶剂。o2分子可以置换mo边缘上吸附的dmso分子或直接结合到多原子mo位点上,并且在mo边缘上快速解离成两个结合的o原子(状态5)。在一些情况下,解离的o原子可以在mo边缘上重排,并且形成活性结合位点(状态6),并且o2可以在这个位点上被还原成o2-(状态7)。然而,在mo边缘上持续的o2解离在热力学上是有利的并且最终将产生非常稳定的氧化mo边缘(状态8),它是失活的。(图中的数字是反应能量,ev)。
图10是在emim-bf4电解质中形成li2o2的计算反应机制的示意图(反应自由能,ev)。lio2是经由离子液体溶液,通过溶解的li+和o2-的相互作用而形成的。li2o2是经由lio2在离子液体中的歧化而形成的。
具体实施方式
在描述所公开的装置、方法以及组合物之前,应当了解的是,本文所述的方面不限于具体的实施方案、设备、或配置,并且因而当然可以变化。还将了解的是,本文所用的术语仅仅是为了实现描述具体方面的目的,并且除非本文明确定义,否则不意图具有限制性。
在整个本说明书中,除非上下文另外要求,否则词语“包含(comprise)”和“包括(include)”以及变化形式(例如“包含(comprises)”、“包含(comprising)”、“包括(includes)”、“包括(including)”)将被理解成表示包括所述的组分、特征、要素、或步骤或组分、特征、要素或步骤的组,但是不排除任何其它完整事物或步骤或完整事物或步骤的组。
除非上下文另外明确规定,否则如说明书和所附权利要求书中所用的单数形式“一个/种(a/an)”和“所述”包括复数指代对象。
范围在本文中可以被表示为从“约”一个具体值和/或至“约”另一个具体值。当这样的范围被表示时,另一个方面包括从所述一个具体值和/或至所述另一个具体值。类似地,当通过使用先行词“约”将值表示为近似值时,应当了解的是,所述具体值形成了另一个方面。应当进一步了解的是,所述范围中的每一个的端点都相对于另一个端点是有意义的,而独立于另一个端点。
如本文所用的术语“接触”包括至少一种物质与另一种物质的物理接触。
如本文所用的术语“过电位”指的是反应的在热力学上确定的还原电位或氧化电位与以实验方式观测到所述事件时的电位之间电位(电压)的差异。
除非另外说明,否则本文的所有百分比、比率以及比例均是以重量计。除非明确说明相反情况,否则组分的重量百分比(重量%,也为wt%)是基于其中包括所述组分的组合物的总重量(例如离子液体的量)。
鉴于本公开,本文所述的方法和组合物可以由本领域普通技术人员配置以满足所期望的需要。一般来说,所公开的方法和组合物提供了利用分子氧的氧化和/或还原反应的电化学装置,如金属-空气蓄电池的改进。举例来说,在某些方面,本公开的装置和方法在氧还原反应(orr)(即与蓄电池放电以提供电位有关)方面和/或在析氧反应(oer)(即与用外部电位将蓄电池充电有关)方面提供了改进。在某些方面,本文所述的装置和方法表现出高稳定性、循环寿命、以及功率。确切地说,在本公开的某些方面,包含过渡金属二硫属化物(tmdc),如二硫化钼(mos2)的阴极在所述阴极与离子液体电解质接触时表现出比在所述阴极与常规的有机溶剂(如dmso)接触时高至少一个数量级(例如是10倍-100倍、10倍-50倍、10倍-30倍、或10倍-20倍)的氧还原反应(orr)电流密度。此外,与现有的贵金属催化剂相比,与包含离子液体的电解质接触的包含tmdc的阴极也可以表现出显著更高的orr和/或oer性能。
一般来说,本公开提供了可以利用氧的氧化还原反应的电化学材料和装置,如金属-空气蓄电池。通常,金属-空气蓄电池含有阳极、阴极以及与阳极和阴极接触的电解质。图1是根据本公开的一个实施方案的可再充电的金属-空气蓄电池的示意性横截面视图。金属-空气蓄电池1具有包含至少一种过渡金属二硫属化物的阴极2、包含金属的阳极3、与阳极3的金属和阴极2的至少一种过渡金属二硫属化物接触的电解质4。在使用中,所述电解质可以在阴极2与阳极3之间传导离子。如本文别处一般描述的那样,所述电解质包括至少1重量%(例如至少10%、至少20%、至少30%或甚至至少50%)的离子液体。
催化剂可以在阳极或阴极上或在电解质中接触以促进所期望的化学反应。在本公开的装置中,例如,阴极包含过渡金属二硫属化物(如mos2),并且电解质包含离子液体。与氧气(例如来自空气)的反应在阴极的过渡金属二硫属化物的表面处发生,所述阴极因此可以被称为“氧正极”。
在本公开的一些实施方案中,特别是在要测量体系的电化学性能的情况下,可以使用三部件电化学电池。在三部件电池中,工作电极(we)、反电极(ce)以及参比电极(re)与包含离子液体的电解质接触。在本公开的某些实施方案中,例如,we用作阴极并且包含过渡金属二硫属化物。在一个非限制性实施例中,银线可以用作re,铂网可以用作ce,并且we可以包含过渡金属二硫属化物(如mos2)。在这些情况下,可以例如在铂反电极上提供待被氧化的金属。
在金属-空气蓄电池中,在放电期间,阳极的金属(例如li)被氧化以形成金属离子(例如li+):
2m→2m++2e-
所产生的电子经由外部负载电路(即待由蓄电池供电的装置)到达阴极。所述电子还原阴极的过渡金属二硫属化物的表面处的分子氧;所还原的氧物质与来自电解质的金属离子结合以形成金属氧化物产物,如氧化锂(li2o)或过氧化锂(li2o2),所述产物可以沉积在阴极处:
2m++1/2o2+2e-→m2o
2m++o2+2e-→m2o2
经由负载电路从负极到正极的电子流动可以被利用以产生电力。
在外部电位下充电期间,这一过程是反向的。电子从阴极流到阳极以使这些半电池反应反向,并且金属(例如li)在阳极处再生,从而使得能够再放电:
2m++2e-→m
m2o→2m++2e-+1/2o2
m2o2→2m++2e-+o2
如上文所述,在本公开的装置和方法中,阳极包括金属(即在电化学反应中被氧化的金属)。如本领域普通技术人员所将了解的那样,多种构造可用于阳极。阳极可以例如基本上由金属组成(例如呈棒状、板状、或其它形状)。在其它实施方案中,所述阳极可以由金属的合金形成,或可以形成为衬底(例如由不同金属、或由另一种导电材料形成的衬底)上金属的沉积物。如本领域普通技术人员所将了解的那样,可以使用包括处于零价态的金属的其它材料。举例来说,在某些实施方案中,金属可以作为复合金属氧化物或含碳材料的一部分提供,所述金属可以从其中被还原以提供金属离子和一个或多个电子。
尽管锂常常被用作阳极的金属,但是本公开的其它实施方案涉及利用本文所述的其它阳极金属的金属-空气蓄电池。因此,应当了解的是,本文关于锂-空气或li-o2蓄电池的说明仅仅是通过举例的方式,并且在本公开的其它实施方案中,使用其它金属代替锂和/或除了锂之外,还使用其它金属,包括本文所述的那些。适用于本公开的阳极中的金属包括但不限于碱金属,如锂、钠、以及钾;碱土金属,如镁和钙;第13族元素,如铝;过渡金属,如锌、铁以及银;以及含有这些金属中的任一种的合金材料或含有这些金属中的任一种的材料。在具体实施方案中,所述金属选自锂、镁、锌、以及铝中的一种或多种。在其它具体的实施方案中,所述金属是锂。
当使用锂作为阳极的金属时,可以使用含锂的含碳材料、含有锂元素的合金、或锂的复合氧化物、氮化物或硫化物。含有锂元素的合金的实例包括但不限于锂铝合金、锂锡合金、锂铅合金、以及锂硅合金。含锂的复合金属氧化物的实例包括氧化锂钛。含锂的复合金属氮化物的实例包括氮化锂钴、氮化锂铁以及氮化锂锰。
如上所述,本公开的装置和方法的阴极包括至少一种过渡金属二硫属化物。用于本公开的方法和装置中的过渡金属二硫属化物中的一种或多种可以被选择以催化氧气经由电化学反应还原。过渡金属二硫属化物的实例包括选自由以下各项组成的组的那些:tix2、vx2、crx2、zrx2、nbx2、mox2、hfx2、wx2、tax2、tcx2、以及rex2,其中x独立地是s、se、或te。在一个实施方案中,每一种过渡金属二硫属化物选自由以下各项组成的组:tix2、mox2以及wx2,其中x独立地是s、se、或te。在另一个实施方案中,每一种过渡金属二硫属化物选自由以下各项组成的组:tis2、tise2、mos2、mose2、ws2以及wse2。举例来说,在一个实施方案中,每一种过渡金属二硫属化物是tis2、mos2或ws2。在另一个实施方案中,每一种过渡金属二硫属化物是mos2或mose2。在一个实施方案中,过渡金属二硫属化物可以是mos2。
所述至少一种过渡金属二硫属化物本身可以多种形式提供,例如以块状材料、纳米结构形式、一组颗粒、和/或一组负载型颗粒的形式。如本领域普通技术人员所将了解的那样,呈块状形式的tmdc可以具有对于这样的化合物来说典型的层状结构。tmdc可以具有纳米结构形态,包括但不限于单层、纳米管、纳米颗粒、纳米片(例如多层纳米片)、纳米薄片、纳米带、纳米多孔固体等。如本文所用的术语“纳米结构”指的是具有纳米范围(即大于1nm并且小于1μm)内的尺寸(例如孔隙、厚度、直径,视结构的情况而定)的材料。在一些实施方案中,所述过渡金属二硫属化物是具有金属原子封端的边缘的层堆叠型块状tmdc(例如具有钼封端的边缘的mos2)。在其它实施方案中,在本公开的装置和方法中可以使用tmdc纳米颗粒(例如mos2纳米颗粒)。在其它实施方案中,在本公开的装置和方法中可以使用tmdc纳米片(例如mos2纳米片)。纳米片可以例如经由液体剥离来制备,如以下文献中所述:coleman,j.n.等,《由层状材料的液体剥离产生的二维纳米薄片(two-dimensionalnanosheetsproducedbyliquidexfoliationoflayeredmaterials)》,science331,568-71(2011);以及yasaei,p.等,《通过液相剥离制成的高质量黑色磷原子层(high-qualityblackphosphorusatomiclayersbyliquid-phaseexfoliation)》,adv.mater.(2015)(doi:10.1002/adma.201405150),上述文献中的每一篇在此以引用的方式整体并入本文。在其它实施方案中,在本公开的装置和方法中可以使用tmdc纳米带(例如mos2纳米带)。在其它实施方案中,在本公开的装置和方法中可以使用tmdc纳米薄片(例如mos2纳米薄片)。本领域普通技术人员可以选择用于具体装置的适当的形态。举例来说,在本公开的某些装置中,呈纳米片形式的tmdc在orr和oer电流密度方面可以优于呈纳米颗粒形式的相同的tmdc(参见例如对于图6所述的结果)。
在某些实施方案中,过渡金属二硫属化物纳米结构(例如纳米片、纳米颗粒、纳米带等)具有约1nm至1000nm的平均尺寸。纳米颗粒的相关尺寸是它的最大直径。纳米片的相关尺寸是它沿它的主要表面的最大宽度。纳米带的相关尺寸是它横跨带的宽度。纳米薄片的相关尺寸是它的厚度。在一些实施方案中,过渡金属二硫属化物纳米结构具有以下平均尺寸:约1nm至约400nm、或约1nm至约350nm、或约1nm至约300nm、或约1nm至约250nm、或约1nm至约200nm、或约1nm至约150nm、或约1nm至约100nm、或约1nm至约80nm、或约1nm至约70nm、或约1nm至约50nm、或50nm至约400nm、或约50nm至约350nm、或约50nm至约300nm、或约50nm至约250nm、或约50nm至约200nm、或约50nm至约150nm、或约50nm至约100nm、或约10nm至约70nm、或约10nm至约80nm、或约10nm至约100nm、或约100nm至约500nm、或约100nm至约600nm、或约100nm至约700nm、或约100nm至约800nm、或约100nm至约900nm、或约100nm至约1000nm、或约400nm至约500nm、或约400nm至约600nm、或约400nm至约700nm、或约400nm至约800nm、或约400nm至约900nm、或约400nm至约1000nm。在某些实施方案中,过渡金属二硫属化物纳米结构具有约1nm至约200nm的平均尺寸。在某些其它实施方案中,过渡金属二硫属化物纳米结构具有约1nm至约400nm的平均尺寸。在某些其它实施方案中,过渡金属二硫属化物纳米结构具有约400nm至约1000nm的平均尺寸。在某些实施方案中,过渡金属二硫属化物纳米结构是具有约1nm至约200nm的平均尺寸的纳米片。在某些其它实施方案中,过渡金属二硫属化物纳米片具有约1nm至约400nm的平均尺寸。在某些其它实施方案中,过渡金属二硫属化物纳米片具有约400nm至约1000nm的平均尺寸。
在某些实施方案中,过渡金属二硫属化物纳米片具有约1nm至约100μm的平均厚度(例如约1nm至约10μm、或约1nm至约1μm、或约1nm至约1000nm、或约1nm至约400nm、或约1nm至约350nm、或约1nm至约300nm、或约1nm至约250nm、或约1nm至约200nm、或约1nm至约150nm、或约1nm至约100nm、或约1nm至约80nm、或约1nm至约70nm、或约1nm至约50nm、或约50nm至约400nm、或约50nm至约350nm、或约50nm至约300nm、或约50nm至约250nm、或约50nm至约200nm、或约50nm至约150nm、或约50nm至约100nm、或约10nm至约70nm、或约10nm至约80nm、或约10nm至约100nm、或约100nm至约500nm、或约100nm至约600nm、或约100nm至约700nm、或约100nm至约800nm、或约100nm至约900nm、或约100nm至约1000nm、或约400nm至约500nm、或约400nm至约600nm、或约400nm至约700nm、或约400nm至约800nm、或约400nm至约900nm、或约400nm至约1000nm);以及约20nm至约100μm的沿主要表面的平均尺寸(例如约20nm至约50μm、或约20nm至约10μm、或约20nm至约1μm、或约50nm至约100μm、或约50nm至约50μm、或约50nm至约10μm、或约50nm至约1μm、或约100nm至约100μm、或约100nm至约50μm、或约100nm至约10μm、或约100nm至约1μm)。纳米片的纵横比(最大主要尺寸:厚度)可以平均是例如至少约5:1、至少约10:1或至少约20:1。举例来说,在某些实施方案中,过渡金属二硫属化物纳米片具有约1nm至约1000nm范围的平均厚度(例如约1nm至约100nm)、约50nm至约10μm的沿主要表面的平均尺寸、以及至少约5:1的纵横比。
本领域技术人员将认识到的是,阴极的至少一种过渡金属二硫属化物可以多种形式提供,前提条件是它与电解质接触。举例来说,过渡金属二硫属化物可以被设置在衬底上。举例来说,过渡金属二硫属化物可以被设置在多孔构件上,所述构件可以允许气体(例如空气或氧气)通过所述构件扩散到tmdc。所述多孔构件可以是导电的。在其中所述多孔构件不导电的情况下,本领域技术人员可以布置以使阴极与阴极的某个其它部分进行电连接。所述衬底可以被选择以允许氧气(例如空气)以显著量吸收到装置中并且输送到tmdc。用于衬底的多孔材料的实例包括基于碳的材料,如碳以及炭黑(例如科琴黑(ketjenblack)、乙炔黑、槽黑、炉黑、以及介孔碳)、活性炭以及碳纤维。在一个实施方案中,使用具有大比表面积的碳材料。可以使用具有约1ml/g的孔体积的材料。在另一种情况下,可以通过将tmdc与导电材料(例如superp品牌的炭黑)和粘合剂(例如ptfe)混合,继而涂在集电器(例如铝网)上来制备阴极。这些元素的比率一般可以变化。在各种实施方案中,含tmdc的阴极材料(例如被涂覆到集电器上的材料)包括至少10重量%、至少20重量%、至少50重量%、至少70重量%、10重量%-99重量%、20重量%-99重量%、50重量%-99重量%、10重量%-95重量%、20重量%-95重量%、50重量%-95重量%、10重量%-70重量%、20重量%-70重量%、40重量%-70重量%或70重量%-99重量%的tmdc。在某些实施方案中,它可以是95重量%的tmdc、4重量%的ptfe粘合剂以及5重量%的superp;或50重量%的tmdc、40重量%的ptfe粘合剂以及10重量%的superp。
可以任何方便的厚度,例如以最多1000μm的厚度将含tmdc的材料涂覆到集电器上。整个阴极理想地具有一定的孔隙度以使得可以向tmdc材料提供氧气。
使用包括多孔衬底的阴极的金属-空气蓄电池的一种特定的构造示于图2中。蓄电池81包括阴极82和阳极83。阴极82包括多孔构件86,所述多孔构件86具有被设置在其表面上的过渡金属二硫属化物85。多孔构件86允许空气扩散穿过到电解质/tmdc界面。阳极和阴极可以连接到外部电路(例如待由蓄电池供电的电路、或提供电位以为蓄电池充电的电路)。
本领域技术人员将能够优化阴极处存在的气体扩散材料中存在的tmdc的量。
如上所述,在本公开的装置和方法中,电解质包含至少1%的离子液体。本领域技术人员还将认识到的是,术语“离子液体”指的是在标准温度和压力(25℃、1atm)下呈液态的离子物质(即阳离子和阴离子的组合)。在某些实施方案中,所述离子液体是包含至少一个带正电荷的氮、硫或磷基团(例如磷
离子液体的具体实例包括但不限于以下各项的盐中的一种或多种:乙酰胆碱、丙氨酸、氨基乙腈、甲基铵、精氨酸、天冬氨酸、苏氨酸、氯甲脒
在一些实施方案中,本公开的离子液体可以是咪唑
在某些实施方案中,本公开的离子液体包括但不限于咪唑
其中r1-r12独立地选自由以下各项组成的组:氢、-oh、直链脂族c1-c6基团、支链脂族c1-c6基团、环状脂族c1-c6基团、-ch2oh、-ch2ch2oh、-ch2ch2ch2oh、-ch2chohch3、-ch2coh、-ch2ch2coh、以及-ch2coch3。
在某些实施方案中,本公开的方法和金属-空气蓄电池的离子液体是下式的咪唑
其中r1、r2以及r3独立地选自由以下各项组成的组:氢、直链脂族c1-c6基团、支链脂族c1-c6基团、以及环状脂族c1-c6基团。在其它实施方案中,r2是氢,并且r1和r3独立地选自直链或支链c1-c4烷基。在具体实施方案中,本公开的离子液体是1-乙基-3-甲基咪唑
当然,并不是每一种与o2-形成络合物的物质都将用作离子液体。当中间体与离子液体结合时,所述中间体的反应性降低。如果所述中间体与离子液体过强地键合,那么所述中间体将变成无反应性的,因此所述物质将不会有效。本领域普通技术人员将了解的是,这可以对用作离子液体的物质提供关键的限制,并且将相应地选择离子液体。
一般来说,本领域技术人员可以如下确定给定的离子液体是否是由tmdc催化的反应(r)的助催化剂:
(a)将标准3电极电化学电池填充以通常用于反应r的电解质。常见的电解质包括诸如0.1m硫酸或也可以使用0.1mkoh的水溶液;
(b)将tmdc安装到3电极电化学电池和适当的反电极中;
(c)运行几次cv循环以清洁电池;
(d)测量电解质中的可逆氢电极(rhe)电位;
(e)将反应r的反应物加入电池中,并且测量反应r的cv,从而记录与反应r相关的峰的电位;
(f)计算vi,所述vi是与反应相关的峰的起始电位与rhe之间的差异;
(g)计算via,所述via是与反应相关的峰的最大电位与rhe之间的差异;
(h)将0.0001重量%至99.9999重量%的离子液体添加到电解质中;
(i)测量与离子液体的反应的rhe;
(j)再次测量反应r的cv,从而记录与反应r相关的峰的电位;
(k)计算v2,所述v2是与反应相关的峰的起始电位与rhe之间的差异;以及
(l)计算v2a,所述v2a是与反应相关的峰的最大电位与rhe之间的差异。
如果在所述离子液体的任何浓度(例如0.0001重量%至99.9999重量%)下v2<v1或v2a<via,那么所述离子液体是所述反应的助催化剂。
在一些实施方案中,所述离子液体在如下范围内存在于电解质中:水溶液的约50重量%至约100重量%、或约50重量%至约99重量%、或约50重量%至约98重量%、或约50重量%至约95重量%、或约50重量%至约90重量%、或约50重量%至约80重量%、或约50重量%至约70重量%、或约50重量%至约60重量%、或约80重量%至约99重量%、约80重量%至约98重量%、或约80重量%至约95重量%、或约80重量%至约90重量%、或约70重量%至约99重量%、约70重量%至约98重量%、或约70重量%至约95重量%、或约70重量%至约90重量%、或约70重量%至约80重量%、或约50重量%、或约70重量%、或约80重量%、或约90重量%、或约95重量%、或约96重量%、或约97重量%、或约98重量%、或约99重量。在某些实施方案中,所述离子液体在以下范围内存在于电解质中:约75重量%至约100重量%、或约90重量%至约100重量%。在一些其它实施方案中,所述离子液体以约90重量%存在于电解质中。在其它实施方案中,电解质基本上由离子液体组成。
在某些实施方案中,电解质还可以包括水或其它水溶液、溶剂、缓冲溶液、体系的组分的添加剂、或与体系中催化剂中的至少一种结合的溶液。一些合适的溶剂包括但不限于单独或呈任何组合形式的二氧戊环、二甲亚砜(dmso)、四甘醇二甲醚(tegdme)、碳酸二甲酯(dmc)、碳酸二乙酯(dec)、碳酸二丙酯(dpc)、碳酸乙酯甲酯(emc)、碳酸亚乙酯(ec)、碳酸亚丙酯(pc)、四氢呋喃(thf)、碳酸亚丁酯、内酯、酯、甘醇二甲醚、亚砜、环丁砜、聚氧化乙烯(peo)以及聚丙烯腈(pan)。在某些实施方案中,水或非离子液体有机溶剂以如下量存在:少于约40重量%、少于约30重量%、少于约20重量%、少于约10重量%、少于约5重量%、或甚至少于约1重量%。在某些实施方案中,电解质基本上不含水或非离子液体有机溶剂。
在某些实施方案中,电解质还可以包含其它物质,如酸、碱以及盐。举例来说,电解质可以包括阳极的金属的盐(例如当阳极包括金属锂时,电解质可以包括锂盐,如高氯酸锂、双(三氟甲磺酰)亚胺锂、六氟磷酸锂、三氟甲磺酸锂、六氟砷酸锂等)。在某些实施方案中,阳极的金属的盐以如下范围的浓度存在:约0.005m至约5m、约0.01m至约1m、或约0.02m至约0.5m。这样的其它物质的包括对于本领域普通技术人员来说将是明显的,这取决于电解质的所期望的电化学和物理化学特性,并且不意图限制本公开的范围。
本公开的金属-空气蓄电池可以任选地包括膜(例如被设置在阳极与阴极之间)。对于本领域普通技术人员来说,膜没有特别的限制。举例来说,可以使用聚合物非织造织物,如聚丙烯非织造织物或聚苯硫醚非织造织物、烯烃树脂的微孔膜,如聚乙烯或聚丙烯、或其组合。本领域技术人员将认识到的是,膜是否可能用于本公开的装置和方法中,这取决于所期望的用途。
所述装置可以任选地包括膜(例如被设置在阳极与阴极之间,未示),如许多电化学电池中常见的那样;在这种情况下,在膜的任一侧上的电解质被认为与阳极和阴极这两者接触。因此,在具有膜的装置中,在阴极侧的电解质应当包括离子液体;在阳极侧的电解质中不需要包括离子液体。然而,含离子液体的电解质与tmdc直接接触。
金属空气蓄电池可以被容纳在任何所期望的壳体或外壳(未示)中。举例来说,常规用作蓄电池的外部材料的材料,如金属罐、树脂或层压包装可以用作本公开的金属-空气蓄电池的外部材料。所述外部材料可以包括其中形成的与tmdc处于流体连通的孔,氧气穿过所述孔被供应到蓄电池。举例来说,所述外部材料可以具有与阴极的多孔构件处于流体连通以允许空气接触tmdc的孔。
有利的是,本公开的实施方案中所用的氧气可以从任何来源获得,例如干燥空气、纯氧、或大气空气。因此,本文所公开的金属-空气蓄电池也可以被表征为“金属-o2蓄电池”。在某些实施方案中,本公开的金属-空气蓄电池可以包括氧气渗透膜。氧气渗透膜可以被设置在阴极上与电解质相对的侧面上并且与空气接触。作为氧气渗透膜,例如可以使用允许空气中的氧气通过并且可以防止水分进入的防水多孔膜(例如聚酯或聚苯硫醚的多孔膜)。防水膜可以被单独设置。
本文所述的金属-空气蓄电池可以单独或组合使用,并且可以被集成到各种系统或装置中或与各种系统或装置集成以在广泛应用中提高效率并且解决能量需求。举例来说,金属-空气蓄电池可以用于大型系统和装置(例如kw范围的功率电平)中,其中改进金属-空气蓄电池的环境方面可以提供性能的显著增长(例如以高效率进行能量转换和储存)。同样,金属-空气蓄电池可以用于更小的系统(w范围的功率电平)中,其中消费类电子产品的进步提供了以所期望的尺寸提供并且具有相对长的寿命的能量转换和储存的机会。
本公开的金属-空气蓄电池可以用于例如助听器、耳机(例如蓝牙或其它无线耳机)、手表、医疗装置、照相机、便携式音乐播放器、膝上型计算机、电话(例如蜂窝电话)、玩具、以及便携式工具中。金属-空气流蓄电池可以提供用于调峰、负载均衡、以及备用电源(例如用于可再生能源,如风能、太阳能、以及波能)的能量储存和转换解决方案。本公开的金属-空气蓄电池还可以用于为电动车辆(例如混合电动车辆、插电式混合电动车辆、纯电动车辆等)提供原动力、为蓄电池提供备用电源(例如作为范围扩展器)、为车辆内的诸如电子器件、gps/导航系统、无线电设备、空调等的其它车辆电负载提供电力、以及提供车辆内任何其它电力需求。
本公开的金属-空气蓄电池的形状没有特别的限制,只要它具有氧气进气孔即可。金属-空气蓄电池可以具有任何所期望的形状,如圆柱形、棱柱形、立方形、钮扣状、硬币状或扁平形。本公开的金属-空气蓄电池可以形成蓄电池组、模块、或系统。本公开的金属-空气蓄电池可以用作二次蓄电池并且可以用作一次蓄电池。
本公开的一些实施方案提供了能够被完全充电和完全放电至少约20次循环的金属-空气蓄电池。在其它实施方案中,这一稳定性可以维持超过约50次循环、超过约100次循环、超过约200次循环、超过约240次循环、超过约500次循环、超过约750次循环、或超过约1000次循环。
在某些实施方案中,可以在本公开的蓄电池中实现高电流密度。举例来说,在某些实施方案中,放电的电流密度是至少约0.1ma/cm2、或至少约0.5ma/cm2、或至少约1ma/cm2、或至少约2ma/cm2、或至少约3ma/cm2、或至少约4ma/cm2、或至少约5ma/cm2、或至少约10ma/cm2。在一个实施方案中,电流密度是约1ma/cm2至约20ma/cm2、或约1ma/cm2至约10ma/cm2、或约3ma/cm2至约10ma/cm2、或约5ma/cm2至约10ma/cm2、或约5ma/cm2至约20ma/cm2、或约5ma/cm2至约30ma/cm2。
本文所述的金属-空气蓄电池和方法可以在多种压力和温度下操作,并且本领域技术人员将能够优化这些条件以实现所期望的性能。举例来说,在某些实施方案中,本公开的金属-空气蓄电池和方法在以下范围的压力下操作:约0.1atm至约2atm、或约0.2atm至约2atm、或约0.5atm至约2atm、或约0.5atm至约1.5atm、或约0.8atm至约2atm、或约0.9atm至约2atm、约0.1atm至约1atm、或约0.2atm至约1atm、或约0.3atm至约1atm、或约0.4atm至约1atm、或约0.5atm至约1atm、或约0.6atm至约1atm、或约0.7atm至约1atm、或约0.8atm至约1atm、或约1atm至约1.5atm、或约1atm至约2atm。在一个具体的实施方案中,本公开的金属-空气蓄电池和方法是在约1atm的压力下运行的。在其它实施方案中,本公开的金属-空气蓄电池和方法在以下范围内的温度下操作:约0℃至约50℃、或约10℃至约50℃、或约10℃至约40℃、或约15℃至约35℃、或约20℃至约30℃、或约20℃至约25℃、或约20℃、或约21℃、或约22℃、或约23℃、或约24℃、或约25℃。在一个具体的实施方案中,本公开的金属-空气蓄电池和方法在约20℃至约25℃的温度下操作。
本领域普通技术人员将了解的是,本文所述的阴极材料在其它应用中可用作电子材料。因此,本公开的另一个方面是一种电子材料,所述电子材料包括至少一种过渡金属二硫属化物以及与所述过渡金属二硫属化物接触(例如直接接触)的电解质,所述电解质包含至少1%(例如至少10%、至少20%、至少30%或至少50%)的离子液体。过渡金属二硫属化物可以在固相中,所述固相包括例如至少10重量%、至少20重量%、至少50重量%或至少70重量%、10重量%-99重量%、20重量%-99重量%、50重量%-99重量%、10重量%-95重量%、20重量%-95重量%、50重量%-95重量%、10重量%-70重量%、20重量%-70重量%、40重量%-70重量%或70重量%-99重量%的过渡金属二硫属化物。所述离子液体和过渡金属二硫属化物可以如对于上述任何实施方案所述。所述电子材料可以如对于本文所述的任何阴极材料所述。
进一步通过以下实施例来说明本公开的方法和装置,所述实施例证实mos2纳米片在离子液体1-乙基-3-甲基咪唑
实验方法
mos2纳米片合成:使用修改的液体剥离方法来合成mos2纳米片。简单地说,将300mgmos2粉末(阿法埃莎公司(alfaaesar))分散于60ml异丙醇中,并且使用超声处理探针(vibracellsonics130w)超声处理20小时。
mos2表征:通过进行扫描透射电子显微镜术(stem)和扫描电子显微镜术(sem)实验在微观和原子尺度上将mos2纳米片的形态可视化。使用装备有200kv冷场发射枪的探针校正的jeoljem-arm200cf进行stem实验。在高角度或低角度环形暗场(h/laadf)中获取mos2纳米片图像,其中前者提供约z2对比度,而后者对更低角度散射更灵敏。使用14mrad探针会聚角进行成像,其中haadf和laadf检测器角度分别被设置为54mrad-220mrad和24mrad-96mrad。对于stem实验,通过铜网(200目,购自electronmicroscopysciences公司)将mos2纳米片于稀释溶液中的液滴直接沉积在具有2μm圆孔的
动态光散射(dls)测量:使用nicompzls380系统在25℃进行dls粒度测量。所述仪器包括具有670nm发射的35mw半导体激光器和用于样品的热电温度控制器。使用分散于异丙醇中的mos2纳米片进行dls实验。dls数据中的典型误差是约5%-8%。
拉曼光谱法:为了检测mos2在平面内和平面外的声子模式,通过使用renishawraman2000仪器记录拉曼光谱。通过使沉积在硅衬底上的mos2纳米片(没有经过任何特定的处理)暴露于514nm激光束(ar激光器,功率:10mw以及光点尺寸:10μm)来获得光谱。对于li-o2蓄电池系统的放电产物分析,将所有样品用碳酸二甲酯冲洗以洗掉所有的杂质并且直接放置在定制的电池中,在拉曼光谱法实验之前将所述电池良好密封。使用horibalabramhrevolution共焦拉曼显微镜获取拉曼光谱。所述仪器配置有785nm激光源、1200g/mm光栅、horibasynapseoeccd检测器、以及50×或100×物镜。在样品处的激光功率是1mw-15mw。在来自tedpella公司的si(111)片上进行校准。选择积分时间和平均参数来使信噪比达到最大,同时使任何样品降解减到最低限度。
电化学实验:为了研究mos2纳米片对氧还原反应和析氧反应的催化活性,在标准的三电极电化学电池中进行电化学实验。图3是三电极电池的示意图。所述电池是由工作电极(we)、反电极(ce)以及参比电极(re)构成的,并且所述电极被浸入具有0.1m双(三氟甲磺酰)亚胺锂(litfsi)作为锂盐的电解质中。将所述电池适当密封并且连接到恒电位仪以进行电解表征。使用li线(99.9%金属基,阿法埃莎公司)作为反电极。使用质量流量控制器(sierra公司,针对o2气体校准),基于流速(约0.2ml/min-0.4ml/min),使用1mm直径的玻璃管将气体(氩气或o2)鼓泡到溶液中,持续所需的时间(例如30分钟-60分钟)以确保在实验之前将电解质用o2饱和。在实验期间还继续进行氧气鼓泡,连同搅拌一起以使质量传递的影响减到最低限度。所有实验是在填充ar的手套箱中进行的。为了制备阴极电极,将0.3mg催化剂(根据实验,合成的mos2纳米片、pt纳米颗粒以及au纳米颗粒,每一种均分散于异丙醇中)逐层涂覆到作为气体扩散层(gdl)的1.5cm2toray碳纸(tgp-h-030,购自fuelcellsetc公司)上并且在真空室中在120℃干燥24小时。使用锂线(99.9%金属基,阿法埃莎公司)作为反电极。1-乙基-3-甲基咪唑
蓄电池实验:所有的蓄电池实验均是在定制的世伟洛克型蓄电池设置中进行的。图4是电池的示意性分解图。所述电池具有沉积在多孔碳气体扩散层上的mos2纳米片作为阴极;锂片作为阳极;铝网作为载体和集电器这两者;以及在具有0.1mlitfsi作为锂盐(蓄电池级,西格玛奥德里奇公司)的emim-bf4电解质(hplc级,西格玛奥德里奇公司)中饱和的玻璃碳纤维滤纸。使用玻璃碳纤维作为隔板以避免阴极与阳极之间的直接接触。将0.3mg的mos2纳米片(分散于异丙醇中)逐层涂覆到1.5cm2气体扩散层(gdl)上并且在真空室内在120℃干燥24小时以去除所有杂质。将蓄电池设置在填充ar的手套箱中组装并且转移到密封的o2室中以进行电化学测量。为了消除寄生反应的影响,将腔室用纯o2吹扫以去除所有气体杂质。通过以恒定电流密度(例如0.1ma/g)进行电流测定实验以检查电化学极化间隙来研究组装的li-空气蓄电池的充电-放电曲线。通过以恒定电流速率将充电-放电实验运行不同的循环次数(最多50次循环)来研究蓄电池容量和可循环性。
x射线衍射(xrd)光谱法:为了鉴定反应产物,使用rigakuatx-g薄膜衍射工作站来收集xrd谱。类似于拉曼光谱法实验,在xrd实验之前,将所有的样品用碳酸二甲酯冲洗以去除所有杂质并且放置在良好密封的定制的电池中。将高强度18kw铜x射线旋转阳极源联接到多层镜面。所述系统具有适用于利用单晶、薄膜或多晶膜样品工作的可选择的x射线光学配置。使用0.05宽度和10度/分钟扫描速率,以20°与80°之间的角度,在放电过程之前和之后对催化剂样品进行2θ-ω扫描和记录。还进行校准和对准扫描以在测量之前使光谱的强度达到最大。
能量色散x射线(edx)光谱法:在具有装备有si(li)检测器的集成oxfordazteceds系统的feiquantaesem仪器上获得edx谱。以15kv加速电压和10mm工作距离获取图谱。绘制与523ev处的谱峰相关的氧图谱。
计算细节:为了研究离子液体(emim-bf4)在使用mos2纳米片的li-o2蓄电池的电催化反应中的作用,特别是对于o2-*形成的作用,使用平面波基组进行密度泛函理论(dft)计算,所述计算是在vasp包中实施的。使用单层mos2纳米带来模拟在mos2纳米片的mo边缘上发生的相互作用。由优化的mos2单位晶胞(晶格常数:
mos2表征
沉积在气体扩散层(gdl)衬底上的合成态mos2nf的扫描电子显微镜术(sem)图像作为图5(a)提供。更高放大倍率的sem图像(图5(a)的插图,比例尺=100nm)进一步显示沉积的催化剂的表面形态,从而确认mos2纳米片是高度堆积的和无规定向的。还进行动态光散射(dls)实验以确定合成态纳米片的尺寸。图5(b)的dls分析表明合成的mos2纳米片的基本上均匀的尺寸分布,具有窄的尺寸范围(110nm-150nm,约1层-10层厚),其中平均纳米片尺寸(即沿主要表面)是135nm。图5(b)的插图提供了合成的纳米片的拉曼光谱,在300cm-1与500cm-1之间表现出两个不同的mos2峰。约382cm-1处的第一峰由于e12g声子模式(平面内)而出现,并且约409cm-1处的第二峰对应于mos2的a1g模式(平面外)。
通过进行高分辨率扫描透射电子显微镜术(stem)实验在原子尺度上进一步对mos2nf进行表征。图5(c)是蕾丝碳膜上支撑的具有约200nm×150nm的尺寸的mos2纳米片的低放大倍率低角度环形暗场(laadf)图像。从相同的mos2纳米片获取的典型六方选区电子衍射(saed)图(图5(c)的右上方插图)揭示了它无缺陷以及单相结晶层结构。此外,对应于从真空描绘到成像的纳米片上的中心的谱线的强度轮廓显示与单层、双层以及三层mos2相关的台阶(图5(c)的底部插图)。还对合成的单层mos2纳米片的边缘状态进行成像。如图5(d)中所示,mos2纳米片的边缘沿(100)和(010)晶面封端,其中mo原子构成了边缘。
随后,获取单层和多层纳米片的平面结构上的硫l-边缘以及单层mos2的边缘的电子能量损失谱(eels)。通常,162ev能量损失处的预峰强度与从s2p3/2初始状态跃迁到导带和具有可用电荷载流子的密度的尺度有关。参见图5(e)。图5(f)示出了作为mos2的层数的函数以及单层mos2的边缘处的归一化的峰强度。结果表明在单层的mo边缘处降低到接近1/10,而随远离边缘的mos2层的变化没有明显的差异。这一测量结果提供了直接证据表明在mo边缘处有非常高的电子密度,这被认为是电化学反应的负责位点。
mos2/il体系的电化学表征
对于电化学实验,经由将合成的mos2纳米片逐层涂覆到气体扩散层(gdl)上来制备样品。最初,在标准三电极电化学电池中研究mos2纳米片的orr和oer性能,其中使用于离子液体(在此,是1-乙基-3-甲基咪唑
基于所记录的orr和oer电流密度以及与先前报道的催化剂性能的比较,mos2纳米片/离子液体体系提供了对于orr和oer这两者特别最高效的体系。在此,应当指出的是,高极性以及o22-和o2在离子液体中形成o2-*的归中反应的低δg值(吉布斯自由能(gibbsfreeenergy)-61.7kj/mol)可以允许更稳定的中间络合物。此外,mo边缘原子上高密度的电子促进所观测到的优越的orr性能。
绘制最大orr和oer电流密度对扫描速率的平方根的曲线以研究反应的可逆性。如图6(b)中所示,orr和oer电流密度相对于扫描速率的平方根线性增加,这表明这两个反应在这一体系中是可逆的。电流密度比orr/oer相对于扫描速率的平方根保持恒定的事实提供了进一步的证据表明所述反应的可逆性。
相反,如图6(c)中所示,mos2纳米片的催化性能在二甲亚砜(dmso)和四甘醇二甲醚(tegdme)中相对不良,二甲亚砜和四甘醇二甲醚是li-o2蓄电池系统中常用的电解质。在mos2纳米片/dmso的情况下,在2.0v和4.2v的电位下分别仅记录到-0.75ma·cm-2(orr)和1.2ma·cm-2(oer)的电流密度。对于mos2纳米片/tegdme体系,在相同电位下orr和oer这两者的电流密度也仍低于0.5ma·cm-2。这些结果表明mos2纳米片和离子液体对于orr和oer这两者的强协同作用。在dmso和tegdme中不良的性能归因于它们更小的溶剂受体数(an)或极性以及o22-和o2形成o2-*的归中反应的高δg值,这阻止了稳定o2中间体的形成。
为了排除活性边缘原子在orr和oer中的作用,在相同的实验条件下对mos2纳米颗粒进行电化学实验。选择类似尺寸的mos2纳米片和mos2纳米颗粒以消除尺寸影响。图2(d)示出了mos2纳米颗粒表现出3ma/cm2的orr电流密度和1ma/cm2的oer电流密度。在2v和4.2v,mos2nf的orr电流密度和oer电流密度分别是mos2纳米颗粒的那些的超过三倍和五倍。在mos2纳米片中,orr还从可忽略不计的过电位(接近2.96v)开始,相比之下,对于mos2纳米颗粒观测到大的过电位(0.5v)。
在相同的实验条件下用pt纳米颗粒(100nm)和au纳米颗粒(120nm)在o2饱和的离子液体中进行另外的电化学实验。图7(a)表明mos2纳米片的orr表观活性超过铂纳米颗粒(约7ma/cm2)和金纳米颗粒(4.5ma/cm2)的orr表观活性。它也高于先前对于许多其它先进的催化剂,如金属氧化物(例如mn3o4)、贵金属(例如au和pd)、以及掺杂或官能化的碳纳米材料(例如n型掺杂石墨烯)所报道。此外,图7(b)中所示的oer结果明确证实了mos2纳米片在从3.0v的热力学电位到4.2v的范围的所有电位下相对于pt纳米颗粒和au纳米颗粒的优越性。应当指出的是,在4.2v,对于mos2nf所记录的oer电流密度(5.04ma/cm2)比au纳米颗粒(0.3ma/cm2)和pt纳米颗粒(0.5ma/cm2)的oer电流密度高出超过1个数量级。在相同的电位下,mos2nf的这一性能也显著高于钙钛矿纳米颗粒(1.0ma/cm2)和高活性介孔钙钛矿纳米线(4.6ma/cm2)。
还使用粗糙度因数(rf)基于活性边缘位点的数目来对mos2纳米片以及铂纳米颗粒和金纳米颗粒的实际催化活性进行表征。mos2中计算的活性位点数比au和pt要低得多。然而,对于大范围的过电位,mos2/离子液体对于orr的转换频率(tof)与pt/il和au/il催化剂相比具有高出约2个数量级的值,如图7(c)中所示。为了研究溶剂的影响,在不同的电解质,即离子液体、dmso以及tgdme中对mos2纳米片进行类似的计算。如图7(d)中所示,在低范围的过电位下,与dmso和tgdme相比,在离子液体电解质中获得超过三倍的tof。然而,在高过电位下,在离子液体中获得比在其它电解质中高出约1个数量级的tof。
这些结果证实在离子液体中的mos2纳米片是对于orr和oer这两者高活性的催化剂体系。
为了解决体系的长期效率,监测orr和oer性能直到750次循环伏安法(cv)循环(约22小时),然后进行元素分析。图7(e)示出了在2v下orr电流密度的趋势。在750次连续cv循环之后仅观测到orr电流密度有6.5%的损失,这可能是归因于li盐浓度由于li的消耗而降低。这表明了我们的催化剂有非常高的稳定性。在cv实验之前以及在750次循环之后对mos2纳米片进行的x射线光电子光谱法(xps)实验(参见图7(e)的插图)也确认了所述催化剂的稳定性。在750次cv循环之后获得的mos2纳米片的xps谱由类似的峰组成,所述峰在峰位的结合能上有小的偏移,这可能是归因于嵌入的li原子的存在或mos2相态的微不足道的变化,如先前所报道。然而,mo6+3d5/2峰的强度(约236.4ev)仍然很低,这确认了mos2纳米片在orr和oer循环期间基本上没有被氧化。
在li-o2蓄电池中mos2纳米片/离子液体体系的性能
上文所述的研究证实了在三电极电化学系统中mos2纳米片的高双功能性和长期稳定性。随后在li-o2蓄电池中测试mos2纳米片/离子液体阴极/电解质体系。为了研究这一点,使用于离子液体中0.1m的litfsi和不含碳的(即不使用superp或粘合剂)mos2纳米片阴极组装世伟洛克型电池(图4)。这一配置避免了由于superp碳粉所致的任何影响,所述superp碳粉也已知为li-o2蓄电池系统的活性催化剂。图8(a)提供了如通过以0.1ma/cm的电流密度进行容量限制(500mah/g)的循环直到50次循环所测试的这种mos2纳米片/离子液体体系的放电和充电曲线。放电(在第1次循环时)从2.90开始,并且在电位2.69v获得目标放电容量(500mah/g)。充电过程也在3.49v的电位完成。
极化间隙是li-o2蓄电池的另一个重要的参数,这是因为较低的极化间隙会导致较高的往返能量效率。在500mah·g-1的容量(相对于mos2质量归一化)下,mos2纳米片/离子液体体系的极化间隙是0.8v,这在10次循环之后增加到0.85。这与对于以0.04ma/cm(与本文所述的体系的0.1ma/cm2相比)的电流密度所测试的基于au-pt纳米颗粒的li-o2蓄电池所报告的约0.8v的间隙相当。此外,mos2纳米片/离子液体体系的结果类似于对于沉积在al2o3钝化superp炭黑上的pd纳米颗粒所获得的结果。对于相同的容量(500mah/g),基于pd的催化剂的极化间隙在10次循环期间从0.55v增加到0.9v。mos2纳米片/离子液体阴极/电解质体系也具有比其它体系,如基于tic(1.25v)和金属介孔烧绿石(1.5v)的li-o2蓄电池在它们的最佳实验条件下的极化间隙低的极化间隙。
图8(a)还示出了作为循环次数的函数的放电和充电电位的变化。放电电位(约20mv)和充电电位(约120mv)从第2次循环到第50次循环有小幅增加,表明了orr产物的可逆形成/分解以及mos2纳米片/离子液体体系的高稳定性。此外,基于2.7v截止电位,mos2纳米片/离子液体体系的放电容量保持率在第2次循环与第50次循环之间是约8%。这种助催化剂体系还显示出第1次循环的非常高的往返效率(约85%),这在50次循环之后略微下降到约80%。在50次循环之后的故障可能是因为锂阳极因o2的跨越而被腐蚀,这是因为在50次循环之后阳极变成黑色。
还将更深的放电和充电性能与在相同电解质中的au纳米颗粒和pt纳米颗粒相比较。结果表明mos2纳米片/离子液体体系的完全可逆的放电和充电,其中au纳米颗粒和pt纳米颗粒只能再充电它们的总容量(分别是1450mah/g和1000mah/g)的40%(约600mah/g)和50%(约500mah/g)。此外,在500mah/g容量下,已经对于au纳米颗粒和pt纳米颗粒观测到比mos2纳米片/离子液体体系宽约1.0v的极化间隙。此外,蓄电池的更深的放电和充电实验显示mos2纳米片在离子液体中的性能比在dmso中的性能高得多。结果表明mos2纳米片/离子液体的容量(约1250mah/g)是mos2纳米片/dmso的容量(约85mah/g)的将近15倍。这可以归因于优越的活性并且在离子液体电解质中mos2纳米片的可逆性与我们的cv结果相一致。
为了研究在mos2纳米片/离子液体体系中放电产物的形态,在放电过程之前和之后对阴极表面进行sem(图8(b)和(c))。sem图像表现出膜样特性以及表面上一定的纳米颗粒形态。放电阴极的能量色散x射线(edx)o2相图像进一步确认了在阴极表面上存在富氧的积聚颗粒。
随后,通过施加0.1ma·cm-2的电流密度并且定量产物对第1次、第20次、以及第50次充电过程进行差示电化学质谱分析(dems)实验。图8(d)显示o2信号的立即上升,这确认了o2分子由于放电产物(li2o2)分解而析出。然而,h2和co2的信号保持小和不变。对于整个充电过程观测到这些结果直到达到截止容量(500mah/g)为止。此外,在第1次、第20次以及第50次充电过程期间,计算的荷质比(约2e-/o2)保持几乎恒定,相对于第1次循环有±4%的变化。这些结果不仅表明在充电过程期间发生li2o2的分解,而且还表明基于mos2纳米片/离子液体的li-o2蓄电池直到50次循环的高可循环性和稳定性。计算还表明在放电过程期间产生83.8μg的li2o2,这非常接近于它的理论值(86μg),进而再次确认了li2o2是主要的放电产物。
在第1次放电循环和第1次、第20次以及第50次充电循环结束时进行拉曼光谱法以进一步研究电池的稳定性和可循环性。图8(e)提供了在放电过程之前和之后阴极的拉曼光谱,它是相对于石墨g谱带峰归一化的。在放电阴极的光谱中清楚地看到250cm-1处与li2o2相关的新的峰。然而,788cm-1处li2o2的第二特征峰干扰了在相同位置处的催化剂峰,但是它的强度似乎大于未放电的阴极的强度。此外,在拉曼实验中没有观测到作为中间产物的lio2(1123cm-1)、或li2co3(1088cm-1)的峰。在第20次和第50次充电循环之后获得类似的结果。
还对原始阴极表面和放电阴极表面进行x射线衍射(xrd)分析以进一步阐明产物的晶体结构;结果提供于图8(f)中。xrd谱分别在33°、35°、49°以及58°表现出对应于li2o2的(100)、(101)、(103)以及(110)晶体表面的尖峰。在第1次充电循环之后这些峰完全消失。这些结果也对于第20次和第50次循环重复,这进一步确认了(i)li2o2形成和它的完全分解是主要的放电产物;以及(ii)在50次循环之后电池的高可循环性和稳定性。
密度泛函计算
进行密度泛函理论(dft)计算以提供对在放电期间mos2/离子液体体系的机制理解。先前的研究已经表明li-o2蓄电池的放电产物形成的第一步骤涉及阴极处氧气的还原:
o2+*→o2*(阴极)(1)
e-+o2*→o2-*(阴极)(2)
其中阴极上的初始反应是o2结合到电极的表面上,继而还原以形成吸附物质o2-*(方程式1、2)。在氧气还原之后可以发生各种可能的反应步骤。一种情况是在初始氧气还原之后与li+阳离子反应以及另外的电子转移,这些全部是在阴极表面上发生的,从而引起li2o2的生长。另一种情况是基于通过溶液的机制,其中o2-解吸到电解质中并且溶液相反应引起放电产物形成。在这种情况下,li2o2可以通过在溶液中或在表面上lio2的歧化(方程式3)而形成。
2lio2→li2o2+o2(3)
o2-*的形成(方程式(1)和(2))在决定氧气还原发生的速率以及因此放电过程的效率方面是重要的。因此,在这一计算研究中,将重点放在使用dmso和离子液体作为电解质在mos2纳米片上o2-*的形成以提供对实验结果的深入了解。
在dmso或离子液体存在下o2吸附到mos2纳米片上的反应途径示于图9中。如该图中所示,在dmso电解质中,o2分子吸附到mos2纳米片(作为mos2纳米带建模)的暴露的mo边缘上使得o2分子直接解离以在mo边缘上形成两个结合的o原子,而没有能垒(图9,状态5或状态6)。这一解离吸附反应是非常有利的,其中计算的吸附能是-8.0ev。基于所述计算,在mo边缘上发生持续的o2分子解离,并且最终产生完全氧化的mo边缘(图9,状态8)。高度稳定的、完全氧化的mo边缘不会结合另外的o2分子并且因此,不会非常有利于氧气还原。然而,在一些情况下,在mo边缘仅被部分氧化的情况下,mo边缘可以与另外的o2分子结合(图9,状态6),从而在电荷转移的情况下形成o2-*(图5,状态7)。然而,热力学将朝向mo边缘的完全氧化驱动反应并且使催化剂中毒(图9,状态8)。
另一方面,使用离子液体作为电解质可以有效地防止o2在电极上解离(图9,状态1至3)。先前,计算研究和实验研究这两者已经证实离子液体离子在电化学条件下表现出与电极表面的强吸引性相互作用。一般来说,离子液体的阳离子由阴极吸引,而阴离子由阳极吸引。在本dft研究中,将(emim++e-)对添加到mo边缘以模拟emim+在mos2电极上的电化学吸附,并且保持计算体系呈中性。dft计算显示emim+离子有可能以平行于mo边缘的emim+环与mos2纳米片结合,并且每一个emim+离子与两个mo原子结合。计算的状态密度显示在额外的电子存在下emim+离子与mo边缘之间的强相互作用,这有利于mo边缘在放电过程期间基本上由emim+离子覆盖。由于吸附过程的随机性和在边缘上相邻emim+离子的空间排斥,因此emim+覆盖中的间隙产生边缘上暴露的隔离的mo原子。然而,为了发生o2解离,每一个o2分子需要至少两个邻近的mo原子。隔离的mo位点(图9,状态2)将仅引起o2结合而没有解离(图9,状态3),这形成o2-*。基于这些计算,离子液体(emim+离子)与mos2纳米片之间的强静电相互作用倾向于阻止mo边缘上完全的o2解离,并且引起氧还原位点o2-*的形成。
在o2-*形成之后,研究emim-bf4电解质中li2o2形成的机制。在基于mos2/离子液体的li-o2蓄电池中,上述第一种情况,即表面生长机制是不可能的。原因是催化剂活性位点,即mos2纳米片的mo边缘原子将因块状li2o2的生长而被阻挡和失活,这由于电池的优良性能而是非常不可能的。另一方面,第二种情况,即通过溶液的机制是可能的,这是因为它不一定阻挡催化位点。因此,使用dft计算来研究第二种情况中的一些步骤;其它方面,如成核和生长超出了本研究的范围。o2-超氧化物阴离子被计算为在emim-bf4中通过大的溶剂化能(3.03ev)而稳定。这也与emim-bf4的高gutman受体数(an)(33.5)相一致,这表明了o2-在离子液体溶液中的高稳定性。因此,在催化剂活性位点上形成o2-之后,它可以由于强溶剂化效应而解吸到emim-bf4电解质中。下一步是在离子液体中溶剂化的li+和o2-形成溶剂化的lio2(li++o2-→lio2),这被计算为在热力学上是有利的,反应自由能是-2.49ev。然后,两个溶剂化的lio2分子可以形成(lio2)2二聚体,其中二聚化能是-0.48ev(参见图10)。(lio2)2二聚体可以歧化而以0.25ev的小能垒形成li2o2(图10)。由于li2o2不是高度可溶的,因此很可能li2o2然后通过成核和生长而沉积在电极上并且进一步结晶。上述的dems结果确认了li2o2是主要产物,这与通过dft计算建模的放电机制相一致。
因此,提出mos2/离子液体组合用作助催化剂,由此离子液体通过阻止边缘的氧化并且促进o2-的溶解来促进mos2纳米片的催化特性。li2o2的形成在这一体系中有可能经历通过溶液的机制。非质子电解质dmso和tegdme的较差性能确认了由理论对mos2/离子液体组合所预测的协同作用。
总结
综上所述,本文所述的实验研究和理论研究已经证实基于二硫化钼(mos2)纳米片的阴极与离子液体emim-bf4组合共同用作li-o2电池中放电和充电的有效助催化剂。循环伏安法结果证实在相同的实验条件下,与au和pt金属催化剂相比,这种助催化剂在较低的过电位下对氧还原和析出反应的优越的反应速率。这种mos2/离子液体助催化剂在li-o2蓄电池系统中也表现非常好,具有小的放电/充电极化间隙以及良好的稳定性和可循环性。使用原子尺度表征(stem实验和eels实验)以及dft计算来解释mos2和离子液体电解质共同起作用以促进mos2的催化特性的机制。证实了mo边缘由emim+离子覆盖倾向于形成隔离的mo位点,这阻止了o2解离并且使得能够进行氧气还原。此外,离子液体促进o2-的溶解,这引起li2o2经由通过溶液的机制形成。本文所公开的mos2/离子液体助催化剂提供了利用离子液体的独特特性(如它们在li-空气蓄电池中的稳定性)与纳米结构化的mos2作为阴极材料的活性的组合的新的机会。
应当了解的是,本文所述的实施例和实施方案仅是用于说明目的并且鉴于其的各种改动方案或变化方案将由本领域技术人员想到并且被并入到本申请的精神和范围以及所附权利要求书的范围内。本领域普通技术人员将了解的是,在某些方面,在此对于mos2/[emim-bf4]体系所提供的数据将可延及其它过渡金属二硫属化物和/或其它离子液体。本文引用的所有出版物、专利、以及专利申请在此出于所有目的以引用的方式并入本文。
- 还没有人留言评论。精彩留言会获得点赞!