一种甘丙肽在制备防止缺血性脑卒的试剂中的应用的制作方法
本发明属于医药领域,具体来说,涉及一种甘丙肽在防止缺血性脑卒中的用途。
背景技术:
缺血/低氧是一种以身体整体或局部供氧/葡萄糖不足为特点的病理生理状态,从而导致一些相关病症的发生,如窒息、高原反应、脑卒中、心肌梗塞和肿瘤细胞转移等。在这一系列疾病中,脑卒中是患病率和死亡率最高的。迄今为止,缺血性脑卒中的治疗方案主要停留在早期溶栓和康复治疗。虽然重大的研究突破令脑卒中的治疗效果有明显改善,尤其是在溶栓窗口的延长上,但其结果并不理想。为了改善疗效,人们开始将研究重点转移到细胞自身具有的内源性保护功能上,如缺血/低氧预适应机制。甘丙肽(Galanin,GAL)是一种由29个氨基酸(人甘丙肽为30个氨基酸)组成的神经肽。这一神经肽最初由Tatemoto K等于1983年从猪小肠中分离提纯。有研究报道,甘丙肽广泛分布于中枢神经系统的同时,在神经垂体、下丘脑室旁核和视上核内神经细胞,以及脊髓背角的神经胞体和纤维含量丰富。甘丙肽所发挥的生理功能主要由三种受体亚型来调节,这三种受体均属G蛋白偶联受体超家族(G-protein-coupled receptors,GPCRs),并分别名为甘丙肽1型受体(GALR1)、甘丙肽2型受体(GalR2)和甘丙肽3型受体(GalR3)。这三种受体亚型的主要结构和特性都存在较大的差异,他们的药理作用和第二信使传导也大不相同,它们的氨基酸序列也只有35~40%的相似度。同时有研究表明,甘丙肽在学习记忆、下丘脑-垂体激素、癫痫、神经病理性痛、炎症和神经保护中起到重要作用。然而,关于它在缺血性脑卒中的作用及其可能机制方面尚缺乏系统研究。
技术实现要素:
本发明所要解决的技术问题是提供一种甘丙肽在制备防止缺血性脑卒的 试剂中的应用。
本发明解决上述技术问题所采取的技术方案如下:
一种甘丙肽在制备防止缺血性脑卒的试剂中的应用,所述试剂中,以甘丙肽GAL或者其受体GalR1作为有效成分,当病人突发脑卒或者脑缺血手术时,将所述试剂打入缺血的大脑半球的侧脑室内,使其穿透血脑屏障,直接作用于缺血状态下的脑组织。
优选的是,将甘丙肽和生理盐水混合并制成试剂。
优选的是,所述试剂中,所述甘丙肽的浓度为10-13nM。
优选的是,所述试剂中,所述甘丙肽的浓度为10-5nM。
优选的是,所述试剂被制备成用于静脉注射的合成药物或具有特异性激活GalR1的药物。
优选的是,所述试剂,在缺血后再灌48h的时期,mRNA水平达到最高峰,而且是梗死灶和梗死灶边缘区域同时上升。
一种防止缺血性脑卒的试剂,所述试剂中,以甘丙肽GAL或者其受体GalR1作为有效成分,当病人突发脑卒或者脑缺血手术时,将所述试剂打入缺血的大脑半球的侧脑室内,使其穿透血脑屏障,直接作用于缺血状态下的脑组织。
本发明采取了上述方案以后,GAL作为一个短肽,成分相对单一,作用也比较明确,容易人工合成,具有制作成本相对便宜的优势。
本发明的其它特征和优点将在随后的说明书中阐述,并且,部分地从说明书中变得显而易见,或者通过实施本发明而了解。本发明的目的和其他优点可通过在所写的说明书、权利要求书、以及附图中所特别指出的结构来实现和获得。
附图说明
下面结合附图对本发明进行详细的描述,以使得本发明的上述优点更加明确。其中,
图1a是甘丙肽在小鼠脑缺血1h后实施再灌的不同时间点下的动态变化图,其中,即甘丙肽在再灌后6h开始出现蛋白水平的明显提升,并于6至24h 的急性期表现为最高峰,由此提示甘丙肽可能参与了脑缺血损伤早期的作用机制;
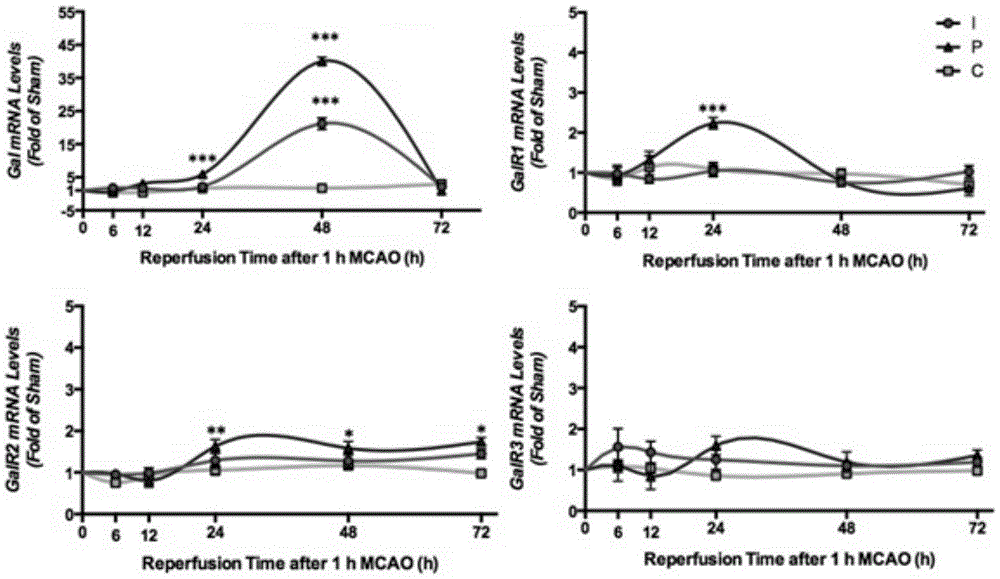
图1b是甘丙肽及其受体亚型的mRNA在脑缺血再灌后发生的动态变化图,其中,图中可见GAL的mRNA水平在缺血1h再灌24h后出现明显的上升,而其受体GalR1和GalR2也有明显的mRNA的提升。由此提示GAL的作用是通过其一型或二型受体所介导的;
图2a是甘丙肽和GalR2/3(甘丙肽2/3型受体)激动剂AR-M1896在原代神经元中的作用示意图;
图2b是甘丙肽GalR2/3(甘丙肽2/3型受体)激动剂AR-M1896在原代神经元中的作用示意图;
图2c是利用LDH试剂盒来测量神经元经过OGD处理后的LDH释放量的示意图;
图2d是利用神经损伤评分表在小鼠脑缺血1h/再灌24h后观测到甘丙肽给药组有明显的行为学损伤减轻的对比图;
图2e是利用圆柱体实验发现小鼠在脑缺血1h/再灌24h后肢体的协调性有明显的下降,而术前给予甘丙肽的小鼠则有明显的肢体协调性增强的对比图;
图2f是利用悬挂实验发现小鼠在脑缺血1h/再灌24h后肢体力量有明显下降,而甘丙肽给药组的悬挂时间则明显长于单纯MCAO组的对比图;
图2g是利用TTC染色可直观的检测到小鼠在脑缺血1h/再灌24h后脑组织的梗死灶面积,而对于两个不同浓度的甘丙肽给药组,均有明显的梗死灶减小趋势的对比图;
图2h是TTC染色的典型图片;图3a和图3b是利用GalR1(甘丙肽1型受体)的病毒干扰对原代神经元进行基因敲减可观测到甘丙肽保护作用消失,但是甘丙肽受体GalR1的敲减本身并不会影响到神经元的活性的对比图;
图3c和3d是利用GalR2(甘丙肽1型受体)的病毒干扰对原代神经元进行基因敲减可观测到甘丙肽保护作用并未受到影响,而且甘丙肽受体GalR2的敲减本身并不会影响到神经元的活性的比对图;
图3e和图3f,利用基因敲除小鼠发现,cPKCγ(经典型蛋白激酶C gamma) KO(knockout)小鼠的神经元经过OGD处理后,即使是甘丙肽给药组也同样具有较低的存活率,但是cPKCγ并不会影响神经元的正常,由此可知,甘丙肽需要cPKCγ参与其下游信号通路才可发挥保护作用的比对图。
图4a是利用神经损伤评分表,在小鼠脑缺血1h/再灌24h后观测到甘丙肽给药组有明显的行为学损伤减轻,而当GalR1被病毒敲减后,甘丙肽则失去其保护作用的示意图;
图4b是利用圆柱体实验发现,小鼠在脑缺血1h/再灌24h后肢体的协调性有明显的下降,而术前给予甘丙肽的小鼠则有明显的肢体协调性增强,而当GalR1被病毒敲减后,甘丙肽则失去其保护作用的示意图;
图4c是利用悬挂实验发现,小鼠在脑缺血1h/再灌24h后肢体力量有明显下降,而甘丙肽给药组的悬挂时间则明显长于单纯MCAO组,而当GalR1被病毒敲减后,甘丙肽则失去其保护作用的示意图;
图4d和图4e分别为甘丙肽给药组和GalR1基因敲减组的TTC染色结果,其中d为统计结果,而e为典型图片。
具体实施方式
以下将结合附图及实施例来详细说明本发明的实施方式,借此对本发明如何应用技术手段来解决技术问题,并达成技术效果的实现过程能充分理解并据以实施。需要说明的是,只要不构成冲突,本发明中的各个实施例以及各实施例中的各个特征可以相互结合,所形成的技术方案均在本发明的保护范围之内。
本发明的发明目的是利用小鼠整体MCAO局部缺血性脑卒中模型,探讨甘丙肽在缺血性脑卒中的作用及其可能的分子机制。从而进一步丰富人们对脑缺血/低氧性损伤和适应机制的认识,并为临床防治缺血性脑卒中提供实验依据。
由此,本发明提供了一种甘丙肽在制备防止缺血性脑卒的试剂中的应用,所述试剂中,以甘丙肽GAL或者其受体GalR1作为有效成分,当病人突发脑卒或者脑缺血手术时,将所述试剂打入缺血的大脑半球的侧脑室内,使其穿透血脑屏障,直接作用于缺血状态下的脑组织。
优选的是,将甘丙肽和生理盐水混合并制成试剂。
优选的是,所述试剂中,所述甘丙肽的浓度为10-13nM。
优选的是,所述试剂中,所述甘丙肽的浓度为10-5nM。
优选的是,所述试剂被制备成用于静脉注射的合成药物或具有特异性激活GalR1的药物。
优选的是,所述试剂,在缺血后再灌48h的时期,mRNA水平达到最高峰,而且是梗死灶和梗死灶边缘区域同时上升。
一种防止缺血性脑卒的试剂,所述试剂中,以甘丙肽GAL或者其受体GalR1作为有效成分,当病人突发脑卒或者脑缺血手术时,将所述试剂打入缺血的大脑半球的侧脑室内,使其穿透血脑屏障,直接作用于缺血状态下的脑组织。
本发明采取了上述方案以后,GAL作为一个短肽,成分相对单一,作用也比较明确,容易人工合成,具有制作成本相对便宜的优势。
下面针对本专利中所涉及的实验方法进行说明,其中,本发明涉及的各种图进行简单说明如下:
图1a表示:甘丙肽在小鼠脑缺血1h后实施再灌的不同时间点下的动态变化,即甘丙肽在再灌后6h开始出现蛋白水平的明显提升,并于6至24h的急性期表现为最高峰。由此提示甘丙肽可能参与了脑缺血损伤早期的作用机制;
图1b表示,甘丙肽及其受体亚型的mRNA在脑缺血再灌后发生的动态变化。图中可见GAL的mRNA水平在缺血1h再灌24h后出现明显的上升,而其受体GalR1和GalR2也有明显的mRNA的提升。由此提示GAL的作用是通过其一型或二型受体所介导的;
图2a和图2b分别表示甘丙肽和GalR2/3(甘丙肽2/3型受体)激动剂AR-M1896在原代神经元中的作用,a中可见神经元经过氧糖剥夺(OGD)的处理后有明显的死亡,而在加入了甘丙肽后,随着甘丙肽浓度的递增,神经元的存活率也有所升高。但是这一现象在给予AR-M1896的时候则不再出现。由此提示甘丙肽的保护作用并不是通过GalR2/3介导的;
图2c,利用LDH试剂盒来测量神经元经过OGD处理后的LDH释放量 (死亡率)同样看了甘丙肽对神经元的保护,即随着甘丙肽浓度的递增可有效的降低OGD处理后的神经元死亡率;
图2d,利用神经损伤评分表,在小鼠脑缺血1h/再灌24h后观测到甘丙肽给药组有明显的行为学损伤减轻;
图2e,利用圆柱体实验发现,小鼠在脑缺血1h/再灌24h后肢体的协调性有明显的下降,而术前给予甘丙肽的小鼠则有明显的肢体协调性增强。
图2f,利用悬挂实验发现,小鼠在脑缺血1h/再灌24h后肢体力量有明显下降,而甘丙肽给药组的悬挂时间则明显长于单纯MCAO组
图2g,利用TTC染色可直观的检测到小鼠在脑缺血1h/再灌24h后脑组织的梗死灶面积(白色区域),而对于两个不同浓度的甘丙肽给药组,均有明显的梗死灶减小趋势;
图2h是TTC染色的典型图片,其趋势和图2g中的统计一致;
图3a和3b,利用GalR1(甘丙肽1型受体)的病毒干扰对原代神经元进行基因敲减可观测到甘丙肽保护作用消失,但是甘丙肽受体GalR1的敲减本身并不会影响到神经元的活性。
图3c和3d,利用GalR2(甘丙肽1型受体)的病毒干扰对原代神经元进行基因敲减可观测到甘丙肽保护作用并未受到影响,而且甘丙肽受体GalR2的敲减本身并不会影响到神经元的活性。图3e和3f,利用基因敲除小鼠发现,cPKCγ(经典型蛋白激酶C gamma)KO(knockout)小鼠的神经元经过OGD处理后,即使是甘丙肽给药组也同样具有较低的存活率,但是cPKCγ并不会影响神经元的正常。由此可知,甘丙肽需要cPKCγ参与其下游信号通路才可发挥保护作用。
图4a,利用神经损伤评分表,在小鼠脑缺血1h/再灌24h后观测到甘丙肽给药组有明显的行为学损伤减轻,而当GalR1被病毒敲减后,甘丙肽则失去其保护作用。
图4b,利用圆柱体实验发现,小鼠在脑缺血1h/再灌24h后肢体的协调性有明显的下降,而术前给予甘丙肽的小鼠则有明显的肢体协调性增强,而当GalR1被病毒敲减后,甘丙肽则失去其保护作用。
图4c,利用悬挂实验发现,小鼠在脑缺血1h/再灌24h后肢体力量有明 显下降,而甘丙肽给药组的悬挂时间则明显长于单纯MCAO组,而当GalR1被病毒敲减后,甘丙肽则失去其保护作用。
图4d和4e分别为甘丙肽给药组和GalR1基因敲减组的TTC染色结果,其中d为统计结果,而e为典型图片。从此结果中可见GalR1敲减后甘丙肽的保护作用几乎完全丧失,进一步巩固了前面细胞水平上的实验结果。
其中,本发明的详细实验过程如下:
3.1小鼠MCAO模型的建立
为了方便今后采用基因修饰的方法来研究各种甘丙肽受体在缺血性脑卒中的作用机制,我们选择8~16周的雄性C57/BL6小鼠(体重20~25g)作为研究对象,采用大脑中动脉阻塞(Middle Cerebral Artery Occlusion,MCAO)的方法建立缺血性脑卒中模型。这些小鼠均从中国医学科学院实验动物所购买。将实验动物分为假手术、MCAO和MCAO+GAL 5pmol三组,分别对其进行相应的操作,手术流程严格遵循首都医科大学有关实验动物的实用规定并与NIH实验动物守则(NIH Publications No.80-23)一致;利用蛋白印迹(Western blot)和免疫组织化学法,检测甘丙肽及其受体在MCAO卒中小鼠脑内蛋白表达量的变化情况,运用qRT-PCR检测MCAO小鼠脑内甘丙肽及其受体mRNA表达水平的改变。
以MCAO组为例,将小鼠分为假手术和MCAO组后对其进行相应的处理。MCAO手术流程如下:术前12h禁食不禁水,小鼠用1%戊巴比妥钠(4.0mL/kg)腹腔麻醉,仰卧位固定,于颈正中纵行切开皮肤,钝性分离集群,游离左侧颈总动脉(CCA)、颈外动脉(ECA)和颈内动脉(ICA),结扎ECA和CCA近心端,同时运用动脉夹夹闭ICA远端,在ECA结扎部位的近心端用动脉剪剪一小口,将浸于肝素生理盐水中的尼龙线拴(头端直径为0.23mm)沿ECA插入ICA,约12mm,然后在ECA的近心端用一个活扣将线栓固定,由此造成小鼠脑缺血。待小鼠缺血1h后将线栓拔出,并将CCA上的假手术组小鼠则只是进行动脉分离,然后缝合皮肤。整个手术过程中室温保持在22~25℃。术后将动物先置于37℃保温箱中1h,以促进其恢复,随后放在有清洁垫料的饲养盒中,自由饮水、进食。
建立小鼠MCAO缺血性脑卒中模型后,通过Bederson量表观察小鼠神经 损伤和行为学变化,来确定是否缺血成功。其中Bederson量表的具体评分标准为:0,无损伤;1,前肢弯曲;2,侧推时无阻力;3,单侧旋转;4,纵向旋转;5,无运动。
3.2小鼠侧脑室药物注射。
术前1h,按Alvaro Munoz的注射方法,以前囱为零点,在前囱后0.5mm,右侧1.0mm和3.5mm深度分别将5pmol或5fmol的GAL缓慢地注入小鼠左侧脑室,结束后再进行小鼠脑缺血模型的制备。
3.3蛋白样品制备及免疫印迹。
分别于MCAO术后再灌24h、48h和72h这三个时间点将小鼠断头取脑,迅速分离出皮层缺血核心区、半影区和对侧皮层组织,并利用全细胞裂解液Buffer C[50mM Tris–Cl,pH 7.5,containing 2mM EDTA,1mM EGTA,100mM iodoacetamide(SH-group blocker),5g/mL each of leupeptin,aprotinin,pepstatin A and chymostatin,50mM potassium fluoride,50nM okadaic acid,5mM sodium pyrophosphate,2%SDS]抽提蛋白组分。BCA法蛋白定量后,将蛋白样品全部调制成相同浓度,-20℃保存备用。每组分别取50μg总蛋白样品进行蛋白电泳(12%SDS-PAGE,4℃,20~30mA)和转膜(PVDF膜,400mA,2-3h)。经过TTBS(20mM Tris–Cl,pH 7.5,0.15M NaCl and 0.05%Tween-20)漂洗后,用10%脱脂牛奶封闭1h后用一抗在4℃中孵育过夜(具体抗体及公司见上文)。所得结果用GelDoc凝胶成像系统扫描分析。
3.4cDNA样品制备及实时定量PCR(qRT-PCR)。
分别于MCAO术后再灌24h、48h和72h这三个时间点将小鼠断头取脑,剥离大脑缺血核心区、半影区和对侧皮层组织,对于Sham和I/HPC组则取与缺血区同侧的皮层组织。用RNeasy Mini Kit(Qiagen)从组织中提取RNA,,然后再用Transcriptor First Strand cDNA Synthesis Kit(Roche)将其逆转录为cDNA,放入-20℃保存备用。
通过Power SYBR Green PCR Master Mix(Applied Biosystems)荧光标记物并分别利用GAL、GalR1、GalR2、GalR3的引物对已经制备好了的cDNA样品进行检测,具体的反应体系如下:1ul cDNA,1ul primer,8ul ddH2O,10ul SYBR Green Master Mix。用于qPCR的具体引物如下:
GAL:F:5’-CACTCTGGGACTTGGGATG-3’;R:5’-CAGGCAAGAGGGAGTTACAA-3’
GALR1:F:5’-CTTACTGCTCATCTGCTTTTGC-3’;R:5’-GTATTTGGCATATCCTGGCTG-3’
GALR2:F:5’-CCTCATCTTCCTCACTATGCAC-3’;R:5’-CATCGGGCTCATCTGGG-3’
GALR3:F:5’-AGGATGAAGCAAAGGTCGG-3’;R:5’-CAACAGGAAGATGAGGGCAA-3’
3.5原代神经元的提取及离体氧糖剥夺(OGD)模型。
0.05%多聚赖氨酸铺板,在培养前用无菌去离子水清洗培养皿1-2次,以减少多聚赖氨酸对神经元的毒性。取新生乳鼠,用95%乙醇消毒取脑,剥离皮层及海马。用眼科剪刀剪成小块,加入0.25%胰蛋白酶37℃消化15min,去除胰酶,加入种植液(DMEM培养基+10%胎牛血清+10%马血清)终止消化,将组织块用种植液清洗,为减少吹打对已消化细胞所造成的损伤,需吹打后静止数分钟,再吸去上层已经离散的细胞悬液,再次加入种植液吹打未离散的组织团块,如此反复3~4次即可,用300目细胞筛过滤入50mL的小烧杯中。重复上述操作2~3次并取10μl进行细胞计数。按照5×105的密度种植在35mm的小皿中。培养4h后弃去种植液,将其更换为饲养液(Neurobasal+2%B-27Supplement)。规律更换饲养液(84h换全液1次或每48h换半液1次),培养7天后可以用于实验。
在培养7天后对神经元进行氧糖剥夺(oxygen glucose deprivation,OGD)以在离体情况下模拟脑卒中的情况。具体来说,将培养神经元用的Neurobasal更换为不含葡萄糖的DMEM培养基并将细胞置于低氧箱中(2%氧气,5%二氧化碳,93%氮气)。对于需要给药的组分,如GAL处理组,在OGD前15分钟的时间点进行提前孵育。
3.6小鼠行为学检测。
当小鼠缺血1h/再灌24h后,对其进行行为学检测。首先根据Rodriguez的神经损伤评分系统对小鼠进行总体的行为学评价,然后再分别利用圆柱体实验(Cylinder Test)和悬索实验(Wire Hanging Test)来检测小鼠的肢体协调能 力和肌肉强度。具体说来,在缺血1h/再灌24h后利用图1中的量表对小鼠的神经损伤程度进行评分。与此同时,运用圆柱体实验来评价小鼠术后肢体协调能力,通过记录小鼠在玻璃烧杯中用左右上肢触碰烧杯壁的次数,并通过运算公式。
3.7TTC染色及脑梗死面积的计算。
MCAO术后24h,迅速断头取脑,置-20℃冷冻。20min后取出在冰台上由前向后行厚度为2.0mm的冠状切片,将切片立即置于1%的2,3,5-氯化三苯基四氮(TTC)磷酸盐缓冲液中,避光,37℃恒温孵育30min。扫描染色后的脑片,然后分别取取皮层缺血区,半影区和对侧区,假手术组取手术同侧皮层组织,放入液氮备用。
根据Eric所建方法进行计算,公式S=(ΣLT-ΣRT)/(ΣLT+ΣRT)×100%计算水肿率,ΣLT代表左侧大脑半球的总面积,ΣRT代表右侧大脑半球的总面积。根据公式B=假手术组未经TTC染色的面积/总面积计算背景率,然后再通过公式A=ΣSN(1-S)/(ΣLT+ΣRT)(1-B)×100%计算脑梗死区占整个大脑体积的百分比,ΣSN代表梗死区面积。
3.8细胞活性和Caspase活性等试剂盒。
对于细胞活性检测,即MTS Assay,我们将原代神经元按照2×104细胞/孔种在96孔板中,待培养7天后OGD 1h成模。再灌24h后,按照CellTiter 96AQueous One Solution Cell Proliferation Assay System(Promega)的说明书加入MTS试剂,放入温箱中孵育30min后用酶标仪读取数据(波长490nm)。
除了用以上方法检测细胞活性外,实验还同时应该了CytoTox 96Non-Radioactive Cytotoxicity Assay(Promega,Wisconsin 53711,USA)试剂盒来检测细胞毒性,即细胞经过1h OGD/24h复糖复氧后的死亡率。经过24h复糖复氧后,抽取一部分用于培养神经元的Neurobasal培养基来测量实验组的乳酸脱氢酶(lactate dehydrogenase,LDH)释放量,同时利用试剂盒中自带的裂解液将细胞全部裂解以测量神经元的最大LDH释放量。经过试剂盒自带的反应底物孵育30min后,加入反应停止液,在酶标仪中记录490nm的吸光值。细胞毒性经过以下公式运算而得:实验组LDH释放量/最大LDH释放量x100%。
Caspase活性检测的方法和MTS类似,将原代神经元种植在白色96孔板 并运用Caspase-Glo 9试剂盒检测系统(Cat.#G7211,Promega,Madison,WI53711,USA),最后用SpectraMax i3(Molecular Devices,Sunnyvale,CA 94089,USA)来检测试剂盒的白光信号。
3.9数据处理方法:
应用SPSS 20.0软件进行数据统计分析。各组结果比较时采用单因素方差分析(One-way ANOVA),以p<0.05作为统计学显著性差异的标准,各组实验数据以均值±标准误(Mean±SEM)表示。利用Graphpad Prism 6(GraphPad Software,La Jolla,CA 92037,USA)绘图软件作图。
三、实验结果:
1.GAL及其受体的表达量在小鼠MCAO缺血再灌模型当中的有明显的上升趋势
经过Western Blot检测(图1a),我们发现GAL在1h MCAO后的再灌期有明显的上升趋势,尤其是尚可挽救的梗死灶边缘区(peri-infarct,P),再灌6h后有明显的蛋白表达量升高(p=0.0044),这一上升趋势持续到了再灌后12h(p=0.0052),24h(p=0.0003)和48h(p<0.0001)。与此同时,在小鼠脑组织的梗死灶(infarct,I)和对侧皮层(contra-lateral cortex,C)也观测到了GAL的明显上升趋势。从mRNA的角度来看(图1b),GAL在1h MCAO后的再灌时期的表达量变化其蛋白水平的趋势略有不同,即它在缺血后再灌48h的时期,mRNA水平达到最高峰,而且是梗死灶和梗死灶边缘区域同时上升(p<0.0001)。而对于GAL的受体,在1h MCAO/24h再灌后GalR1(p<0.0001)和GalR2(p=0.0087)均有明显的表达量上升,但是GalR3并没有明显的表达量变化。
此结果提示GAL及其受体与小鼠脑缺血具有相关性,并且当中可能发挥一定的作用,但是具体是否具有保护作用尚不明确。
1.GAL在原代神经元OGD模型和动物MCAO模型中起到保护作用
既然脑缺血可提升GAL的蛋白表达量,以及GAL、GalR1和GalR2的mRNA 表达量,需要进一步探讨GAL在离体OGD模型和活体MCAO模型中对于神经元存活率和小鼠术后神经损伤的效果。在离体细胞实验中,将GAL按照10-13至10-5M的浓度梯度给药,并在更换为无葡萄糖DMEM培养基 但置于低氧箱前在常氧状态下孵育15分钟。经过MTS细胞活性试剂盒的检测,实验结果显示GAL具有浓度依赖型的保护作用,而当我们运用GalR2/3受体的激动剂AR-M1896时,并不能观测到相似的保护作用(Fig.2A和B,n=18per group)。这一保护作用在GAL浓度达到10-9M(p=0.0385)时起效,而在更高的浓度10-8M(p=0.0007),10-7M(p<0.0001),10-6M(p<0.0001)与10-5M(p<0.0001)的时候,保护作用则变得更加显著。根据对实验数据的分析,可计算出半数有效浓度(LogEC50)为-7.382。同时,运用CytoTox 96Non-Radioactive Cytotoxicity Assay(Promega,Wisconsin 53711,USA)试剂盒来检测神经元经过1h OGD/24h复糖复氧后LDH释放量可发现GAL处理后的神经元有明显的死亡率下降(Fig.2C)
从动物水平的来看,在MCAO手术前1h的时候,分别不同浓度的GAL,5fmol和5pmol,注射到小鼠缺血侧的脑室内,并于再灌后24h对小鼠进行行为学评价,处死后对其进行TTC染色以测量梗死灶体积。通过对梗死灶的观测,我们发现5fmol和5pmol均可有效降低小鼠缺血后的梗死面积(p=0.0146for 5fmol,p<0.0001for 5pmol,n=6per group,Fig.2F)。但是只有当GAL的浓度达到5pmol的时候,行为学上的损伤才能被减缓,具体表现为神经损伤评分的明显降低(n=8 per group,p=0.8518 for 5fmol and p<0.0001 for 5pmol Fig.2C),肢体力量的恢复(n=8 per group,p=0.9903 for 5fmol and p<0.0001 for 5pmol,Fig.2E)和前肢协调性的增强(n=8 per group,p=0.7721 for 5fmol and p=0.0033 for 5pmol,Fig.3D)。
2.GAL通过GalR1和PKCγ发挥其保护作用
利用慢病毒包装的siRNA干扰将GalR1和GalR2的表达敲除,在原代神经元中看到敲除GalR1以后GAL的保护作用被抵消掉,而GalR1的敲除对于神经元本身并没有作用(Fig.3A和B),而此现象在动物实验中,同样得到了验证(Fig.4)。同时,当敲减GAL的另一个受体GalR2的时候,我们发现干扰并没有形象到GAL的保护作用(Fig.3C和D)。由此结果可以得知GAL的保护作用的确是通过GalR1介导的。在此信号通路中另一个重要的角色是PKCγ。
本专利的保护点在于利用GAL来保护缺血时的大脑,以及治疗脑卒中后 的神经损伤。
虽然现在已经有多种药物被用于脑卒中的治疗,但是多数依然处于临床实验阶段,而且临床应该的效果并不明显。迄今为止,脑卒中最好的治疗方法依然是药物溶栓,对脑组织实施再灌注。GAL作为一个短肽,成分相对单一,作用也比较明确,容易人工合成,具有制作成本相对便宜的优势。
需要说明的是,对于上述方法实施例而言,为了简单描述,故将其都表述为一系列的动作组合,但是本领域技术人员应该知悉,本申请并不受所描述的动作顺序的限制,因为依据本申请,某些步骤可以采用其他顺序或者同时进行。其次,本领域技术人员也应该知悉,说明书中所描述的实施例均属于优选实施例,所涉及的动作和模块并不一定是本申请所必须的。
最后应说明的是:以上所述仅为本发明的优选实施例而已,并不用于限制本发明,尽管参照前述实施例对本发明进行了详细的说明,对于本领域的技术人员来说,其依然可以对前述各实施例所记载的技术方案进行修改,或者对其中部分技术特征进行等同替换。凡在本发明的精神和原则之内,所作的任何修改、等同替换、改进等,均应包含在本发明的保护范围之内。
- 还没有人留言评论。精彩留言会获得点赞!
- 一种基于图像信息的缺血性脑卒中治疗监测系统的制作方法
- miR-106b-5p及其检测引物和其反义核苷酸序列在诊断、治疗缺血性脑卒中领域中的应用
- 一种辅助诊断急性缺血性脑卒中的早期生物标志物及其基因芯片和实时荧光定量pcr评 ...的制作方法
- 瓜蒌桂枝汤在制备治疗缺血性脑卒中后遗症药物中的应用
- 一种治疗髓海不足型缺血性脑卒中后血管性痴呆的中药组合物的制作方法
- 一种用于治疗缺血性脑卒中的药物组合物的制作方法
- 用于治疗和预防脑卒中或缺血、阿尔茨海默病和帕金森病和肌萎缩性侧索硬化的甾族硝酮的制作方法
- 一种治疗脾肾两虚型缺血性脑卒中后血管性痴呆的中药组合物的制作方法
- 缺血性脑卒中诊断标记物的制作方法
- 缺血性脑卒中miRNA标记物的制作方法
- 一种基于图像信息的缺血性脑卒中治疗监测系统的制作方法
- miR-106b-5p及其检测引物和其反义核苷酸序列在诊断、治疗缺血性脑卒中领域中的应用
- 一种辅助诊断急性缺血性脑卒中的早期生物标志物及其基因芯片和实时荧光定量pcr评 ...的制作方法
- 瓜蒌桂枝汤在制备治疗缺血性脑卒中后遗症药物中的应用
- 一种治疗髓海不足型缺血性脑卒中后血管性痴呆的中药组合物的制作方法
- 一种用于治疗缺血性脑卒中的药物组合物的制作方法
- 用于治疗和预防脑卒中或缺血、阿尔茨海默病和帕金森病和肌萎缩性侧索硬化的甾族硝酮的制作方法
- 一种治疗脾肾两虚型缺血性脑卒中后血管性痴呆的中药组合物的制作方法
- 缺血性脑卒中诊断标记物的制作方法
- 缺血性脑卒中miRNA标记物的制作方法
- 一种基于图像信息的缺血性脑卒中治疗监测系统的制作方法
- miR-106b-5p及其检测引物和其反义核苷酸序列在诊断、治疗缺血性脑卒中领域中的应用
- 一种辅助诊断急性缺血性脑卒中的早期生物标志物及其基因芯片和实时荧光定量pcr评 ...的制作方法
- 瓜蒌桂枝汤在制备治疗缺血性脑卒中后遗症药物中的应用
- 一种治疗髓海不足型缺血性脑卒中后血管性痴呆的中药组合物的制作方法
- 一种用于治疗缺血性脑卒中的药物组合物的制作方法
- 用于治疗和预防脑卒中或缺血、阿尔茨海默病和帕金森病和肌萎缩性侧索硬化的甾族硝酮的制作方法
- 一种治疗脾肾两虚型缺血性脑卒中后血管性痴呆的中药组合物的制作方法
- 缺血性脑卒中诊断标记物的制作方法
- 缺血性脑卒中miRNA标记物的制作方法
- 一种用于缺血性脑卒中后神经再生的药物组合物及其应用的制作方法与工艺
- 一种与抗血小板药物氯吡格雷治疗缺血性脑卒中相关的SNP标志物及其应用的制作方法与工艺
- Nur77在制备改善缺血性脑卒中预后药物中的应用的制作方法与工艺
- 一种缺血性脑卒中治疗药物的制作方法与工艺
- 反式肉桂醛制备治疗缺血性脑卒中的药物的用途的制作方法与工艺
- LINC01094在诊治缺血性脑卒中的应用的制造方法与工艺
- 一种检测缺血性脑卒中的生物标志物及其应用的制造方法与工艺
- 与缺血性脑卒中组织特异性结合的HGG多肽及其应用的制造方法与工艺
- 一种检测缺血性脑卒中的分子标志物及其用途的制造方法与工艺
- 肉苁蓉多糖制备治疗缺血性脑卒中的药物的用途的制造方法与工艺