马来酸匹杉琼脂质体及其制备方法与流程
本发明涉及一种马来酸匹杉琼脂质体及其制备方法,属于医药技术领域。
背景技术:
匹杉琼(pixantrone dimaleate)是一种细胞毒性氮杂蒽二酮、弱拓扑异构酶II抑制剂,2012年被欧盟批准用于治疗成人复发或难治侵略性非霍奇金B细胞淋巴瘤,商品名为Pixuvri。匹杉琼的母核为米托蒽醌,多年临床应用表明米托蒽醌具有明显的毒性副反应,尤其是与骨髓抑制和心脏中毒相关的毒副作用,而匹杉琼的动物试验研究未表现出可测量的心脏毒性,并且细胞毒性和骨髓抑制更小,在不同的肿瘤模型中具有明显的抗肿瘤活性,尤其在白血病和淋巴瘤模型中始终优于米托蒽醌和阿霉素。匹杉琼游离形式不稳定,因此将其合成二马来酸盐的形式,维持酸性pH值,使其稳定。目前上市的匹杉琼为普通注射液,有报道显示,临床给予匹杉琼普通注射液会出现严重的蓄积性心脏毒性反应,并且存在剂量依赖性。因此,本发明将马来酸匹杉琼制备成脂质体形式,减少单次给药剂量,降低严重不良反应的发生。
脂质体是一种靶向给药系统的新剂型,近年来一直是学者们的研究热点。脂质体具有靶向性、可缓慢释放药物延长作用时间、提高疗效、降低药物毒性等特点。最具有代表性的脂质体药物是美国Alza公司开发的盐酸多柔比星脂质体注射液,于1995年在美国上市,商品名为Doxil。Doxil是采用硫酸铵梯度法主动包封技术将盐酸多柔比星包封在脂质体内部,形成稳定的、高包封率的盐酸多柔比星脂质体。静脉注射后,盐酸多柔比星脂质体会蓄积到肿瘤组织中,体内分布呈现肿瘤靶向性,同时降低毒性,显著提高抗癌效能。经过多年临床证明,硫酸铵梯度法制备的盐酸多柔比星脂质体的安全性高、疗效好。
已有专利将马来酸匹杉琼制备成脂质体,分别为一种马来酸匹杉琼的脂质体制剂及其制备工艺(公开号:CN103479578A)和6,9-二-[(2-氨基乙基)氨基]苯并[g]异喹啉-5,10-二酮二马来酸酯的脂质体制剂(公开号:CN1382039A)。专利CN103479578A中采用pH梯度法制备的马来酸匹杉琼脂质体包封率高,但是由于引入新缓冲盐粒子,增加临床用药风险;同时该专利中研究硫酸铵梯度法无法制备符合临床需要的样品,包封率低于10%。另一专利CN1382039A是采用被动载药方法,直接向磷脂膜中加入匹杉琼溶液水合,包封率仅为85%,且药物容易从脂质体内泄漏,未达到降低匹杉琼注射剂毒性反应的目的。
技术实现要素:
本发明的技术方案如下:
本发明马来酸匹杉琼脂质体每1000体积份脂质体中包含:
本发明马来酸匹杉琼脂质体每1000体积份脂质体中其余部分含pH调节剂和注射用水。本发明马来酸匹杉琼脂质体每1000体积份脂质体中DSPC与CHO重量比为3:1~3,DSPC与PEG-DSPE2000重量比为3:1~2;硫酸铵溶液的浓度为0.1~0.3mol/L;氢氧化钠调节蔗糖溶液pH至6.50~7.50。本发明所述体积份/重量份为ml/g。
本发明马来酸匹杉琼脂质体的制备方法,采用硫酸铵梯度法制备,包括以下步骤:
(1)成膜:称取二硬脂酰基磷脂酰胆碱/胆固醇/聚乙二醇化磷脂2000,溶于三氯甲烷,加热溶解后于旋转蒸发仪上减压蒸发除去氯仿,得到脂质薄膜;
(2)水化:向脂质薄膜加入0.1~0.3mol/L硫酸铵水溶液水化,得到空白脂质体初品;
(3)整粒:将空白脂质体于超声波分散仪上超声整粒,整粒后采用不同孔径的微孔滤膜过滤,得到粒径分布均匀的空白脂质体;
(4)制造脂质体内外跨膜梯度:采用超滤法,用9%蔗糖溶液置换外水相硫酸铵溶液,得到空白脂质体;
(5)载药、孵化:称取马来酸匹杉琼溶于上述空白脂质体中,用氢氧化钠调节pH至6.50~7.10,55~65℃保温,得到马来酸匹杉琼脂质体;
(6)保存:马来酸匹杉琼脂质体用0.22μm微孔滤膜除菌分装,4℃保存。
本发明马来酸匹杉琼脂质体的制备方法还可以是,采用硫酸铵梯度法制备,包括以下步骤:
(1)油相:称取二硬脂酰基磷脂酰胆碱/胆固醇/聚乙二醇化磷脂2000,溶于无水乙醇,加热溶解后于55~65℃保温;
(2)水相:配制0.1~0.3mol/L的硫酸铵水溶液,于55~65℃保温;
(3)乳化:在55~65℃下将油相注入到水相中,不断搅拌,并通入氮气,直到无水乙醇完全挥发,得到空白脂质体初品;
(4)整粒:将空白脂质体于超声波分散仪上超声整粒,整粒后采用不同孔径的微孔滤膜过滤,得到粒径分布均匀的空白脂质体;
(5)制造脂质体内外跨膜梯度:采用超滤法,置换液为9%蔗糖溶液,置换空白脂质体外水相的硫酸铵溶液,得到空白脂质体;
(6)载药、孵化:称取马来酸匹杉琼溶于上述空白脂质体中,用氢氧化钠调节pH至6.50~7.10,55℃~65℃保温,得到马来酸匹杉琼脂质体;
(7)保存:马来酸匹杉琼脂质体用0.22μm微孔滤膜除菌分装,4℃保存。
所述制造脂质体内外跨膜梯度的方法还可以为透析法,采用9%蔗糖溶液,置换空白脂质体外水相的硫酸铵溶液,得到空白脂质体。
本发明脂质体磷脂浓度为10~30mg/mL,马来酸匹杉琼浓度为1~2mg/mL,马来酸匹杉琼脂质体的平均粒径为50~200nm,优选70~150nm。本发明采用高压均质-挤出机制备空白脂质体的粒径。
本发明采用硫酸铵梯度法制备马来酸匹杉琼脂质体,解决了现有技术中使用硫酸铵梯度法制备马来酸匹杉琼脂质体包封率低的问题,降低匹杉琼注射液的毒性反应,抗肿瘤效果更优。硫酸铵梯度法制备脂质体用于临床多年,安全性更为可靠。本发明采用高压均质-挤出机能更好的控制空白脂质体的粒径,使其分布均匀,适合工业化生产。
附图说明
图1为a9粒径分布图;
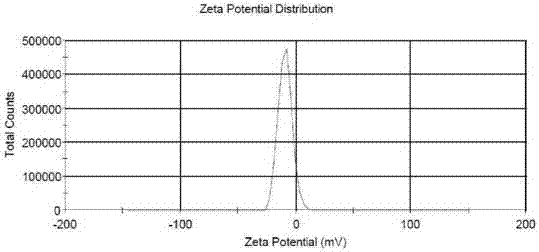
图2为a9电位分布图。
实验例:
本发明通过实施例1-9不同方法制备的马来酸匹杉琼脂质体,包封率见表1。实施例5中用透析的方法除去外水相硫酸铵溶液,虽然包封率达到89.6%,但不适合工业化生产。实施例7和8采用缓冲液调节pH值,脂质体包封率仅为4%。实施例9采用高压均质机-挤出机制备的马来酸匹杉琼脂质体粒径为87.29nm,粒径分布均匀,分布宽度40.15,电位-9.06mV,结果见图1和图2。
表1实施例中制备的马来酸匹杉琼脂质体的包封率
实施例1
(1)成膜:称取DSPC 300.2mg,CHO 100.2mg,DSPE-PEG200099.8mg,溶于10mL三氯甲烷,加热溶解,于旋转蒸发仪上55℃减压蒸发除去三氯甲烷,得到脂质薄膜;
(2)水化:向脂质薄膜加入0.2mol/L硫酸铵溶液26mL,于55℃水化30min,得到空白脂质体初品;
(3)整粒:将空白脂质体初品于超声波分散仪上超声分散4min,功率600~800w,整粒后用0.45微米微孔滤膜过滤3次,0.22微米微孔滤膜过滤1次,得到空白脂质体24mL;
(4)制造脂质体内外跨膜梯度:采用超滤法,用9%蔗糖溶液置换空白脂质体外水相的硫酸铵溶液,置换7次,得到空白脂质体20mL;
(5)载药、孵化:称取马来酸匹杉琼34.5mg溶于18mL上述空白脂质体中,用0.1mol/L氢氧化钠调节pH至6.95,55℃孵化1h,得到马来酸匹杉琼脂质体a1;
(6)保存:马来酸匹杉琼脂质体用0.22μm微孔滤膜除菌分装,4℃保存。
实施例2
(1)油相:称取DSPC 450.6mg,CHO 150.3mg,DSPE-PEG2000 149.9mg,溶于3.9mL无水乙醇,加热溶解后于55℃保温30min;
(2)水相:配制0.2mol/L的硫酸铵水溶液39mL,于55℃保温30min;
(3)乳化:在55℃下将油相注入到水相中,用磁力搅拌器不断搅拌,直到无水乙醇完全挥发,得到空白脂质体初品37mL;
(4)整粒:将空白脂质体初品于超声波分散仪上超声分散4min,功率为600~800w,整粒后采用0.45微米的微孔滤膜过滤3次,0.22微米的微孔滤膜过滤1次,得到空白脂质体35mL;
(5)制造脂质体内外跨膜梯度:采用超滤法,用9%蔗糖溶液置换空白脂质体外水相的硫酸铵溶液,超滤7次,得到空白脂质体30.8mL;
(6)载药、孵化:称取马来酸匹杉琼53.8mg溶于28mL上述空白脂质体中,用0.1mol/L氢氧化钠调节pH至6.98,55℃孵化1h,得到马来酸匹杉琼脂质体a2;
(7)保存:马来酸匹杉琼脂质体用0.22μm微孔滤膜除菌分装,4℃保存。
实施例3
(1)油相:称取DSPC 450.2mg,CHO 149.8mg,DSPE-PEG2000 150.1mg,溶于3.9mL无水乙醇,加热溶解后于55℃保温30min;
(2)水相:配制0.2mol/L的硫酸铵水溶液39mL,于55℃保温30min;
(3)乳化:在55℃下将油相注入到水相中,用磁力搅拌器不断搅拌,直到无水乙醇完全挥发,得到空白脂质体初品36.5mL;
(4)整粒:将空白脂质体初品于超声波分散仪上超声分散4min,功率为600~800w,整粒后采用0.45微米的微孔滤膜过滤3次,0.22微米的微孔滤膜过滤1次,得到空白脂质体34mL;
(5)制造脂质体内外跨膜梯度:采用超滤法,用9%蔗糖溶液置换空白脂质体外水相的硫酸铵溶液,超滤7次,得到空白脂质体30.4mL;
(6)载药、孵化:称取马来酸匹杉琼80.4mg溶于28mL上述空白脂质体中,用0.1mol/L氢氧化钠调节pH至7.02,55℃孵化1h,得到马来酸匹杉琼脂质体a3;
(7)保存:马来酸匹杉琼脂质体用0.22μm微孔滤膜除菌分装,4℃保存。
实施例4
(1)油相:称取DSPC 450.8mg,CHO 150.4mg,DSPE-PEG2000 150.3mg,溶于3.9mL无水乙醇,加热溶解后于55℃保温30min;
(2)水相:配制0.2mol/L的硫酸铵水溶液39mL,于55℃保温30min;
(3)乳化:在55℃下将油相注入到水相中,用磁力搅拌器不断搅拌,直到无水乙醇完全挥发,得到空白脂质体初品36.2mL;
(4)整粒:将空白脂质体初品于超声波分散仪上超声分散4min,功率为600~800w,整粒后采用0.45微米的微孔滤膜过滤3次,0.22微米的微孔滤膜过滤1次,得到空白脂质体34.4mL;
(5)制造脂质体内外跨膜梯度:采用超滤法,用9%蔗糖溶液置换空白脂质体外水相的硫酸铵溶液,超滤7次,得到空白脂质体31mL;
(6)载药、孵化:称取马来酸匹杉琼42.8mg溶于28mL上述空白脂质体中,用0.1mol/L氢氧化钠调节pH至7.01,55℃孵化1h,得到马来酸匹杉琼脂质体a4;
(7)保存:马来酸匹杉琼脂质体用0.22μm微孔滤膜除菌分装,4℃保存。
实施例5
(1)油相:称取DSPC 449.9mg,CHO 149.8mg,DSPE-PEG2000 149.6mg,溶于3.9mL无水乙醇,加热溶解后于55℃保温30min;
(2)水相:配制0.2mol/L的硫酸铵水溶液39mL,于55℃保温30min;
(3)乳化:在55℃下将油相注入到水相中,用磁力搅拌器不断搅拌,直到无水乙醇完全挥发,得到空白脂质体初品32.8mL;
(4)整粒:将空白脂质体初品于超声波分散仪上超声分散4min,功率为600~800w,整粒后采用0.45微米的微孔滤膜过滤3次,0.22微米的微孔滤膜过滤1次,得到空白脂质体31mL;
(5)制造脂质体内外跨膜梯度:采用透析法,用体积为5L的9%蔗糖溶液为透析液,透析12小时,得到空白脂质体;
(6)载药、孵化:称取马来酸匹杉琼53.6mg溶于28mL上述空白脂质体中,用0.1mol/L氢氧化钠调节pH至6.96,55℃孵化1h,得到马来酸匹杉琼脂质体a5;
(7)保存:马来酸匹杉琼脂质体用0.22μm微孔滤膜除菌,4℃保存。
实施例6
(1)油相:称取DSPC 449.2mg,CHO 149.0mg,DSPE-PEG2000 148.8mg,溶于3.9mL无水乙醇,加热溶解后于65℃保温30min;
(2)水相:配制0.2mol/L的硫酸铵水溶液39mL,于65℃保温30min;
(3)乳化:在65℃下将油相注入到水相中,用磁力搅拌器不断搅拌,直到无水乙醇完全挥发,得到空白脂质体初品35.2mL;
(4)整粒:将空白脂质体初品于超声波分散仪上超声分散4min,功率为600~800w,整粒后采用0.45微米的微孔滤膜过滤3次,0.22微米的微孔滤膜过滤1次,得到空白脂质体32.9mL;
(5)制造脂质体内外跨膜梯度:采用超滤法,用9%蔗糖溶液为置换液,置换空白脂质体外水相硫酸铵溶液,超滤7次,得到30.4mL空白脂质体;
(6)载药、孵化:称取马来酸匹杉琼53.7mg溶于28mL上述空白脂质体中,用0.1mol/L氢氧化钠调节pH至6.91,65℃孵化1h,得到马来酸匹杉琼脂质体a6;
(7)保存:马来酸匹杉琼脂质体用0.22μm微孔滤膜除菌,4℃保存。
实施例7
(1)油相:称取HSPC 450.3mg,CHO 150.1mg,PEG-DSPE2000 149.6mg,溶于3.9mL无水乙醇中,加热溶解后,于55℃水浴保温30min;
(2)水相:配制0.2mol/L硫酸铵水溶液39mL,于55℃水浴保温30min;
(3)乳化:在55条件℃下,将油相注入到水相中,用磁力搅拌器搅拌,直到乙醇完全挥发,得到空白脂质体初品35mL;
(4)整粒:将空白脂质体初品于超声波分散仪上超声分散4min,功率为600~800w,整粒后采用0.45微米的微孔滤膜过滤3次,0.22微米的微孔滤膜过滤1次,得到空白脂质体33mL;
(5)制造脂质体内外跨膜梯度:采用超滤法,用9%蔗糖溶液置换空白脂质体外水相的硫酸铵溶液,超滤7次,得到30.6mL空白脂质体;
(6)载药、孵化:取空白脂质体28mL,加入2.8mL组氨酸缓冲液,测定混合液pH6.55,称取53.4mg马来酸匹杉琼溶于上述混合液中,加热溶解,在55℃水浴中孵化1h,得到马来酸匹杉琼脂质体a7;
(7)保存:马来酸匹杉琼脂质体用0.22μm微孔滤膜过滤除菌,4℃保存。
实施例8
(1)油相:称取HSPC 450.7mg,CHO 150.2mg,PEG-DSPE2000 149.9mg,溶于3.9mL无水乙醇中,加热溶解后,于55℃水浴保温30min;
(2)水相:配制0.2mol/L硫酸铵水溶液39mL,于55℃水浴保温30min;
(3)乳化:在55条件℃下,将油相注入到水相中,用磁力搅拌器搅拌,直到乙醇完全挥发,得到空白脂质体初品34.6mL;
(4)整粒:将空白脂质体初品于超声波分散仪上超声分散4min,功率为600~800w,整粒后采用0.45微米的微孔滤膜过滤3次,0.22微米的微孔滤膜过滤1次,得到空白脂质体33.1mL;
(5)制造脂质体内外跨膜梯度:采用超滤法,用9%蔗糖溶液置换空白脂质体外水相的硫酸铵溶液,超滤7次,得到31.2mL空白脂质体;
(6)载药、孵化:取空白脂质体28mL,加入3.5mL磷酸二氢钠-磷酸氢二钠缓冲液,测定混合液pH7.03,称取53.5mg马来酸匹杉琼溶于上述混合液中,加热溶解,在55℃水浴中孵化1h,得到马来酸匹杉琼脂质体a8;
(7)保存:马来酸匹杉琼脂质体用0.22μm微孔滤膜过滤除菌,4℃保存。
实施例9
(1)油相:称取DSPC 15.08g,CHO 5.03g,DSPE-PEG2000 5.05mg,溶于0.13L无水乙醇,加热溶解后于55℃保温30min;
(2)水相:配制0.2mol/L的硫酸铵水溶液1.3L,于55℃保温30min;
(3)乳化:在55℃下将油相注入到水相中,用磁力搅拌器不断搅拌,通入氮气,直到无水乙醇完全挥发,得到空白脂质体初品1.19L;
(4)整粒:空白脂质体粗品用高压均质机在不同压力下高压均质,均质压力分别为200bar、405bar、805bar、1010bar、1300bar每个压力2min,在最大压力1300bar时均质10min,均质后将空白脂质体通过挤出器挤出,循环挤出10次,挤出频率20Hz,滤膜孔径为0.1μm,得到空白脂质体1.08L;
(5)制造脂质体内外跨膜梯度:采用超滤法,用9%蔗糖溶液置换空白脂质体外水相的硫酸铵溶液,超滤7次,得到空白脂质体0.99L;
(6)载药、孵化:称取马来酸匹杉琼1.86g溶于0.97L上述空白脂质体中,用0.1mol/L氢氧化钠调节pH至6.99,55℃孵化1h,得到马来酸匹杉琼脂质体a9;
(7)保存:马来酸匹杉琼脂质体用0.22μm微孔滤膜除菌分装,4℃保存。
- 还没有人留言评论。精彩留言会获得点赞!