对虾miR‑35在对虾抗病毒和抑制人肿瘤转移中的应用的制作方法
本发明涉及一条miRNA的应用,尤其是涉及了一种对虾miR-35在对虾抗病毒和抑制人肿瘤转移中的应用,这更有利于了解miRNA跨物种调控的机制。
背景技术:
MicroRNA(miRNA)是小的非编码RNA,约由18-25个核苷酸组成,很多miRNA在不同物种中都是高度保守的。MiRNA是调控基因表达的重要因子,它们参与基因转录后水平的调控。它们通过种子序列与靶基因3’端非编码区域(3’UTR)直接结合,从而抑制靶基因的翻译或介导靶基因的降解。
对虾作为重要的水产品之一,具有很大的商业价值。然而,由于对虾白斑综合症病毒(WSSV)等病毒感染而引起的对虾疾病成为对虾养殖的棘手问题。在病毒感染对虾后,对虾体内miRNA的表达谱发生明显变化,说明miRNA可能参与对虾的抗病毒免疫反应。因此,可以将宿主和病毒miRNA作为靶点,通过影响对虾体内病毒的感染和复制来减轻病毒感染引起的对虾疾病,同时提高对虾的免疫防御能力。
以往研究表明,水稻的miR-168a能够抑制哺乳动物低密度脂蛋白受体衔接蛋白基因(LDLRAP1)的表达水平,这个基因表达的下降会促使肝脏低密度胆固醇水平的上升;金银花编码的miR-2911,能够广泛作用于流感病毒(包括H1N1、H5N1和H7N9);外源的miRNA可以通过胎盘传递给胎儿,影响胎儿的基因表达。这说明植物miRNA能够进入动物体内并“跨界”影响动物的生理活性,发挥生物学功能。前期研究结果表明,巨噬细胞分泌的CHI3L1蛋白可以促进肿瘤细胞的迁移。因此,可以将巨噬细胞中的CHI3L1蛋白作为肿瘤治疗的靶点。
技术实现要素:
为了解决背景技术中存在的问题,本发明的目的在于克服现有技术中存在的上述不足,而筛选获得到一条miRNA(miRNA-35),这条miRNA既能抑制WSSV病毒对对虾的感染,又能通过作用于CHI3L1 3’UTR来抑制肿瘤细胞的迁移。
本发明的对虾miR-35为对虾特有的miRNA,通过测序获得其碱基序列为SEQ ID NO.1:5’-AACUGUGAGAAGUUCCGGU-3’。
本发明对虾病害防治的应用针对的是对虾白斑综合症病毒(WSSV)。
本发明抑制人肿瘤转移的应用针对的肿瘤细胞是乳腺癌细胞MDA-MB-231。
所述的对虾miR-35抑制作用的靶基因为人单核细胞系THP-1细胞诱导分化后的M2型巨噬细胞中的CHI3L1基因。
本发明的有益效果是:
本发明对虾miRNA-35不仅可以抑制病毒在对虾体内的感染和复制,发挥抗病毒作用,还能与CHI3L1mRNA 3’UTR相互作用,敲低巨噬细胞内CHI3L1基因的表达,从而影响肿瘤细胞的转移。
附图说明
图1是miR-35对对虾体内WSSV拷贝数的影响。
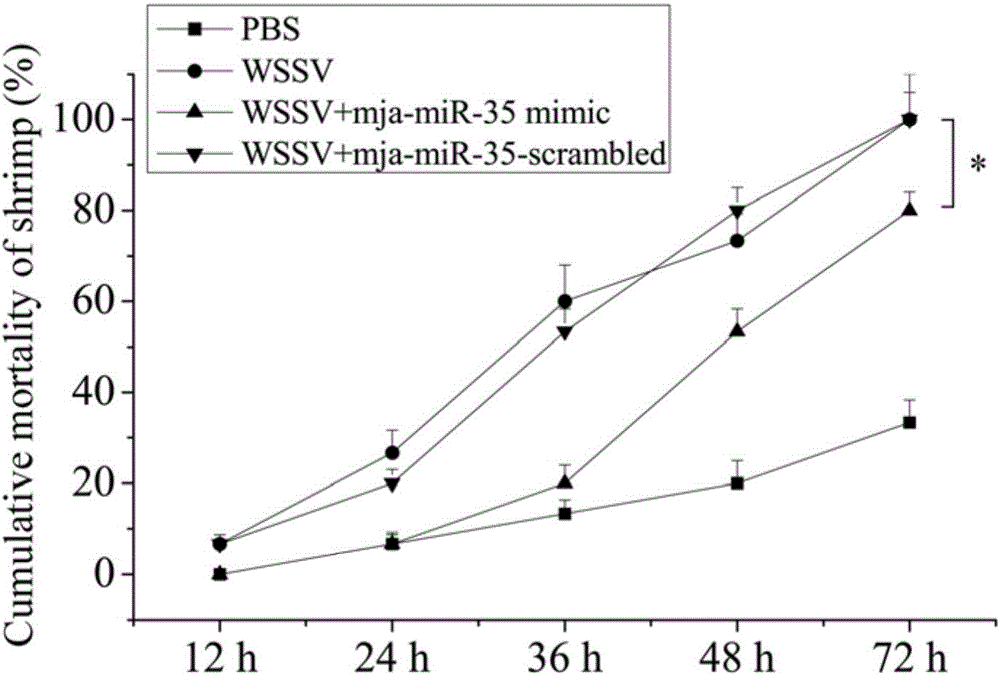
图2是miR-35对对虾死亡率的影响。
图3是miR-35对M2型巨噬细胞内CHI3L1基因表达量的影响。
图4是miR-35对M2型巨噬细胞内CHI3L1蛋白表达量的影响。
图5是miR-35对乳腺癌细胞MDA-MB-231迁移的影响。
具体实施方式
下面结合附图和实施例对本发明作进一步说明。
本发明的实施例如下:
实施例先制备实验样本:
对虾miR-35、阴性对照miRNA和control miRNA具体均是利用In vitro Transcription T7Kit(Takara)体外转录获得。
制备用于对虾病害防治实施例的阴性对照miRNA,阴性对照miRNA的碱基序列为SEQ ID NO.2:5’-UAAGCGUAGUAUUGCAGCG-3’。
制备用于抑制人肿瘤转移实施例的control miRNA,control miRNA的碱基序列为SEQ ID NO.3:5’-UUCUCCGAACGUGUCACGUUU-3’。
实施例1
1)配制实验组和对照组:
实验组,将对虾miR-35与稀释于磷酸盐缓冲溶液(PBS)的WSSV病毒液同时注射到对虾体内,对虾miR-35注射30μg miRNA的剂量,WSSV病毒液中含有104个WSSV病毒粒子;
第一对照组,将阴性对照miRNA与稀释于磷酸盐缓冲溶液(PBS)的WSSV病毒液同时注射到对虾体内,阴性对照miRNA注射30μg miRNA的剂量,WSSV病毒液中含有104个WSSV病毒粒子;
第二对照组,将稀释于磷酸盐缓冲溶液(PBS)的WSSV病毒液单独注射到对虾体内,WSSV病毒液中含有104个WSSV病毒粒子;
第三对照组,将磷酸盐缓冲溶液(PBS)单独注射到对虾体内,PBS溶液中不含WSSV病毒粒子。
2)然后按照以下方式进行两方面的实验:
A)实验组、第一对照组、第二对照组和第三对照组中,在注射对虾24h、36h和48h后,收集各组对虾的腮丝,提取腮丝中的基因组,通过real-time PCR检测其中的病毒拷贝数。
病毒拷贝数结果如图1所示,图中可见将对虾miR-35与WSSV病毒液同时注入对虾之后,对虾体内的病毒拷贝数较只注射WSSV病毒液组和同时注射阴性对照miRNA与WSSV病毒液组均有显著下降,说明对虾miR-35可以有效抑制病毒的感染和复制。
B)实验组、第一对照组、第二对照组和第三对照组中,在注射对虾12h、24h、36h、48h和72h后,计数各组对虾的死亡率。
对虾的死亡率结果如图2所示,图中可见将对虾miR-35与WSSV病毒液同时注入对虾之后,对虾的死亡率较只注射WSSV病毒液组和同时注射阴性对照miRNA与WSSV病毒液组均有显著下降,说明对虾miR-35可以有效提高对虾的存活率。
实施例2
1)获得M2型巨噬细胞,M2型巨噬细胞由THP-1单核细胞诱导分化而来,具体方法为:先以320nM丙二醇甲醚醋酸酯(PMA)处理THP-1细胞6h,再以20ng/ml白细胞介素4(IL-4)和白细胞介素13(IL-13)继续处理THP-1细胞18h。
2)配制实验组和对照组:
实验组:利用lipo RNAiMAX转染试剂(Invitrogen)将对虾miR-35转染到M2型巨噬细胞中,转染48h后,收集细胞及其培养上清。
第一对照组:利用lipo RNAiMAX转染试剂(Invitrogen)将control miRNA转染到M2型巨噬细胞中,转染48h后,收集细胞及其培养上清。
第二对照组:M2型巨噬细胞不做任何处理,48h后,收集细胞及其培养上清。
3)然后按照以下方式进行两方面的实验:
A)对于实验组、第一对照组和第二对照组,均提取收集的M2型巨噬细胞中的RNA,并检测CHI3L1基因的表达情况,结果如图3所示,图中可见转染对虾miR-35之后,M2型巨噬细胞内CHI3L1基因mRNA水平的表达量发生了显著下调,说明对虾miR-35可以有效抑制CHI3L1基因的表达。
B)对收集的M2型巨噬细胞进行Western blot试验,检测CHI3L1蛋白水平的变化。结果如图4所示,图中可见转染对虾miR-35之后,M2型巨噬细胞内CHI3L1蛋白水平的表达量发生了显著下调,进一步说明对虾miR-35可以有效抑制CHI3L1基因的表达。
C)将收集的M2型巨噬细胞培养上清与乳腺癌细胞MDA-MB-231于transwell中共培养,其中transwell上室铺上无血清培养基重悬的MDA-MB-231细胞,transwell下室为M2型巨噬细胞培养上清。共培养12h后,检测迁移至transwell下层膜的MDA-MB-231细胞,并用显微镜计数。
计数获得的乳腺癌细胞MDA-MB-231迁移结果情况如图5所示,图中可见当M2型巨噬细胞中转染对虾miR-35后,与之共培养的乳腺癌细胞MDA-MB-231的迁移能力显著下降,说明对虾miR-35可以有效抑制乳腺癌细胞MDA-MB-231的迁移。
由上述实施例可见,本发明的对虾miRNA-35既能抑制病毒在对虾体内的感染和复制,发挥抗病毒作用,还能与CHI3L1mRNA 3’UTR相互作用,敲低巨噬细胞内CHI3L1基因的表达。
本发明涉及到的RNA序列如下:
SEQ ID NO.1:对虾miR-35
来源:人工合成
序列:5’-AACUGUGAGAAGUUCCGGU-3’;
SEQ ID NO.2:阴性对照miRNA
来源:人工合成
序列:5’-UAAGCGUAGUAUUGCAGCG-3’;
SEQ ID NO.3:control miRNA
来源:人工合成
序列:5’-UUCUCCGAACGUGUCACGUUU-3’。
- 还没有人留言评论。精彩留言会获得点赞!