DC靶向猪蓝耳病PLGA纳米佐剂灭活疫苗及其制备方法与流程
本发明涉及一种疫苗及其制备方法,具体为DC靶向猪蓝耳病PLGA纳米佐剂灭活疫苗及其制备方法,属于生物疫苗技术领域。
背景技术:
猪蓝耳病又称猪繁殖与呼吸综合征(PRRS),是由PRRS病毒(PRRSV)引起,以母猪繁殖障碍和仔猪呼吸系统疾病为主要特征的高度接触性、高致死率烈性传染病。自美国1987年报道以来,近年来己经遍布全球各个主要养猪国家,是被国际兽医局(OIE)通报的动物A类烈性传染病之一,为高发病率和高死亡率的重大传染病。自从2006年6月起,一场被称为“高热病”或“无名高热症”的疫病在我国南方一些猪场以不同数量和规模呈灾难性暴发,以后几乎席卷全国,2006年入冬至2007年,“猪高热病”已由急性转为慢性持续感染,主要侵害母猪和仔猪。至今该病仍然不断发生,是目前猪场内最难解决的重大疫病。猪蓝耳病的发生给我国养殖业造成很大的经济损失,目前还没有有效的药物能对其彻底治愈,对母猪和仔猪进行免疫预防是控制猪蓝耳病最为经济有效的方法,但现行的猪蓝耳病灭活疫苗和减毒活疫苗免疫应答较迟缓且效果不理想。
技术实现要素:
为弥补现有技术的不足,本发明提供一种新型的DC靶向猪蓝耳病PLGA纳米佐剂灭活疫苗及其制备方法,能有效防控猪蓝耳病病毒,解决了蓝耳病给养殖业带来的经济损失。本发明的技术方案如下:
一种DC靶向猪蓝耳病PLGA纳米佐剂灭活疫苗(10头份),包括以下物质:PRRSV TCID50=5×105-5×107,甘露糖1-20wt%,PLGA0.01-5wt%,Poly(I:C)0.01-5wt%,PLGA为本领域熟知的聚乳酸-羟基乙酸共聚物。
本发明同时请求保护所述的DC靶向猪蓝耳病PLGA纳米佐剂灭活疫苗的制备方法,该方法包括如下步骤:
S1.制备PLGA纳米佐剂灭活疫苗;
S2.合成甘露糖修饰的PLGA纳米佐剂疫苗。
进一步的,所述的步骤S1为:
a.制备W2相:PVA加入到水中,全部溶解;
b.制备O相:PLGA加入到二氯甲烷中,全部溶解;
c.制备W1相:Poly(I:C)与PRRSV混合,溶解充分;
d.将W1相加入到O相中,进行超声波处理得到混合物Ⅰ;
e.将混合物Ⅰ加入到W2相中,进行超声乳化后除去二氯甲烷得到混合物Ⅱ;
f.将混合物Ⅱ离心除去上清液,保留沉淀即为PLGA纳米佐剂疫苗。进一步的,所述的步骤S2为:
a.向步骤S1得到的PLGA纳米佐剂疫苗中分别加入1-10wt%N-羟基琥珀酰亚胺和1-10wt%二环己基碳二亚胺溶液,混合均匀;
b.将步骤a混合均匀的液体置于透析袋中透析6-8小时,除去多余的N-羟基琥珀酰亚胺、二环己基碳二亚胺;
c.向经透析后的液体中加入乙二胺,用浓盐酸调节pH至5.0,形成铵化PLGA;
d.将1-20wt%甘露糖溶解于0.1mol/L醋酸钠溶液中,将甘露糖-醋酸钠溶液加入到步骤c得到的铵化PLGA中,在37℃震荡处理2天;
e.将步骤d处理后的液体离心,得到沉淀,用生理盐水洗涤、重悬沉淀即得甘露糖修饰的PLGA纳米佐剂疫苗。
进一步的,所述的W2相中PVA的质量分数为0.25-1.25%。
进一步的,所述超声乳化的条件为:时间110s,0.6s/次,55%。
PLGA是无毒的生物可降解聚合物,在美国已被FDA批准上市,产品用于药用辅料、生物医用材料。包括药物缓释剂、控释制剂载体(包括冠脉支架载药材料),如阿霉素缓释剂,多肽类生物降解缓释微球等,也用于多种疫苗载体,如HIV、乙肝、口蹄疫等。Poly(I:C)中文名字为聚肌胞苷酸,为多聚肌苷酸的共聚物,药理研究和临床工作证实,聚肌胞是及时高效的内源性干扰素诱导剂,又是免疫调节剂,具有广谱抗病毒、抗肿瘤作用、刺激吞噬作用和增强机体免疫功能作用。另外,大量实验证明甘露糖可以靶向结合树突状细胞的甘露糖受体。故本课题拟采用甘露糖修饰PLGA纳米佐剂,加入Poly(I:C)辅佐PRRSV,加快及增强对PRRSV的细胞免疫应答,以期有效防控猪蓝耳病毒,解决蓝耳病给养殖业带来的经济损失。
本发明的有益效果如下:本发明利用甘露糖残基修饰PLGA,辅以Poly(I:C)为刺激剂,制备DC靶向猪蓝耳病PLGA纳米佐剂灭活疫苗。利用甘露糖残基修饰PLGA,旨在构建具有甘露糖受体的树突状细胞(DC)、巨噬细胞的靶向性疫苗的输送系统;加入Poly(I:C)在于增强免疫猪只免疫力,加强细胞免疫应答;采用无毒可降解材料PLGA为载体制备纳米疫苗,目的在于延缓病毒的释放时间、降低药物的毒害性、延长药物的半衰期。
附图说明
图1为本发明的纳米佐剂疫苗激光粒度检测结果图;
图2为本发明的纳米佐剂疫苗的病毒释放曲线图;
图3为本发明的纳米佐剂疫苗红外光谱检测图;
图4为本发明硫酸苯酚法测多糖含量标准曲线图;
图5为本发明的纳米佐剂疫苗淋巴细胞增殖结果图;
图6为本发明的纳米佐剂疫苗ELISPOT检测结果图。
其中:1、甘露糖修饰PLGA纳米佐剂疫苗,2、PLGA纳米佐剂疫苗。
具体实施方式
下面结合具体实施例对本发明做进一步说明,如无特殊说明,所用原料均市售可得,作为优选,食用小苏打购于山东海天生物化工有限公司。按照如下表1配方制备DC靶向猪蓝耳病PLGA纳米佐剂灭活疫苗:
表1
实施例1
制备PLGA纳米佐剂疫苗
(1)W2相:用30mL蒸馏水配制0.25wt%的PVA(聚乙烯醇)溶液,放入转子,用封口膜封口,放在恒温加热磁力搅拌器中,恒温加热磁力搅拌器加水没过铁圈,调节适宜的转速,调节电压最大,待水沸腾后,调节电压逐渐减小,直至PVA全部溶解后取出。
(2)O相:取5mL离心管,加入2mL二氯甲烷,称量0.01wt%PLGA(聚乳酸羟基乙酸)加入到二氯甲烷中,在涡旋振荡器上震荡,直至PLGA全部溶解。
(3)W1相:称取0.01wt%Poly(I:C)(聚肌苷酸-聚胞苷酸)放入1mL离心管中,与TCID50=5×105PRRSV(高致病性猪繁殖与呼吸综合征灭活病毒)混合,将混合体系加入到离心管中,震荡溶解。
(4)把W1相中的物质加入到O相中,放入冰盒中,W1/O于新芝超声仪1min,振幅80%,2s。
(5)把W1/O相中的物质加入到W2相中,放入冰盒中,W1/O/W2超声乳化110s(UP400型超声仪,振幅55%,0.6s)。
(6)吸取步骤(5)超声乳化的液体于载玻片上,在倒置显微镜下观察,W1/O/W2相放在恒温加热磁力搅拌器中,室温搅拌3h以除去二氯甲烷。
(7)W1/O/W2相合并于离心管中,10000rpm离心15min,弃上清,用蒸馏水洗涤,按上述步骤反复洗涤三次。
合成甘露糖修饰的PLGA纳米佐剂疫苗
(1)称取1wt%N-羟基琥珀酰亚胺和1wt%二环己基碳二亚胺分别用蒸馏水溶解,加入PLGA纳米佐剂疫苗中混匀。
(2)混匀后置于透析袋中透析6h,除去多余的N-羟基琥珀酰亚胺、二环己基碳二亚胺。
(3)取出透析袋,将液体倒入离心管中,加入96μL乙二胺,此时PH为9.0,用浓盐酸调节其PH至5.0,形成铵化PLGA。
(4)将1wt%甘露糖溶解于1mL的0.1mol/L醋酸钠溶液中,加入上述溶液中,37℃震荡2天。
(5)将上述溶液取出离心8000rpm,10min,弃上清,用生理盐水洗涤,重复洗涤两次。最后用生理盐水将沉淀重悬,为甘露糖修饰的PLGA纳米佐剂疫苗。
实施例2
制备PLGA纳米佐剂疫苗
(1)W2相:用30mL蒸馏水配制0.75wt%的PVA(聚乙烯醇)溶液,放入转子,用封口膜封口,放在恒温加热磁力搅拌器中,恒温加热磁力搅拌器加水没过铁圈,调节适宜的转速,调节电压最大,待水沸腾后,调节电压逐渐减小,直至PVA全部溶解后取出。
(2)O相:取5mL离心管,加入2mL二氯甲烷,称量0.5wt%PLGA(聚乳酸羟基乙酸)加入到二氯甲烷中,在涡旋振荡器上震荡,直至PLGA全部溶解。
(3)W1相:称取0.1wt%Poly(I:C)(聚肌苷酸-聚胞苷酸)放入1mL离心管中,与TCID50=5×106PRRSV(高致病性猪繁殖与呼吸综合征灭活病毒)混合,将混合体系加入到离心管中,震荡溶解。
(4)把W1相中的物质加入到O相中,放入冰盒中,W1/O新芝超声仪超声1min,80%振幅,2s。
(5)把W1/O相中的物质加入到W2相中,放入冰盒中,W1/O/W2超声乳化110s(UP400型超声仪55%振幅,0.6s)。
(6)吸取步骤(5)超声乳化的液体于载玻片上,在倒置显微镜下观察,W1/O/W2相放在恒温加热磁力搅拌器中,室温搅拌3h以除去二氯甲烷。
(7)W1/O/W2相合并于离心管中,10000rpm离心15min,弃上清,用蒸馏水洗涤,按上述步骤反复洗涤三次。
合成甘露糖修饰的PLGA纳米佐剂疫苗
(8)称取3.5wt%N-羟基琥珀酰亚胺和4.5wt%二环己基碳二亚胺分别用蒸馏水溶解,加入PLGA纳米佐剂疫苗中混匀。
(9)混匀后置于透析袋中透析6h,除去多余的N-羟基琥珀酰亚胺、二环己基碳二亚胺。
(10)取出透析袋,将液体倒入离心管中,加入96μL乙二胺,此时PH为9.0,用浓盐酸调节其pH至5.0,形成铵化PLGA。
(11)将5wt%甘露糖溶解于1mL的0.1mol/L醋酸钠溶液中,加入上述溶液中,37℃震荡2天。
(12)将上述溶液取出离心8000rpm,10min,弃上清,用生理盐水洗涤,重复洗涤两次。最后用生理盐水将沉淀重悬,为甘露糖修饰的PLGA纳米佐剂疫苗。
实施例3
制备PLGA纳米佐剂疫苗
(1)W2相:用30mL蒸馏水配制1.25wt%的PVA(聚乙烯醇)溶液,放入转子,用封口膜封口,放在恒温加热磁力搅拌器中,恒温加热磁力搅拌器加水没过铁圈,调节适宜的转速,调节电压最大,待水沸腾后,调节电压逐渐减小,直至PVA全部溶解后取出。
(2)O相:取5mL离心管,加入2mL二氯甲烷,称量5wt%PLGA(聚乳酸羟基乙酸)加入到二氯甲烷中,在涡旋振荡器上震荡,直至PLGA全部溶解。
(3)W1相:称取5wt%Poly(I:C)(聚肌苷酸-聚胞苷酸)放入1mL离心管中,与TCID50=5×107PRRSV(高致病性猪繁殖与呼吸综合征灭活病毒)混合,将混合体系加入到离心管中,震荡溶解。
(4)把W1相中的物质加入到O相中,放入冰盒中,W1/O新芝超声仪超声1min,80%振幅,2s。
(5)把W1/O相中的物质加入到W2相中,放入冰盒中,W1/O/W2超声乳化110s(UP400型超声仪55%振幅,0.6s)。
(6)吸取步骤(5)超声乳化的液体于载玻片上,在倒置显微镜下观察,W1/O/W2相放在恒温加热磁力搅拌器中,室温搅拌3h以除去二氯甲烷。
(7)W1/O/W2相合并于离心管中,10000rpm离心15min,弃上清,用蒸馏水洗涤,按上述步骤反复洗涤三次。
合成甘露糖修饰的PLGA纳米佐剂疫苗
(8)称取6wt%N-羟基琥珀酰亚胺和8wt%二环己基碳二亚胺分别用蒸馏水溶解,加入PLGA纳米佐剂疫苗中混匀。
(9)混匀后置于透析袋中透析6h,除去多余的N-羟基琥珀酰亚胺、二环己基碳二亚胺。
(10)取出透析袋,将液体倒入离心管中,加入96μL乙二胺,此时pH为9.0,用浓盐酸调节其pH至5.0,形成铵化PLGA。
(11)将20wt%甘露糖溶解于1mL的0.1mol/L醋酸钠溶液中,加入上述溶液中,37℃震荡2天。
(12)将上述溶液取出离心8000rpm,10min,弃上清,用生理盐水洗涤,重复洗涤两次。最后用生理盐水将沉淀重悬,为甘露糖修饰的PLGA纳米佐剂疫苗。
实施例4-纳米粒径的检测
取上述甘露糖修饰的PLGA纳米佐剂疫苗。用激光粒度分析仪测定粒径及分布,见图1。激光粒度仪检测,DC靶向猪蓝耳病PLGA纳米佐剂灭活疫苗粒度为434.8nm。
实施例5-包封率、载药量测定
包封率(EE%)=W包/W药×100%
载药量(DL%)=W包/W总×100%
式中W药:投入的总药量(mg)
W总:纳米粒的总重量(mg)
W包:纳米粒中包裹的药物量(mg)
结果:包封率约为46.9%,载药量约为6.36%。
实施例6-安全性检测
分别给50只小白鼠腹腔注射上述样品,正常饲养一个月,观察其生长状况,结果未表现体温、采食、精神等方面的异常反应。
实施例7-二喹啉甲酸法(BCA法)蛋白测定
(1)将实施例1得到的DC靶向猪蓝耳病PLGA纳米佐剂灭活疫苗离心3次后得到的沉淀加蒸馏水,定容至10ml。
(2)取3个1.5ml离心管,每个加入步骤(1)所得溶液0.5ml,离心10000rpm,10min,去上清,各加入0.1mol/L NaOH 1ml,吹散沉淀,置于37℃摇床1h,BCA法测定。
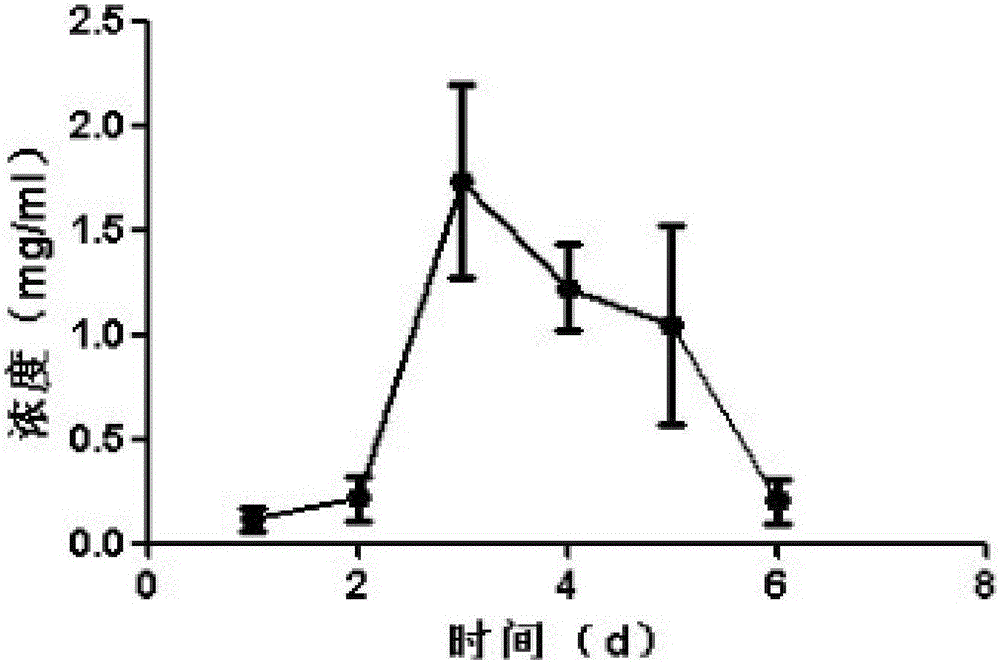
(3)取3个1.5mL离心管,编号1、2、3,每个加入步骤(2)所得溶液1.5ml,置于37℃摇床,每天取80微升,离心10000rpm,10min,BCA法测定上清蛋白含量,观察病毒释放曲线,结果见图2。
实施例8-红外光谱分析
(1)将实施例1得到的DC靶向猪蓝耳病PLGA纳米佐剂灭活疫苗冷冻干燥处理。
(2)研磨溴化钾和DC靶向猪蓝耳病PLGA纳米佐剂灭活疫苗冻干粉直至粉状。
(3)粉末压片机排气:使用时首先将手轮调节压力丝杠顶好,并将放油阀手轮顺时针拧好,不要拧的过紧,上下摆动手把,待压力表指针向上运动后停止加压,压力不要过高,松开排气阀后会听到排气声,然后将排气阀拧紧,逆时针开放油阀手轮,松开压力丝杠。
(4)将模具放在压片机工作空间中央位置,上下摆动手把。同时观察压力表示值读数,当达到所需压力后停止加压,保持1min,取出压制好的样品。
(5)记录数据,并整理分析,见图3。
实施例9-硫酸苯酚法测多糖含量
精密量取D-甘露糖对照品溶液50μg/ml 0ml、0.2ml、0.4ml、0.6ml、0.8ml、1.0ml,分别置具塞试管中,各加水至1ml,再加3%苯酚溶液1ml,摇匀,迅速加入硫酸4.5ml,摇匀,放置至室温,以0管为空白,于200-650nm波长之间扫描,D-甘露糖衍生物在490nm处有最大吸收,故选择490nm为检测波长。在490nm处测定吸光度,以对照品浓度(x)为横坐标,吸光度(y)为纵坐标,进行线性回归,得回归方程为y=16.284x-0.0685(r=0.9991)。结果表明D-甘露糖衍生物浓度在10.2~51μg/ml范围内与吸光度呈良好线性关系,符合Lambert‐Beer定律,说明根据吸光度来计算供试品中D-甘露糖含量是可靠的。
(1)标准曲线的建立,如图4所示。
(2)疫苗中甘露糖的测定结果见表2。
表2样品总糖含量测定结果
实施例10-DC靶向猪蓝耳病PLGA纳米佐剂灭活疫苗免疫临床观察
在规模化养猪场取5头母猪窝产仔猪,每窝8头,共40头17-22日龄仔猪,分三组,分别注射DC靶向猪蓝耳病PLGA纳米佐剂灭活疫苗2ml(含1头份)、市售猪蓝耳病减毒活疫苗2ml(含1头份)和生理盐水2ml,进行临床观察,结果:免疫纳米佐剂灭活疫苗和市售减毒活疫苗猪与对照组比较,在体温、采食、生产速度等临床表现方面没有明显区别。说明免疫纳米佐剂灭活疫苗和市售减毒活疫苗未表现副作用。
实施例11-淋巴细胞增殖实验
按上述免疫一个月后采血,分离单个核淋巴细胞,用淋巴细胞增殖实验检测T细胞病原特异性增殖和非特异性增殖。
1)猪外周血单个核细胞的分离。将新鲜采集的猪外周静脉血,用肝素抗凝。用1.5倍体积的RPMI-1640培养基稀释,之后按l:l比例将其沿管壁缓慢加至淋巴细胞分离液液面上,2000r/min离心20分钟。之后细胞分为四层,第一层为血浆或者组织匀浆液层;第二层为环状乳白色淋巴细胞富集层;第三层为透明分离液层:第四层为红细胞层。吸出中间环状乳白色PBMC富集层,加入等体积RPMI-1640培养基进行漂洗,2000r/min离心10分钟,漂洗2次后获得PBMC。把新鲜分离的PBMC使用1ml RPMI-1640培养基重悬。
2)猪外周血单个核细胞的染色与计数。细胞悬液与0.08wt%的台盼蓝溶液按照1:1的比例充分混匀(终浓度为0.04wt%),之后置于倒置显微镜下观察计数。
3)淋巴细胞增殖实验
a.利用动物外周血淋巴细胞分离液提取淋巴细胞。
b.1000rpm离心10min,弃去上清,用红细胞裂解液重悬。
c.洗涤,1000rpm离心6min,重复两次。
d.进行细胞计数后,分别加入96孔板中,5×105个/孔。
e.加入刺激物,分别为TJM-F92(MOI=0.01)、PRRSV(MOI=0.01)、阳性对照PHA(20μg/mL)、阴性对照LPS(10ng/mL)、空白对照,在37℃培养箱中培养70h。
f.加入MTT溶液10μL/孔,放入37℃培养箱中孵育4h。
g.终止孵育,小心吸去孔内液体,加入二甲亚砜100μL/孔,轻轻震荡是充分混匀后在490nm和630nm处检测吸光度。结果见图5,DC靶向猪蓝耳病PLGA纳米佐剂灭活疫苗免疫猪后,其淋巴细胞对于非特异性刺激物LPS和PHA及特异性抗原高致病性蓝耳病疫苗毒株(TJM-F92)和野毒株(TJ-F10毒株)的细胞免疫反应都明显好于市售疫苗和对照组(*p<0.05,**p<0.01)。
实施例12-ELISPOT检测
上述试验猪群在免疫一个月后采血,分离单个核淋巴细胞,用ELISPOT实验检测IFNγ分泌水平。
1)蓝耳病病毒多肽池设计与合成
选用NetMHC4服务器多肽MHCI类分子结合人工神经网络(ANN)预测。多肽序列来自于NCBI中查找的病毒蛋白氨基酸序列,利用计算机软件进行设计,选出nm最小的,以及rank值最小的,即为最可能有效的多肽表位。
2)ELISpot检测方法
a.取出市售已包被IFNγ抗体的PVDF膜板,用无菌PBS/HBSS洗板5次,200μl/孔。
b.封闭,加入含有10wt%胎牛血清的RPMI-1640培养基,室温孵育30min。
c.将细胞调整至2×105个/孔,100μl/孔,检测孔分别加入10μl不同浓度稀释的病毒刺激物,阳性对照加PHA,浓度10μg/ml;阴性对照每孔加入110μl的细胞液,空白对照每孔加入110μl的RPMI-1640培养基;均设复孔。
d.将培养板放入37℃,5%CO2培养箱中,培养24h。
e.弃去培养液,用无菌PBS/HBSS洗板5次,200μl/孔。
f.用含0.5%胎牛血清的PBS/HBSS稀释生物素标记抗IFNγ至1μg/ml,100μl/孔,室温2h。
g.弃去培养液,用无菌PBS/HBSS洗板5次,200μl/孔,用含0.5%胎牛血清的PBS/HBSS稀释碱性磷酸酶标记的链霉亲和素至1g/ml,100μl/孔,室温2h。
h.弃去培养液,用无菌PBS/HBSS洗板5次,200μl/孔,加入底物显色15min,直至斑点出现。结果见图6,表明DC靶向猪蓝耳病PLGA纳米佐剂灭活疫苗免疫猪后,其淋巴细胞对蓝耳病GP5蛋白多肽池产生较强的反应,表现在产生IFNγ明显增多(*p<0.001)。
- 还没有人留言评论。精彩留言会获得点赞!
- 靶向PD-1的多肽及其应用的制造方法与工艺
- 靶向同位素生产系统的制造方法与工艺
- 在制备68GA‑螯合物官能化的靶向剂中用作金属抑制剂的单糖、二糖或多糖的制造方法与工艺
- 用于引导和靶向按需物质递送的纳米结构的载体的制造方法与工艺
- 通过PROSTRATIN靶向K‑RAS介导的信号转导通路和恶性肿瘤的制造方法与工艺
- 肿瘤靶向核磁共振/荧光双模态成像造影剂及其制备和应用的制造方法与工艺
- pH氧化还原双敏感的PAMAM靶向纳米给药载体及其制备方法与制造工艺
- 具有卵巢肿瘤靶向D构型多肽及其基因递释系统的制造方法与工艺
- 靶向survivin纳米抗体及其制备方法和应用与制造工艺
- 用于PSMA靶向的成像和放射疗法的金属/放射性金属标记的PSMA抑制物的制造方法与工艺
- 阻断UBE2M介导Neddylation修饰在肾细胞癌治疗中的应用的制造方法与工艺
- 无载体共组装肿瘤靶向抗癌纳米药物及其制备方法与应用与流程
- 一种用于判断靶向单克隆抗体治疗肿瘤疗效的预测分子的制造方法与工艺
- 一种靶向CD47的免疫检查点抑制剂药物组合物及其制备方法与流程
- 具有淋巴靶向功能的生物自组装纳米晶注射剂及制备方法与流程
- 用于检测肝癌的基因标志物及其用途的制造方法与工艺
- 特异性shRNA筛选及其靶向Ang‑2基因抑制肺癌细胞的验证方法与流程
- 一种多功能自动化生物细胞提取分离控制系统及采用该系统实现的细胞提取分离方法与流程
- 一种融合蛋白及光敏剂复合物及其制备方法和应用与流程
- 具有可视化和显示光斑边界功能的光动力治疗系统的制造方法与工艺
- 肿瘤靶向核磁共振/荧光双模态成像造影剂及其制备和应用的制造方法与工艺
- pH氧化还原双敏感的PAMAM靶向纳米给药载体及其制备方法与制造工艺
- 具有卵巢肿瘤靶向D构型多肽及其基因递释系统的制造方法与工艺
- 靶向survivin纳米抗体及其制备方法和应用与制造工艺
- 用于PSMA靶向的成像和放射疗法的金属/放射性金属标记的PSMA抑制物的制造方法与工艺
- 一种线粒体靶向的粘度荧光探针及其制备方法和应用与制造工艺
- 一种兼具荧光可视、磁靶向和pH敏多功能的复合空心微球药物载体及其制备方法与制造工艺
- 一种用于修饰微泡的多肽以及靶向GBM的药物制剂的制造方法与工艺
- 白果内酯作为脑靶向增效剂在制备防治脑肿瘤药物的应用的制造方法与工艺
- 机器人辅助精确靶向穿刺软组织目标柔性针夹紧固定装置的制造方法
- 一种用于判断靶向单克隆抗体治疗肿瘤疗效的预测分子的制造方法与工艺
- 一种检测肺癌相关基因热点突变的试剂盒及其应用的制造方法与工艺
- 一种为肺癌提供离体个体化药物测试的方法及培养基与流程
- 一种谷胱甘肽/超声双重刺激响应纳米聚合物囊泡、其制备方法及应用与流程
- 一种多重刺激响应交联型聚合物纳米水凝胶、其制备方法及应用与流程
- 一种靶向CD47的免疫检查点抑制剂药物组合物及其制备方法与流程
- 具有淋巴靶向功能的生物自组装纳米晶注射剂及制备方法与流程
- 用于检测肝癌的基因标志物及其用途的制造方法与工艺
- 特异性shRNA筛选及其靶向Ang‑2基因抑制肺癌细胞的验证方法与流程
- 一种具有靶向功能仿病毒结构高分子囊泡及其制备与应用的制造方法与工艺