HOXA1在制备抗肿瘤药物中的用途的制作方法
本发明涉及一种针对hoxa1分子的肿瘤免疫治疗新方法,属细胞生物学、分子生物学领域及临床应用领域,具体涉及肺癌患者肿瘤组织mdscs流式分选、hoxa1表达载体构建及其在肿瘤治疗中的应用。
背景技术:
肿瘤诱导的免疫抑制是造成肿瘤逃逸的重要机制,它不仅能够阻止天然的肿瘤免疫监视,而且也限制了针对肿瘤的免疫治疗。肿瘤微环境诱导体内多种不同的免疫抑制细胞大量产生,包括调节性t细胞、肿瘤相关的巨噬细胞等。这些肿瘤诱导产生的抑制细胞对肿瘤特异性的效应性t细胞产生抑制效应,从而有利于肿瘤的进一步发展和恶化。近年来,越来越多的研究发现,肿瘤患者及荷瘤小鼠体内存在着一群具有免疫抑制功能的髓源性抑制细胞(myeloidderivedsuppressorcells,mdscs),它们能够负向调节免疫应答,有效地抑制t细胞介导的抗瘤免疫应答,促进肿瘤的生长。
mdscs作为一群异质性细胞,由未成熟的骨髓细胞组成。在健康人体内,这些未成熟的骨髓细胞迅速分化成为成熟的粒细胞、巨噬细胞、dc细胞。在一些病理条件下,如肿瘤、炎症等,这些未成熟的骨髓细胞分化被阻断从而导致mdscs大量扩增。小鼠体内,mdscs根据骨髓细胞分化抗原cd11b,gr1进行分型,故其表型为cd11b+gr1+。根据gr1两个特异性表位ly6g和ly6c的不同将mdscs又进一步分为粒细胞样mdscs(granulocyticmdscs,g-mdscs)和单核细胞样mdscs(monocyticmdscs,m-mdscs)。其中g-mdscs的表型为cd11b+ly6g+ly6clow,m-mdscs的表型为cd11b+ly6g-ly6chi。人类mdscs表型为lin-cd14-cd11b+cd33+cd34+hla-dr-/lo,并且在cd15以及其他标记的表达上存在差异。mdscs主要通过其产生的免疫抑制分子如精氨酸酶(arginase1,arg-1)、诱导性一氧化氮合酶(iduciblenitricoxidesynthase,inos)和活性氧(reactiveoxygenspecies,ros)发挥对t细胞介导的抗肿瘤免疫的抑制作用。除此以外,mdscs还可以通过诱导cd4+cd25+foxp3+调节性t细胞(treg)的产生来下调效应性t细胞的功能。
在人类基因组中存在四种hox基因:hoxa、hoxb、hoxc与hoxd。这四种hox基因簇能够有效的调节胚胎发育且在哺乳动物体内具有高度的保守性。其中hoxa基因簇由hoxa1~7、9、10、11、13组成,它们在血细胞生成过程中发挥着重要的作用。已有研究证实hoxa1与hoxa9高表达于成熟的中性粒细胞并能够调控中性粒细胞吞噬功能。xueqingzhang等人的研究表明:在白血病细胞中,hoxa1低表达;在使用全反式维甲酸诱导nb4白血病细胞发育成为成熟粒细胞过程中,随着细胞的成熟hoxa1的表达显著上调。同时,在髓系前体细胞分化过程中,hoxa1可以促进其分化成粒细胞而抑制髓系前体细胞分化成为dc。目前有研究证实lncrnahotairm1可以靶向作用于hoxa1进而调控粒细胞的发育成熟。抑制nb4细胞中lncrnahotairm1的表达后,hoxa1的表达随之出现显著地下调,此时全反式维甲酸无法继续有效地促进nb4细胞发育为成熟粒细胞。
mdscs本质上就是一群具有免疫抑制功能的未成熟髓系细胞,并且主要由未成熟粒细胞组成。目前针对mdscs的抗肿瘤免疫治疗策略主要包括以下几种:1.促进骨髓细胞的分化;2.抑制mdscs增殖;3.抑制mdscs功能;4.药物清除mdscs。因此,通过有效的手段,对mdscs的活化、分化以及功能进行调控,将会有效控制肿瘤诱导的免疫抑制的形成,从而有利于抗瘤免疫治疗的进行,抑制肿瘤的发生和发展。而hoxa1在mdscs活化、扩增及免疫抑制功能中发挥的作用目前未见报道。
技术实现要素:
本发明的目的在于提供hoxa1在肿瘤免疫治疗中的新用途。
本发明在实验中发现hoxa1能够调控肿瘤条件下髓源性抑制细胞(myeloid-derivedsuppressorcells,mdscs)的免疫抑制效应。首次发现:与癌旁组织相比,肺癌患者肿瘤组织来源mdscs中hoxa1的表达显著下调。检测了hoxa1过表达对mdscs免疫抑制效应的调控,发现在髓系前体细胞分化过程中,hoxa1分子可以促进其分化成粒细胞而抑制髓系前体细胞分化成为dc。此外,hoxa1分子的表达随着粒细胞的成熟逐渐上调。hoxa1分子在肺癌患者肿瘤组织/外周血来源mdscs中低表达,且与mdscs效应分子arg1的表达呈负相关。在手术切除肿瘤组织后,肺癌患者外周血中hoxa1分子表达显著升高。
结果证实:促进mdscs中hoxa1的表达,能够有效下调mdscs的免疫抑制效应,增强体内th1/ctl细胞介导抗肿瘤免疫应答,进而延缓肿瘤的发展进程。
基于以上发现,本发明提供了以下技术方案:
本发明公开了hoxa1在制备治疗肿瘤药物中的应用。
所述的抗肿瘤药物是指抑制mdscs的免疫抑制功能的药物。
进一步,所述应用是构建hoxa1过表达载体,用于制备抗肿瘤药物的用途。即hoxa1过表达载体在制备肿瘤免疫治疗药物中的用途。
所述的肿瘤为肺癌。
所述的过表达载体是利用真核表达载体pcdna3.1构建的pcdna3.1-hoxa1,可以促进hoxa1在细胞中的表达,调控mdscs的免疫抑制效应。其它真核表达载体如慢病毒载体、腺病毒载体以及腺相关病毒载体也可以用于构建hoxa1过表达载体。
还公开了一种人髓源抑制性细胞分选方法,具体操作如下:首先利用胶原酶消化肺癌患者肿瘤组织制成细胞悬液,随后细胞悬液加入抗人cd11b、抗人cd33、抗人cd14以及抗人hla-dr单抗进行流式染色30min后,最后使用ariaii流式细胞仪进行细胞检测与分选。
本发明通过利用生物学技术,首次证实hoxa1对mdscs免疫抑制功能的调控。我们发现,促进hoxa1的表达能够下调mdscs的免疫抑制功能,进而延缓肿瘤的生长。因此,将hoxa1作为抗肿瘤治疗的靶点,对肿瘤的免疫治疗具有重要的意义。
附图说明
图1是:hoxa1在肺癌患者mdscs中的表达;
图2是:hoxa1对肿瘤发展进程的影响;
图3是:hoxa1对肿瘤发展过程中mdscs免疫抑制分子的调控;
图4是:hoxa1对th1、ctl细胞介导的抗肿瘤免疫的调控。
具体实施方式
下面结合具体实施例对本发明所述的技术方案作进一步的详细说明。
实施例1:肺癌患者肿瘤组织来源mdscs中hoxa1的检测
(1)肺癌患者肿瘤、癌旁组织细胞悬液的制备
新鲜组织称重后剪碎至1-2mm3。随后按照10ml/0.27g加入组织消化液(sigma公司),在37℃水浴中消化2h,每10min吹打一次。消化后结束后,用筛网过滤掉残余组织团块,4℃、500g离心5min后,弃去上清保留细胞沉淀。随后利用ack裂解红细胞,pbs洗涤后4℃、500g离心5min,弃去上清保留细胞沉淀。
(2)体外诱导mdscs
ficoll梯度离心分离健康人外周血pbmcs后,按照1×107/孔种于6孔板,随后加入40ng/mlgm-csf(peprotech公司)与40ng/mlil-1β(peprotech公司)刺激4天。刺激结束后,收集细胞使用免疫磁珠分选cd33+细胞。
(3)流式细胞仪检测分选cd33+cd11b+cd14-hla-dr-mdscs
细胞悬液加入抗人cd11b(ebioscience公司)、抗人cd33(ebioscience公司)、抗人cd14(ebioscience公司)以及抗人hla-dr单抗(ebioscience公司)进行流式染色30min后,使用ariaii流式细胞仪进行细胞检测与分选。
(4)肺癌患者外周血样本收集及处理
①k2edta抗凝外周静脉血2ml,18℃2000rpm/min离心5min,收集上层血浆于ep管中,保存于-80℃冰箱备用。
②收集到的血细胞使用6~8mlack重悬,室温下静置10min后500g离心5min。
③弃去上清,细胞沉淀用10mlpbs缓冲液洗涤两次,每次500g离心5min。
④弃去上清,细胞沉淀弹匀。
(5)qrt-pcr检测法
收集待检测细胞,加入1mltrizol,颠倒混匀数次,抽提总rna,逆转录合成cdna。以cdna作为模板,加入相应目的基因检测引物进行pcr。采用biorad(cfx96)荧光定量pcr仪上进行检测。以β-actin计算目的基因相对表达量。
(6)qrt-pcr检测mdscs中hoxa1的表达
1)trizol(invitrogen公司)提取细胞rna,经逆转录获得cdna,qrt-pcr检测hoxa1的表达量。逆转录试剂采用toyobo公司的revertraaceqpcrrtkit(codeno.:fsq-101)。
2)qrt-pcr检测hoxa1的表达:
人hoxa1引物序列:
humanhoxa1forward:5’-tcacggaactggagaaggag-3’,(seqid.1)
humanhoxa1reverse:5’-ggagagatgggcaagagacc-3’,(seqid.2)
人β-actin引物序列:
humanβ-actinforward:5’-cacgaaactaccttcaactcc-3’,(seqid.3)
humanβ-actinreverse:5’-catactcctgcttgctgatc-3’,(seqid.4)
实时荧光定量pcr反应程序:95℃5min,95℃10s,60℃30s,72℃30s,扩增30个循环。采用-△ct法计算hoxa1的相对表达量。
如图1所示,与癌旁组织相比,肺癌患者肿瘤组织中cd33+cd11b+cd14-hla-dr-细胞中,hoxa1表达显著下调(图1a)。与pbmcs相比较,gm-csf+il-1β诱导的mdscs中hoxa1表达显著下调(图1b)。与健康对照相比,肺癌患者外周血中hoxa1的表达显著下调(n=300),且与mdscs比例(n=100)和arg1的表达(n=300)呈现明显的负相关(图1c-d)。在肺癌患者接受手术治疗后,外周血中hoxa1的表达显著升高(n=35)(图1e)。
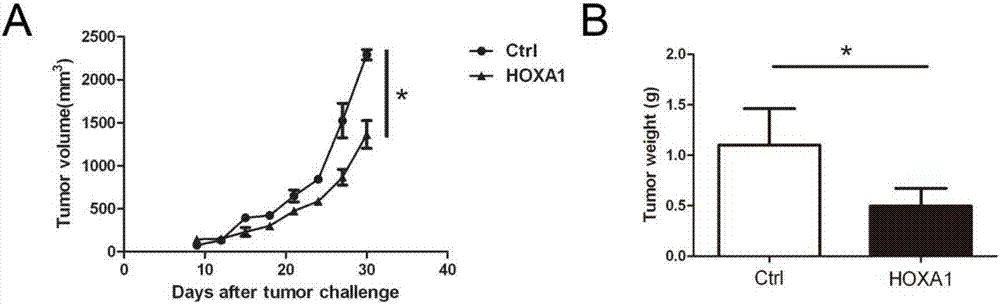
实施例2:hoxa1对肿瘤发生发展的影响
(1)细胞体外培养:体外在5%co2、37℃条件下用10%小牛血清dmem培养lewis肺癌细胞,取对数生长期进行后续实验。
(2)肺癌移植瘤模型的建立:取6~8周龄雄性c57bl/6小鼠,在超净台中用医用酒精消毒小鼠右侧腹壁皮肤,每只小鼠皮下注射1x106个细胞/200μl。
(3)将荷瘤小鼠分为两组:ctrl组与hoxa1组。在肿瘤植入第七天后,每三天肿瘤局部注射pcdna3.1vector或pcdna3.1-hoxa1,连续注射2-4周。在这期间,每2天测量一次肿瘤大小,以公式体积=0.5×长×宽2来计算肿瘤的体积。最后一次注射24h后处死小鼠,称取肿瘤重量。
如图2所示,在肿瘤局部高表达hoxa1后,能够有效延缓肿瘤的生长,肿瘤重量显著减轻(图2a-b)。
实施例3:hoxa1对肿瘤发展过程中mdscs免疫抑制分子的调控
(1)荷瘤小鼠肿瘤组织mdscs分选
1)制备荷瘤小鼠肿瘤组织细胞悬液:超净台中小心剥离完整的肿瘤组织到玻璃平皿中,称重后将肿瘤组织剪碎至1-2mm3。随后按照10ml/0.27g加入组织消化液,在37℃水浴中消化2h,每10min吹打一次。消化后结束后,用筛网过滤掉残余组织团块,4℃、500g离心5min后,弃去上清保留细胞沉淀。
2)流式细胞术检测肿瘤局部mdscs的比例
取1×106ctrl组和hoxa1组小鼠肿瘤组织细胞于1mlep管中,重悬于100μlpbs中,加入pe-anti-mouse-gr1和pe/cy5-anti-mouse-cd11b抗体或对应的同型抗体各0.25μg。4℃避光混匀30min,用pbs洗涤后细胞重悬于200μlpbs,fcm检测cd11b+gr1+mdscs比例。
3)磁珠分选mdscs:4℃、500g离心5min,弃去上清,保留细胞沉淀,按照350μlpbe缓冲液/108个细胞重悬细胞沉淀后按照50μl/108个细胞加入fcr阻断剂,充分混匀,4℃孵育10min。在这之后按照100μl/108个细胞加入anti-cd11b-biotin,4℃孵育10min。孵育结束后,用pbe洗涤细胞(5ml/108个细胞),4℃、500g离心5min后弃去上清。按照800μl/108个细胞加入pbe缓冲液重悬细胞后按照200μl/108个细胞加入anti-biotin-microbeads,充分混匀,4℃孵育15min。孵育结束后,加入pbe进行洗涤,4℃、300g离心10min,弃去上清,细胞沉淀用500μlpbe缓冲液重悬混匀。将ls分离柱放置在磁性分离器上,先用3mlpbe缓冲液润洗分离柱,加入细胞悬液,再用pbe缓冲液洗涤分离柱3次,每次3ml。将ls分离柱撤移磁性分离器,用pbe缓冲液将结合在磁柱上的细胞冲洗下来,收集细胞悬液,计数后4℃、500g离心5min,小心弃去上清,保留细胞沉淀。
4)比色法检测mdscs中arg1的活性
向肿瘤来源mdscs中加入ripa裂解液50μl混匀后,冰上放置30min,每10min在涡流振荡器上震荡一次。4℃、14000g离心10min,保留上清以备后续检测。
①配制1mm尿素标准品、5×底物缓冲液
5×底物缓冲液:精氨酸酶缓冲液(8μl)+锰缓冲液(2μl)
1mm尿素标准品:尿素标准品(6μl)+h2o(44μl)
②加样
空白孔:50μlh2o
标准孔:50μl1mm尿素标准品
样本空白孔:40μl样本稀释液
样本孔:样本稀释液(40μl)+5×底物缓冲液(10μl)
37℃孵育1h后每孔加200μlureareagant,样本空白孔中加入5×底物缓冲液(10μl/孔),室温条件下放置15min。
③520nm测吸光度。
④计算精氨酸酶活性
5)fcm检测mdscs中ros的表达水平
向肿瘤组织来源mdscs中加1mlpbs将细胞重悬后,向细胞悬液中加入1μlpma(10μg/ml)、0.5μlh2dcfda(2.5μm),37℃孵育1h。4℃、500g离心5min,弃去上清,细胞沉淀用pbs重悬4℃、500g离心5min(重复两次)。细胞沉淀加入200μlpbs混匀,用流式细胞仪检测mdscs中ros的表达。
如图3所示,促进肿瘤局部hoxa1的表达后,肿瘤局部mdscs比例显著下调。促进肿瘤局部hoxa1的表达后,能够抑制mdscs中效应分子arg1的活性与ros的表达(图3b-c)。
实施例4:hoxa1对th1、ctl细胞介导的抗肿瘤免疫的调控
(1)fcm检测小鼠脾脏、局部引流淋巴结th1和ctl细胞比例
将脾脏细胞、淋巴结细胞悬液按照1.0×106/孔加入24孔板中,加入50ng/mlpma、1μg/ml离子霉素和1μg/ml莫能霉素刺激4~6h,收集细胞,进行荧光抗体染色:
①收集细胞于1.5mlep管中,pbs洗涤2次后,4℃500g5min,弃掉上清,将细胞重悬于100μlpbs中,分别加入pe/cy5-anti-mousecd3、fitc-anti-mouse
cd4、fitc-anti-mousecd8各0.25μg。4℃避光孵育30min。
②4℃500g5min,弃掉上清,用lmlicpermeabilization重悬细胞,4℃避光孵育10min。
③使用lmlicpermeabilization洗涤缓冲液洗涤,4℃500g5min,弃掉上清。重复2次。
④用40μlicpermeabilization重悬细胞。加入pe-anti-mouseifn-γ0.25μg,4℃避光孵育45min。
⑤使用lmlicpermeabilization洗涤缓冲液洗涤,4℃500g5min,弃掉上清。重复2次。细胞重悬于300μlpbs。
(2)荷瘤小鼠肿瘤组织中th1和ctl细胞比例
①分离荷瘤小鼠肿瘤组织中淋巴细胞:将消化好的肿瘤组织细胞重悬于5ml的80%percoll分离液中,上面缓慢加入5ml40%percoll,25℃3000rpm离心20min,缓升缓降。80%和40%percoll两液面之间的白膜层即为富集的淋巴细胞。小心吸出淋巴细胞,用pbs洗涤后,4℃500g5min,弃上清。
②取淋巴细胞进行流式荧光染色,流程同上。
通过流式细胞仪(bd公司,facscalibur)进行检测,flowjo软件分析数据。
如图4所示,促进肿瘤局部hoxa1的表达能够显著上调荷瘤小鼠脾脏、肿瘤中cd3+cd4+ifn-γ+th1比例。促进肿瘤局部hoxa1的表达能够显著上调脾脏、肿瘤、淋巴结中cd3+cd8+ifn-γ+ctl细胞介导的抗肿瘤免疫应答(图4a-b)。
sequencelisting
<110>镇江市第一人民医院
<120>hoxa1在制备抗肿瘤药物中的用途
<130>
<160>4
<170>patentinversion3.3
<210>1
<211>20
<212>dna
<213>人工序列
<400>1
tcacggaactggagaaggag20
<210>2
<211>20
<212>dna
<213>人工序列
<400>2
ggagagatgggcaagagacc20
<210>3
<211>21
<212>dna
<213>人工序列
<400>3
cacgaaactaccttcaactcc21
<210>4
<211>20
<212>dna
<213>人工序列
<400>4
catactcctgcttgctgatc20
- 还没有人留言评论。精彩留言会获得点赞!
- 一种抗肿瘤药物奈拉滨化合物的制造方法与工艺
- 四苯基卟啉连二胺芳基钌化合物及其制备方法和用途与制造工艺
- 一种具抗肿瘤活性的不对称双1‑取代5‑N杂靛红席夫碱类化合物的合成方法与制造工艺
- 一种具抗肿瘤活性的不对称双7‑N杂靛红席夫碱类化合物的合成方法与制造工艺
- 一种具抗肿瘤活性的不对称双取代靛红席夫碱类化合物及其合成方法与制造工艺
- 一种抗肿瘤药物奈拉滨组合物的制造方法与工艺
- 含Micranthanone A用于抗肿瘤的药物的制造方法与工艺
- 一种小分子靶向药物脂质体制剂的制备方法与制造工艺
- 一种5?溴?1H?吡咯并[2,3?b]吡啶的合成方法
- 一种作用于EGFR敏感突变激酶EGFR<sup>L858R</sup>,EGFR<sup>(d746-750)</sup>的6-取代氨基嘌呤类化合物及 ...的制作方法