一种载青蒿素类药物及金属卟啉类化合物的纳米粒及其制备方法和应用与流程
本发明涉及一种药物复方纳米粒制剂,特别涉及一种青蒿素和卟啉的复方纳米粒制剂。
背景技术:
:
青蒿素类药物是从中草药黄花蒿(artemisiaannualinn)中分离得出的具有过氧桥的倍半萜内酯,具有吸收速度快、分布广、排泄和代谢快及高效、低毒等优点,临床主要用于治疗疟疾(疟原虫的抑制率高达100%)、红斑狼疮、肿瘤等疾病。在青蒿素的基础上又开发了一些衍生物,如:双氢青蒿素、蒿甲醚、青蒿琥酯等。这些衍生物保留了青蒿素的过氧桥结构,相比于青蒿素稳定性更好,疗效增强。复方青蒿素和各类联合用药的青蒿素类药物成为目前临床上治疗疟疾的一线药物。
但青蒿素类药物仍存在一些问题,如药物水溶性差、半衰期短、生物利用度低等,为了克服这些缺点,常常需要联合用药。近年来的临床报道和体外监测反应显示,青蒿素类药物治疗疟疾的体外敏感性呈下降趋势,目前主要通过联合用药和增加给药剂量的方式延缓疟疟原虫产生抗药性。此外,青蒿素在使用过程中还面临疟原虫复燃率高的问题。因此,通过合理用药、开发新剂型、研发复方制剂等来解决上述问题,对提高药物溶解度和生物利用度,降低用药剂量和提高疗效,以及延缓抗药性的产生十分有意义。
目前研究表明,青蒿素类药物所含的过氧中心是该类化合物抗疟作用的关键,缺少过氧中心的脱氧青蒿素则无抗疟活性。以治疗疟疾为例,有研究认为,疟原虫侵入红细胞时,可消化宿主的血红蛋白以合成自身的蛋白质,同时产生大量有毒性的亚铁血红素。当青蒿类药物作用于疟原虫时,其过氧基可以被虫体内丰富的亚铁血红素断裂而生成氧自由基,进一步通过重排形成碳自由基,随后烷基化血红素,形成的血红素-青蒿素复合物能抑制血红素聚合过程,从而导致毒性血红素的释放和疟原虫的死亡。也有研究认为,青蒿类药物与亚铁血红素作用,过氧桥断裂形成的是碳正离子中间体,碳正离子中间体可通过烷基化作用、氧化膜脂质、干扰线粒体的功能,与疟原虫或肿瘤细胞的蛋白质作用从而发挥疗效。
由此可见,青蒿素类药物的活性与亚铁血红素的作用密切相关。亚铁血红素由铁原子及原卟啉区组成,其合成的最终步骤为原卟啉ix在亚铁螯合酶的作用下与fe2+生成亚铁血红素,因此提高原卟啉ix的细胞内浓度,将促进亚铁血红素的生物合成,从而高效激发青蒿素类药物的抗疟、抗肿瘤等的疗效。此外,研究表明包括原卟啉ix在内的金属卟啉类化合物,也具有一定的抗疟疾、抗肿瘤活性。
文献报道,青蒿素类药物和卟啉类联用,对人结肠癌细胞株hct116的杀伤力显著提高,30μm的青蒿素类药物,癌细胞抑制率约为35%,而与原卟啉ix联用后抑制率约提高至80%。然而,现有报道中,两者合用虽然能提高青蒿素类药物疗效,但目前的常规给药系统尚无法达到令人满意的程度,药物水溶性差,副作用偏高,效价低。
本发明在现有技术的基础上,设计了一种全新的药物递送系统,将青蒿素类药物与金属卟啉类化合物制备成共同递送两种药物的纳米粒制剂,载青蒿素类药物及金属卟啉类化合物的纳米粒作为新型药物递送系统具有以下特征:
①采用纳米技术物理包裹难溶性青蒿素类药物及金属卟啉类化合物,显著提高药物溶解度、稳定性和生物利用度;
②借助纳米粒的高效摄取将药物递送至靶细胞;
③金属卟啉类化合物有效促进靶细胞内的亚铁血红素的生物合成,高效激发青蒿素类药物的活性;
④同时,在制备成纳米粒后,青蒿素类药物及金属卟啉类化合物可以充分发挥协同增效作用,可显著提高药物的生物利用度和药效。
技术实现要素:
本发明的目的是提供一种载青蒿素类药物及金属卟啉类化合物的复方纳米粒制剂。
本发明的纳米粒物理负载难溶性青蒿素类药物及金属卟啉类化合物,显著提高药物溶解度、稳定性和生物利用度,在体内借助纳米粒的高效摄取将药物递送至靶细胞,金属卟啉类化合物可有效促进靶细胞内的亚铁血红素的生物合成,从而高效激发青蒿素类药物的活性,同时青蒿素类药物及金属卟啉类化合物发挥联合用药疗效,该负载青蒿素类药物及金属卟啉类化合物的纳米粒可显著提高药物的生物利用度和药效。
本发明的另一个目的是提供本发明的纳米粒制剂的制备方法。
本发明的另一个目的是提供本发明的纳米粒制剂在临床中的应用。
为此,本发明提供一种载青蒿素类药物及金属卟啉类化合物的复方制剂。本发明的复方制剂,优选纳米粒制剂,所述制剂,由以下重量百分比例的原辅料制备而成:
其中,
所述的载青蒿素类药物选自:青蒿素、双氢青蒿素、蒿甲醚、青蒿琥酯、蒿乙醚中的任一种或多种混合物;优选蒿甲醚、青蒿琥酯、青蒿素和双氢青蒿素。
所述金属卟啉类化合物选自:原卟啉ix、氯化血红素、卟啉铜、卟啉镍、卟啉钴、卟啉锌、卟啉锰、铜原卟啉、镍原卟啉、钴原卟啉、锌原卟啉、锰原卟啉、四苯基卟啉铜、四苯基卟啉镍、四苯基卟啉钴、四苯基卟啉锌;优选原卟啉ix、锌原卟啉、铜原卟啉、镍原卟啉、钴原卟啉和锰原卟啉。
所述液体脂质选自:大豆油、玉米油、花生油、葵花籽油、橄榄油、蓖麻油、麻油、油酸、亚油酸、液体石蜡、中链脂肪酸甘油酯、长链脂肪酸甘油酯、月桂酸己酯、维生素e、莪术油、薏米仁油、青蒿油、松节油、茶油、薄荷油、香茅油、香叶油、2-辛基月桂醇、棕榈酸异丙脂中的任一种或多种混合物;
所述磷脂选自:蛋黄卵磷脂、大豆卵磷脂、氢化蛋黄卵磷脂、氢化大豆卵磷脂、人工合成卵磷脂。
所述固体脂质选自:三硬脂酸甘油三酯、三月桂酸甘油三酯、三肉豆蔻酸甘油三酯、三棕榈酸甘油三酯、单硬脂酸甘油酯、鲸蜡醇棕榈酸酯、十六酸鲸蜡酯、棕榈酰硬脂酰甘油酯、山嵛酸甘油酯、硬脂酸、硬脂醇、棕榈酸、月桂酸、二十二碳烷酸、胆固醇;
所述聚乙二醇衍生物选自:聚乙二醇-胆固醇衍生物、聚乙二醇-二硬脂酰基磷脂酰乙醇胺衍生物、聚乙二醇-1,2-二棕榈酰-sn-甘油-3-磷酰乙醇胺衍生物、聚乙二醇-脂肪酸甘油酯衍生物、聚乙二醇-脂肪胺衍生物、聚乙二醇-脂肪醇衍生物。
所述稳定剂选自:吐温80、吐温20、甘油、泊洛沙姆188、泊洛沙姆407、胆酸、脱氧胆酸、油酸、油酸钾盐、油酸钠盐中的任一种或几种。
所述溶剂选自:甲醇、乙醇、二氯甲烷、三氯甲烷、乙酸乙酯、乙腈、甲酰胺、n,n-二甲基甲酰胺、四氢呋喃、二甲基亚砜中的任一种或几种;
本发明进一步提供所述的纳米粒制剂的制备方法,所述方法,操作步骤如下:将青蒿素类药物及金属卟啉类化合物用溶剂溶解,加入液体脂质、磷脂、固体脂质和聚乙二醇衍生物溶解,将稳定剂溶解于纯化水或注射用水,两种溶液混合后,经溶剂挥发或超声或高压均质处理,所得溶液用透析法或超滤法或柱分离法除去有机溶剂和小分子,分装后冻干制得粒径为10-1000nm的载药纳米粒制剂。
本发明的纳米粒制剂,可以为注射剂,口服制剂,外用制剂,优选为注射用冻干制剂,可以用于血管内或肌肉注射。
以下通过实验数据进一步说明本发明的有益效果:
药效学实验
一、抗疟疗效
1.蒿甲醚/原卟啉ix纳米粒的抗疟疗效
取-80℃保存的约氏疟原虫感染的冷冻血(感染率60%-70%)于冰盒中,解冻后涡旋,取健康雌性小鼠,按照0.2ml/只的剂量进行腹腔注射进行复苏,从复苏第3天开始涂片观察感染率。在复苏鼠感染率达到50%时,进行眼球取血,供下一步转染使用。
取健康雌性小鼠40只,每只注射大约0.2ml的复苏鼠血液,随机分为4组,1组为生理盐水,2组为蒿甲醚混悬液,3组为蒿甲醚纳米粒,4组为蒿甲醚/原卟啉ix纳米粒。每天同一时间点,连续口服灌胃药物4天,蒿甲醚给药剂量为3mg/kg,原卟啉ix给药剂量为1.5mg/kg。给药结束后第二天涂片观察感染率,按公式原虫抑制率=[(生理盐水组原虫感染率一给药组原虫感染率)/生理盐水组原虫感染率]×100%。
各组对约氏疟原虫的抑制率见表1,实验结果表明,蒿甲醚/原卟啉ix纳米粒抑制疟原虫增殖能力显著高于原料药物(蒿甲醚混悬液)和单独药物的纳米粒(蒿甲醚纳米粒),抑制率可达到97%。
表1各组制剂对小鼠约氏疟原虫的抑制率(%)。
2.青蒿琥酯/锌原卟啉纳米粒的抗疟疗效
取-80℃保存的约氏疟原虫感染的冷冻血(感染率60%-70%)于冰盒中,解冻后涡旋,取健康雌性小鼠,按照0.2ml/只的剂量进行腹腔注射进行复苏,从复苏第3天开始涂片观察感染率。在复苏鼠感染率达到50%时,进行眼球取血,供下一步转染使用。
取健康雌性小鼠40只,每只注射大约0.2ml的复苏鼠血液,随机分为4组,1组为生理盐水,2组为青蒿琥酯水溶液,3组为青蒿琥酯纳米粒,4组为青蒿琥酯/锌原卟啉纳米粒。每天同一时间点,连续口服灌胃药物4天,青蒿琥酯给药剂量为4mg/kg,锌原卟啉给药剂量为2mg/kg。给药结束后第二天涂片观察感染率,按公式原虫抑制率=[(生理盐水组原虫感染率一给药组原虫感染率)/生理盐水组原虫感染率]×100%。
各组对约氏疟原虫的抑制率见表2,实验结果表明,青蒿琥酯/锌原卟啉纳米粒抑制疟原虫增殖能力显著高于原料药物水溶液(青蒿琥酯溶液)和单独药物的纳米粒(青蒿琥酯纳米粒),抑制率可达到99%。
表2各组制剂对小鼠约氏疟原虫的抑制率(%)。
3.蒿甲醚/铜原卟啉纳米粒的抗疟疗效
取-80℃保存的约氏疟原虫感染的冷冻血(感染率60%-70%)于冰盒中,解冻后涡旋,取健康雌性小鼠,按照0.2ml/只的剂量进行腹腔注射进行复苏,从复苏第3天开始涂片观察感染率。在复苏鼠感染率达到50%时,进行眼球取血,供下一步转染使用。
取健康雌性小鼠40只,每只注射大约0.2ml的复苏鼠血液,随机分为4组,1组为生理盐水,2组为蒿甲醚混悬液,3组为蒿甲醚纳米粒,4组为蒿甲醚/铜原卟啉纳米粒。每天同一时间点,连续口服灌胃药物4天,蒿甲醚给药剂量为3mg/kg,铜原卟啉给药剂量为3mg/kg。给药结束后第二天涂片观察感染率,按公式原虫抑制率=[(生理盐水组原虫感染率一给药组原虫感染率)/生理盐水组原虫感染率]×100%。
各组对约氏疟原虫的抑制率见表3,实验结果表明,蒿甲醚/铜原卟啉纳米粒抑制疟原虫增殖能力显著高于原料药物混悬剂(蒿甲醚混悬液)和单独药物的纳米粒(蒿甲醚纳米粒),抑制率可达到97%。
表3各组制剂对小鼠约氏疟原虫的抑制率(%)。
4.青蒿素/镍原卟啉纳米粒的抗疟疗效
取-80℃保存的约氏疟原虫感染的冷冻血(感染率60%-70%)于冰盒中,解冻后涡旋,取健康雌性小鼠,按照0.2ml/只的剂量进行腹腔注射进行复苏,从复苏第3天开始涂片观察感染率。在复苏鼠感染率达到50%时,进行眼球取血,供下一步转染使用。
取健康雌性小鼠40只,每只注射大约0.2ml的复苏鼠血液,随机分为4组,1组为生理盐水,2组为青蒿素混悬液,3组为青蒿素纳米粒,4组为青蒿素/镍原卟啉纳米粒。每天同一时间点,连续口服灌胃药物4天,青蒿素给药剂量为25mg/kg,镍原卟啉给药剂量为5mg/kg。给药结束后第二天涂片观察感染率,按公式原虫抑制率=[(生理盐水组原虫感染率一给药组原虫感染率)/生理盐水组原虫感染率]×100%。
各组对约氏疟原虫的抑制率见表4,实验结果表明,青蒿素/镍原卟啉纳米粒抑制疟原虫增殖能力显著高于原料药物混悬液(青蒿素混悬液)和单独药物的纳米粒(青蒿素纳米粒),抑制率可达到94%。
表4各组制剂对小鼠约氏疟原虫的抑制率(%)。
5.双氢青蒿素/钴原卟啉纳米粒的抗疟疗效
取-80℃保存的约氏疟原虫感染的冷冻血(感染率60%-70%)于冰盒中,解冻后涡旋,取健康雌性小鼠,按照0.2ml/只的剂量进行腹腔注射进行复苏,从复苏第3天开始涂片观察感染率。在复苏鼠感染率达到50%时,进行眼球取血,供下一步转染使用。
取健康雌性小鼠40只,每只注射大约0.2ml的复苏鼠血液,随机分为4组,1组为生理盐水,2组为双氢青蒿素混悬液,3组为双氢青蒿素纳米粒,4组为双氢青蒿素/钴原卟啉纳米粒。每天同一时间点,连续口服灌胃药物4天,双氢青蒿素给药剂量为10mg/kg,钴原卟啉给药剂量为5mg/kg。给药结束后第二天涂片观察感染率,按公式原虫抑制率=[(生理盐水组原虫感染率一给药组原虫感染率)/生理盐水组原虫感染率]×100%。
各组对约氏疟原虫的抑制率见表5,实验结果表明,双氢青蒿素/钴原卟啉纳米粒抑制疟原虫增殖能力显著高于原料药物混悬液(双氢青蒿素混悬液)和单独药物的纳米粒(双氢青蒿素纳米粒),抑制率可达到98%。
表5各组制剂对小鼠约氏疟原虫的抑制率(%)。
6.双氢青蒿素/锰原卟啉纳米粒的抗疟疗效
取-80℃保存的约氏疟原虫感染的冷冻血(感染率60%-70%)于冰盒中,解冻后涡旋,取健康雌性小鼠,按照0.2ml/只的剂量进行腹腔注射进行复苏,从复苏第3天开始涂片观察感染率。在复苏鼠感染率达到50%时,进行眼球取血,供下一步转染使用。
取健康雌性小鼠40只,每只注射大约0.2ml的复苏鼠血液,随机分为4组,1组为生理盐水,2组为双氢青蒿素混悬液,3组为双氢青蒿素纳米粒,4组为双氢青蒿素/锰原卟啉纳米粒。每天同一时间点,连续口服灌胃药物4天,青蒿琥酯给药剂量为10mg/kg,锰原卟啉给药剂量为5mg/kg。给药结束后第二天涂片观察感染率,按公式原虫抑制率=[(生理盐水组原虫感染率一给药组原虫感染率)/生理盐水组原虫感染率]×100%。
各组对约氏疟原虫的抑制率见表6,实验结果表明,双氢青蒿素/锰原卟啉纳米粒抑制疟原虫增殖能力显著高于原料药物混悬液(双氢青蒿素混悬液)和单独药物的纳米粒(双氢青蒿素纳米粒),抑制率可达到96%。
表6各组制剂对小鼠约氏疟原虫的抑制率(%)。
二、抗肿瘤疗效
1.蒿甲醚/原卟啉ix纳米粒的抗肿瘤疗效
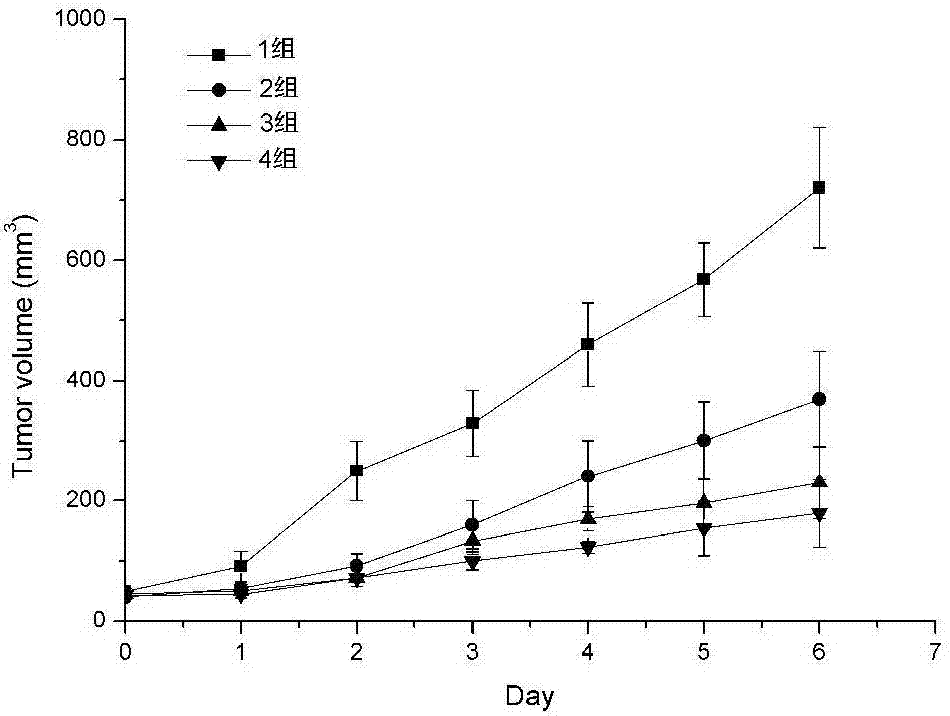
在无菌条件下,抽取小鼠腹腔内传代8~10天的肉瘤s180腹水,生理盐水稀释成1×107/ml的细胞悬液,充分混匀后,以0.2ml接种于小鼠右侧腋窝皮下。接种24小时后,随机分组,待用。按移植性肿瘤研究法接种s180肉瘤,接种24小时后,随机分成3组,每组10只,1组为生理盐水,2组为蒿甲醚纳米粒,3组为蒿甲醚/原卟啉ix纳米粒。以第一次给药计为第0天,按照20mg/kg的剂量,分别于0、2、4、6日尾静脉注射给药,停药后第2天处死解剖小鼠。
图1为小鼠的皮下实体瘤生长曲线。由图可知,包含蒿甲醚/原卟啉ix纳米粒组与生理盐水组相比,能显著抑制肿瘤生长的速度,且抑制效果强于单独药物的蒿甲醚纳米粒组。第六天时,包含蒿甲醚/原卟啉ix组肿瘤体积约为生理盐水组体积的32.11%,约为蒿甲醚纳米粒组体积的55.71%。
2.青蒿琥酯/锌原卟啉纳米粒的肿瘤疗效
在无菌条件下,抽取小鼠腹腔内传代8~10天的肉瘤s180腹水,生理盐水稀释成1×107/ml的细胞悬液,充分混匀后,以0.2ml接种于小鼠右侧腋窝皮下。接种24小时后,随机分组,待用。按移植性肿瘤研究法接种s180肉瘤,接种24小时后,随机分成4组,每组10只,1组为生理盐水,2组为青蒿琥酯水溶液,3组为青蒿琥酯纳米粒,4组为青蒿琥酯/锌原卟啉纳米粒。以第一次给药计为第0天,按照20mg/kg的剂量,分别于0、2、4、6日尾静脉注射给药,停药后第2天处死解剖小鼠。
图2为小鼠的皮下实体瘤生长曲线。由图可知,包含青蒿琥酯/锌原卟啉纳米粒组与生理盐水组相比,能显著抑制肿瘤生长的速度,且抑制效果强于单独药物的蒿甲醚纳米粒组。第六天时,包含青蒿琥酯/锌原卟啉纳米粒组肿瘤体积约为生理盐水组体积的24.83%,约为青蒿琥酯纳米粒组体积的77.82%。
本发明的纳米粒制剂的有益效果:
一、本发明实现青蒿素类药物和金属卟啉类化合物的联合用药,通过不同作用机制增强疟疾、肿瘤等疾病的治疗效果。
二、本发明提供的载青蒿素类药物和金属卟啉类化合物的纳米粒,对青蒿素类药物和金属卟啉类化合物具有较好的负载,例如通过该纳米粒的增溶作用,显著提高两种药物溶解度、稳定性和生物利用度。
三、本发明提供的载青蒿素类药物和金属卟啉类化合物的纳米粒,在体内可选择性的将药物递送至靶细胞,在靶细胞内,金属卟啉类化合物可有效促进亚铁血红素的生物合成,从而更高效激发青蒿素类药物的活性。
四、本发明提供的载青蒿素类药物及金属卟啉类化合物的纳米粒,可用于注射、口服、外用或粘膜给药,粒径可控制在10-1000nm。
附图说明:
图1蒿甲醚制剂给药后小鼠的皮下实体瘤生长曲线
图2青蒿琥酯制剂给药后小鼠的皮下实体瘤生长曲线
具体实施方式:
下面结合实施例对本发明作详细说明,但不仅限于下列实例。
不同的青蒿素及其衍生物、金属卟啉类化合物、液体脂质、磷脂、固体脂质与聚乙二醇衍生物等溶解于溶剂中,将稳定剂溶解于纯化水或注射用水,两种溶液混合后,经溶剂挥发或超声或高压均质处理,所得溶液用透析法或超滤法或柱分离法除去有机溶剂和小分子,冻干制得粒径为10~1000nm的载药纳米粒。
实施例1
负载青蒿素/原卟啉ix的纳米粒的制备和表征
1、制备工艺
(1)溶剂挥发法:
将2mg青蒿素、3mg原卟啉ix、100mg亚油酸、100mg橄榄油、50mg三肉豆蔻酸甘油三酯、50mg十六酸鲸蜡酯溶解于9ml三氯甲烷,氮气保护下加入250mg注射用大豆卵磷脂充分溶解,将150mg泊洛沙姆188溶解于2.25%(w/v)的甘油水溶液(10ml),将两溶液混合,高速分散后机械搅拌10min制成初乳,继续搅拌过夜,使三氯甲烷挥发,室温条件下,用透析袋(mwco3500)在蒸馏水中透析12h,3000rpm离心10min,用0.45μm滤膜过滤3次,冷冻干燥。
(2)探头超声法:
称取5mg青蒿素、2.5mg原卟啉ix、300mg莪术油、50mg单硬脂酸甘油酯充分溶解于20ml乙醇-甲醇(1:1),氮气保护下加入150mg注射用蛋黄卵磷脂和15mg聚乙二醇-脂肪酸甘油酯衍生物充分溶解,旋转蒸发成膜。真空干燥12h后用0.5%吐温80溶液(20ml)复溶,冰浴超声60min,室温条件下,用透析袋(mwco3500)在蒸馏水中透析12h,3000rpm离心10min,用0.45μm滤膜滤过3次,冷冻干燥。
(3)高压均质法:
称取10mg青蒿素、2mg原卟啉ix、100mg大豆油、15mg薄荷油、40mg月桂酸、35mg二十二碳烷酸充分溶解于20mg二氯甲烷,氮气保护下加入50mg氢化蛋黄卵磷脂和5.0mg聚乙二醇-胆固醇衍生物充分溶解,与2%甘油溶液15ml混合,在压力为105mpa条件下均质5次,得到均匀的乳状溶液,室温用透析袋(mwco3500)在蒸馏水中透析12h或减压蒸除有机溶剂,3000rpm离心10min,用0.45μm滤膜滤过3次,冷冻干燥。
2.理化性质表征
电镜分析表明,所获得的青蒿素/原卟啉ix纳米粒,为较均匀的球状或近球状小囊泡,粒径约70nm。纳米粒度分析仪测定也表明所获得的青蒿素/原卟啉ix纳米粒的粒径约为75nm。通过hplc分析了青蒿素的包封率为80%,荧光分光光度法测定了原卟啉ix的包封率为82%。
通过调整青蒿素、原卟啉ix和磷脂的投料比,可以获得包封率为10-80%的纳米粒。
实施例2
负载蒿甲醚/原卟啉ix的纳米粒的制备和表征
1、制备工艺
(1)溶剂挥发法:
将7.5mg蒿甲醚、3.75mg原卟啉ix、150mg大豆油、300mg中链甘油三酯、35mg三棕榈酸甘油三酯溶解于9ml二氯甲烷,氮气保护下加入235mg注射用大豆卵磷脂充分溶解,将235mg吐温80溶解于2.25%(w/v)的甘油水溶液(9ml),将两溶液混合,高速分散后机械搅拌20min制成初乳,继续搅拌过夜,使二氯甲烷挥发,室温条件下,用透析袋(mwco3500)在蒸馏水中透析12h或减压蒸除有机溶剂,3000rpm离心10min,用0.45μm滤膜过滤3次,冷冻干燥。
(2)探头超声法:
称取10mg蒿甲醚、2mg原卟啉ix、30mg油酸、50mg单硬脂酸甘油酯充分溶解于10ml乙醇-甲醇(1:1),氮气保护下加入35mg注射用蛋黄卵磷脂和2.5mg聚乙二醇-胆固醇衍生物充分溶解,旋转蒸发成膜。真空干燥12h后用2%泊洛沙姆188溶液(7.5ml)复溶,冰浴超声60min,室温条件下,用透析袋(mwco3500)在蒸馏水中透析12h或减压蒸除有机溶剂,3000rpm离心10min,用0.45μm滤膜滤过3次,冷冻干燥。
(3)高压均质法:
称取7mg蒿甲醚、7mg原卟啉ix、45mg长链脂肪酸甘油酯、10mg维生素e、25mg三棕榈酸甘油三酯、20mg山嵛酸甘油酯充分溶解于20mg三氯甲烷,氮气保护下加入50mg氢化大豆卵磷脂和4.0mg聚乙二醇-二硬脂酰基磷脂酰乙醇胺衍生物充分溶解,与1%泊洛沙姆407、1%胆酸溶液10ml混合,在压力为105mpa条件下均质5次,得到均匀的乳状溶液,室温用透析袋(mwco3500)在蒸馏水中透析12h或减压蒸除有机溶剂,3000rpm离心10min,用0.45μm滤膜滤过3次,冷冻干燥。
2.理化性质表征
电镜分析表明,所获得的蒿甲醚/原卟啉ix纳米粒,为较均匀的球状或近球状小囊泡,粒径约100nm。纳米粒度分析仪测定也表明所获得的蒿甲醚/原卟啉ix纳米粒的粒径约为110nm。通过hplc分析了蒿甲醚的包封率为83%,荧光分光光度法测定了原卟啉ix的包封率为85%。
通过调整蒿甲醚、原卟啉ix和磷脂的投料比,可以获得包封率为20-85%的纳米粒。
实施例3
负载青蒿琥酯/原卟啉ix的纳米粒的制备和表征
1、制备工艺
(1)溶剂挥发法:
将10.0mg青蒿琥酯、2.0mg原卟啉ix、200mg玉米油、100mg长链甘油三酯、75.0mg月桂酸己酯、50mg十六酸鲸蜡酯、50mg山嵛酸甘油酯、25mg硬脂醇溶解于20ml二氯甲烷,氮气保护下加入300mg注射用大豆卵磷脂充分溶解,与1%吐温20(w/v)溶液(10ml)混合,高速分散后机械搅拌20min制成初乳,继续搅拌过夜,使二氯甲烷挥发,室温条件下,用透析袋(mwco3500)在蒸馏水中透析12h或减压蒸除有机溶剂,3000rpm离心10min,用0.45μm滤膜过滤3次,冷冻干燥。
(2)探头超声法:
称取5mg青蒿琥酯、10mg原卟啉ix、50mg松节油、50mg茶油、50mg薄荷油、200mg三肉豆蔻酸甘油三酯充分溶解于10ml乙腈,氮气保护下加入50mg人工合成卵磷脂和25mg聚乙二醇-1,2-二棕榈酰-sn-甘油-3-磷酰乙醇胺衍生物充分溶解,旋转蒸发成膜。真空干燥12h后用5%泊洛沙姆188溶液(10ml)复溶,冰浴超声60min,室温条件下,用透析袋(mwco3500)在蒸馏水中透析12h或减压蒸除有机溶剂,3000rpm离心10min,用0.45μm滤膜滤过3次,冷冻干燥。
(3)高压均质法:
称取8mg青蒿琥酯、8mg原卟啉ix、55mg薏米仁油、30mg青蒿油、25mg三硬脂酸甘油三酯、25mg硬脂酸充分溶解于15mg三氯甲烷,氮气保护下加入50mg蛋黄卵磷脂和10mg聚乙二醇-胆固醇衍生物充分溶解,与1%胆酸溶液、1%油酸钾盐溶液15ml混合,在压力为105mpa条件下均质5次,得到均匀的乳状溶液,室温用透析袋(mwco3500)在蒸馏水中透析12h或减压蒸除有机溶剂,3000rpm离心10min,用0.45μm滤膜滤过3次,冷冻干燥。
2.理化性质表征
电镜分析表明,所获得的青蒿琥酯/原卟啉ix纳米粒,为较均匀的球状或近球状小囊泡,粒径约150nm。纳米粒度分析仪测定也表明所获得的青蒿琥酯/原卟啉ix纳米粒的粒径约为150nm。通过hplc分析了青蒿琥酯的包封率为88%,荧光分光光度法测定了原卟啉ix的包封率为82%。
通过调整青蒿琥酯、原卟啉ix和磷脂的投料比,可以获得包封率为10-88%的纳米粒。
实施例4
负载双氢青蒿素/原卟啉ix的纳米粒的制备和表征
1、制备工艺
(1)溶剂挥发法:
将2mg双氢青蒿素、2mg原卟啉ix、100mg香叶油、100mg2-辛基月桂醇、60mg二十二碳烷酸、30mg胆固醇溶解于8ml四氢呋喃,氮气保护下加入200mg氢化蛋黄卵磷脂和聚乙二醇-胆固醇衍生物充分溶解,与0.5%的泊洛沙姆188溶液(10ml)混合,高速分散后机械搅拌20min制成初乳,继续搅拌过夜,使四氢呋喃挥发,室温条件下,用透析袋(mwco3500)在蒸馏水中透析12h或减压蒸除有机溶剂,3000rpm离心10min,用0.45μm滤膜过滤3次,冷冻干燥。
(2)探头超声法:
称取10mg双氢青蒿素、1mg原卟啉ix、100mg葵花籽油、50mg鲸蜡醇棕榈酸酯、25mg月桂酸充分溶解于10ml甲醇,氮气保护下加入50mg人工合成卵磷脂和10mg聚乙二醇-脂肪酸甘油酯衍生物充分溶解,旋转蒸发成膜。真空干燥12h后用2%吐温80溶液(8ml)复溶,冰浴超声60min,室温条件下,用透析袋(mwco3500)在蒸馏水中透析12h或减压蒸除有机溶剂,3000rpm离心10min,用0.45μm滤膜滤过3次,冷冻干燥。
(3)高压均质法:
称取10mg双氢青蒿素、5mg原卟啉ix、50mg蓖麻油、100mg麻油、50mg亚油酸、25mg三月桂酸甘油三酯、25mg单硬脂酸甘油酯充分溶解于20mg二氯甲烷,氮气保护下加入50mg蛋黄卵磷脂和10mg聚乙二醇-脂肪胺衍生物充分溶解,与1%油酸钠盐溶液、1%甘油溶液20ml混合,在压力为105mpa条件下均质5次,得到均匀的乳状溶液,室温用透析袋(mwco3500)在蒸馏水中透析12h或减压蒸除有机溶剂,3000rpm离心10min,用0.45μm滤膜滤过3次,冷冻干燥。
2.理化性质表征
电镜分析表明,所获得的双氢青蒿素/原卟啉ix纳米粒,为较均匀的球状或近球状小囊泡,粒径约100nm。纳米粒度分析仪测定也表明所获得的双氢青蒿素/原卟啉ix纳米粒的粒径约为120nm。通过hplc分析了双氢青蒿素的包封率为82%,荧光分光光度法测定了原卟啉ix的包封率为80%。
通过调整双氢青蒿素、原卟啉ix和磷脂的投料比,可以获得包封率为10-82%的纳米粒。
- 还没有人留言评论。精彩留言会获得点赞!