一种双靶标融合蛋白及其制备方法和用途与流程
本发明涉及生物医药和技术领域,特别是涉及一种双靶标融合蛋白及其制备方法和用途,所述双靶标融合蛋白能同时结合pdgfβ和vegf细胞因子,并可用于治疗与pdgfβ和vegf介入的相关疾病。
背景技术:
新生血管的形成需要多种细胞生长因子参与,其中血管内皮生长因子(vegf)尤为重要。
vegf和细胞膜上的氨酸激酶受体结合,激活下行信号传递通路,与其他多个血管内皮生长因子协同参与一系列生理或病理作用。其中,vegf对血管内皮细胞的生长、迁移、存活以及血管渗透性起着至关重要作用。
vegf及其受体(vegfr)不仅在生长发育,生殖,组织创伤和骨折修复等过程中起重要作用,而且在病理过程中,如在肿瘤,特别是实体肿瘤的发生、发展和肿瘤的转移扩散过程,在湿性amd等血管增生性疾病中发挥关键作用。在人体血管异常增生性疾病中多伴有vegf的过度表达。
通过阻断vegf/vegfr的信号通路来抑制异常新生血管增生从而达到治疗癌症和amd目的,在临床上已取得了令人振奋的效果。然而,仍有相当部分临床病例对目前治疗血管异常增生性疾病的治疗方案无明显疗效,或仅呈现短期效果或出现反弹现象。其中重要原因之一是血管周边细胞(pericyte)与血管内皮细胞的相互作用。pdgfβ通过与其受体pdgfrβ的作用,不仅能够募集血管周边细胞到新生血管壁周,对新生血管起着稳定支持作用;还能够诱导分化的胚胎干细胞毛细血管生成,加速内皮细胞的分化。增加pdgfrβ活性又伴随vegf-a和vegfr-2过度表达,促进新生血管形成。在单纯干预vegf/vegfr信号的情况下,周边细胞仍然能够向血管内皮细胞提供支持和生存信号,使得单靶向作用vegf或vegfr的抗血管增生药物在临床上治疗效果不尽人意。血管增生是一个复杂、有多重因素参与的过程。仅针对血管增生中一个因素或环节的治疗策略往往不能够取得满意的临床治疗效果。若同时阻断vegf/vegfr和pdgfβ/pdgfrβ的信号通路,无疑具有改变现有临床生物药物单靶向治疗异常血管增生疾病的不足,提高治疗效果。联合用药已在临床上广泛用于肿瘤等多因素介入多机理参与的复杂疑难性疾病。而联合用药,特别是联合应用特异性的生物靶向药物,将会增加医疗成本。
目前主要用于抗血管增生性疾病的特异性的生物靶向药物尚是单靶向药物,其中包括与vegf-a特异性结合的贝法单抗、与vegfr2结合的雷莫芦单抗,与vegf结合的zaltrap和康柏西普融合蛋白。同时双靶向阻断vegf/pdgfβ或受体的特异性生物靶向药物在临床上尚未见报道。本发明研发成功,无疑将改变现有治疗血管异常增生性疾病的不足。
技术实现要素:
鉴于以上所述现有技术的缺点,本发明的目的在于提供一种双靶标融合蛋白及其制备方法和用途,用于解决现有技术的不足。所述双靶标融合蛋白是能同时结合pdgfβ和vegf细胞因子的融合蛋白,并可用于治疗与pdgfβ和vegf引起的相关疾病,如肿瘤,amd。
由于在人体多种癌症和amd疾病中均有异常新生血管生长和vegf水平异常升高,伴有pdgfβ/pdgfrβ通路活性增强,因此在治疗这类异常新生血管增生疾病时,同时阻断pdgfβ和vegf的生物作用会比单独阻断vegf的生物作用更加有效。所以本发明的目的在于构建和制备具有生物活性的嵌合分子,所述嵌合分子能够结合并阻断与血管生长密切相关的细胞生长因子pdgfβ和vegf。为实现上述目的及其他相关目的,本发明第一方面提供一种双靶标融合蛋白,所述双靶标融合蛋白包括三个结构功能区域,所述三个结构功能区域分别是pdgfrβ胞外免疫样球蛋白区域d1-d3(pdgfrβd1-d3)、vegfr1ii-vegfr2iii和人免疫球蛋白恒定区fc片段。
所述pdgfrβd1-d3的氨基酸序列如seqidno.1所示。
所述vegfr1ii-vegfr2iii的氨基酸序列如seqidno.2所示。
所述人免疫球蛋白恒定区fc可以是人igg1的,也可以是亚型igg2,igg3,igg4或人igm和iga的。fc片段可以是恒定区全长也可以是部分。
优选的,所述人免疫球蛋白的fc片段为人免疫球蛋白igg的恒定区(fc)包括胶链区、ch2和ch3区。
优选的,所述人免疫球蛋白的fc片段的氨基酸序列如seqidno.3所示。
本发明提供一种双靶标融合蛋白,所述双靶标融合蛋白的结构功能域之间还包括连接肽,所述连接肽的氨基酸序列为(ggg)n、(gggs)n或(gs)n,n=0,1,2,-----8。
本发明提供一种双靶标融合蛋白,所提供的一种双靶标融合蛋白各功能区域具有以下的排列方式:
所述双靶标融合蛋白从n端到c端依次包括pdgfrβd1-d3、vegfr1ii-vegfr2iii、igfc,seqidno.4所示。
优选的,所述双靶标融合蛋白从n端到c端依次包括vegfr1ii-vegfr2iii、pdgfrβd1-d3、igfc,所述双靶标融合蛋白的氨基酸序列如seqidno.5所示。
优选的,所述双靶标融合蛋白从n端到c端依次包括pdgfrβd1-d3、igfc、vegfr1ii-vegfr2iii,所述双靶标融合蛋白的氨基酸序列如seqidno.6-8所示。
本发明第二方面提供一种多核苷酸,所述的多核苷酸编码所述的双靶标融合蛋白。
优选的,所述多核苷酸的多核苷酸序列为seqidno.9-13。
本发明第三方面提供一种含有所述的多核苷酸的序列的表达载体。
所述载体可以为真核细胞或原核细胞蛋白表达载体。
优选的,所述载体为真核细胞蛋白表达载体。
本发明第四方面提供一种重组的宿主细胞,所述宿主细胞含有所述的表达载体、或者宿主细胞染色体中整合有所述表达载体的多核苷酸。
所述宿主细胞可以是细菌细胞、酵母细胞、昆虫细胞、或哺乳动物细胞。
由于所述融合蛋白需要糖基化,哺乳动物细胞表达系统应该是最佳选择。所述宿主细胞优选为如cho-s、cho-k1、hek-293、cos7、sp20、sf9、perc6等。
对于本发明所提供的双靶标融合蛋白,本领域技术人员根据经验,即可完成对所述双靶标融合蛋白的制备工作。具体步骤包括:在允许融合多肽产生并回收生产的多肽的条件下,完成如上所述表达载体构建,转染上述宿主-载体表达系统的细胞,通过基因扩增,如用dhfr或gs系统或抗抗生素系统筛选得到稳定细胞株,继而进行细胞扩增放大,得到生产的融合蛋白。
本发明第五方面提供所述双靶标融合蛋白的制备方法,包括如下步骤:
1)用基因合成法分别得到pdgfrβd1-d3、vegfr1ii、vegfr2iii、人免疫球蛋白的fc片段的多核苷酸序列;
2)将pdgfrβd1-d3、vegfr1ii、vegfr2iii、人免疫球蛋白的fc片段通过搭桥pcr拼接,并克隆到蛋白表达质粒中,分别得到上述不同组合的融合蛋白的表达质粒;
3)将所获得的质粒转化到宿主细胞中进行表达,将细胞表达分泌在细胞培养液上清中的融合蛋白用蛋白a亲和、离子交换、疏水层析捕获,洗脱,得到所需要的双靶标融合蛋白。
本发明第六方面提供一种药物组合物,含有所述的双靶标融合蛋白及至少一种药学可接受的载体或赋形剂。更优选的是液体注射制剂,冻干粉制剂。
本发明第七方面提供所述的双靶标融合蛋白在制备或筛选治疗血管增生性肿瘤、amd的药物或制剂中的用途。
本发明所用的igfc,功能一是使药物分子形成二聚体,增加药物与靶点的结合能力,功能二是延长药物在血液中的半衰期,结果是增强药物治疗效果,减少临床用药频率,降低疾病的临床治疗成本。
本发明在融合蛋白的各功能域之间加一连接肽,目的是排除功能域之间的物理干扰,避免其对药物功能的影响。
本发明是用生物工程技术,将两个分别能与靶点vegf和pdgfβ结合的功能分子通过fc融合在一起,通过优化和筛选,得到最佳排列方式的功能分子。把该分离的核酸分子克隆到宿主表达载体,在宿主载体表达系统中表达该融合蛋白,该融合蛋白能够同时结合vegf和pdgfβ,能够抑制vegf165诱导的人脐静脉内皮细胞(huvec)增殖作用。在动物模型上,能够有效抑制肿瘤生长,抑制脉络膜新生血管增生,具有治疗vegf和pdgfβ相关的疾病和病症,特别适合治疗血管增生性肿瘤和amd。
附图说明
图1为本发明中所述融合蛋白结构示意图。
图2为融合蛋白的sds-page.
图3为基于已建立的elisa方法进行的融合蛋白与pdgfββ(3a)和vegf165(3b)体外结合实验。
图4为对融合蛋白与pdgfββ(4a)和vegf165(4b)体外结合实验比较的结合曲线。
图5为融合蛋白与v165和pdgfββ的共结合实验:
(a)融合蛋白aa0。(b)融合蛋白aa1。(c)融合蛋白aa5。
图6为融合蛋白对vegf165诱导的huvec细胞增殖的抑制作用。
图7为融合蛋白对小鼠肿瘤生长抑制作用。
图8为融合蛋白对小鼠cnv抑制作用。
具体实施方式
以下通过特定的具体实例说明本发明的实施方式,本领域技术人员可由本说明书所披露的内容轻易地了解本发明的其他优点与功效。本发明还可以通过另外不同的具体实施方式加以实施或应用,本说明书中的各项细节也可以基于不同观点与应用,在没有背离本发明的精神下进行各种修饰或改变。
在进一步描述本发明具体实施方式之前,应理解,本发明的保护范围不局限于下述特定的具体实施方案;还应当理解,本发明实施例中使用的术语是为了描述特定的具体实施方案,而不是为了限制本发明的保护范围;在本发明说明书和权利要求书中,除非文中另外明确指出,单数形式“一个”、“一”和“这个”包括复数形式。当实施例给出数值范围时,应理解,除非本发明另有说明,每个数值范围的两个端点以及两个端点之间任何一个数值均可选用。除非另外定义,本发明中使用的所有技术和科学术语与本技术领域技术人员通常理解的意义相同。除实施例中使用的具体方法、设备、材料外,根据本技术领域的技术人员对现有技术的掌握及本发明的记载,还可以使用与本发明实施例中所述的方法、设备、材料相似或等同的现有技术的任何方法、设备和材料来实现本发明。
除非另外说明,本发明中所公开的实验方法、检测方法、制备方法均采用本技术领域常规的分子生物学、生物化学、染色质结构和分析、分析化学、细胞培养、重组dna技术及相关领域的常规技术。这些技术在现有文献中已有完善说明,具体可参见sambrook等molecularcloning:alaboratorymanual,secondedition,coldspringharborlaboratorypress,1989andthirdedition,2001;ausubel等,currentprotocolsinmolecularbiology,johnwiley&sons,newyork,1987andperiodicupdates;theseriesmethodsinenzymology,academicpress,sandiego;wolffe,chromatinstructureandfunction,thirdedition,academicpress,sandiego,1998;methodsinenzymology,vol.304,chromatin(p.m.wassarmananda.p.wolffe,eds.),academicpress,sandiego,1999;和methodsinmolecularbiology,vol.119,chromatinprotocols(p.b.becker,ed.)humanapress,totowa,1999等。
实施例1表达载体构建
vegfr包含有7个免疫球蛋白样细胞外区域,pdgfrβ含有5个免疫球蛋白样细胞外区域。人vegfr1和vegfr2基因序列来源于ncbi(referencesequence:np_001153392.1,np_002244.1)。
pdgfrβ基因序列来源于ncbi(referencesequence:nm_002609.3)。
用基因合成法分别得到pdgfrβd1-d3、vegfr1ii-vegfr2iii、fc序列(seqidno.1-3)。aa0质粒构建
用引物1和引物2,用引物3和引物4分别以合成基因pdgfrβ和fc为模板,pcr扩增放大,其产物用质粒纯化试剂(qiagen公司)纯化后,用引物1和引物4搭桥pcr将其拼接在一起,经xhoi/ecori双酶切,纯化,连接到带有分泌信号肽的pcdna3.1s-puro表达载体上,构成质粒aa0(seqidno.14)。
aa1质粒构建:以aa0质粒为模板,用引物1和引物2,引物7和引物4分别pcr扩增出pdgfrβd1-d3片段和fc片段。以合成基因vegfr1ii-vegfr2iii为模板,引物5和引物6pcr扩增出该片段。经过纯化,用引物1和引物4搭桥pcr将上述3个片段拼接在一起,然后用xhoi/ecori双酶切,纯化后连接酶切产物到表达载体上,构建成aa1质粒(seqidno.4)。
aa2质粒构建:以aa0、vegfr1ii-vegfr2iii为模板,分别用引物8和引物12、引物9和引物10、引物11和引物4pcr扩增出pdgfrβd2d3、vr1ii-vr2iii和fc片段。利用引物8和引物4搭桥pcr将这3个片段拼接一起。xhoi/ecori双酶切,通过t4连接酶连接到表达载体上,构建成aa2质粒(seqidno.15)。
aa3质粒构建:以aa0、vegfr1ii-vegfr2iii为模板,分别用引物1和引物2、引物12和引物13、引物14和引物4pcr扩增出pdgfrβd1-d3、vr1ii和fc片段。利用引物1和引物4搭桥pcr将3个片段拼接一起。xhoi/ecori双酶切,通过t4连接酶连接到表达载体上,构建成aa3质粒(seqidno.16)。
aa4质粒构建:以aa0、vegfr1ii-vegfr2iii为模板,分别用引物15和引物6、引物16和引物2、引物17和引物4pcr扩增出pdgfrβd1-d3、vr1ii-vr2iii和fc片段。利用引物15和引物4搭桥pcr将3个片段拼接一起。xhoi/ecori双酶切,通过t4连接酶连接到表达载体上,构建成aa4质粒(seqidno.5)。
aa5质粒构建:以aa0质粒和vegfr1ii-vegfr2iii为模板,分别用引物1和引物2、引物18和引物19、引物20和引物21pcr扩增出pdgfrβd1-d3、vr1ii-vr2iii和fc片段。利用引物1和引物21搭桥pcr将3个片段拼接一起。xhoi/ecori双酶切,通过t4连接酶连接到表达载体上,构建成aa5质粒(seqidno.6)。
aa6质粒构建:以aa0质粒和vegfr1ii-vegfr2iii为模板,分别用引物1和引物2、引物18和引物19、引物22和引物21pcr扩增出pdgfrβd2d3、vr1ii-vr2iii和fc片段。利用引物1和引物21搭桥pcr将3个片段拼接一起。xhoi/ecori双酶切,通过t4连接酶连接到表达载体上,构建成aa6质粒(seqidno.7)。
aa7质粒构建:以aa0质粒和vegfr1ii-vegfr2iii为模板,分别用引物1和引物2、引物23和引物19、引物20和引物21pcr扩增出pdgfrβd1-d3、vr1ii-vr2iii和fc片段。利用引物1和引物21搭桥pcr将3个片段拼接一起。xhoi/ecori双酶切,通过t4连接酶连接到表达载体上,构建成aa7质粒(seqidno.8)。
上述所有构建的表达质粒均经过核酸测序验证正确。
引物1:5’-accccgctcgagggcctggtcgtcacaccc-3’
引物2:5’-ttgtagtgtgcccacctctcc-3’
引物3:5’-gaggtgggcacactacaaggtggaggttctgacaaaactcacacatgcccactg-3’
引物4:5’-accggaatcctcatttacccggagacagggag-3’
引物5:
5’-gaggtgggcacactacaaggtggaggttctggtggaggttctggtagacctttcgtagagatgtacag-3’
引物6:5’-tttttcatggaccctgacaaatgtgc-3’
引物7:5’-gtcagggtccatgaaaaaggaggaggttctgacaaaactcacacatgcccact-3’
引物8:5’-accccgctcgagcacaatgactcccgtggactg-3’
引物9:5’-gcaggtagtgttcgagggtggaggtggatctcctttcgtagagatgtacagtgaaatcc-3’
引物10:5’-aggtttttcatggaccctgacaaatg-3’
引物11:5’-gggtccatgaaaaacctggacctgacaaaactcacacatgcccactg-3’
引物12:
5’-ggttgagagcggctactcatcatcgtcatcttcatcttcttcaagacctttcgtagagatgtacagtgaaat-3’
引物13:5’-ggtttgtcgatgtgtgagatagtttgt-3’
引物14:
5’-cacacatcgacaaaccggaggtggaggtggcggaggtggcggagacaaaactcacacatgcccactg-3’
引物15:5’-accccgctcgagggtagacctttcgtagagatgtaca-3’
引物16:5’-gtcagggtccatgaaaaaggaggaggttctggaggaggttctggcctggtcgtcacaccc-3’
引物17:5’-gtgggcacactacaaggaggtggatctgacaaaactcacacatgcccactg-3’
引物
18:5’-aggtgggcacactacggtggaggttctggtggaggttctgacaaaactcacacatgcccactg-3’
引物19:5’-tttacccggagacagggagagg-3’
引物
20:5’-ctgtctccgggtaaaggtggaggttctggtggaggttctggtagacctttcgtagagatgtaca-3’
引物21:5’-accggaatccctatttttcatggaccctgacaaatgtg-3’
引物22:5’-ctgtctccgggtaaaggtagacctttcgtagagatgtaca-3’
引物23:5’-aggtgggcacactacgacaaaactcacacatgcccactg-3’
实施例2细胞转染、重组克隆筛选和融合蛋白表达
当瞬时表达本发明中融合蛋白,重组质粒用dna纯化试剂盒(qiagen)提纯后,用脂质体2000(invitrogen)或用聚乙烯亚胺(polyethylenimine)(polysciences公司)转染到hek293(atcc#crl-1573)细胞。4小时后将培养皿中的培养基换成不含血清的cdopti-memi培养基,继续在无血清培养液中培养3天后收集上清液。所表达的蛋白浓度用酶联免疫吸附试验(elisa)法测定。
所述elisa测定的具体方法为:用bethyl公司的fc夹心酶联免疫分析elisa检测试剂盒来测定各融合蛋白fc浓度。将用1%bsa稀释后的融合蛋白加入到事先用碳酸盐缓冲液(ph9.0)稀释过抗fc包被抗体(200ng/孔)并在4度过夜包被的96孔elisa板,37度孵育1.5小时,用1.5%bsa封闭1.5小时后,加入用1%bsa稀释过的辣根过氧化酶(hrp)赘合的抗fc(fc-hrp)检测抗体,在室温孵育45分钟后加入50微升底物3,3’,5,5’-四甲基联苯胺(tmb)(thermofisher公司)溶液显色,在450nm波长读数,根据所做的标准曲线计算出融合蛋白的浓度。
当稳定表达本发明融合蛋白,用电穿孔法将纯化后的质粒转染到cho-s细胞(invitrogen公司)或hek-296细胞。在无血清培养基cdopti-cho或cdopti-memi中培养48小时后,添加2ug/ml的puromycin(amresco公司)到培养液中。2周后,用无血清培养基稀释细胞溶液到每毫升含有15个细胞,向96孔板每孔加100微升稀释好的细胞溶液,使每孔含有1.5个细胞。将含有细胞的96孔板放置在37℃和5%co2培养箱继续进行培养。第五周,用elisa法测定各克隆细胞株蛋白表达量,挑选高产克隆细胞株,进行放大培养。细胞培养上清经由葡萄球菌a蛋白亲和沉析法纯化后得到表达的融合蛋白。将等量的不同融合蛋白分别以1、5和10微克在还原条件下用10%的sds-page电泳分离,用考马斯亮蓝进行凝胶染色(图2)。
实施例3融合蛋白与vegf165(v165)和与pdgfββ结合实验
通过elisa测定融合蛋白分别与v165和pdgfββ在溶液中的结合能力。将不同浓度的融合蛋白(0-25000pm)与10pm的v165(r&dsystems)或10pm的pdgfββ(r&dsystems)在室温下孵育过夜。向事先用抗人vegf抗体(r&dsystems)和抗人pdgfβ抗体(r&dsystems)包被过的96孔板中分别加入100微升上述过夜孵育样本,在室温培育2小时。然后分别加入100微升抗人vegf-hrp或100微升抗人pdgfβ-hrp嵌合抗体,室温下反应1小时。加入100微升底物tmb溶液显色,通过加入100微升1mhcl终止反应,用酶标仪(moleculardevice380)在波长450nm下读数并用软件(graphpadprism5)分析作图(图3)。通过与vegf165和pdgfββ的结合力比较,融合蛋白aa5较融合蛋白aa2和融合蛋白aa3要好(图4)。
实施例4融合蛋白与v165和pdgfββ共结合实验
为了检测重组融合蛋白是否具有同时结合vegf165和pdgfββ能力,在96孔板上分别加入150微升用hepes缓冲液(10mmhepesph7.4,150mmnacl,1%bsa,3mmedta,and0.005%v/vpolysorbatep20)梯度稀释(0-100pm)的人igfc、v165和pdgfββ。在摄氏30度,用100nm融合蛋白aa0、aa1和aa5分别与具有抗人fc的生物感应器(fortebio公司)结合反应。用hepes缓冲液洗去未结合的融合蛋白后,将包被有融合蛋白的感应器按顺序分别与96孔板中的人igfc反应,然后与vegf165反应(500毫秒),再继续与pdgfββ反应(500毫秒)。结合曲线用octetred96(fortebio)采集分析。实验结果证明,融合蛋白aa1和融合蛋白aa5均能同时与vegf165和pdgfββ有效的结合(图5)。
实施例5人脐静脉内皮细胞(huvec)增值实验
用已建立好的huvec增殖实验来进一步验证融合蛋白的生物活性。用含10%fbs的m-199培养基(hyclone)重悬vegf(sigma)至40ng/ml,分别与系列梯度浓度的融合蛋白混合,分装50微升混合液到事先用胶原蛋白包被过的96孔板的每个孔中,在摄氏37度培养1个小时。胰酶消化后,huvec细胞用新鲜培养基(m-199,10%fbs)重悬至每毫升1x105个细胞,分装50微升细胞悬液到上述含有vegf-融合蛋白混合液的96孔培养板每个孔中,在摄氏37度,5%二氧化碳培养箱培养72小时。每孔加入10微升的cck-8(dojindo),测定450/650nm吸收光谱并作数据处理(graphpadprism5)。所测试的融合蛋白均有抑制vegf诱导的huvec增殖作用。蛋白aa5-aa7的作用优于蛋白aa2和蛋白aa3(图6)。
实施例6小鼠肿瘤模型实验
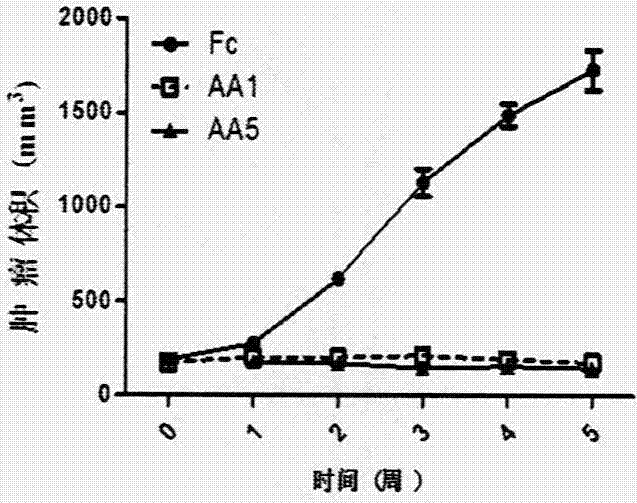
colo-205细胞是人结直肠癌细胞,广泛应用于癌症研究。用2×106colo-205细胞皮下注射cb-17scid小鼠(8-12周龄)。当肿瘤体积增长到150-200mm3,向小鼠腹腔内注射融合蛋白或人igg(5mg/kg),每周2次,持续5周。每周称小鼠体重和测量肿瘤体积。按(l(w)2)公式计算肿瘤体积。其中,l代表长,w代表宽,l大于w。结果用graphpadprism软件进行数据分析。结果显示,在动物肿瘤模型上,融合蛋白aa5和融合蛋白aa1均有很好抑制肿瘤生长的效果。单独应用aa0没有抑制肿瘤生长作用(图7)。
实施例7抑制小鼠脉络膜新生血管(cnv)增生实验
成年c57bl/6j小鼠,在麻醉和散瞳的条件下,用激光(670nm,50-80μm,100-120mw,0.1s)分别在视网膜9、12和3的三个钟点位置上击破bruch膜,并形成气泡。由于形成气泡是bruch膜破裂的标志,也是cnv增生的前提,视网膜3个钟点均形成气泡的动物纳入试验。试验动物对照组不做处理;向治疗组动物玻璃体内注射400μg纯化后的融合蛋白或人fc。10天后,荧光造影,动物安乐死后,摘取眼球,按文献(moriketal.,investophthalmolvissci.2002;43(6):1994-2000)所述的实验方法检测试验动物视网膜脉络膜新生血管程度。结果表明,在动物cnv模型上,融合蛋白aa1和aa5能够有效抑制激光诱发的脉络膜新生血管生长(图8)。
综上所述,本发明通过对融合蛋白结构优化、筛选和离体结合力的比较,发现本发明较现有相似技术,显著提高了融合蛋白与靶点的结合力,同时在瞬时转染细胞表达的融合蛋白产量方面也较现有技术的高。本发明不仅较现有相似技术与靶点的结合力好,而且本发明具有同时有效结合二个靶点的功能,具有高度产业化和临床应用价值。
上述实施例仅例示性说明本发明的原理及其功效,而非用于限制本发明。任何熟悉此技术的人士皆可在不违背本发明的精神及范畴下,对上述实施例进行修饰或改变。因此,举凡所属技术领域中具有通常知识者在未脱离本发明所揭示的精神与技术思想下所完成的一切等效修饰或改变,仍应由本发明的权利要求所涵盖。
- 还没有人留言评论。精彩留言会获得点赞!
- 一种抗CD24人源化抗体融合蛋白的制造方法与工艺
- 特异性人EWS‑FLI1融合蛋白抗体的制备方法及在制备尤文肉瘤诊断抗体试剂的应用与制造工艺
- 一种融合蛋白表达纯化方法与制造工艺
- 抗USP2a蛋白单克隆抗体杂交瘤细胞及其产生的抗USP2a单克隆抗体和应用的制造方法与工艺
- 与癌症相关的基因融合体和基因变异体的制造方法与工艺
- 包含邻近氨基酸端的志贺毒素A亚基效应子区和细胞靶向性免疫球蛋白型结合区的蛋白的制造方法与工艺
- 杀虫融合蛋白改进的制造方法与工艺
- vin‑cdtb在大肠杆菌中的表达和制备的制造方法与工艺
- 一种抗肿瘤侵袭转移的多靶点融合蛋白的制备及用途的制造方法与工艺
- 重组人成纤维细胞生长因子21融合蛋白及其在制备治疗代谢疾病药物中的应用的制造方法与工艺