一种霍利斯格里蒙特氏菌的快速检测方法与流程
本发明涉及生物检测的技术领域,尤其涉及一种副溶血性弧菌的检测方法。
背景技术:
霍利斯格里蒙特氏菌又名为霍利斯弧菌(Vibrio hollisae,Vh),2003年被正式重新命名为霍利斯格里蒙特氏菌,为格里蒙特氏菌属之一,是革兰氏阴性、兼性厌氧、嗜盐病原细菌,为较小的杆菌。霍利斯格里蒙特氏菌广泛分布于海洋、海口、近海岸及水域海产品中,为海洋优势菌,具有致病性。它是12种致病性弧菌中的1种,是第三类病原微生物,产毒性强。霍利斯格里蒙特氏菌引起致病的主要毒素包括耐热溶血毒素和耐热相关溶血毒素。其中耐热直接溶血素,该毒素有肠毒性、肝毒性及细胞毒性作用,还能产生不耐热肠毒素,可拉长中国仓鼠卵巢细胞并且可使小鼠积水;菌体还具有黏附素和入侵真核细胞的能力,可进入血循环引起菌血症。患者病前因生食或食用未煮熟的被霍利斯格里蒙特氏菌感染的海产品,而引起严重腹泻,呈水样便,腹痛、呕吐、发热,甚至引起肠、肺、肝、肾脏组织细胞水肿、变性、白细胞渗出、聚集等还能引起菌血症。该菌在患者体内潜伏期短,多在2~26 h之间,平均6~10 h。轻者自愈,重者需补液纠正失水及电解质紊乱。近年来由该菌引起国内外的食物中毒事件已逐渐增加,快速简便的检测方法的建立是预防霍利斯格里蒙特氏菌食物中毒的有效途径。
已建立的霍利斯格里蒙特氏菌的检测方法有传统方法:增菌培养法、最大可能计数法及PCR法。环介导等温扩增技术是近些年来被国内外研究人员研究较多并且也是使用较广泛、发展较快的方法之一,其在细菌、病毒、寄生虫等病原生物的检测被广泛运用,更是在现场检验和基层实验室中得到广泛推广。目前该方法已被用在诸如副溶血性弧菌、单核细胞增多性李斯特氏菌、创伤弧菌、河流弧菌、溶藻弧菌、大肠杆菌、类志贺邻单胞菌、沙门氏菌、结核杆菌、金黄色葡萄球菌的检测,尚未有用于检测霍利斯格里蒙特氏菌的报道。
有鉴于此,本发明人研究和设计了一种霍利斯格里蒙特氏菌的快速检测方法,本案由此产生。
技术实现要素:
本发明的第一个目的是提供一种用于霍利斯格里蒙特氏菌的特异性引物。
本发明的第二个目的是提供一种霍利斯格里蒙特氏菌的检测方法。
为了实现上述目的,本发明解决其技术问题所采取的技术方案是:
一种用于霍利斯格里蒙特氏菌的特异性引物,是根据副溶血性弧菌种特异性基因fur的保守区域所设计的一对外引物、一对内引物和一对环引物;
所述的一对外引物为:
如序列表SEQ ID NO:1所示的正向外引物GHF3:GGCAACTGTCTACCGTGTAC;
如序列表SEQ ID NO:2所示的反向外引物GHB3:GCTGTGATTCGTCAGTCTGA;
所述的一对内引物为:
如序列表SEQ ID NO:3所示的正向内引物GHFIP:GTCGCCAGCTCAAACACAGATTTTTTTAACCAGTTTGATGATGCCGG;
如序列表SEQ ID NO:4所示的反向内引物GHBIP:
CACCACCATGACCACTTGGTTTGTTTTTATCTCTCTGGCGCTGCTC;
所述的一对环引物为:
如序列表SEQ ID NO:5所示的正向环引物GHLF:CCACCTTCAAAATGGTGACGGGT;
如序列表SEQ ID NO:6所示的反向环引物GHLB:GTCGAGTCATCGAGTTTACGGACG。
一种霍利斯格里蒙特氏菌的快速检测方法,包括以下步骤:
步骤一、霍利斯格里蒙特氏菌模板DNA的提取
利用100℃水浴10min热裂解或细菌基因组DNA提取试剂盒,试剂盒购于TIANGEN厦门泰京生物技术有限公司,提取霍利斯格里蒙特氏菌的总DNA作为模板;
步骤二、外引物的验证
用一对外围引物GHF3/GHB3对模板进行扩增,扩增后的产物进行测序:若外围引物扩增的片段为霍利斯格里蒙特氏菌fur的保守区域核酸序列,说明该外围引物合适,可用于后续环介导等温扩增法实验;
步骤三、环介导等温扩增反应体系的建立
25μL的恒温反应体系包括:反应液RM(2×)12.5 μL;内引物0.8 μM;外引物0.1 μM;环引物0.4 μM;Bst聚合酶1.0 μL;荧光染料I 0.5 μL;DNA模板1.0 μL;加超纯水至25 μL;所述的反应液RM、Bst聚合酶、荧光染料I为商品化的DNA扩增试剂盒,购于广州迪澳生物科技有限公司;
步骤四、环介导等温扩增程序
将待反应PCR管放置于实时荧光定量PCR仪选用FAM通道进行检测,反应程序包括1个循环63℃反应30 s;40个循环:63℃反应1 min,在16 s处开始采集荧光信号;
步骤五、扩增产物的检测结果判定
若有“S”型扩增曲线,则判断为阳性,即有核酸扩增, 若无“S”型扩增曲线,则判断为阴性,即无核酸扩增。
与现有技术相比,本发明具有以下的有益效果:
1、灵敏度高,最低检测至102CFU/mL;
2、特异性强,只检出霍利斯格里蒙特氏菌,对其他致病菌检测结果均为阴性;
3、快速检测,比实时荧光定量PCR的检测速度快,明显提高检测效率;
4、扩增产物通过实时荧光定量PCR仪检测,20~40min即可完成,尤其适用在基层实验。
附图说明
图1为霍利斯格里蒙特氏菌环介导等温扩增产物电泳图;其中,M:D2000DNAMarker;1:扩增产物;2:阴性对照;
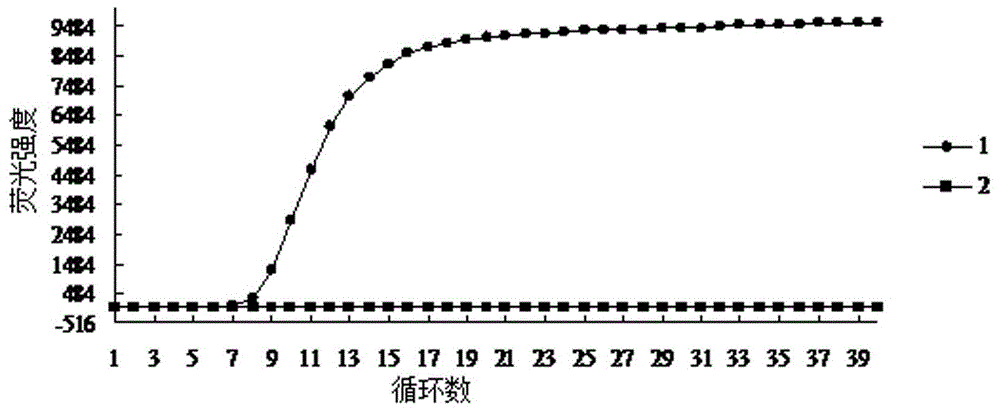
图2为环介导等温扩增实时荧光定量PCR仪检测结果图;其中,1:霍利斯格里蒙特氏菌环介导等温扩增产物;2:阴性对照;
图3为环介导等温扩增检测霍利斯格里蒙特氏菌特异性电泳图;其中,1:霍利斯格里蒙特氏菌;non-Gh包括:副溶血性弧菌、嗜盐单胞菌、溶藻弧菌、河弧菌、创伤弧菌、拟态弧菌、弗氏弧菌、哈维弧菌、鳗弧菌、阪崎肠杆菌、单增李斯特菌、甲型副伤寒沙门氏菌、大肠埃希氏菌。
具体实施方式
实施例1 引物的设计与合成
根据霍利斯格里蒙特氏菌种特异性基因fur的保守区域设计了三对引物,序列如下:
所述一对外引物为:
正向外引物GHF3:GGCAACTGTCTACCGTGTAC;
反向外引物GHB3:GCTGTGATTCGTCAGTCTGA;
所述的一对内引物为:
正向内引物GHFIP:GTCGCCAGCTCAAACACAGATTTTTTTAACCAGTTTGATGATGCCGG;
反向内引物GHBIP:CACCACCATGACCACTTGGTTTGTTTTTATCTCTCTGGCGCTGCTC;
所述的一对环引物为:
正向环引物GHLF:CCACCTTCAAAATGGTGACGGGT;
反向环引物GHLB:GTCGAGTCATCGAGTTTACGGACG;
所述霍利斯格里蒙特氏菌种特异性基因fur是编码调控霍利斯格里蒙特氏菌铁吸收蛋白的重要基因,广泛存在霍利斯格里蒙特氏菌中,且具有种特异性。
实施例2 LAMP方法的建立
霍利斯格里蒙特氏菌模板DNA的提取:
利用100℃水浴10 min热裂解或细菌基因组 DNA提取试剂盒,试剂盒购于TIANGEN厦门泰京生物技术有限公司,提取霍利斯格里蒙特氏菌的总DNA作为模板。
外引物的验证:
用一对外围引物GHF3/GHB3对模板进行扩增,扩增后的产物进行测序:若外围引物扩增的片段为霍利斯格里蒙特氏菌fur的保守区域核酸序列,说明该外围引物合适,可用于后续环介导等温扩增法实验。
环介导等温扩增反应体系的建立:
25 μL的恒温反应体系包括:反应液RM(2×)12.5 μL;内引物0.8 μM;外引物0.1 μM;环引物0.4 μM;Bst聚合酶1.0 μL;荧光染料I 0.5 μL;DNA模板1.0 μL;加超纯水至25 μL;所述的反应液、Bst聚合酶、荧光染料I为商品化的DNA扩增试剂盒。
环介导等温扩增程序:
LAMP反应程序:将待反应PCR管放置于实时荧光定量PCR仪选用FAM通道进行检测,反应程序包括1个循环63℃反应30 s;40循环:63℃反应1 min,在16 s处开始采集荧光信号。反应结束后,对扩增产物进行电泳,结果如图1所示。
扩增产物的检测结果判定:若有“S”型扩增曲线,则判断为阳性(有核酸扩增), 若无“S”型扩增曲线,则判断为阴性(无核酸扩增)。环介导等温扩增实时荧光定量PCR仪检测结果,如图2所示。
实施例3 LAMP法检测特异性
分别对3株不同的霍利斯格里蒙特氏菌进行检测,结果均为阳性。为了进一步验证其特异性,分别选取副溶血性弧菌、嗜盐单胞菌、溶藻弧菌、河弧菌、创伤弧菌、拟态弧菌、弗氏弧菌、哈维弧菌、鳗弧菌、阪崎肠杆菌、单增李斯特菌、甲型副伤寒沙门氏菌、大肠埃希氏菌作为对照菌进行测试,如图3所示,对照菌结果均为阴性。证明本发明对霍利斯格里蒙特氏菌具有较好的特异性。
LAMP检测副溶血性弧菌的灵敏性。通过就平板菌落计数计算出纯培养物的浓度并对其进行10倍梯度稀释,稀释后的培养物用100℃水浴10 min热裂解进行基因组的提取,将提取后的基因组取1 μL用于LAMP反应检测该方法的灵敏性。经检测,本发明的最低检测限为102CFU/mL。
本领域的普通技术人员能从本发明公开内容直接导出或联想到的所有变形,均应认为是本发明的保护范围。
- 还没有人留言评论。精彩留言会获得点赞!