一种沙门氏菌毒力岛基因mgtC、sseL双重PCR检测方法及用途与流程
本发明属于微生物检测技术领域,具体涉及一种沙门氏菌毒力岛基因的双重PCR检测方法以及肠炎沙门氏菌的鉴定方法。
背景技术:
沙门氏菌是一种常见的革兰氏阴性杆菌(参考文献[1]),属肠杆菌科,血清型种类繁多,现已知的血清型将近2500种(参考文献[2])。沙门氏菌病在公共卫生学上是拥有非常重要意义的人畜共患病之一。因此,建立一种简单快捷、特异性高、敏感性强的快速检测方法,对于医疗卫生监控和动物疫病防控都具有积极意义。
沙门氏菌的致病性与其毒力基因有关(参考文献[3]),已知的沙门氏菌毒力岛基因(SPI)主要有5个,即SPI-1,SPI-2,SPI-3,SPI-4,SPI-5。SPI-1编码III型分泌系统,通过编码的效应蛋白进入宿主细胞(参考文献[4])。SPI-2编码另一种III型分泌系统(参考文献[5]),以及多种效应蛋白,能通过效应蛋白通过细胞膜转移到细胞内,并为沙门氏菌创造合适的生存环境(参考文献[6])。SPI-2中4个操纵子(ssa、ssc、sse、ssr)中的一个(参考文献[7])编码T3SS2效应蛋白sseL,调控沙门氏菌在上皮细胞与吞噬细胞内复制(参考文献[8]),使其躲避巨噬细胞辅酶II依赖的杀伤作用。SPI-3能够介导沙门氏菌在巨噬细胞和低Mg2+环境中生活(参考文献[9]),编码巨噬细胞生存蛋白mgtC。SPI-4编码I型分泌系统,并介入调控沙门氏菌在巨噬细胞内环境中的生活(参考文献[10])。SPI-5编码控制肠黏膜液体分泌和炎症反应的相关蛋白(参考文献[11])。近年来,大量研究人员对沙门氏菌毒力岛基因展开大量研究,张成龙(参考文献[12])发现多重耐药的沙门氏菌菌株几乎都含有mgtC、sseL基因;邹兰(参考文献[13])发现沙门氏菌毒力岛标志基因mgtC、sseL拥有高度同源性;陈飞(参考文献[14])等人发现mgtC、sseL的核苷酸序列拥有高度同源保守性,能够当作检测沙门氏菌的标志。综上,沙门氏菌毒力岛mgtC、sseL基因的核苷酸序列具有高度同源保守性,并与沙门氏菌致病性有紧密联系。
参考文献
参考文献1:游勇来.沙门氏菌的分离鉴定及PCR快速分型的研究[D].华南理工大学,2013
参考文献[2]陈惠娟.北京地区肉鸡场沙门氏菌的流行性、耐药性及分子分型研究[D].扬州大学,2011
参考文献[3]刘芳萍,王德宁,李昌文,等.鸡源沙门氏菌耐药性的分析及毒力基因的检测[J].中国兽医科学,2013(12):1236-1239
参考文献[4]薛颖,郭荣显,钱珊珊,安树敏,焦新安,耿士忠.沙门菌毒力岛的研究进展[J].微生物与感染,2015,(06):381-389
参考文献[5]王雪琴,周道国,刘倩.沙门菌侵袭研究进展[J].微生物与感染,2009,4(2):124-128
参考文献[6]方艳红,孙裴,魏建忠,等.沙门菌毒力基因研究进展[C].中国畜牧兽医学会食品卫生学分会第十一次学术研讨会.2010
参考文献[7]殷俊磊,程瞾,夏静,等.鸡白痢门菌中三型分泌系统-2效应蛋白基因分布研究[J].中国家禽,2015,37(19):14-19
参考文献[8]廖申权,袁建丰,覃宗华,等.沙门氏菌与宿主细胞相互作用的分子机制[C].中国畜牧兽医学会2009学术年会论文集(下册).2009
参考文献[9]曹恬雪,蒋文灿,何文成,纪凤仙,魏志刚.沙门氏菌毒力因子的研究进展[J].中国预防兽医学报,2014,(04):331-334
参考文献[10]陈俊,蒋文灿,谭天,等.沙门氏菌毒力岛及III型分泌系统研究进展[J].中国人兽共患病学报,2015,31(4):371-376
参考文献[11]郭伟军,崔照琼,李华春.沙门氏菌毒力岛及其III型分泌系统[J].上海畜牧兽医通讯,2006(5):49-51
参考文献[12]张成龙.非伤寒沙门氏菌临床株毒力基因初步分析[D].天津医科大学,2015
参考文献[13]邹兰.致病性大肠杆菌、沙门氏菌毒力岛双重PCR方法建立与应用[D].安徽农业大学,2012
参考文献[14]陈飞,成大荣,王丽芳,孙怀昌,张鑫宇.禽沙门氏菌毒力岛标志基因研究与mgtC基因序列分析[J].江苏农业科学,2010,(06):53-56
技术实现要素:
本发明目的包括:
以沙门氏菌毒力岛标志基因mgtC、sseL为目的基因,建立的双重PCR检测方法:
提供一种同时检测沙门氏菌毒力岛标志基因mgtC、sseL的方法;
提供一种鉴定沙门氏菌的方法;
提供一种区分伤寒沙门氏菌和肠炎沙门氏菌的鉴定方法等。
本发明具体提供了两对用于沙门氏菌毒力岛基因mgtC、sseL的双重PCR检测方法的引物,其中毒力岛基因mgtC的引物的核苷酸序列如序列表SEQ ID NO.1和SEQ ID NO.2所示,毒力岛基因mgtC的引物的核苷酸序列如序列表SEQ ID NO.3和SEQ ID NO.4所示。基于本发明公开的引物,通过多次单一PCR方法,或使用双重PCR方法,可用于鉴定沙门氏菌的鉴定。
本发明公开了一种检测沙门氏菌毒力岛基因mgtC、sseL的双重PCR检测方法,其中毒力岛基因mgtC的引物的核苷酸序列如序列表SEQ ID NO.1和SEQ ID NO.2所示,毒力岛基因mgtC的引物的核苷酸序列如序列表SEQ ID NO.3和SEQ ID NO.4所示;包括以下步骤:
(1)双重PCR反应;双重PCR反应体系:样品细菌模板溶液3uL,(mgtC引物对0.15uL,sseL引物对0.85uL),2×Taq Master MIX 8.5uL,双蒸水11.5uL;
双重PCR扩增参数:94℃变性5min,之后开始扩增循环,每个循环的程序为:94℃变性45s,57℃退火45s,72℃延伸1min,共35个循环;最后72℃延伸10min;降温至15℃,PCR反应结束;
(2)PCR扩增产物凝胶电泳分析判定:取步骤(1)PCR扩增产物进行凝胶电泳;
进一步的,凝胶电泳结果在449bp和184bp位置同时出现扩增条带,则说明样品中含沙门氏菌;如果电泳结果在184bp位置出现单一条带,说明样品中含伤寒沙门氏菌;如果电泳结果在449bp和184bp位置均未出现扩增条带,则说明样品中不含沙门氏菌。
其次,本发明还公开了上述鉴定方法用于鉴定沙门氏菌毒力岛基因mgtC和sseL的用途,以及用于鉴定沙门氏菌的用途;
本发明还公开了上述方法用于鉴定区分伤寒沙门氏菌和肠炎沙门氏菌的用途。
优选的,上述方法中步骤(1)样品细菌含有的沙门氏菌≥3×103cfu·mL-1。
本发明提供的双重PCR方法,可针对沙门氏菌(乙型副伤寒沙门氏菌、伤寒沙门氏菌、肠炎沙门氏菌)特异性的扩增出清晰的目标基因mgtC、sseL条带,而大肠杆菌、金黄色葡萄球菌则不能扩增出条带。
本发明提供的双重PCR方法,在将沙门氏菌菌液浓度稀释到仅为3×103cfu·mL-1时,该方法仍能扩增出两条清晰的目标条带,具有良好的敏感性。
伤寒沙门氏菌和肠炎沙门氏菌是沙门氏菌属中较常见的两种。但伤寒沙门氏菌毒力岛内只表达mgtC基因,没有sseL基因表达,这与肠炎沙门氏菌有明显区别,所以,本次试验所建立的沙门氏菌毒力岛mgtC、sseL基因双重PCR检测方法对于沙门氏菌属伤寒沙门氏菌和肠炎沙门氏菌两个菌种的鉴别鉴定可提供一定的依据。
有益效果
沙门氏菌病作为常见的人畜共患病之一,能够感染哺乳动物,爬行动物,鸟、昆虫,以及人;在家禽家畜和野生动物中传播,可造成肉蛋等畜禽产品的污染。因此,及时的发现沙门氏菌,控制传染源,对该病的治疗和防控有积极的作用。传统的沙门氏菌鉴定,需要增菌纯化培养、生化试验和血清学试验等方法,所以,传统培养鉴定工作量大、难度大、易出错和漏检、灵敏度较低。
本研究针对沙门氏菌毒力岛特异性mgtC、sseL基因所建立的双重PCR检测方法,具有操作简单,快速、准确、敏感性高、特异性强等特点,能够为检测省力、省时、节约成本。所以,该检测方法有非常广泛的应用前景,可以应用于沙门氏菌的流行病学调查、临床检测;还可以应用于养殖各环节中沙门氏菌的检测和食品流通环节中沙门氏菌的监测;还可以应用于沙门氏菌致病机理及免疫机理的相关性研究。
本发明提供的沙门氏菌毒力岛mgtC、sseL基因双重PCR检测方法具有简单快捷,准确率高,敏感性高,特异性强的特点。本次试验所建立的沙门氏菌毒力岛mgtC、sseL基因双重PCR检测方法对于沙门氏菌属伤寒沙门氏菌和肠炎沙门氏菌两个菌种的鉴别鉴定可提供一定的依据。
附图说明
图1 mgtC基因温度梯度结果
其中,M:MakerD2000;1:52.8℃;2:53.9℃;3:54.9℃;4:56℃;5:57.1℃;6:58.2℃。
图2 sseL基因温度梯度结果
其中,M:MakerD2000;1:49℃;2:50.5℃;3:52.4℃;4:54.5℃;5:56.7℃;6:58.5℃。
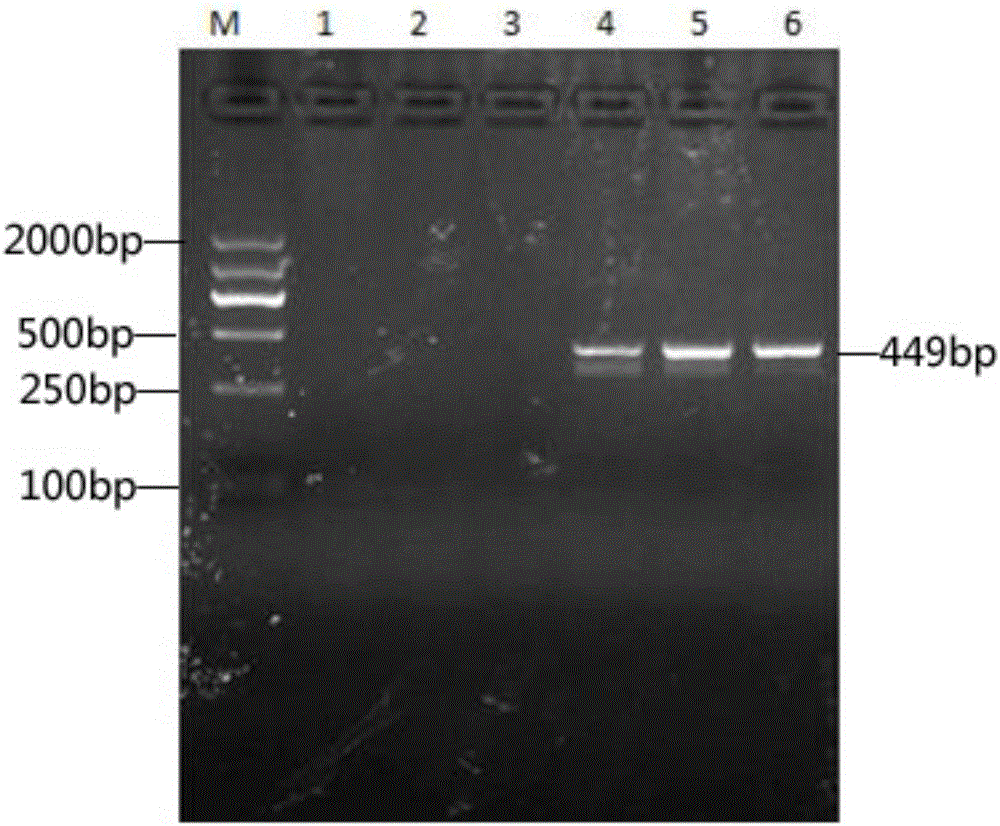
图3双重PCR特异性试验结果
其中,M:MakerD2000;1乙型副伤寒沙门氏菌;2肠炎沙门氏菌;3伤寒沙门氏菌;4大肠埃希氏菌;5金黄色葡萄球菌;6空白对照。
图4双重PCR敏感性试验结果
其中,MakerD2000;1原菌液;2 3×108cfu·mL-1;3 3×107cfu·mL-1;4 3×106cfu·mL-1;5 3×105cfu·mL-1;6 3×104cfu·mL-1;7 3×103cfu·mL-1;8 3×102cfu·mL-1;9 3×101cfu·MmL-1。
具体实施方式
以下为实施例的实验菌株、试剂与仪器、细菌的增殖、细菌DNA模板制备的方法。
实验菌株
乙型副伤寒沙门氏菌CMCC50094,肠炎沙门氏菌CMCC(B)50335,伤寒沙门氏菌CMCC(B)50071,大肠埃希氏菌ATCC25922,金黄色葡萄球菌ATCC6538,菌株购自中国兽药监察所。
试剂与仪器
细菌基因组DNA提取试剂盒、GeneGreen核酸染料、2×Taq Master MIX、ddH2O等,购自天根生化科技有限公司。
PCR扩增仪、SDS-PAGE凝胶成像系统、切胶仪、电泳仪等。
细菌的增殖
将乙型副伤寒沙门氏菌、肠炎沙门氏菌、金黄色葡萄球菌、伤寒沙门氏菌、大肠埃希氏菌分别接种到营养肉汤(LB)培养基中,置于恒温摇床37℃、180r/min培养14h后,保存备用。
细菌DNA模板制备
分别抽取各菌菌液1ml,按细菌DNA提取试剂盒操作说明提取细菌DNA,-20℃保存,备用。
实施例一、沙门氏菌毒力岛基因mgtC、sseL双重PCR检测方法的建立
(1)引物设计及合成
参照GenBank中已发布的沙门氏菌毒力岛mgtC和sseL基因序列,用Primer5.0软件设计2对特异性引物,并引物进行分析,确保在引物之间无二聚体和发夹结构等。分析合格后的引物由上海杰李生物科技有限公司合成.
mgtC基因引物序列为:
mgtC-F:5′>TGACGACATCGCCAGACA<3′
mgtC-R:5′>GCCCTAAGCCGCATAACA<3′
sseL基因引物序列为:
sseL-F:5′>GCGAATGTGGTCGTCAGA<3′
sseL-R:5′>TGGTAGCAGGATCGTTTT<3′
mgtC扩增产物测序结果和GenBank中发表的沙门氏菌mgtC基因比对,同源性达到100%。sseL扩增产物测序结果和GenBank中发表的沙门氏菌sseL基因比对,同源性达到99%。
(2)单一引物PCR实验
以乙型副伤寒沙门氏菌为PCR扩增DNA模板,做单一引物温度梯度PCR扩增,确定mgtC、sseL基因PCR扩增最佳退火温度。
PCR反应体系(25uL):DNA模板3uL,上游引物0.5uL,下游引物0.5uL,2×Taq Master MIX 8.5uL,ddH2O 12.5uL。
单一PCR检测扩增参数具体为:94℃变性5min;之后开始扩增循环,每个循环的程序为:94℃变性45s→56±5℃退火45s→72℃延伸1min,35个循环;最后72℃延伸10min;降温至15℃,结束。
分别取上述PCR扩增产物15uL点样于1.5%琼脂糖凝胶,105V恒压,电泳40min。电泳完成后放入SDS-PAGE凝胶成像仪,观察条带并将清晰的条带切胶送往上海杰李生物科技有限公司进行序列测定。
测序结果与NCBI数据库中已发表的沙门氏菌相应基因序列,运用BLAST程序进行同源性比对。单一mgtC基因、sseL基因的温度梯度PCR扩增结果如图1、图2所示。扩增结果图谱显示,乙型副伤寒沙门氏菌的mgtC、sseL基因均能扩增出特异性目标条带,条带大小分别是184bp、449bp;引物mgtC在温度57.1℃电泳成像条带较亮,引物sseL在温度56.7℃电泳成像条带较亮。
(3)双重PCR检测的建立
双重PCR体系为25uL:mgtC引物对0.15uL,sseL引物对0.85uL,细菌DNA模板3uL,2×Taq Master MIX 8.5uL,ddH2O 11.5uL。
PCR检测扩增参数具体为:94℃变性5min,之后开始扩增循环,每个循环的程序为:94℃变性45s,57℃退火45s,72℃延伸1min,共35个循环;最后72℃延伸10min;降温至15℃,结束。
实施例二、基于沙门氏菌毒力岛基因mgtC、sseL双重PCR检测方法特异性试验
分别将乙型副伤寒沙门氏菌、肠炎沙门氏菌、伤寒沙门氏菌、大肠埃希氏菌、金黄色葡萄球菌DNA作为细菌DNA模板,空白对照组以ddH2O为模板,按实施例一步骤(3)试验条件进行双重PCR,检测该方法特异性。
双重PCR特异性结果如图3。乙型副伤寒沙门氏菌和肠炎沙门氏菌均能扩增出2条清晰的目的条带,伤寒沙门氏菌能扩增出1条清晰条带;大肠埃希氏菌、金黄色葡萄球菌和空白对照不能扩增出条带。
伤寒沙门氏菌缺失sseL基因,所以没有扩增出449bp长度的条带。因此,本试验设计的沙门氏菌毒力岛mgtC-sseL双重PCR检测方法特异性强。
实施例三、基于沙门氏菌毒力岛基因mgtC、sseL双重PCR检测方法敏感性试验
将增菌后的乙型副伤寒沙门氏菌菌液稀释菌液浓度为3×108cfu/L。进一步用无菌营养肉汤对其做10倍梯度稀释,使菌液终浓度为106-100cfu/L,并编号。分别取各浓度菌液1ml提取细菌DNA,按实施例一步骤(3)试验条件进行双重PCR,检测该方法敏感性。
敏感性结果显示,菌液浓度从3×108cfu·mL-1稀释至3×103cfu·mL-1时,9个浓度均能扩增出两条清晰的目标条带如图4。
试验设计的沙门氏菌毒力岛mgtC-sseL双重PCR检测方法在菌液浓度为3×103cfu·mL-1时仍能检测出沙门氏菌,敏感性高。
序列表
<110> 西昌学院
<120> 一种沙门氏菌毒力岛基因mgtC、sseL双重PCR检测方法及用途
<130> 2016
<160> 4
<170> PatentIn version 3.3
<210> 1
<211> 18
<212> DNA
<213> 人工序列
<220>
<221> mgtC F引物
<222> (1)..(18)
<400> 1
tgacgacatc gccagaca 18
<210> 2
<211> 18
<212> DNA
<213> 人工序列
<220>
<221> mgtC R引物
<222> (1)..(18)
<400> 2
gccctaagcc gcataaca 18
<210> 3
<211> 18
<212> DNA
<213> 人工序列
<220>
<221> sseL F引物
<222> (1)..(18)
<400> 3
gcgaatgtgg tcgtcaga 18
<210> 4
<211> 18
<212> DNA
<213> 人工序列
<220>
<221> sseL R引物
<222> (1)..(18)
<400> 4
tggtagcagg atcgtttt 18
- 还没有人留言评论。精彩留言会获得点赞!