一种钴配合物与制备方法及其应用与流程
本发明属于钴配合物技术领域,尤其是涉及一种钴配合物与制备方法及其应用。
背景技术:
DNA的有效识别在疾病治疗、新药研发及诊断方式的发展等方面起关键作用,因此研究者对于设计合成生理条件下识别DNA的小分子化合物产生了的极大兴趣。过渡金属化合物被广泛用作研究一些生物大分子的探针,因此化学工作者致力于设计合成具有生物活性的过渡金属配合物。开发低毒,水溶性好的新型药物显得尤为迫切。
以人体本身存在的微量元素作为金属中心的配合物,可能对身体正常细胞具有较低的毒性,而且其水溶性也较好。钴是人体必须的微量元素,作为生物体内一些结构和催化中心的辅助因子参与体内多个生物反应过程。近年来,许多钴的化合物被设计合成,而且表现出了较好的DNA识别能力和抗肿瘤活性。
技术实现要素:
有鉴于此,本发明旨在提出一种钴配合物与制备方法及其应用,该钴配合物具有较好的DNA键合能力和BSA键合能力,从而为产物作为药物较好的在体内运输提供了一定依据,制备方法简单、可靠。
为达到上述目的,本发明的技术方案是这样实现的:
一种钴配合物,化学式为[Co(bpma)(N3)3],其中bpma为N-甲基-N,N-二吡啶甲基胺。
进一步的,该钴配合物的结构式为:
进一步的,该钴配合物属于单斜晶系,P21/n空间点群。晶胞参数为α=γ=90°,β=105°,单胞体积为
进一步的,该钴配合物的中心离子CoIII的配位数是六,配位原子分别是bpma中的N1,N2,N3和三个叠氮阴离子的氮原子N4,N7,N10,形成一个八面体构型,其中N1,N3,N7,N10组成八面体的赤道面,N2和N4占据八面体的顶点位置,与中心离子的距离分别是Co-N的平均键长是金属Co离子到赤道面的距离为
本发明还提供了制备所述钴配合物的方法,包括如下步骤:
将Co(NO3)2·6H2O溶于乙腈和水的混合溶液中,然后加入含有bpma的乙腈溶液,常温下搅拌20~30min,接着加入NaN3,待搅拌2.5~3小时后过滤,滤液置于室温,挥发后得黑红色针状晶体即为产物,所述Co(NO3)2·6H2O、bpma、NaN3的投料范围为(0.1~1.0mmol):(0.1~1.0mmol):(0.1~1.0mmol)。
进一步的,所述Co(NO3)2·6H2O、bpma、NaN3的投料范围为(0.1~0.5mmol):(0.1~0.5mmol):(0.3~1.0mmol)。
进一步的,所述Co(NO3)2·6H2O、bpma、NaN3的摩尔比为1:1:3。
进一步的,所述乙腈和水的体积比为(0.5~1):(1~2)。
进一步的,所述乙腈和水的体积比为1:2。
本发明同时提供了如上所述的钴配合物在制备抗癌药物中的应用。
电子吸收光谱实验和荧光淬灭实验证实所述配合物与CT-DNA之间有中等键合的插入作用。
电子吸收光谱实验证实配合物能够有效地与BSA白蛋白结合。
相对于现有技术,本发明所述的钴配合物与制备方法及其应用具有以下优势:
本发明所述的钴配合物与制备方法及其应用,步骤简短,常温搅拌、自然挥发条件下即可得到目标产物,不需过多外界辅助如加热回流、水热合成等,目标产物具有良好的水溶性,从而为进一步性质测试及临床试验提供一个良好的开端,产物与CT-DNA存在较强的键合作用;此外,化合物还能够有效地与BSA键合,为化合物作为潜在药物在体内有效运输提供了有价值的信息,具体地将讲,运用多种光谱方法证实配合物与CT-DNA存在较强的键合作用,而且作用方式为部分插入作用;此外,运用电子吸收光谱实验探讨了配合物与BSA的相互作用,结果显示配合物能够有效地与BSA白蛋白结合。
附图说明
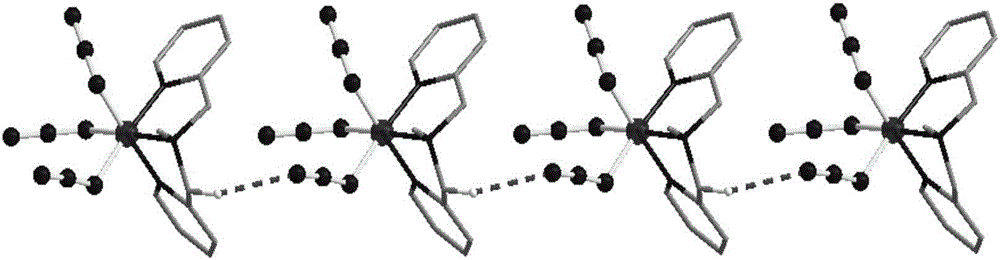
图1为本发明实施例1所述的钴配合物的单元结构图;
图2为本发明实施例1所述的钴配合物的一维链示意图;
图3为本发明实施例1所述的钴配合物的紫外-可见光谱示意图;
图4为本发明实施例1所述的钴配合物在加入不同量的CT-DNA后的电子吸收光谱变化示意图;
图5为本发明实施例1所述的钴配合物与EB竞争的荧光淬灭实验结果;
图6为本发明实施例1所述的钴配合物在0℃和25℃下对EB-DNA复合物荧光的影响;
图7为本发明实施例1所述的钴配合物加入不同量BSA后的电子吸收光谱变化示意图。
具体实施方式
除有定义外,以下实施例中所用的技术术语具有与本发明所属领域技术人员普遍理解的相同含义。以下实施例中所用的试验试剂,如无特殊说明,均为常规生化试剂;所述实验方法,如无特殊说明,均为常规方法。
下面结合实施例及附图1~7来详细说明本发明。
实施例1
将0.3mmol Co(NO3)2·6H2O溶于15mL乙腈和水的体积比为1:2的混合溶液中,然后加入0.5mL含有bpma的乙腈溶液,其中bpma为0.3mmol,常温下搅拌30min,接着加入0.6mmol NaN3,待搅拌3小时后过滤,滤液置于室温,挥发后得黑红色针状晶体即为产物。
1)元素分析结果(%),实验值:C 39.14,H 3.75,N 42.16;理论值:C 39.16,H 3.77,N 42.18。
用KBr压片的IR光谱值为:3414cm-1(s)(νH2O),2922cm-1(w)(νC-H),2027cm-1(s)(νN≡N),1634cm-1(m)(νC-N),769cm-1(w),619cm-1(w)。实验值与理论值基本一致。
X射线单晶衍射测定配合物晶体结构:
实验过程:
在173(2)K下,选取大小合适的晶体,用经石墨单色器单色化的Mo-Kα射线作为入射光源,以ω-2θ扫描方式收集衍射数据。晶体结构用直接法解出,先用差值函数法和最小二乘法确定全部非原子氢坐标,再用理论加氢的方法得到氢原子位置,最后用最小二乘法对晶体结构进行精修。所有的计算使用SHELXS-97和SHELXL-97程序包进行。
实验结果:
从元素分析、红外光谱及X射线单晶衍射数据可知,配合物属于单斜晶系,P21/n空间点群。如图1所示,配合物的中心离子CoIII的配位数是六,配位原子分别是bpma中的N1,N2,N3和三个叠氮阴离子的氮原子N4,N7,N10,形成一个八面体构型。其中N1,N3,N7,N10组成八面体的赤道面,N2和N4占据八面体的顶点位置。与中心离子的距离分别是Co-N的平均键长是金属Co离子到赤道面的距离为
配合物中存在多种弱作用力,如图2所示,配合物通过C6-H6A…N12键,连成的一维链状结构。
2)实施配合物的紫外-可见光谱试验:
实验过程:
在室温下,向样品池和参比池中各加2.0mL三蒸水,然后向样品池加入一定量体积浓的配合物水溶液并向参比池中补加相应等体积的水。配合物的浓度为2.0×10-4mol/L,在200-1200nm测定配合物的紫外可见光谱。
实验结果:
如图3所示,配合物在200~1200nm的范围内有三个吸收带。203nm处的吸收,为π-π跃迁;312nm处的吸收,为配体到金属离子的荷移跃迁;570nm处的吸收,为金属离子的d-d跃迁。
3)实施加入不同量的CT-DNA,观察配合物的电子吸收光谱变化试验:
实验过程:
在室温下,向样品池和参比池中各加2.0mL缓冲溶液,然后向样品池加入一定量体积的配合物溶液并向参比池中补加相应等体积的缓冲溶液。用微量进样器向样品池和参比池中加入一定量相同体积的CT-DNA储备液,使CT-DNA与配合物的浓度比值不断增加,观察配合物吸收峰的变化并将数据保存,所述缓冲溶液中含有NaCl和Tris,其中NaCl的浓度为50mM,Tris的浓度为5mM,用三蒸水配制,用盐酸调至pH=7.4。
实验结果:
配合物在205nm处有强的紫外吸收,如图4所示,随着CT-DNA的逐渐等量加入,配合物的最大紫外吸收强度出现明显的下降,即出现了明显的“减色效应”,同时伴随了红移现象,红移距离△λ为11nm。配合物荷移跃迁峰也发生了减色效应,但不如π-π跃迁峰减色明显。说明配合物在本实验条件下,可能是以部分插入的键合方式和DNA发生相互作用。
4)实施加入不同量的配合物,观察EB-DNA的荧光淬灭试验:
铜配合物本身不产生荧光,所以不能采用直接荧光光谱法研究配合物与DNA的相互作用。故我们采用配合物淬灭EB-DNA结合物的荧光,通过研究EB-DNA结合物荧光强度的变化来间接测定配合物与DNA的结合程度。
实验过程:
配制CT-DNA和EB的混合溶液,其含量分别为2.4×10-6M EB和4.8×10-5M CT-DNA,储备于4℃冰箱中。配合物配制成10-3M储备液。淬灭滴定实验时,向样品池中加入2.0mL储备的EB-DNA混合液,观察其荧光强度,然后用微量进样器每次向样品池中加入等体积的配合物储备液,观察发射光谱的变化并将数据保存以便拟合处理。
实验结果:
配合物淬灭EB-DNA的荧光光谱如图5所示,在加入配合物后,EB-DNA的荧光强度出现明显的降低,并且随着配合物浓度的增加,其荧光强度逐渐降低,表明配合物与CT-DNA的竞争结合取代了EB。根据经典的荧光淬灭理论Stern–Volmer方程式,I0/I=1+K[Q],以加入配合物前后EB-DNA的荧光强度比值(I0/I)为纵坐标,配合物的浓度为横坐标,做出了Stern–Volmer图即图5,对测试数据进行拟合,得到较好的线性关系。根据方程KEB[EB]=Kapp[complex],KEB=1.0×107M-1,其中[EB]=2.38μM,计算出配合物的表观键合常数Kapp为9.16×104M-1,小于经典键合常数107M-1。说明配合物与DNA之间为中等键合作用。
5)更进一步分析了在0℃和25℃下,配合物对EB-DNA复合物荧光的影响。如图6所示,配合物随着温度升高,斜率K减小,说明该配合物与EB-DNA形成的复合物随着温度的升高越来越不稳定,其荧光淬灭为静态淬灭机理。
6)实施加入不同量的BSA,观察配合物的电子吸收光谱变化试验:
血清白蛋白中含有色氨酸、苯丙氨酸、络氨酸等具有光学活性的氨基酸残基,当血清白蛋白的结构发生变化或者是氨基酸残基所处的微环境受到干扰时,光学活性会发生变化。小分子配合物在和血清白蛋白作用时,能生成复合物或者是影响甚至是改变血清白蛋白的结构,进而影响血清白蛋白的光谱变化。
紫外-可见吸收光谱法主要是利用血清白蛋白中色氨酸、苯丙氨酸、络氨酸等氨基酸残基吸收峰的变化来进行分析的,如果吸收峰在小分子配合物和血清白蛋白作用的前后发生了变化,则说明小分子配合物和血清白蛋白发生了作用。由此,我们通过电子吸收光谱研究了铜配合物与BSA的相互作用。
实验过程:
在室温下,向样品池和参比池中各加2.0mL缓冲溶液,缓冲溶液用三蒸水配制的浓度为10mM NaH2PO4/Na2HPO4,pH=7.0,然后向样品池加入一定量体积的配合物溶液并向参比池中补加相应等体积的缓冲溶液。用微量进样器向样品池和参比池中加入一定量相同体积的BSA储备液,使BSA与配合物的浓度比值不断增加,观察配合物吸收峰的变化并将数据保存。
实验结果:
由图7可以清晰地看出,随着BSA的不断加入,配合物在205nm处的π-π跃迁峰发生明显的减色现象并伴有红移,红移的距离为6nm;255nm处的荷移跃迁峰几乎未受BSA浓度增加的影响。说明在本实验条件下,表明配合物与BSA之间发生了相互作用。
表1配合物的晶体结构的主要数据
表2配合物晶体的主要键长、键角
实施例2
将0.1mmol Co(NO3)2·6H2O溶于15mL乙腈和水1:2的混合溶液中,然后加入0.2mL含有bpma的乙腈溶液,其中bpma为0.1mmol,常温下搅拌30min,接着加入0.3mmol NaN3,待搅拌3小时后过滤,滤液置于室温,挥发一个月。
结论:得到棕黑色粉末。
实施例3
将0.5mmol Co(NO3)2·6H2O溶于20mL乙腈和水1:1的混合溶液中,然后加入1mL含有bpma的乙腈溶液,其中bpma为0.6mmol,常温下搅拌30min,接着加入1mmol NaN3,待搅拌3小时后过滤,滤液置于室温,挥发两个月。
结论:得到棕黑色微晶,不适合单晶解析。
以上所述仅为本发明的较佳实施例而已,并不用以限制本发明,凡在本发明的精神和原则之内,所作的任何修改、等同替换、改进等,均应包含在本发明的保护范围之内。
- 还没有人留言评论。精彩留言会获得点赞!