一种IL28B基因多态性检测试剂盒的制作方法
本实用新型涉及一种基因检测试剂盒,特别是涉及一种IL28B基因多态性检测试剂盒。
背景技术:
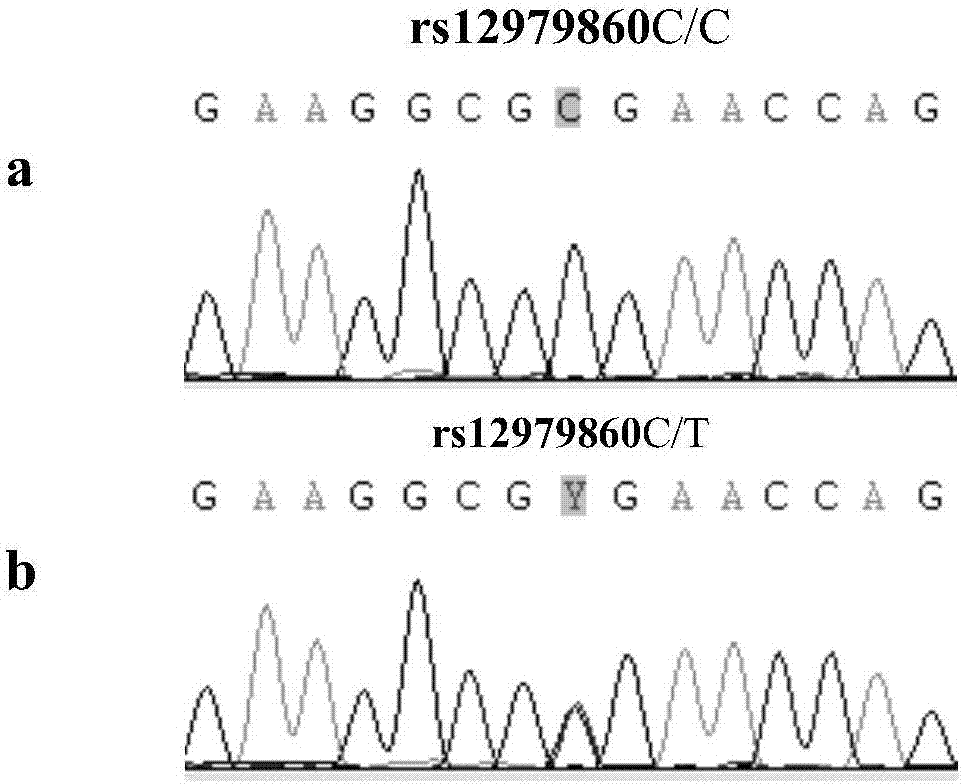
:丙型肝炎病毒(hepatitisCvirus,HCV)的感染已经成为一个世界性的卫生难题。据流行病学调查,全球HCV的感染人口接近3%,并且以每年300-400万的病例递增,是目前国际上慢性终末期肝病和肝癌的主要病因之一。由于缺乏有效的疫苗,因此及早发现并给予有效的抗HCV病毒治疗,是丙型肝炎患者治疗的关键。目前丙型肝炎的抗病毒治疗的标准模式为长效干扰素-α(Pegylatedinterferon-α,PEG-IFN-α)和利巴韦林(ribavirin,RBV)的联合治疗。由于1型丙型肝炎患者的持续病毒应答率低,长期服用相关药物所带来的严重不良反应,使得丙型肝炎的抗病毒治疗成为一大难题。2009-08/2010-01,世界上有4个独立的研究小组,各自在不同种族的丙型肝炎患者中进行全基因关联(Genome-WideAssociationStudy,GWAS)研究,证实IL-28B区域附近存在与长效干扰素-α与利巴韦林标准方案疗效相关的单核苷酸多态位点(SNP)。美国杜克大学Ge等报道,19号染色体上IL-28B基因上游3kb的一个单核苷酸多态位点rs12979860,与1型丙型肝炎治疗的持续病毒反应率、标准方案SVR预测的特异性及敏感性密切相关,可作为预测1型HCV患者标准方案疗效的重要独立指标。研究表明,具有CC基因型的患者,标准方案治疗所带来的持续病毒反应率比TT型人群要高2倍左右。有研究证实,rs12979860位点CC型对标准方案SVR预测的特异性及敏感性分别达到了78%和65%,其作为对1型丙型肝炎患者标准治疗方案的持续病毒反应率(SVR)所具有独特的预测作用,CC型对非CC型的优势比达到了5.79。有研究则进一步证实了该位点的多态性对非1型慢性丙型肝炎患者,特别是对具有早期病毒学反应(rapidvirologicalresponse,RVR)的这部分患者标准方案的疗效具有同样的预测作用。澳大利亚悉尼大学的Suppiah等、日本名古屋城市大学Tanaka等以及瑞士伯尔尼大学Rauch等人通过在不同种族的丙型肝炎中所进行全基因关联研究中,一致证实了另1个与持续病毒反应率密切相关的单核苷酸多态位点的存在——即位于IL-28B基因上游8kb的位点rs8099917。研究表明,相对于其他与1型HCV患者抗病毒方案疗效相关的因素,如年龄、病毒载量等,rs8099917基因型对持续病毒反应及无病毒反应(NVR)的预测最为重要。常见的rs8099917位点TT型基因与SVR密切相关,可达到50%,NVR仅为12%,GG型患者中,SVR接近于0%,NVR则可高达80%,GT型的SVR及NVR则介于TT型与GG型之间,这充分说明rs8099917基因型可以作为预测1型HCV患者标准方案抗病毒治疗的另一个指标,特别是针对NVR的预测。有研究进一步证实,rs8099917对其他非1型HCV患者联合治疗方案疗效同样具有预测作用。其中rs8099917位点TT型患者的SVR要高于非TT型患者(SVR为76%vs51%),特别是对于其中的2a型HCV患者,经单变量分析可知rs8099917位点TT型可以作为一个预测持续病毒反应的独立指标。Tanaka等研究中同时还证实了在日本人中还存在第三个与持续病毒反应率密切相关的单核苷酸多态位点的存在——即位于IL-28B基因下游3kb的位点rs12980275。在其报告中,该位点AA型和AG型患者的持续病毒反应率与位点rs8099917十分相似,分别为63.6%和17.5%。同时,国内学者研究中也显示rs12980275的基因型在SVR、NVR组中的相关性分析r均大于0,呈正相关。rs12980275基因型AA型与AG型,在SVR和NVR患者中差异均有统计学意义(P<0.05)。rs12980275多态性可有效地预测干扰素抗病毒治疗应答效果,具有独立预测抗病毒治疗的特征。除上述对治疗效果的预测作用外,IL28B基因还与HCV感染流行特点、HCV的自发清除率、标准治疗相关的不良反应也存在着一定的关联。有研究发现,HCV慢性感染患者中,非1型HCV患者,rs12979860位点CC型的概率明显高于1型患者(66.7%vs39.1%),CC型的非1型HCV感染率显著高于其他基因型的患者。还有研究表明,无论是欧洲还是非洲人群中,rs12979860位点CC别的患者发生的病毒自发清除率,要远远高于非CC患者(欧洲人80.3%vs66.7%;非洲人56.2%vs37.0%)。此外,研究还发现,rs12979860位点TT型患者食欲不振、乏力等常见不良反应的发生率明显低于非TT型患者,其严重不良反应发生率仅为3.1%,而在CT型、CC型患者中则分别达到了10.1%、8.9%。因此,IL-28B基因型不仅与SVR存在着很大的相关性,而且在一定程度上也与HCV感染的流行病学分布、自发清除及治疗中所带来的各种不良反应相关。目前已有多个全基因关联研究证实,IL-28B基因区域附近的SNP位点rs8099917,rs12979860和rs12980275基因型与当前标准方案抗病毒疗效密切相关。通过该位点基因型的检测,可以达到对丙型肝炎标准方案疗效的预测,从而对不同基因型的患者采取区别对待及治疗的原则,从而改变当前丙型肝炎治疗策略,提高整个丙型肝炎诊疗水平。因此,2011年美国肝脏病研究协会(AmericanAssociationfortheStudyofLiverDiseases,AASLD)和欧洲肝脏病学会(EuropeanAssociationForTheStudyOfTheLiver,EASL)在更新的HCV感染防治指南已将IL-28B基因多态性列为预测慢性HCV感染疗效的重要的因素。目前关于SNP的检测包括根据DNA列阵的微测序法、动态等位基因特异的杂交、寡聚核苷酸特异的连接、DNA芯片以及TaqMan系统等,但在所有SNP的检测方法中,对待检测片段进行直接扩增、测序是最为准确的方法,也是SNP分析的金标准。而IL-28Brs12979860,rs8099917和rs12980275多态性的研究多采用芯片的方法,但该方法准确度不高,并且成本较高。本实验室采用采用的基于PCR扩增后进行直接测序分析的检测方法,具有准确度高,特异性和重复性好等特点,可直接对IL-28Brs12979860,rs8099917和rs12980275进行序列比对分析,能准确对SNP位点的基因型进行直观的判断,是IL-28Brs12979860、rs8099917和rs12980275SNP分析的金标准。技术实现要素:本实用新型所要解决的技术问题是提供一种IL28B基因多态性检测试剂盒,本实用新型将IL28B基因多态性检测所需要的试剂进行预混、整合,操作灵活,使用便捷,易于保存。本实用新型解决其技术问题所采用的技术方案是:提供一种IL28B基因多态性检测试剂盒。一种IL28B基因多态性检测试剂盒,包括盒体1、盒盖2和设置在盒体内的两块衬垫3,衬垫3上设有小孔,左侧小孔中设有装有PCR扩增试剂的试剂管4和装有扩增引物的试剂管5,右侧小孔中设有装有PCR产物纯化试剂的试剂管6、装有DNA测序试剂的试剂管(7)和装有测序正反向引物的八联管8;盒盖2内侧设有条码区9。所述两块衬垫3将PCR扩增所需试剂和测序纯化所需试剂分开放置。扩增引物为测序正反引物预混成的引物。所述小孔在衬垫3上平行排列。所述条码区9内含试剂盒中试剂保存、配制信息。有益效果由于采用了上述的技术方案,本实用新型与现有技术相比,具有以下的优点和积极效果:本实用新型将IL28B基因多态性检测所需要的试剂进行预混、整合,操作灵活,使用便捷,易于保存;本实用新型采用基于PCR扩增后进行直接测序分析的检测方法,具有准确度高,特异性和重复性好等特点,可直接对IL-28Brs12979860,rs8099917和rs12980275进行序列比对分析,能准确对SNP位点的基因型进行直观的判断,是IL-28Brs12979860、rs8099917和rs12980275SNP分析的金标准。附图说明图1是本实用新型的一种IL28B基因多态性检测试剂盒结构示意图;图2是本实用新型的IL-28Brs12979860C/T杂合型(b)和C/C纯合型(a)的测序峰图;图3是本实用新型的IL-28Brs8099917T/G杂合型(b)和T/T纯合型(a)的测序峰图;图4是本实用新型的IL-28Brs12980275A/G杂合型(b)和A/A纯合型(a)的测序峰图。具体实施方式下面结合具体实施例,进一步阐述本实用新型。应理解,这些实施例仅用于说明本实用新型而不用于限制本实用新型的范围。此外应理解,在阅读了本实用新型讲授的内容之后,本领域技术人员可以对本实用新型作各种改动或修改,这些等价形式同样落于本申请所附权利要求书所限定的范围。下述实施例中所使用的实验方法如无特殊说明,均为常规方法;下述实施例中所使用的实验材料如无特殊说明,均可从商业途径获得。本实用新型的实施方式涉及一种IL28B基因多态性检测试剂盒。如图1所示,为本实用新型提供的一种IL28B基因多态性检测试剂盒的结构示意图,包括盒体1)盒盖2和设置在盒体内的衬垫3,所述衬垫3将盒体分为左右两部分,衬垫上设有小孔,左侧小孔中设有装有PCR扩增试剂的试剂管4和装有扩增引物的试剂管5,右侧设有装有PCR产物纯化试剂的试剂管6、装有DNA测序试剂的试剂管7和装有测序正反向引物的八联管8,盒盖2内侧设有条码区9,条码区9内含试剂盒中试剂保存、配制信息。各试剂排列如图1所示。操作步骤如下:1.DNA提取:(使用天根公司人类基因组DNA提取试剂盒,货号:DP331),按照试剂盒说明书提取DNA,使用50ul去离子水洗脱DNA,若当天不使用,则要-20℃保存。2.PCR:将PCR扩增试剂(成分包括:0.05U/μLTaqDNA聚合酶、400μMdNTPs、4mMMgCl2、20mMTris-HCLPH8.0和50mMKCL)、去离子水及IL-28Brs12979860、rs8099917和rs12980275SNP扩增引物,室温解冻并混匀,瞬时离心。3.本试剂盒包含3对PCR引物,860F/RPCR扩增产物检测rs12979860突变;917F/RPCR扩增产物检测rs8099917突变;275F/RPCR扩增产物检测rs12980275突变,测序引物与PCR引物共用,如下表:引物浓度均为5umol/L。4.PCR反应体系:每个样本需要做三管PCR扩增(使用不同的PCR引物),体系配制如下表,每一个PCR扩增总体积20uL。PCR扩增试剂10μL去离子水6μLPCR引物(上游)1μLPCR引物(下游)1μLDNA2μL5.PCR反应条件:6.PCR产物纯化:每一个反应孔体系总体积为11uL,由PCR产物纯化试剂2uL和PCR产物9uL组成。反应条件为:37℃、50分钟;95℃、5分钟;4℃保存。7.DNA测序反应:每一个反应孔体系总体积为5uL,有去离子水2uL、测序引物1uL、PCR纯化产物1uL和DNA测序试剂1uL组成。反应条件为:95℃、4分钟;95℃、15秒;56℃、20秒、60℃、2分钟,共25个循环;4℃保存。8.反应结束后,每管加入2uL125MM乙二胺四乙酸二钠EDTA-2Na和15uL无水乙醇,震荡混匀,3700转/分,4℃离心30分钟,轻轻倒去上清液体;每管加入50uL75%的乙醇,3700转/分,4℃离心15分钟,轻轻倒去上清液体;室温放置10~15分钟后,每管加入10ul去离子甲酰胺HIDI溶液,震荡混匀,静置10分钟,上测序仪。9.结果分析:将测序仪上的结果拷贝下来,使用Chromas分析测序结果。IL-28Brs12979860C/T杂合型(b)和C/C纯合型(a)的测序峰图见图2;IL-28Brs8099917T/G杂合型(b)和T/T纯合型(a)的测序峰图见图3;IL-28Brs12980275A/G杂合型(b)和A/A纯合型(a)的测序峰图见图4。当前第1页1 2 3
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1
- ERCC1基因多态性检测体系及其试剂盒的制造方法与工艺
- 用于检测CYP2C19基因多态性的引物、探针及检测试剂盒的制造方法与工艺
- 高脂血症风险关联基因多态性检测方法与制造工艺
- 用于检测AGTR1基因的A1166C多态性位点的核酸、试剂盒及方法与制造工艺
- 一种检测与结直肠癌靶向用药西妥昔单抗治疗敏感性相关基因的多态性的试剂盒及其应用的制造方法与工艺
- 线粒体基因组9bp序列基因多态性在评价苯中毒风险中的应用的制造方法与工艺
- 一种rs12979860基因分型双色荧光PCR快速检测试剂盒的制造方法与工艺
- CYP2C19基因多态性检测引物、探针及试剂盒的制造方法与工艺
- 检测CYP2C9和VKORC1基因多态性的引物、探针和试剂盒的制造方法与工艺
- 一种检测CYP2C9基因多态性的ARMS引物的制造方法与工艺
- HaeIII检测食管癌易感基因PTEN多态性方法与流程
- 用于检测人类ADRB1基因 G1165C多态性的核酸、试剂盒及方法与流程
- 一种用于检测CYP2C9和VKORC1基因多态性的组合物及其应用的制作方法与工艺
- 一种用于检测CYP2C19基因多态性的组合物及其应用的制作方法与工艺
- 一种CYP2C19基因多态性检测试剂盒及检测方法与流程
- ERCC1基因突变检测特异性引物和液相芯片试剂盒的制作方法与工艺
- 一种IL28B基因多态性检测试剂盒的制造方法与工艺
- 检测10个位点耳聋基因多态性的SNaPshot试剂盒的制造方法与工艺
- 一种检测人类CYP2C19基因多态性的方法及试剂盒与流程
- 检测22个位点耳聋基因多态性的SNaPshot试剂的应用的制造方法与工艺