一种山楂叶中黄酮单体的制备方法与流程
本发明属于中药有效成分的高效制备技术领域,具体涉及一种山楂叶中黄酮单体的制备方法。
技术背景
山楂叶(Crataegi Folium)为蔷薇科(Rosaceae)植物山里红(Crataegus pinnatifida Bge.Var.major N.E.Br.)或山楂(Crataegus pinnatifida Bge.)的干燥叶,具有活血化瘀,理气通脉,化浊降脂等多种功效,在我国山东、陕西、山西等地均广泛分布。山楂叶作为山楂果实的副产物,资源丰富、产量高,具有广泛的开发价值。现代药理研究表明山楂叶具有降血脂、抗心肌缺血缺氧、防治糖尿病、抗炎和镇痛等多种药理活性。并且已广泛的应用于山玫胶囊、益心酮片等多味中药中。传统的山楂叶中黄酮类化合物的分离方法为聚酰胺色谱、硅胶柱色谱和Sephadex LH-20等制备方法,其局限性是费时费力、污染环境、样品纯度低,而且反复柱层析对样品有不可逆性吸附作用,分离得到黄酮类化合物单体制备效率低、成本较高,难以发展成为制备量大的分离技术。
高速逆流色谱(High-speed Counter-current Chromatography,HSCCC)是近30年发展起来的一种连续的无需任何固体支持物的高效、快速的液-液分配色谱分离技术,它避免了固态支持体或载体带来的样品易被死吸附、损耗和变性等各种问题,使用其它液相色谱法进行制备型分离时,其分配效率会显著降低,溶剂消耗量大,HSCCC保证较高峰型分辨度,分离量大、样品无损失、回收率高、分离环境缓和,节约溶剂。高速逆流色谱能直接进大量粗提样品或合成混合物,分离结果能达到相当高的纯度,已广泛应用于生物、医药、环保等领域化学物质的制备分离和纯化。但是溶剂系统的选择对于HSCCC分离效果十分关键,而到目前为止,溶剂系统的选择还没有充分的理论依据,而是根据操作人员积累的丰富经验来选择,如根据实际情况,总结分析并参照相关的专著及文献,从所需分离的物质的类别出发寻找相似的分离实例,选择极性适合的溶剂系统。如果遇到待分离纯化的物质种类较多时,而且没有与待分离的物质的极性相似的分离实例时,则难以确定溶剂系统,更无法对溶剂系统中的各种溶剂的比例进行调节,难以实现待分离物质的分离。
技术实现要素:
针对上述现有技术中存在的技术问题,本发明提供了一种山楂叶中黄酮单体的制备方法,包括如下步骤:
1)将山楂叶粉碎、提取、富集、蒸干,制得山楂叶总黄酮样品;
2)应用高速逆流色谱法将样品中的槲皮素-3-O-(2,6-di-α-L-吡喃鼠李糖基)-β-D-半乳糖苷,4”-O-牡荆素葡糖苷、异槲皮苷和(2R,3R)-3,5,7,3',5'-五羟基黄烷进行分离纯化;
溶剂系统为氯仿:甲醇:水:正丁醇=3.5-4.5:2.5-3.5:1.5-2.5:1-2(v/v)。
本发明中将提取得到的总黄酮样品经特定溶剂系统的高速逆流色谱分离纯化,得到纯度大于98%的槲皮素-3-O-(2,6-di-α-L-吡喃鼠李糖基)-β-D-半乳糖苷,4”-O-牡荆素葡糖苷、异槲皮苷和(2R,3R)-3,5,7,3',5'-五羟基黄烷。该方法成本低,操作简便,效率高,可以大批量分离制备高纯度山楂叶黄酮单体化合物。
进一步的,步骤1)中,所述提取是将一定质量的山楂叶粉末用7-9倍量的50-95%乙醇加热回流提取,得提取液。
采用50-95%乙醇可以对山楂叶粉中的槲皮素-3-O-(2,6-di-α-L-吡喃鼠李糖基)-β-D-半乳糖苷,4”-O-牡荆素葡糖苷异槲皮苷和(2R,3R)-3,5,7,3',5'-五羟基黄烷具有良好的提取效果,有利于这四种单体的制备。
更进一步的,对山楂叶粉末提取的次数为2-4次,每次提取1.5-2.5h。
更进一步的,将所述提取液减压回收乙醇,至无醇味,加入一定量热水,过滤后,得到上柱溶液,将上柱溶液用大孔树脂柱富集,洗脱、浓缩,制得总黄酮样品。
大孔树脂柱有利于槲皮素-3-O-(2,6-di-α-L-吡喃鼠李糖基)-β-D-半乳糖苷,4”-O-牡荆素葡糖苷、异槲皮苷和(2R,3R)-3,5,7,3',5'-五羟基黄烷四种黄酮单体的富集,避免了这四种单体的损失。
更进一步的,所述洗脱包括如下步骤:先用纯水洗脱,再用70%乙醇洗脱,将70%乙醇的洗脱物合并收集。
进一步的,步骤2)中,高速逆流色谱法的溶剂系统为氯仿:甲醇:水:正丁醇=4:2.5-3.5:1.5-2.5:1-2(v/v)。
进一步的,高速逆流色谱法的溶剂系统为氯仿:甲醇:水:正丁醇=4:3:2:1.5,v/v。
进一步的,高效逆流色谱仪的分离参数为:柱体积200-400mL,上样量150-800mg,转速600-1000rpm,上相为固定相,下相为流动相,流动相的流速1-10mL/min,检测波长254nm。
更进一步的,柱体积300mL,上样量200mg,转速850rpm,流动相的流速5.0-10.0mL/min。
进一步的,启动高速逆流色谱仪,根据其检测器的紫外光谱图接收目标成分,制得(2R,3R)-3,5,7,3',5'-五羟基黄烷、异槲皮苷和4”-O-牡荆素葡糖苷,然后将逆流色谱管内溶液按 照从头到尾的模式吹出,根据色谱图收集,制得槲皮素-3-O-(2,6-di-α-L-吡喃鼠李糖基)-β-D-半乳糖苷。
一种具有降血脂、抗心肌缺血缺氧、防治糖尿病、抗炎、抗镇痛药理活性的药物的制备方法,包括利用上述方法从山楂叶中制备高纯度槲皮素-3-O-(2,6-di-α-L-吡喃鼠李糖基)-β-D-半乳糖苷,4”-O-牡荆素葡糖苷、异槲皮苷和(2R,3R)-3,5,7,3',5'-五羟基黄烷的步骤。
本发明的有益效果为:
本发明的制备方法利用大孔树脂柱富集山楂叶中总黄酮,最后经高速逆流色谱分离纯化,槲皮素-3-O-(2,6-di-α-L-吡喃鼠李糖基)-β-D-半乳糖苷,4”-O-牡荆素葡糖苷、异槲皮苷和(2R,3R)-3,5,7,3',5'-五羟基黄烷。成本低于现有技术,操作简便,效率高,可以较大批量分离制备出纯度大于98%的山楂叶黄酮单体化合物。
附图说明
构成本申请的一部分的说明书附图用来提供对本申请的进一步理解,本申请的示意性实施例及其说明用于解释本申请,并不构成对本申请的不当限定。
图1为本发明的工艺流程图;
图2为实施例1山楂叶总黄酮分离的高速逆流色谱图,I:(2R,3R)-3,5,7,3',5'-五羟基黄烷;II:异槲皮苷;III:4”-O-牡荆素葡糖糖苷;IV:槲皮素-3-O-(2,6-di-α-L-吡喃鼠李糖基)-β-D-半乳糖苷;
图3为实施例1山楂叶总黄酮样品的高效液相色谱图;
图4为实施例1中制备的(2R,3R)-3,5,7,3',5'-五羟基黄烷的高效液相色谱图;
图5为实施例1中制备的异槲皮苷单体的高效液相色谱图;
图6为实施例1中制备的4”-O-牡荆素葡糖苷单体的高效液相色谱图;
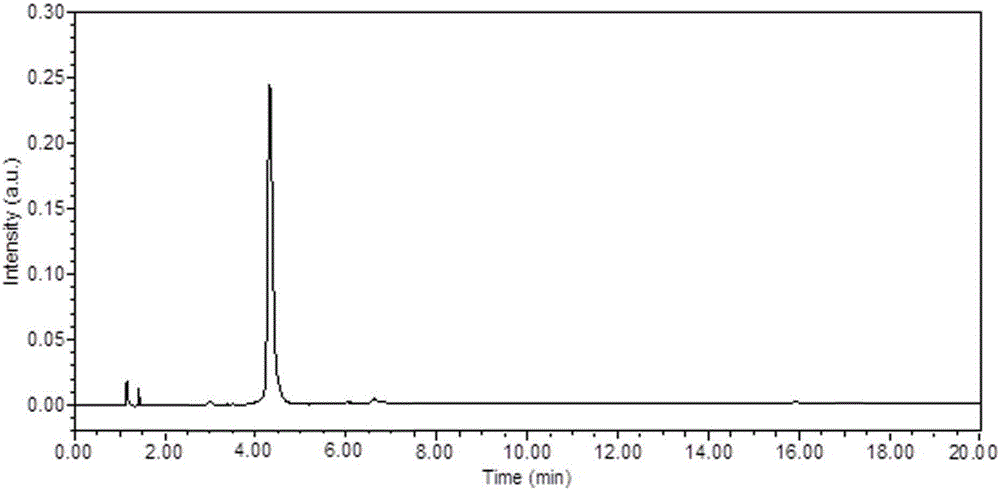
图7为实施例1中制备的槲皮素-3-O-(2,6-di-α-L-吡喃鼠李糖基)-β-D-半乳糖苷单体的高效液相色谱图;
图8为对比例1中的山楂叶总黄酮分离的高速逆流色谱图;
图9为对比例2中的山楂叶总黄酮分离的高速逆流色谱图。
具体实施方式
应该指出,以下详细说明都是例示性的,旨在对本申请提供进一步的说明。除非另有指明,本文使用的所有技术和科学术语具有与本申请所属技术领域的普通技术人员通常理解的相同含义。
需要注意的是,这里所使用的术语仅是为了描述具体实施方式,而非意图限制根据本申请的示例性实施方式。如在这里所使用的,除非上下文另外明确指出,否则单数形式也 意图包括复数形式,此外,还应当理解的是,当在本说明书中使用术语“包含”和/或“包括”时,其指明存在特征、步骤、操作、器件、组件和/或它们的组合。
实施例1
如图1所示,一种山楂叶中黄酮单体的制备方法,包括如下步骤:
1.山楂叶总黄酮的提取
山楂叶总黄酮的提取:将山楂叶粉碎,加8倍量70%乙醇(70%是体积分数)加热回流提取2次,每次2h。两次提取液合并,减压回收乙醇,至无醇味,加入适量热水,抽滤或离心,即得上柱溶液。将上述溶液进行大孔树脂柱富集,先用纯水洗脱,再用70%乙醇洗脱,70%乙醇洗脱物合并收集,减压浓缩至浸膏,得山楂叶总黄酮样品。
2.应用高速逆流色谱分离纯化山楂叶总黄酮单体
溶剂系统为氯仿-甲醇-水-正丁醇(4:3:2:1.5,v/v),高速逆流色谱仪柱体积为300mL,上样量200mg,转速850rpm,上相为固定相,下相为流动相,流速5.0mL/min,检测波长254nm。
具体的操作步骤是:按上述溶剂比例配制溶剂系统,置于分液漏斗中,摇匀后静置分层,待平衡一段时间后将上下两相分开,取200mg富含山楂叶总黄酮样品,溶解于10mL加上相和10mL下相中待用。采用上海同田公司研制的半制备型高速逆流色谱仪,它是由柱塞泵、进样阀、紫外检测仪、记录仪和色谱分离柱(由聚四氟乙烯管多层缠绕形成的螺旋管柱,容量为300mL)等组成,首先使进样阀处于进样状态,将固定相用泵以一定流速灌满色谱分离柱,停泵。开启速度控制器,使高速逆流色谱仪的色谱分离柱正转,转速达850rpm时,将溶解好的样品用注射器注入逆流色谱仪进样阀的贮液管中,旋转进样阀为接柱状态,使样品进入色谱分离柱。设置流动相流速为5.0mL/min,开始泵流动相,然后根据检测器紫外光谱图(如图2所示)接收目标成分,得(2R,3R)-3,5,7,3',5'-五羟基黄烷(8.9mg,图4),异槲皮苷(47.3mg,图5),4”-O-牡荆素葡糖苷(18.2mg,图6)。将逆流色谱管内溶液按照从头到尾的模式吹出,分瓶收集,根据色谱图收集峰,得到槲皮素-3-O-(2,6-di-α-L-吡喃鼠李糖基)-β-D-半乳糖苷(10.3mg,图7),HPLC分析得四种黄酮单体的纯度均为98%以上。
利用高效液相色谱分析分离物,液相条件:Waters XBridge BEH C18柱(100mm×4.6mmi.d.,2.5μm),紫外检测波长254nm,柱温:25℃,流速:1.0mL/min,进样量:10μL,洗脱溶剂为乙腈和水,梯度条件为:0-3min,13%-14%乙腈;3-15min,14%-17%乙腈;15-15.1min,17%-13%乙腈;15.1-20min,13%乙腈。
结构鉴定:对分离得到的黄酮应用Agilent 5973N质谱仪和Bruker AV-400MHz核磁共振 波谱仪分别进行MS,NMR谱的测定,所得数据如下:
(2R,3R)-3,5,7,3',5'-五羟基黄烷:ESI-MS,m/z 289.1[M-H]-,579.2[2M-H]-.1H-NMR(400MHz,DMSO-d6)δ:9.11(1H,s,OH),8.82-8.89(3H,br s,OH),6.89(2H,d,J=1.2Hz,H-2',6'),5.89(1H,d,J=2.0Hz,H-6),5.70(1H,d,J=2.4Hz,H-8),4.74(1H,s,OH),4.67(1H,d,J=2.4Hz,H-2),4.00(1H,d,J=2.4Hz,H-3),2.68(1H,dd,J=4.0,16.4Hz,H-4),2.47(1H,dd,J=4,16.4Hz,H-4).13C-NMR(100MHz,DMSO-d6)δ:157.0(C-7),156.7(C-9),156.2(C-5),145.0(C-3'),144.9(C-5'),131.1(C-1'),118.4(C-4'),115.4(C-2'),115.3(C-6'),99.0(C-10),95.6(C-6),94.6(C-8),78.5(C-2),65.4(C-3),28.7(C-4).
槲皮素-3-O-(2,6-di-α-L-吡喃鼠李糖基)-β-D-半乳糖苷:ESI-MS,m/z 757.3[M+H]+. 1H-NMR(400MHz,DMSO-d6)δ:7.69(1H,dd,J=2.0,8.4Hz,H-6'),7.49(1H,d,J=2.0Hz,H-2'),6.82(1H,d,J=8.4Hz,H-5'),6.40(1H,br s,H-8),6.20(1H,br s,H-6),5.58(1H,d,J=7.6Hz,galH-1),5.06(1H,s,rha-a H-1),4.39(1H,s,rha-b H-1),1.05(3H,d,J=6.0Hz,rha-b H-6),0.80(3H,d,J=6.0Hz,rha-aH-6).13C-NMR(100MHz,DMSO-d6)δ:177.7(C-4),164.6(C-7),161.7(C-5),156.7(C-2),156.7(C-9),148.8(C-4'),145.3(C-3'),133.3(C-3),122.5(C-6'),121.6(C-1'),116.2(C-2'),115.7(C-5'),104.4(C-1),101.0(rha-a C-1),100.5(rha-b C-1),99.5(C-1),99.2(C-6),94.0(C-8),75.3(C-2),74.4(C-3),73.8(C-5),72.4(rha-αC-4),72.4(rha-βC-4),71.9(rha-αC-3),71.1(rha-αC-2),71.1(rha-βC-2),70.9(rha-βC-3),69.0(C-4),68.7(rha-αC-5),68.6(rha-βC-5),65.5(C-6),18.4(rha-βC-6),17.7(rha-αC-6).
4”-O-牡荆素葡糖苷:ESI-MS,m/z 593.2[M-H]-.1H-NMR(400MHz,DMSO-d6)δ:13.15(1H,s,5-OH),8.01(2H,d,J=8.8Hz,H-2',6'),6.90(2H,d,J=8.8Hz,H-3',5'),6.73(1H,s,H-3),6.24(1H,s,H-6),4.86(1H,d,J=10.0Hz,H-1”'),4.80(1H,d,J=10.0Hz,H-1”).13C-NMR(100MHz,DMSO-d6)δ:182.4(C-4),164.2(C-2),162.9(C-9),161.2(C-4'),160.4(C-7),156.7(C-5),129.3(C-6'),129.1(C-2'),122.2(C-1'),116.6(C-5'),116.3(C-3'),105.6(C-3),104.2(C-10),104.0(C-8),103.1(C-1”'),98.7(C-6),82.2(C-1”),81.6(C-4”),78.9(C-5”),76.7(C-5”'),76.5(C-3”'),74.8(C-2”'),72.0(C-3”),70.5(C-2”),70.4(C-4”'),61.4(C-6”),60.9(C-6”').
异槲皮苷:ESI-MS,m/z 463.2[M-H]-.1H-NMR(400MHz,DMSO-d6)δ:12.75(1H,s,4'-OH),7.58(1H,dd,J=6.0,2.0Hz,H-6'),7.57(1H,d,J=2.0Hz,H-2'),6.89(1H,d,J=8.4Hz,,H-5'),6.41(1H,d,J=2.0Hz,H-8),6.21(1H,d,J=2.0Hz,H-6),5.46(1H,d,J=7.2Hz,H-1”). 13C-NMR(100MHz,DMSO-d6)δ:177.8(C-4),164.7(C-7),161.7(C-5),156.8(C-9),156.5(C-2),148.9(C-4'),145.3(C-3'),133.7(C-3),122.0(C-6'),121.6(C-1'),116.6(C-5'),115.7(C-2'),103.7(C-10),101.4(C-1”),99.2(C-6),94.0(C-8),77.9(C-5”),76.8(C-3”),74.5(C-2”),70.3(C-4”),61.3(C-6”).
实施例2
山楂叶总黄酮的提取:将山楂叶粉碎,加8倍量60%乙醇加热回流提取2次,每次2h。 两次提取液合并,减压回收乙醇,至无醇味,加入适量热水,抽滤或离心,即得上柱溶液。将上述溶液进行大孔树脂柱富集,先用10%乙醇洗脱,再用70%乙醇洗脱,70%乙醇洗脱物合并收集,减压浓缩至浸膏,得山楂叶总黄酮样品。
2.应用高速逆流色谱分离纯化山楂叶总黄酮单体
溶剂系统为氯仿-甲醇-水-正丁醇(4:3:2:1.4,v/v),高速逆流色谱仪柱体积为300mL,上样量180mg,转速850rpm,上相为固定相,下相为流动相,流速6.0mL/min,检测波长254nm。
具体的操作步骤是:按上述溶剂比例配制溶剂系统,置于分液漏斗中,摇匀后静置分层,待平衡一段时间后将上下两相分开,取180mg富含山楂叶总黄酮样品,溶解于10mL加上相和10mL下相中待用。采用上海同田公司研制的半制备型高速逆流色谱仪,它是由柱塞泵、进样阀、紫外检测仪、记录仪和色谱分离柱(由聚四氟乙烯管多层缠绕形成的螺旋管柱,容量为300mL)等组成,首先使进样阀处于进样状态,将固定相用泵以一定流速灌满色谱分离柱,停泵。开启速度控制器,使高速流色谱仪的色谱分离柱正转,转速达850rpm时,将溶解好的样品用注射器注入逆流色谱仪进样阀的贮液管中,旋转进样阀为接柱状态,使样品进入色谱分离柱。设置流动相流速为6.0mL/min,开始泵流动相,然后根据检测器紫外光谱图接收目标成分,得(2R,3R)-3,5,7,3',5'-五羟基黄烷(8.7mg),异槲皮苷(45.1mg),4”-O-牡荆素葡糖苷(17.7mg)。将逆流色谱管内溶液按照从头到尾的模式吹出,分瓶收集,根据色谱图收集峰,得到槲皮素-3-O-(2,6-di-α-L-吡喃鼠李糖基)-β-D-半乳糖苷(10.1mg),HPLC分析纯度均为98%以上。
对比例1
条件:氯仿-甲醇-水(4:3:2,v/v),流速:5mL min-1,进样量:800mg,固定相保留:66%,转速:800rpm,其他条件与操作都与实施例1中的一样。分离结果:出峰时间太慢,化合物未能洗脱出来,如附图8。
对比例2
条件:正丁醇-乙酸-水(4:1:5,v/v),流速:2mL min-1,进样量:800mg,固定相保留:12%,转速:800rpm,其他条件与操作都与实施例1中的一样。分离结果:保留值过低,样品同时被洗脱出,仍未得到有效分离,如附图9。
由图8和图9可以看出,对比例1与实施例1是在溶剂系统中将正丁醇去掉,并且溶剂系统的前三种比例不变,就导致出峰时间太慢,化合物未得到分离,对比例2中使用其他的溶剂系统,同样导致化合物没有得到有效分离。
以上所述仅为本申请的优选实施例而已,并不用于限制本申请,对于本领域的技术人员来说,本申请可以有各种更改和变化。凡在本申请的精神和原则之内,所作的任何修改、等同替换、改进等,均应包含在本申请的保护范围之内。
- 还没有人留言评论。精彩留言会获得点赞!