一种去甲基化试剂在人白血病细胞中的应用的制作方法
本发明涉及细胞分裂素ortho-topolinriboside(otr)作为一种去甲基化试剂对人白血病细胞株的抗肿瘤作用,属于生物化学与分子生物学技术领域。
背景技术:
白血病是造血组织的恶性疾病,又称“血癌”。造血细胞的某一系列、主要是某一白细胞系列的前体细胞失去分化成熟能力,在骨髓中和其他造血组织中呈恶性克隆性增生、积聚,并侵犯肝、脾、淋巴结,最终浸润破坏全身组织、器官,使正常造血功能受到抑制。白血病与实体肿瘤不同,不是生长在局部的赘生物,而是全身散播,可能侵犯各系统、器官和组织的恶性血液病。临床表现为贫血、出血、感染及各器官浸润症状。根据国外统计,白血病约占肿瘤总发病率的3%左右,是儿童和青年中最常见的一种恶性肿瘤。白血病的发病率在世界各国中,欧洲和北美发病率最高,其死亡率为3.2-7.4/10万人口。亚洲和南美洲发病率较低,死亡率为2.8-4.5/10万人口。传统的治疗以联合化疗为主,而患者的完全缓解率和长期无病生存率均较低,然而常用的化疗药物如阿糖胞苷(ara-c)具有骨髓抑制,神经毒性等副作用。因此,寻找有效提高治疗效率,毒副作用小的天然药物来治疗白血病是十分必要的。
白血病的发生发展是多因素参与、多步骤的复杂过程,涉及遗传学和表观遗传学改变。近年来的研究发现,dna甲基化是人类白血病中普遍存在的现象,与其发病密切相关。启动子区cpg岛高甲基化(hypermethylation)是抑瘤基因、dna修复基因、促凋亡基因失活的主要方式之一。甲基转移酶抑制剂如5-杂氮-2'-脱氧胞苷(5-aza-2'-deoxycitydine,5-aza-2dc)能使甲基化沉默的基因重新表达,恢复其正常功能,在白血病治疗中具有良好的应用前景。国外已有应用甲基转移酶抑制剂如阿扎胞苷、地西他滨、普鲁卡因胺等治疗急性髓系白血病(acutemyelogenousleukemia,aml)、骨髓增生异常综合征(myelodysplasticsyndrome,mds)和慢性粒细胞白血病(chronicmyelogenousleukemia,cml)的临床实验报道。但是这些临床试验阶段的去甲基化试剂具有胃肠反应、骨髓移植、肝损害、神经毒性和肺功能衰竭等的较大的毒副作用,限制了临床应用。因此寻找更有效且毒副作用小的天然来源的去甲基化试剂显得尤为重要。
n6-2-苄胺羟基-9-呋喃核糖基嘌呤(ortho-topolinriboside,otr)是一种存在于黎明时杨树叶子内合成的天然核苷类芳香族细胞分裂素。2010年根据美国国立癌症研究中心(nic)测试结果发现,otr对人的9大瘤系60种肿瘤细胞系(nic60)具有非常显著的体外增殖抑制活性,其中对白血病细胞株的药物敏感性最强(ic50≦1.7μm)。并且通过药物体内筛选模型-中空纤维法发现otr在体内对一些肿瘤模型小鼠无明显的急性毒性反应。上述结果充分表明otr作为一种核苷类细胞分裂素具有很强的抗肿瘤临床应用潜力和临床药用研发价值。
人类dna甲基化的修饰主要通过dna甲基转移酶1(dnmt1)和dna甲基转移酶3(dnmt3)完成。其中,dnmt1含量最多,也是调节cpg岛dna甲基化状态最重要的酶。但是目前关于otr是否通过对dnmt1来调节去甲基化作用并发挥抗肿瘤作用的研究尚未见报道。
技术实现要素:
本发明针对上述现有技术,本发明提供了otr在人白血病细胞株中抗肿瘤的应用。
本发明的技术方案:
一种去甲基化试剂在人白血病细胞中的应用,步骤如下:
(1)细胞培养:将人白血病细胞株thp-1悬浮于含有灭活胎牛血清的无菌rpmi1640培养液中,置于浓度为5%co2、相对湿度为90%、温度为37℃的培养箱中培养,细胞长至培养瓶底面积的70%~80%传代1次;
(2)药物配制:ara-c用无菌rpmi1640培养基溶解,otr用0.1%dmso溶解,继续用无菌rpmi1640培养基将溶解好的ara-c和otr稀释至浓度为0.1μm-30μm,过滤除菌,室温保存;
(3)处理细胞:将处于对数生长期的5×103~1×104个细胞接种于每孔含有100μlrpmi1640培养液的96孔板中,设置10组实验,每组4个复孔,第1组:空白对照组;第2组:0.1%dmso组;第3组:0.3μμotr组;第4组:1.5μμotr组;第5组:15μμotr组;第6组:30μμotr组;第7组:0.3μμara-c组;第8组:1.5μμara-c组;第9组:15μμara-c组;第10组:0.3μμara-c组,分别向各组中加入对应的药物,置于浓度为5%co2、相对湿度为90%、温度为37℃的培养箱中孵育3-5天,细胞计数;
(4)检测细胞增殖抑制率:将处于对数生长期的5×103~1×104个细胞接种于每孔含有100μlrpmi1640培养液的96孔板中,依据步骤(3)处理细胞的方法再一次处理细胞,置于浓度为5%co2、相对湿度为90%、温度为37℃的培养箱中孵育3-5天,各4个复孔;采用cck-8试剂盒进行检测,每孔细胞悬液中加10μlcck-8溶液,置于37℃,co2培养箱中孵育2h,测定450nm处各组细胞的吸光度,记录数据;
(5)检测细胞亚倍体峰:将生长状态活跃的thp-1细胞用otr处理48h后,用流式管分装成三个样品,按照annexinv-fitc凋亡检测试剂盒说明书配制染色缓冲液,每个样品加入500μl染色缓冲液37℃避光孵育30min,最后用pbs洗一次;300目筛网过滤后用bdfacscalibur流式细胞仪上机检测,计算细胞凋亡率;
(6)检测otr对dnmt1酶活性的影响:提取步骤(3)各组处理后的细胞核蛋白,按照epiquickdna甲基转移酶活性/抑制分析试剂盒用酶标仪在450nm读取吸光值并计算dnmt活性;dnmt1进行体外表达克隆和纯化,在450nm下读取吸光值检测otr对dnmt1的抑制活性;
(7)生物信息学分子对接实验:采用生物信息学分子对接模拟方法,将甲基转移酶(dnmt)的天然底物s-腺苷高半胱氨酸(sah)与dnmt1模拟对接空间作用力以及otr与dnmt1模拟对接空间作用力。
本发明的有益效果:本发明的数据建立在otr对人的9大瘤系60种肿瘤细胞系具有非常显著的体外增殖抑制活性,其中对白血病细胞株的药物敏感性最强的基础之上。
附图说明
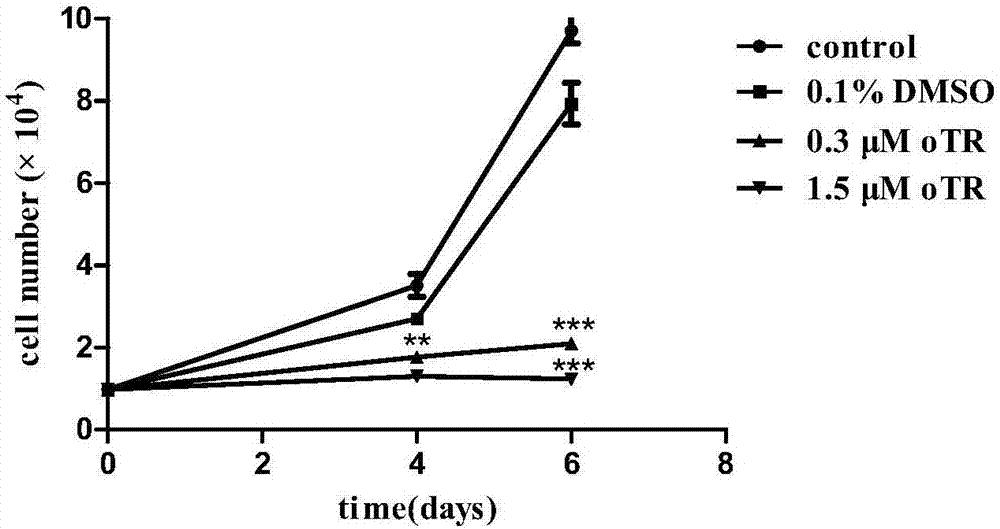
图1为细胞分裂素otr对人白血病细胞增殖的抑制作用。
图2为不同浓度otr处理thp-1细胞的细胞数目变化。
图3为otr对人白血病细胞凋亡的作用。3(a)对照组。3(b)1.5μμotr处理48h后thp-1细胞的细胞周期。
图4为otr对dnmt1酶活性抑制作用。4(a)不同浓度otr作用白血病细胞株48h后总dnmt的活性变化。4(b)不同浓度otr体外对dnmt1克隆酶活性的影响,1:dnmt1;2:0.1μμotr;3:0.1μμotr+dnmt1;4:0.5μμotr+dnmt1;5:1μμotr+dnmt1;6:5μμotr+dnmt1;7:10μμotr+dnmt1。
图5为天然配体sah与dnmt1模拟对接空间作用力示意图及排名前十的libdockscore值。
图6为otr与dnmt1模拟对接空间作用力示意图及排名前十的libdockscore值。
具体实施方式
以下结合附图和技术方案,进一步说明本发明的具体实施方式。
本发明使用的细胞、试剂盒以及试剂:人白血病thp-1细胞株,胎牛血清、双抗(青霉素/链霉素),rpmi1640培养基,cck-8试剂盒,细胞凋亡染色试剂盒,ara-c和otr。
实施例1
otr对人白血病细胞的体外增殖抑制活性:将复苏的人白血病细胞thp-1培养于含有10%fbs灭活胎牛血清、1%青霉素/1%链霉素(双抗)的无菌rpmi1640培养液中,置于悬浮细胞瓶中,在37℃、5%co2及饱和湿度下的培养箱中培养,细胞长至70%-80%左右传代1次。继续培养得到生长状态活跃的人白血病细胞,收集细胞。将处于对数生长期的5×103个细胞接种于每孔含有100μlrpmi1640培养液的96孔板中,按照实验需求,处理组分别加入0.1%dmso、0.3μm、1.5μm、15μm、30μm浓度的ara-c或otr,放入培养箱中孵育3~5天,各4个复孔。采用cck-8试剂盒进行检测,每孔细胞悬液中加10μlcck-8溶液,置于37℃,co2培养箱中孵育2h。测定450nm处各组细胞的吸光度,记录数据,采用重复测量资料的方差分析方法来分析各组数据,结果如图2所示。图2可见,施用不同浓度的otr对人白血病细胞thp-1的增殖速率显著低于ara-c和dmso,表明otr可以抑制人白血病细胞thp-1的增殖速率。
实施例2
otr诱导thp-1细胞凋亡:将生长状态活跃的thp-1细胞用0.3μm的otr处理48h后,按照annexinv-fitc凋亡检测试剂盒说明书配制染色缓冲液,每个样品加入500μl染色缓冲液37℃避光孵育30min,最后用pbs洗一次。300目筛网过滤后用bdfacscalibur流式细胞仪上机检测,计算细胞凋亡率。结果如图3所示,图3可见,细胞凋亡时dna发生断裂,造成细胞内dna含量减少出现亚倍体峰。与对照组(1.21%)相比,otr处理组(19.23%)thp-1细胞出现明显的亚倍体峰(图3),说明在相同实验条件下,otr能诱导thp-1细胞发生凋亡。
实施例3
为了进一步说明otr是一种去甲基化试剂,我们进一步实验发现,otr作用后多种肿瘤细胞内dna甲基转移酶1(dnmt1)的表达量明显降低。通过生物信息学分子对接模拟发现,otr与dnmt1的天然底物sam相比同样可以嵌合在dnmt1结晶模型的活化位点内;小分子亲和性打分函数libdockscore值分析表明,otr与sah的分值相差甚微(图5和图6),上述结果初步表明otr对dnmt1的活性影响更大,因此我们进一步对其进行体外表达克隆和纯化后发现otr明显抑制dnmt1的活性,该结果提示otr通过抑制dnmt1的活性发挥了otr的抗肿瘤作用。试验结果可见,otr是一种去甲基化试剂,但是否可以作为一种临床去甲基化药物现在并不确定。
- 还没有人留言评论。精彩留言会获得点赞!