维生素A酸类和类维生素A酸化合物的前药的制作方法
本申请是第201510594392.3号中国发明专利申请的分案申请。原申请的申请日为2007年01月15日,发明名称为“维生素a酸类和类维生素a酸化合物的前药”。
本发明涉及带有正电荷且水溶性的维生素a酸类及类维生素a酸化合物的前药及其在治疗人或动物的任何维生素a酸类及类维生素a酸化合物可治疗状态上的应用。尤其是,本发明使维生素a酸类及类维生素a酸化合物能快速穿透皮肤。
背景技术:
维生素a酸是一类化合物,其结构含有以头尾相连的方式结合的四个类异戊二烯结构单元。维生素a酸类包括全反式维生素a酸(维生素a酸),顺式-异构维生素a酸,如13-顺式维生素a酸(异维生素a酸)、9-顺式-维生素a酸(阿利维生素a酸),维他命a(维生素a),4-[1-(5,6,7,8-四氢-3,5,5,8,8-五甲基-2-萘基)乙烯基]苯甲酸(蓓萨罗丁,塔革雷汀
另一种可选的给药方式就是外用给药。外用给药系统有几大优点。这种方法帮助避免药物在肝脏和胃肠消化道的首过代谢。它可在无需系统暴露的情况下将适当浓度的药物局部传递至目的作用位点。fishman(fishman;robert,美国专利号7,052,715)指出伴随口服用药产生的另一问题是,为了有效治疗远端位置的疼痛或炎症,血液循环中的药物浓度必须达到很高。这些浓度往往远高于假设药物能直接靶向作用于疼痛或受伤部位的实际所需。yeager试图通过渗透促进剂给药pge1用于治疗男性勃起功能障碍(yeager,jamesl.美国专利号6,693,135)。susanmilosovich等设计并合成了4-二甲基氨基丁酸睾酮酯盐酸盐(tsbh),其具有一脂溶性的部分和一个在生理ph下以质子化形式存在的三级胺结构。他们发现这个前药(tsbh)透过人体皮肤的速度是母药(ts)的近60倍[susanmilosovich,etal.,j.pharm.sci.,82,227(1993)]。
技术问题
维生素a酸类及类维生素a酸化合物已被用于治疗多种健康状态包括痤疮、光致老化、生皮癣、鱼鳞癣、脱发和各种各样的癌症。
然而,维生素a酸类及类维生素a酸化合物的脂溶性太强,在水里完全不溶解。生物膜具有双层结构,亲水的头部结构面向两侧的水相区域。维生素a酸类能进入生物膜的脂质层,但是因相似相容的原因它们会作为生物膜的一部分停留其中,不能有效进入内部的细胞质。由于维生素a酸类具有高度不饱和结构,维生素a酸类对紫外线、空气和氧化剂都非常敏感。维生素a酸类外用给药后,可以进入生物膜但不能进入到细胞内部。阳光、空气或氧化剂会使维生素a酸类发生化学反应,导致皮肤发红、灼热感、蜕皮、开裂、起泡,或发痒。当它们通过口服给药时,又会因首过效应,即肝脏和胃肠道对化合物的化学降解,在几分钟内破坏并失活。口服维生素a酸类会造成不必要的全身系统暴露并且导致许多副作用。
解决方案
本发明涉及带有正电荷的新型的维生素a酸类及类维生素a酸化合物的前药的设计与合成,及其医药用途。9-顺式-维生素a酸(阿利维生素a酸)、13-顺式维生素a酸(异维生素a酸),全反式维生素a酸(维生素a酸)、维他命a(维生素a)、雷替费罗(retiferol)、阿达帕林、非环式维生素a酸,和类维生素a酸化合物的前药具有通式(1到27)“结构式1到27”的结构:
在结构式1-27中,r代表直链或支链,-(ch2)n-,其中n=0、1、2、3、4、5、6、7、8、9、10……,在-(ch2)n-中,任何ch2可以被o、s、ch=ch、c≡c、cr6r6’、芳基或者杂芳基或者其他环状系统基团替代;r1和r2各自独立时可代表相同或不同的基团,可以是h,任一1-12个碳原子的烷基、烷氧基、烯基、或炔基,芳基,或杂芳基,或者合并在一起共同代表-(ch2)n-,其中n=2、3、4、5、6、7、8、9、10……,任何ch2可以被o、s、ch=ch、c≡c、cr6r6’、芳基或者杂芳基或者其他环状系统基团取代;r3代表h,任一1-12个碳原子的烷基、烷氧基、烯基、或炔基,芳基或杂芳基,其中,任何ch2可以被o、s、ch=ch、c≡c、cr6r6’、芳基或者杂芳基或者其他环状系统基团取代;x代表o,s或nh;x1代表h、oh、cl、br、f、i、no2、no、cn、so2r5、cor5、coor5、nr4cor5、sor5、sr5、po3r6r6′、1-6个碳原子的烷基,1-6个碳原子的全氟烷基,1-6个碳原子的烯基,1-6个碳原子的炔基,或1-6个碳原子的烷氧基;x2代表h、oh、cl、br、f、i、no2、cn、so2r5、cor5、coor5、nr4cor5、sor5、sr5、po3r6r6′、sor5、sr5、1-6个碳原子的烷基,1-6个碳原子的全氟烷基,1-6个碳原子的烯基,1-6个碳原子的炔基,或1-6个碳原子的烷氧基;x3代表h、oh、cl、br、f、i、no2、cn、so2r5、cor5、coor5、nr4cor5、sor5、sr5、po3r6r6′、sor5、sr5、1-6个碳原子的烷基,1-6个碳原子的全氟烷基,1-6个碳原子的烯基,1-6个碳原子的炔基,1-6个碳原子的烷氧基;x4代表h、oh、cl、br、f、i、no2、cn、so2r5、cor5、coor5、nr4cor5、sor5、sr5、po3r6r6′、sor5、sr5、1-6个碳原子的烷基,1-6个碳原子的全氟烷基,1-6个碳原子的烯基,1-6个碳原子的炔基,或1-6个碳原子的烷氧基;x5代表h、oh、cl、br、f、i、no2、cn、so2r5、cor5、coor5、nr4cor5、sor5、sr5、po3r6r6′、sor5、sr5、1-6个碳原子的烷基,1-6个碳原子的全氟烷基,1-6个碳原子的烯基,1-6个碳原子的炔基,或1-6个碳原子的烷氧基;x6代表h、oh、cl、br、f、i、no2、cn、so2r5、cor5、coor5、nr4cor5、sor5、sr5、po3r6r6′、sor5、sr5、1-6个碳原子的烷基,1-6个碳原子的全氟烷基,1-6个碳原子的烯基,1-6个碳原子的炔基,或1-6个碳原子的烷氧基;r4代表h、oh、cl、br、f、i、no2、cn、so2r5、cor5、coor5、nr6cor5、sor5、sr5、po3r6r6′、sor5、sr5、1-6个碳原子的烷基,1-6个碳原子的烷氧基,1-6个碳原子的全氟烷基,1-6个碳原子的烯基,1-6个碳原子的炔基,或1-6个碳原子的卤代烷基;r5代表h、oh、cl、br、f、i、no2、cn、so2r6、cor6、coor6、nr6cor4、sor6、sr6、po3r6r6′、sor6、sr6、1-6个碳原子的烷基,1-6个碳原子的烷氧基,1-6个碳原子的全氟烷基,1-6个碳原子的烯基,1-6个碳原子的炔基,或1-6个碳原子的卤代烷基;r11代表h、oh、cl、br、f、i、no2、cn、so2r5、cor5、coor5、nr6cor5、sor5、sr5、po3r6r6′、sor5、sr5、1-6个碳原子的烷基,1-6个碳原子的烷氧基,1-6个碳原子的全氟烷基,1-6个碳原子的烯基,1-6个碳原子的炔基,或1-6个碳原子的卤代烷基;r12代表h、oh、cl、br、f、i、no2、cn、so2r5、cor5、coor5、nr6cor5、sor5、sr5、po3r6r6′、sor5、sr5、1-6个碳原子的烷基,1-6个碳原子的烷氧基,1-6个碳原子的全氟烷基,1-6个碳原子的烯基,1-6个碳原子的炔基,或1-6个碳原子的卤代烷基;r6和r6’各自独立时可代表相同或不同的基团,可以是h、cl、br、f、i、oh、no2、cn、so2r5、cor5、coor5、nr7cor5、sor5、sr5、po3r7r7′、sor5、sr5、1-6个碳原子的烷基、1-6个碳原子的烷氧基、1-6个碳原子的烯基、1-6个碳原子的炔基,或卤代烷基,或者共同代表氧(=o)或-(ch2)n-,其中n=2、3、4、5、6、7、8、9、10……,任何ch2可以被o、s、ch=ch、c≡c、cr7r7’芳基或者杂芳基,或者其他环状系统基团替代;r7和r7各自独立时可代表相同或不同的基团,可以是h、cl、br、f、i、oh、no2、cn、so2r5、cor5、coor5、nr6cor5、sor5、sr5、po3r6r6′、sor5、sr5、1-6个碳原子的烷基、1-6个碳原子的烷氧基、1-6个碳原子的烯基、1-6个碳原子的炔基,或卤代烷基,或共同代表氧(=o)或-(ch2)n-,其中n=2、3、4、5、6、7、8、9、10……,任何ch2可以被o、s、ch=ch、c≡c、cr6r6’、芳基或者杂芳基,或者其他环状系统基团替代;r8和r8’各自独立时可代表相同或不同的基团,可以是h、cl、br、f、i、oh、no2、cn、so2r5、cor5、coor5、nr4cor5、sor5、sr5、po3r6r6′、sor5、sr5、1-6个碳原子的烷基、1-6个碳原子的烷氧基、1-6个碳原子的烯基、1-6个碳原子的炔基,或卤代烷基,或者共同代表氧(=o)或-(ch2)n-,其中n=2、3、4、5、6、7、8、9、10……,任何ch2可以被o、s、ch=ch、c≡c、cr6r6’、芳基或者杂芳基或者其他环状系统基团替代;r9和r9’各自独立时可代表相同或不同的基团,可以是h、cl、br、f、i、oh、no2、cn、so2r5、cor5、coor5、nr4cor5、sor5、sr5、po3r6r6′、sor5、sr5、1-6个碳原子的烷基、1-6个碳原子的烷氧基、1-6个碳原子的烯基、1-6个碳原子的炔基,或卤代烷基,或者共同代表氧(=o)或-(ch2)n-,其中n=2、3、4、5、6、7、8、9、10……,任何ch2可以被o、s、ch=ch、c≡c、cr6r6’、芳基或者杂芳基,或者其他环状系统基团替代;r10和r10’各自独立时可代表相同或不同的基团,可以是h、cl、br、f、i、oh、no2、cn、so2r5、cor5、coor5、nr4cor5、sor5、sr5、po3r6r6′、sor5、sr5、1-6个碳原子的烷基、1-6个碳原子的烷氧基、1-6个碳原子的烯基、1-6个碳原子的炔基,或卤代烷基,或者共同代表氧(=o)或-(ch2)n-,其中n=2、3、4、5、6、7、8、9、10……,任何ch2可以被o、s、ch=ch、c≡c、cr6r6’芳基或者杂芳基,或者其他环状系统基团替代;t代表ch2=c,ch=ch,c(ch3)=ch,c≡c,c=o、c=s、conh,csnh,coo,oco,cos,coch2或ch2co;a-代表cl-,br-,f-,i-,aco-,柠檬酸根,或任何负离子;侧链上的双键可以是z或e构型;所有r,r1,r2,r3,r4,或-(ch2)n-基团可以是支链或直链,可以包含c、h、o,s,n及其他原子,可以含有单键、双键、三键和环状系统。
药物无论是经过肠胃道消化系统还是其他途径吸收,都需要以分子的形式穿过屏障膜。药物需首先溶解,且如果药物具有理想的生物药学特性,它会从高浓度的区域扩散到低浓度的区域,跨过细胞膜进入血液或全身循环系统。所有的生物膜含有脂类作为主要成份。生物膜结构中起主导作用的分子都具有含有磷酸盐的高极性的头部结构,并且,在大多数情况下,两条高度疏水的碳氢尾链。生物膜具有双层结构,亲水的头部结构面向两侧的水相区域。非常亲水的药物无法通过穿过生物膜的脂质层而非常疏水性的药物因相似相容的原因作为生物膜的一部分停留其中,从而不能有效进入内部的细胞质。
本发明的目的是通过提高维生素a酸类及其相关化合物在皮肤表面水分中的溶解度以及提高其对生物膜和皮肤屏障的穿透速度,使其可通过透皮给药(外用)。这些新型维生素a酸类及其相关化合物的前药有两个相同的结构特点:它们有一个亲脂性的部分和一个在生理ph条件下以质子化形式存在的一级、二级、或三级胺基团(水溶性部分)。这样的水溶-油溶平衡是药物能有效穿过生物膜所必需的[susanmilosovich,etal.,j.pharm.sci.,82,227(1993)]。带有正电荷的氨基大大增加了药物在水中的溶解度。很多情况下,药物的溶解是吸收过程中最慢或限制速度的步骤。维生素a酸类及其相关化合物在皮肤表面水分中的溶解度很低,不能以分子形式有效地穿过皮肤屏障。当它们进入皮肤的生物膜以后,因相似相容的原因会作为生物膜的一部分停留其中,从而不能有效进入细胞质,即细胞内部的一种半液态的浓缩水溶液或悬浮液。当这些新型的前药以诸如溶液、喷剂、乳液、软膏、乳胶或凝胶等剂型透皮给药时,它们能迅速溶解在皮肤表面的水分中。这些前药分子中氨基上的正电荷会与细胞膜的磷酸盐端基的负电荷结合。因此,药物在生物膜外侧的局部浓度很高从而有助于这些前药通过高浓度区域到低浓度的区域。当这些前药分子进入到生物膜以后,亲水性部分会推动前药进入细胞质。由于这些前药在皮肤表面的生物膜外侧的停留时间很短,因而不会引起皮肤灼热、疼痛、发痒或肿胀,并且皮肤也不会对阳光敏感。这些前药在人体皮肤中的穿透速度在体外通过改进的franz池测量,其中人体皮肤分离自大腿部位前面或后面的人体皮肤组织(360-400微米厚)。接受溶液由2毫升含有2%的牛血清球蛋白的生理盐水组成并以600转/分的速度搅拌。这些前药和它们的母药穿过皮肤的累积总量对时间的关系是用特定的高效液相色谱法来测定。供体溶液由含有5%某些维生素a酸类前药的溶液,或5%维生素a酸类化合物的混悬液组成,均溶于0.2毫升乙醇和ph7.4的磷酸盐缓冲溶液(0.2m)(v/v,70/30)的混合液中,结果如图1所示。计算穿透人体皮肤的表观穿透值,得到n,n-二乙氨基乙基9-顺式-维生素a酸酯氢溴酸盐、n,n-二乙氨基乙基13-顺式-维生素a酸酯氢溴酸盐、n,n-二乙氨基乙基全反式维生素a酸酯氢溴酸盐、视黄基n,n-二甲基-2-胺基乙酸酯盐酸盐、n,n-二乙氨基乙基4-[1-(5,6,7,8-四氢-3,5,5,8,8-五甲基-2-萘基)乙烯基]苯甲酸酯盐酸盐、9-顺式维生素a酸(阿利维生素a酸)、13-顺式维生素a酸(异维生素a酸)、全反式维生素a酸(维生素a酸)、维他命a(维生素a)和蓓萨罗丁
这些新型的前药对小鼠皮肤的刺激作用或不适反应通过以下方法来评价,将0.1毫升溶于乙醇的1%的各种测试药物外用涂于裸鼠背部,每天两次,一周后评价这些新型的前药对小鼠皮肤的刺激作用或不适反应。对n,n-二乙氨基乙基-9-顺式-维生素a酸酯氢溴酸盐、n,n-二乙氨基乙基-13-顺式-维生素a酸酯氢溴酸盐,n,n-二乙氨基乙基全反式-维生素a酸酯氢溴酸盐,视黄基n,n-二甲基-2-胺基乙酯盐酸盐,n,n-二乙氨基乙基4-[1-(5,6,7,8-四氢-3,5,5,8,8-五甲基-2-萘基)乙烯基]苯甲酸酯盐酸盐未发现刺激作用或不适反应。
一个好的前药应该很容易地变回到母药结构。对这些前药按照以下方法进行体外血浆水解实验。将10毫克前药溶解于0.1毫升0.2mph值7.4的磷酸盐缓冲溶液。将1毫升人血浆预热到37℃,加入至混合物中。混合物于37℃的水浴中保温。每隔两分钟间隔,取出0.2毫升样品并加入0.4毫升甲醇使血浆蛋白沉淀。样品离心5分钟并用高效液相色谱分析。n,n-二乙氨基乙基9-顺式-维生素a酸酯氢溴酸盐水解的半衰期是10±1分钟,n,n-二乙氨基乙基13-顺式-维生素a酸酯氢溴酸盐水解的半衰期为8±2分钟,n,n-二乙氨基乙基全反式维生素a酸酯氢溴酸盐水解的半衰期是9±1分钟,视黄基n,n-二甲基-2-胺基乙酸酯盐酸盐水解的半衰期是13±2分钟,n,n-二乙氨基乙基-4-[1-(5,6,7,8-四氢-3,5,5,8,8-五甲基-2-萘基)乙烯基]苯甲酸酯盐酸盐水解的半衰期是11±2分钟。
塔革雷汀
为了评价这些前药的抗癌活性,将人的乳腺癌细胞(bcap-37,每只小鼠使用3-4毫米3肿瘤组织)植入裸鼠(balb)皮下。1天后,在植入人乳腺癌细胞的区域(靠近前腿)外用涂抹50微升1%的n,n-二乙氨基乙基9-顺式-维生素a酸酯氢溴酸盐和50微升1%的n,n-二乙氨基乙基4-[1-(5,6,7,8-四氢-3,5,5,8,8-五甲基-2-萘基)乙烯基]苯甲酸酯盐酸盐,均溶于乙醇/0.2mph值7.4的磷酸盐缓冲溶液(v/v,70/30),每天涂抹两次。28天后,对照组裸鼠(n=7)的肿瘤发生率为100%(半均肿瘤大小为13±2毫米×12±2厘米),而给药n,n-二乙氨基乙基9-顺式-维生素a酸酯氢溴酸盐或n,n-二乙氨基乙基4-[1-(5,6,7,8-四氢-3,5,5,8,8-五甲基-2-萘基)乙烯基]苯甲酸酯盐酸盐的治疗组裸鼠(n=7)都没有观察到肿瘤。最为重要的是裸鼠给药后没有表现出任何不适或刺激作用。治疗组的裸鼠平均体重为25±2克,空白组的裸鼠平均体重为23±3克。实验结果证明这些前药的副作用非常轻微。
在另一实验中,将人的结肠癌细胞(ls174j,每只小鼠使用使用3-4毫米3肿瘤组织)植入裸鼠(balb)皮下。1天后,在植入人结肠癌细胞的区域(靠近前腿)外用涂抹50微升1%的n,n-二乙氨基乙基9-顺式-维生素a酸酯氢溴酸盐和50微升1%的n,n-二乙氨基乙基4-[1-(5,6,7,8-四氢-3,5,5,8,8-五甲基-2-萘基)乙烯基]苯甲酸酯盐酸盐,均溶于乙醇/0.2mph值7.4的磷酸缓冲溶液(v/v,70/30),每天涂抹两次。28天后,对照组(n=7)的肿瘤发生率为100%(平均肿瘤大小为22±4毫米×20±3毫米),而给药n,n-二乙氨基乙基9-顺式-维生素a酸酯氢溴酸盐或n,n-二乙氨基乙基4-[1-(5,6,7,8-四氢-3,5,5,8,8-五甲基-2-萘基)乙烯基]苯甲酸酯盐酸盐的治疗组(n=7)都没有观察到肿瘤。
所有维生素a酸类都可以购买到。上述通式(1、2、3、5、6、7、8、9、10、11、12、16、17、22、23、24、25、26或27)“结构式1、2、3、5、6、7、8、9、10、11、12、16、17、22、23、24、25、26或27”所表示的化合物可以由维生素a酸类或其相关化合物在偶合剂的作用下与通式(28)“结构式28”所表示的化合物反应制得。偶合剂例如:n,n′-二环己基碳酰亚胺、n,n′-二异丙基碳酰亚胺、o-(苯并三氮唑-1-基)-n,n,n′,n′-四甲基脲四氟硼酸酯、o-(苯并三氮唑-1-基)-n,n,n′,n′-四甲基脲六氟磷酸酯、苯并三氮唑-1-基-氧-三(二甲基氨基)磷鎓六氟磷酸酯等。
其中,r代表直链或支链,-(ch2)n-,其中n=0、1、2、3、4、5、6、7、8、9、10……,在-(ch2)n-中,任何ch2可以被o、s、ch=ch、c≡c、cr6r6’、芳基或者杂芳基,或者其他环状系统基团替代;r1和r2各自独立时可代表相同或不同的基团,可以是h,任一1-12个碳原子的烷基、烷氧基、烯基、或炔基,芳基或杂芳基,或者共同代表-(ch2)n-,其中n=2、3、4、5、6、7、8、9、10……,任何ch2可以被o、s、ch=ch、c≡c、cr6r6’芳基或者杂芳基或者其他环状系统基团替代;x代表o,s或nh。
上述通式(4、13、14、15、20或21)“结构式4、13、14、15、20或21”所表示的化合物可以通过维生素a及其相关化合物与通式(29)“结构式29”所表示的化合物反应得到,
其中,r代表直链或支链,-(ch2)n-,其中n=0、1、2、3、4、5、6、7、8、9、10……,在-(ch2)n-中,任何ch2可以被o、s、ch=ch、c≡c、cr6r6’、芳基或者杂芳基,或者其他环状系统基团替代;r1和r2各自独立时可代表相同或不同的基团,可以是h,任一1-12个碳原子的烷基、烷氧基、烯基、或炔基,芳基或杂芳基,或者共同代表-(ch2)n-,其中n=2、3、4、5、6、7、8、9、10……,任何ch2可以被o、s、ch=ch、c≡c、cr6r6’、芳基或者杂芳基,或者其他环状系统基团替代;r3代表h,任一1-12个碳原子的烷基、烷氧基、烯基、或炔基,芳基或杂芳基,其中,任何ch2可以被o、s、ch=ch、c≡c、cr6r6’、芳基或者杂芳基,或者其他环状系统基团替代;z代表f,cl,br或i;a-代表cl-,br-,f-,i-,aco-,柠檬酸根,或任何负离子。
当x代表o时,上述通式(1、2、3、5、6、7、8、9、10、11、12、16、17、22、23、24、25、26或27)“结构式1、2、3、5、6、7、8、9、10、11、12、16、17、22、23、24、25、26或27”所表示的化合物可以由维生素a酸类及其相关化合物的金属盐、有机碱盐或固定化的碱盐与通式(30)“结构式30”所表示的化合物反应得到。
其中,r代表直链或支链,-(ch2)n-,其中n=0、1、2、3、4、5、6、7、8、9、10……,在-(ch2)n-中,任何ch2可以被o、s、ch=ch、c≡c、cr6r6’、芳基或者杂芳基,或者其他环状系统基团替代;r1和r2各自独立时可代表相同或不同的基团,可以是h,任一1-12个碳原子的烷基、烷氧基、烯基、炔基,芳基或杂芳基,或者共同代表-(ch2)n-,其中n=2、3、4、5、6、7、8、9、10……,任何ch2可以被o、s、ch=ch、c≡c、cr6r6’芳基或者杂芳基,或者其他环状系统基团替代;r3代表h,任一1-12个碳原子的烷基、烷氧基、烯基或炔基,芳基或杂芳基,其中,任何ch2可以被o、s、ch=ch、c≡c、cr6r6’、芳基或者杂芳基,或者其他环状系统基团替代;z代表f,cl,br或i,或对甲苯磺酰基;a-代表cl-,br-,f-,i-,aco-,柠檬酸根,或任何负离子。
优点
本发明中的维生素a酸类及类维生素a酸化合物的前药结构中都有一个脂溶性部分和一个水溶性部分(生理ph值下以质子化形式存在的胺基)。这些前药中带正电的氨基有两大优点。首先,它极大地提高了前药在水中的溶解度,当这些前药以溶液、喷剂、乳液、软膏、乳胶或凝胶等剂型透皮给药时,其能迅速与皮肤、眼睛、生殖器位置、嘴、鼻子或身体其他部位表面水分混合。第二,这些前药氨基上带的正电荷能与生物膜的磷酸盐头部结构带的负电荷结合。因此,生物膜外的局部浓度会很高,从而促进这些前药从高浓度区域穿透至低浓度区域。当这些前药进入到生物膜后,亲水性部分会推动药物进入细胞质,一种浓缩的半液态水溶液或悬浮液。由于在皮肤、眼睛、生殖器位置、嘴、鼻子或身体其他部位的停留时间很短,前药不会引起瘙痒、灼热感或疼痛。实验结果显示超过90%的前药能在几分钟内回到母药。因前药有更高的吸收率且透皮给药可避免首过代谢,因此在相等剂量时这些前药比维生素a酸类及类维生素a酸化合物的作用更强。这些前药透皮给药的另一大好处是用药方便,特别是给儿童用药。
附图说明
图1:通过franz池(n=5)中分离的人体皮肤组织的n,n-二乙氨基乙基9-顺式-维生素a酸酯氢溴酸盐(5%溶液,a),n,n-二乙氨基乙基13-顺式维生素a酸酯氢溴酸盐(5%溶液,b),n,n-二乙氨基乙基全反式维生素a酸酯氢溴酸盐(5%溶液,c),视黄基n,n-二甲基-2-氨基醋酸酯盐酸盐(5%溶液,d),n,n-二乙氨基乙基4-[1-(5,6,7,8-四氢-3,5,5,8,8-五甲基-2-萘基)乙烯基]苯甲酯盐酸盐(5%溶液,e),9-顺式维生素a酸(5%混悬液,f),13-顺式维生素a酸(5%混悬液,g),全反式维生素a酸(5%混悬液,h),维他命a(5%混悬液,i),和蓓萨罗丁(5%混恳液,j)。每个例子中,载体溶液都是乙醇/ph值7.4的磷酸盐缓冲溶液(0.2m)(v/v,70/30)。
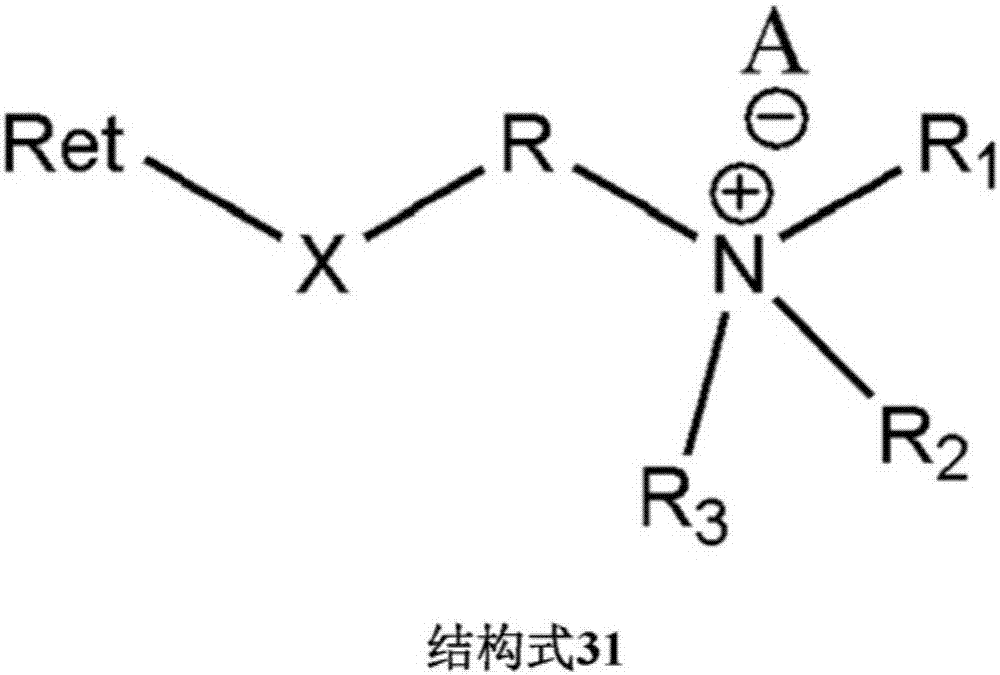
图2:结构31,其中,ret代表维生素a酸类及类维生素a酸的化合物;r代表直链或支链,-(ch2)n-,其中n=0、1、2、3、4、5、6、7、8、9、10……,芳基或杂芳基;r1和r2各自独立时可代表相同或不同的基团,可以是h,任一1-12个碳原子的烷基、烷氧基、烯基或炔基,芳基或杂芳基,或者共同代表-(ch2)n-,其中n=2、3、4、5、6、7、8、9、10……,任何ch2可以被o、s、ch=ch、c≡c、cr4r3、芳基或者杂芳基,或其他环状系统基团替代;r3代表h,任一1-12个碳原子的烷基、烷氧基、烯基、或炔基,或者芳基或杂芳基;r4代表h,任一1-12个碳原子的烷基、烷氧基、烯基、或炔基,或者芳基或杂芳基;x代表o,s或nh;a-代表cl-、br-、f-、i-、aco-,柠檬酸根,或任何负离子;所有r、r1、r2、r3或-(ch2)n-基团是支链或支链,可以包含c,h,o,s或n原子,可以有单键、双键和三键。
最佳实施方式
n,n-二乙氨基乙基9-顺式-维生素a酸酯氢溴酸盐的制备
将32.2克(0.1摩尔)9-顺式-维生素a酸钠溶解于100毫升乙腈中。把26.1克(0.1摩尔)2-溴-n,n-二乙基乙胺氢溴酸盐加入反应混合液。在室温下混合液搅拌过夜。蒸干溶剂。将200毫升乙醇加入蒸干的混合物。过滤除去固体。蒸干滤液。将100毫升乙酸乙酯加入至反应混合物。加入100毫升己烷。过滤收集固体产物。干燥,得到36克预期产品(产率为75%)。易吸湿产品;元素分析:c26h42brno2;分子量:480.52。理论值%c:64.99;h:8.81;br:16.63;n:2.91;o:6.66;实测值%c:65.03;h:8.80;br:16.60;n:2.89;o:6.68。
实施方案
n,n-二乙氨基乙基13-顺式-维生素a酸酯氢溴酸盐的制备
将32.2克(0.1摩尔)13-顺式-维生素a酸钠溶解于100毫升乙腈。把26.1克(0.1摩尔)2-溴-n,n-二乙基乙胺氢溴酸盐加入反应混合液。在室温下将混合液搅拌过夜。蒸干溶剂。将200毫升乙醇加入蒸干的混合物。过滤除去固体。蒸干滤液。将100毫升乙酸乙酯加入至反应混合物。加入100毫升己烷。过滤收集固体产物。干燥,得到38克预期产品(产率为79.1%)。易吸湿产品;元素分析:c26h42brno2;分子量:480.52。理论值%c:64.99;h:8.81;br:16.63;n:2.91;o:6.66;实测值%c:65.03;h:8.80;br:16.60;n:2.89;o:6.68。
n,n-二乙氨基乙基全-反式-维生素a酸酯氢溴酸盐的制备
将32.2克(0.1摩尔)全-反式-维生素a酸钠溶解于100毫升乙腈。把26.1克(0.1摩尔)2-溴-n,n-二乙基乙胺氢溴酸盐加入反应混合液。在室温下将混合液搅拌过夜。蒸干溶剂。将200毫升乙醇加入蒸干的混合物。过滤除去固体。蒸干滤液。将100毫升乙酸乙酯加入至反应混合物。加入100毫升己烷。过滤收集固体产物。干燥,得到35克预期产品(产率为72.9%)。易吸湿产品;元素分析:c26h42brno2;分子量:480.52。理论值%c:64.99;h:8.81;br:16.63;n:2.91;o:6.66;实测值%c:65.03;h:8.80;br:16.60;n:2.89;o:6.68。
n,n-二甲胺基乙酸视黄(维生素a)酯盐酸盐的制备
将28.6克(0.1摩尔)维生素a溶解于100毫升乙腈。25毫升三乙胺加入到该反应液中。16克n,n-二甲胺基乙酰氯盐酸盐加入反应混合液。在室温下将混合液搅拌5小时。过滤除去固体。蒸干滤液。将500毫升乙酸乙酯加入至剩余物中。在搅拌下向混合液中加入200毫升5%碳酸钠溶液。收集有机溶液并用水洗涤(蒸干后得到31克预期产品(产率为75.5%)。易吸湿产品;元素分析:c24h38clno2;分子量:408.02。理论值%c:70.65;h:9.39;cl:8.69;n:3.43;o:7.84;实测值%c:70.60;h:9.46;cl:8.71;n:3.42;o:7.81。
n,n-二乙氨基乙基4-[1-(5,6,7,8-四氢-3,5,5,8,8-五甲基-2-萘基)乙烯基]苯甲酸酯盐酸盐的制备
将34.9克(0.1摩尔)4-[1-(5,6,7,8-四氢-3,5,5,8,8-五甲基-2-萘基)乙烯基]苯甲酸(蓓萨罗丁、塔革雷汀)溶解于300毫升氯仿。把20.6克(0.1摩尔)n,n′-二环己基碳酰亚胺加入到反应混合液。将11.6克二甲胺基乙醇加入到反应混合液中。混合液在室温下搅拌3小时。过滤除去固体。氯仿溶液用5%nahco3(2×100毫升)和水(3×100毫升)洗涤。有机溶液用无水硫酸钠干燥。过滤除去硫酸钠。在搅拌下将溶于100毫升乙醚中的3.6克hcl气体加入到反应混合液中。过滤收集固体产物。干燥后,得到40克预期产品(产率为85.8%)。易吸湿产品;元素分析:c30h42clno2;分子量:484.11。理论值%c:74.43;h:8.74;cl:7.32;n:2.89;o:6.61;实测值%c:74.39;h:8.76;cl:7.29;n:2.91;o:6.65。
工业实用性
通式(1-27)“结构式1-27”表示的这些前药优于维生素a酸类及类维生素a酸化合物。它们可以用于治疗人或动物的任何可用维生素a酸类及类维生素a酸化合物治疗的状态。它们可用于治疗痤疮,痤疮疤痕,牛皮癣,鱼鳞病,湿疹,角质化失调,癌前期病变,药物预防,疣,类肉状瘤病,治疗皮肤光致老化,预防皮肤光致老化,治疗慢性皮肤老化、脱发和各种癌症。
- 还没有人留言评论。精彩留言会获得点赞!