具有SIRT1抑制活性的糖苷类化合物及其制备方法与流程
本发明涉及一种具有sirt1抑制活性的糖苷类化合物及其制备方法。
背景技术:
组蛋白去乙酰化是一种重要的组蛋白共价修饰方式,在基因表达中起着非常重要的调控作用,组蛋白去乙酰化主要由组蛋白去乙酰化酶催化完成。sirt1(silentinformationregulator1)相关蛋白(sirtuins)家族是一组高度保守的烟酰胺腺嘌呤二核苷酸(nad+)依赖的组蛋白去乙酰化酶,广泛存在于从低等生物到人类的各物种中。sirt1主要定位于细胞核中,具有较高的nad+依赖的组蛋白去乙酰化酶活性,通过对组蛋白及多种非组蛋白底物的去乙酰化修饰,调节底物的乙酰化水平和活性,从而参与基因表达调控、细胞凋亡、分化等诸多生理过程,进而影响肿瘤等疾病的发生发展。特异性的sirt1抑制剂作为潜在的药物来源已经引起愈来愈多科学家的关注。近年来,多种不同结构的小分子sirtuin抑制剂被发现或合成,并已有部分小分子抑制剂进入临床研究阶段。
花椒为芸香科(rutaceae)花椒属(zanthoxyluml)植物花椒(zanthoxylumbungeanummaxim.)或青椒(zanthoxylumschinifoliumsieb.etzucc.)的干燥成熟果皮,是十三种调味料之首,既可食用,又可入药。秋季采收,晒干,除去种子和杂质。我国花椒种质资源十分丰富,花椒产量居世界第一,应用广泛。花椒的化学成分主要有挥发油、生物碱、酰胺、脂肪酸、木脂素和香豆素等,具有多种生理功能。花椒中含有糖苷类化合物,该类化合物具有潜在的sirt1抑制活性,故本发明以花椒为主要研究对象,进行糖苷类化合物的发现和sirt1抑制活性筛选。
技术实现要素:
本发明的目的是提供一种具有sirt1抑制活性的糖苷类化合物及其制备方法。
为了满足上述目的,本发明采用的技术方案为:
一种具有sirt1抑制活性的糖苷类化合物,其特征在于具有结构通式如下:
其中r选自以下基团:
其中基团r1选自以下基团:
其中基团r2和r3各自独立的为以下基团:h、oh、och3;
其中基团r4选自以下基团:h、甲基、乙基、丙基;
其中化合物(e)、(f)、(g)中,6位和9位的绝对构型各自独立的为:(6r,9r)、(6r,9s)、(6s,9r)、(6s,9s)。
优选的,一种具有sirt1抑制活性的糖苷类化合物的制备方法,其具体步骤如下:
1)将花椒用提取溶剂进行提取,所述花椒和提取溶剂的质量比为1:3-20,得提取液,再浓缩提取液至无有机溶剂,得到总浸膏a;
2)将总浸膏a溶于水,再利用d101大孔吸附树脂柱层析,或者利用石油醚、乙酸乙酯、正丁醇分别萃取,得到不同的浸膏组分;利用d101大孔吸附树脂柱层析,得到的五个不同的浸膏组分b(水)、c(30%)、d(60%)、e(80%)、f(100%);利用石油醚、乙酸乙酯和正丁醇分别萃取,得到四个不同的浸膏组分g(石油醚相)、h(乙酸乙酯相)、i(正丁醇相)和j(水相);
3)d101大孔吸附树脂柱层析所得浸膏组分b、c、d、e、f和石油醚、乙酸乙酯、正丁醇分别萃取所得浸膏组分g、h、i、j分别进行液质联用仪(hplc-ms/ms或uplc-ms/ms)分析,寻找糖苷类化合物所在部位,实验发现浸膏组分c和i为糖苷类化合物部位,且化合物类型相同,对浸膏组分c和i进行sirt1抑制活性实验测试,实验证实c和i均具有sirt1抑制活性;
4)对浸膏组分c或者i进行硅胶柱层析,用氯仿-甲醇为洗脱剂洗脱,等份收集洗脱液,每份洗脱液采用薄板层析色谱(tlc)定性检测,合并含相同成分的洗脱液,得到六个不同的浸膏组分c-1~c-6或者i-1~i-6;
5)对浸膏c-1~c-6或者i-1~i-6进行制备hplc分离纯化,得到活性化合物,通过核磁共振谱(nmr谱),确定活性化合物的结构。
优选的,所述步骤1)中的提取溶剂为水、甲醇/水的混合溶液或者乙醇/水混合溶液,所述甲醇的体积百分数为0-100%,所述乙醇的体积百分数为0-100%。
优选的,所述步骤1)中的提取方法有室温冷浸提取、加热回流提取、渗漏提取或超声提取。
优选的,所述步骤2)中的利用d101大孔吸附树脂柱层析,所用实验条件为用乙醇/水混合溶液或甲醇/水混合溶液为洗脱溶剂梯度洗脱,梯度洗脱溶剂体积比为水、30%、60%、80%、100%,不同体积比的洗脱溶剂洗脱体积为3-6倍柱体积,分别将不同体积比的洗脱液浓缩,得到五个浸膏组分。
优选的,所述步骤2)中利用石油醚、乙酸乙酯、正丁醇分别萃取,所用实验方法为总浸膏a溶于水后,用等体积的石油醚萃取三次,合并石油醚萃取液,浓缩,得到石油醚相,用同样的方法分别进行乙酸乙酯和正丁醇萃取,得到乙酸乙酯相和正丁醇相,水相浓缩得到水相。
优选的,所述提取方法室温冷浸提取每次需要将花椒在提取溶剂中浸泡5-9天,浸提次数为1-4次;所述提取方法加热回流提取的加热温度为30-100℃,每次提取10-300分钟,提取次数为1-4次,所述提取方法渗漏提取需要将花椒在提取溶剂中浸泡6-24h,再置于渗漏装备;所述提取方法超声提取的提取温度为30-100℃,频率为20-100hz,功率为70-1000w,每次提取0.1-2.0小时,提取次数为1-4次。
优选的,所述步骤3)中uplc-ms/ms分析所用色谱柱为watersacquityuplc®hssc18column(2.1×50mm,1.8μm);hplc-ms/ms分析所用色谱柱为hanbansci&techmegresc18column(4.6×250mm,5μm);流动相为乙腈:0.5%冰醋酸水=a:b;乙腈:0.5%冰醋酸水的洗脱比例:1-20min,a2-15%;20-24min,a15-50%;24-28min,a50-70%;28-32min,a70-92%;流速为0.3ml/min,进样体积:2μl,检测器:pda,检测波长:275nm,离子源:电喷雾离子源。
优选的,所述步骤4)中硅胶柱层析所用洗脱剂氯仿-甲醇中氯仿与甲醇的体积比为30:1~1:3。
优选的,所述步骤5)中制备hplc分离所用色谱柱为半制备benetnachc18柱(hanbansci&tech,10.0×250mm,10μm),流动相为甲醇-水,甲醇与水的洗脱比例为1:20~1:1,流速为2~5ml/min,进样体积:1-100μl,检测器:紫外检测器,检测波长:208nm和254nm。
本发明的有益效果为:
1、在癌症的发生发展方面,sirt1主要通过调节p53基因(p53基因是人体抑癌基因)进而调节癌症的发生发展过程,sirt1抑制剂被应用于多种癌症研究,如乳腺癌、结肠癌、前列腺癌、慢性骨髓性白血病、肺癌等。具有sirt1抑制活性的糖苷类化合物组分的发现及其制备方法的研究,为癌症的治疗提供了一种研究思路,为抗癌药物的研制提供了物质基础。
2、本研究方法运用hplc-ms/ms或uplc-ms/ms指导研究工作,实现糖苷类化合物的快速发现,节省了时间和溶剂、试剂,提高了效率。运用tlc指导研究工作,合并相同组分,提供了分离效率。
3、半制备hplc分离纯化样品,制备单体化合物,获得高纯度(99%以上)的化合物,确定了糖苷类化合物组分的化合物类型和结构,为新药研发提供了物质基础和标准物质。
附图说明
图1为化合物1的化学式;
图2为化合物2的化学式;
图3为化合物3的化学式;
图4为化合物4的化学式;
图5为化合物5的化学式;
图6为化合物6的化学式;
图7为化合物7的化学式;
图8为化合物8的化学式;
图9为化合物9的化学式;
图10为化合物10的化学式;
图11为化合物11的化学式;
图12为化合物12的化学式;
图13为化合物13的化学式;
图14为化合物14的化学式。
具体实施方式
实施例1:糖苷类化合物组分制备方法及组分中活性成分1、2和3的分离鉴定方法,化学式如图1、2和3所示。
1)将花椒用70%的乙醇/水混合溶液用室温冷浸提取3次,每次5天,合并提取液,减压浓缩至无乙醇味,得总浸膏a;
2)将总浸膏a溶于水后,进行d101大孔吸附树脂柱层析,用乙醇/水混合溶液为洗脱溶剂梯度洗脱,洗脱溶剂体积比为水、30%、60%、80%、100%,不同体积比的洗脱溶剂洗脱体积均为3倍柱体积,分别将不同体积比的洗脱液浓缩,得到五个不同的浸膏组分b(水)、c(30%)、d(60%)、e(80%)、f(100%);
3)浸膏组分b、c、d、e、f分别进行uplc-ms/ms分析,寻找糖苷类化合物所在部位。实验发现,浸膏组分c为糖苷类化合物部位。
4)对浸膏组分b、c、d、e和f进行sirt1抑制活性实验测试,实验证实c具有较好的sirt1抑制活性。
5)对浸膏组分c进行硅胶柱层析,用氯仿-甲醇为洗脱剂梯度洗脱,氯仿与甲醇的体积比为20:1、10:1、5:1、2:1、1:1、0:1,等份收集洗脱液,每份洗脱液采用tlc定性检测,合并含相同成分的洗脱液,得到六个不同的浸膏组分c-1~c-6;
6)对浸膏c-2进行制备hplc分离纯化,c-2(75mg)经半制备hplc分离(12%甲醇-水,benetnachc18柱)分离,得到三个组份:c-2-1—c-2-3,c-2-1经半制备hplc(8%甲醇-水,benetnachc18柱)纯化,得到化合物1;c-2-2经半制备hplc(12%甲醇-水,benetnachc18柱)纯化,得到化合物2;c-2-3经半制备hplc(12%甲醇-水,benetnachc18柱)纯化,得到化合物3。经核磁共振波谱解析确定化合物1、2和3的结构,数据如下:
化合物1:分子式:c12h16o7;分子量272;1hnmr(meod,400mhz)δppm:4.73(d,j=7.2hz,h-1′),6.69(2h,dd,j=6.8,2.4hz,h-3,h-5),6.96(2h,dd,j=6.8,2.4hz,h-2,h-6),4.73(d,j=7.2hz,h-1'),3.41(d,j=7.2hz,h-2'),3.36(m,h-3'),3.41(m,h-4'),3.36(m,h-5'),3.88(d,j=12.0hz,h-6'a),3.70(dd,j=12.0,4.8hz,h-6'b);13cnmr(meod,100mhz)δppm:152.4(c-1),116.6(c-2,c-6),119.4(c-3,c-5),153.8(c-4),103.0(c-1′),75.0(c-2′),78.0(c-3′,c-5′),71.4(c-4′),62.5(c-6′)。
化合物2:分子式:c14h20o8;分子量316;1hnmr(meod,400mhz)δppm:7.10(d,j=8.0hz,h-6),6.72(d,j=2.0hz,h-3),6.64(dd,j=8.0,2.0hz,h-5),4.69(d,j=7.2hz,h-1'),3.88(dd,j=12.8,1.6hz,h-6'a),3.70(dd,j=12.8,4.8hz,h-6'b),3.45(2h,dd,j=7.2,6.0hz,h-2',3'),3.39(2h,m,h-4',5'),2.70(2h,t,j=7.2hz,h-7),3.69(2h,t,j=7.2hz,h-8);13cnmr(meod,100mhz)δppm:62.5(c-6′),71.4(c-4′),75.0(c-2′),78.0(c-3′,c-5′),103.0(c-1′),145.3(c-1),148.4(c-2),117.7(c-3),136.2(c-4),121.4(c-5),119.1(c-6),39.7(c-7),64.3(c-8)。
化合物3:分子式:c13h18o7;分子量286;1hnmr(meod,400mhz)δppm:6.41(s,h-2),6.35(s,h-4),6.28(s,h-6),6.28(s,h-6),2.21(3h,s,h3-7),4.84(d,j=7.2hz,h-1'),3.33(m,h-2'),3.65(m,h-3'),3.25(m,h-4'),3.33(m,h-5'),3.90(dd,j=12.0,1.2hz,h-6'a),3.70(dd,j=12.0,5.2hz,h-6'b);13cnmr(meod,100mhz)δppm:160.1(c-1),102.2(c-2),159.2(c-3),109.7(c-4),141.2(c-5),111.2(c-6),21.6(c-7),102.2(c-1'),74.9(c-2'),78.1(c-3'),71.4(c-4'),78.0(c-5'),62.5(c-6')。
实施例2:糖苷类化合物组分制备方法及组分中活性成分4、5、6和7的分离鉴定方法,化学式如图4、5、6和7所示。
1)将花椒用70%的甲醇/水混合溶液室温加热回流提取3次,每次加热温度为80℃,提取2.0小时,合并提取液,减压浓缩至无甲醇味,得总浸膏a;
2)将总浸膏a溶于水后,进行d101大孔吸附树脂柱层析,用甲醇/水混合溶液为洗脱溶剂梯度洗脱,洗脱溶剂体积比为水、30%、60%、80%、100%,不同体积比的洗脱溶剂洗脱体积均为3倍柱体积,分别将不同体积比的洗脱液浓缩,得到五个不同的浸膏组分b(水)、c(30%)、d(60%)、e(80%)、f(100%);
3)浸膏组分b、c、d、e、f分别进行hplc-ms/ms分析,寻找糖苷类化合物所在部位。实验发现,浸膏组分c为糖苷类化合物部位。
4)对浸膏组分b、c、d、e和f进行sirt1抑制活性实验测试,实验证实c具有较好的sirt1抑制活性。
5)对浸膏组分c进行硅胶柱层析,用氯仿-甲醇为洗脱剂梯度洗脱,氯仿与甲醇的体积比为10:1、5:1、3:1、2:1、1:1、0:1,等份收集洗脱液,每份洗脱液采用tlc定性检测,合并含相同成分的洗脱液,得到六个不同的浸膏组分c-1~c-6;
6)对浸膏c-3进行制备hplc分离纯化,c-3(100mg)经半制备hplc分离(45%甲醇-水,benetnachc18柱)分离,得到三个组份:c-3-1—c-3-3,c-3-1经半制备hplc(40%甲醇-水,benetnachc18柱)纯化,得到化合物4;c-3-2经半制备hplc(40%甲醇-水,benetnachc18柱)纯化,得到化合物5和6;c-3-3经半制备hplc(40%甲醇-水,benetnachc18柱)纯化,得到化合物7。经核磁共振波谱解析确定化合物4、5、6和7的结构,数据如下:
化合物4:分子式:c18h26o7;分子量354;1hnmr(meod,400mhz)δppm:6.52(2h,s,h-3,5),5.94(m,h-8),4.90(d,j=17.2hz,h-9a),4.80(d,j=7.6hz,h-1'),3.81(6h,s,2,4-ome),3.33(2h,d,j=7.2hz,h=7),3.39(m,h-2'),3.47(m,h-3'),3.20(m,h-4'),3.39(m,h-5'),3.78(dd,j=12.4,1.6hz,h-6'a),3.66(dd,j=12.0,4.8hz,h-6'b);13cnmr(meod,100mhz)δppm:154.2(c-2,6),138.7(c-1),138.4(c-4),134.7(c-8),116.2(c-9),107.5(c-3,5),105.6(c-1'),78.3(c-3'),77.8(c-5'),75.7(c-2'),71.3(c-4'),62.6(c-6'),57.0(1,3-ome),41.4(c-7)。
化合物5:分子式:c17h24o6;分子量324;1hnmr(meod,400mhz)δppm:3.29–3.49(6h,m,h2-7,2',3',4',5'),3.66(dd,j=12.2,4.0hz,h-6a'),3.84(3h,s,h3-10),3.85(d,j=12.0hz,h-6b'),4.80(mhz,h-1'),5.02(brd,j=9.2hz,h-9a),5.06(dd,j=15.6,1.2hz,h-9b),5.94(m,h-8),6.71(dd,j=8.0,1.6hz,h-5),6.81(d,j=1.6hz,h-3),7.06(d,j=8.0hz,h-6);13cnmr(meod,100mhz)δppm:150.8(c-2),146.3(c-1),139.0(c-4),136.4(c-8),122.10(c-5),118.3(c-6),115.9(c-9),114.1(c-3),103.1(c-1'),78.2(c-3'),77.8(c-5'),74.9(c-2'),71.3(c-4'),62.5(c-6'),56.7(2-ome),40.7(c-7)。
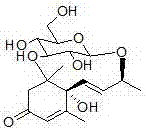
化合物6:分子式:c19h32o7;分子量372;1hnmr(meod,400mhz)δppm:1.97(d,j=17.2hz,h-2a),2.47(d,j=17.2hz,h-2b),5.79(s,h-4),1.96(m,h-6),1.64(m,h-7a),1.79(m,h-7b),1.62(m,h-8a),1.65(m,h-8b),3.80(m,h-9),1.24(3h,d,j=6.0hz,h-10),1.00(3h,s,h3-11),1.08(3h,s,h3-12),2.03(3h,s,h3-13),4.31(d,j=7.6hz,h-1'),3.10–3.49(4h,m,2',3',4',5'),3.66(dd,j=12.0,4.0hz,h-6a'),3.85(d,j=12.0hz,h-6b');13cnmr(meod,100mhz)δppm:37.4(c-1),48.1(c-2),202.4(c-3),125.4(c-4),169.9(c-5),52.5(c-6),26.6(c-7),37.4(c-8),77.8(c-9),21.9(c-10),29.0(c-11),27.5(c-12),25.0(c-13),104.0(c-1'),75.3(c-2'),78.2(c-3'),71.7(c-4'),77.6(c-5'),62.8(c-6')。
化合物7:分子式:c19h30o7;分子量370;1hnmr(meod,400mhz)δppm:2.05(d,j=16.8hz,h-2a),2.48(d,j=16.8hz,h-2b),5.88(s,h-4),2.69(d,j=9.2hz,h-6),5.75(dd,j=15.2,9.2hz,h-7b),5.58(dd,j=15.2,7.2hz,h-8),4.47(brt,j=6.4hz,h-9),1.28(3h,d,j=6.4hz,h-10),0.98(3h,s,h3-11),1.02(3h,s,h3-12),1.98(3h,s,h3-13),4.28(d,j=7.6hz,h-1'),3.10–3.49(4h,m,2',3',4',5'),3.62(dd,j=11.6,6.4hz,h-6a'),3.84(dd,j=11.6,2.0hz,h-6b');13cnmr(meod,100mhz)δppm:37.2(c-1),48.5(c-2),202.0(c-3),126.2(c-4),165.7(c-5),56.9(c-6),131.2(c-7),137.0(c-8),74.8(c-9),22.2(c-10),27.4(c-11),28.0(c-12),23.9(c-13),101.2(c-1'),75.0(c-2'),78.4(c-3'),71.7(c-4'),78.2(c-5'),62.9(c-6')。
实施例3:糖苷类化合物组分制备方法及组分中活性成分8、9和10的分离鉴定方法,化学式如图8、9和10所示。
1)将花椒用甲醇超声提取,提取温度为50℃,频率为40hz,功率为500w,提1.0小时,花椒与提取溶剂的质量比为1:8,提取3次,合并提取液,再进行浓缩,干燥,得到提取物a;
2)将总浸膏a溶于水后,利用石油醚、乙酸乙酯、正丁醇分别萃取。首先,将总浸膏a溶于水后,用等体积的石油醚萃取三次,合并石油醚萃取液,浓缩,得到石油醚相(g);水相用等体积的乙酸乙酯萃取三次,合并乙酸乙酯萃取液,浓缩,得到乙酸乙酯相(h);萃取后的水相继续用等体积的正丁醇萃取三次,合并正丁醇萃取液,浓缩,得到正丁醇相(i),水相浓缩得到水相(j)。
3)浸膏组分g、h、i、j分别进行uplc-ms/ms分析,寻找糖苷类化合物所在部位。实验发现,浸膏组分i为糖苷类化合物部位。
4)对浸膏组分g、h、i和j进行sirt1抑制活性实验测试,实验证实i具有较好的sirt1抑制活性。
5)对浸膏组分i进行硅胶柱层析,用氯仿-甲醇为洗脱剂梯度洗脱,氯仿与甲醇的体积比为15:1、8:1、4:1、2:1、1:1、0:1,等份收集洗脱液,每份洗脱液采用tlc定性检测,合并含相同成分的洗脱液,得到六个不同的浸膏组分i-1~i-6;
6)对浸膏i-4进行制备hplc分离纯化,i-4(720mg)经半制备hplc分离(50%甲醇-水,benetnachc18柱)分离,得到三个组份:i-4-1—i-4-3,i-4-1经半制备hplc(25%甲醇-水,benetnachc18柱)纯化,得到化合物8;i-4-2经半制备hplc(20%甲醇-水,benetnachc18柱)纯化,得到化合物9和10。经核磁共振波谱解析确定化合物8、9和10的结构,数据如下:
化合物8:分子式:c20h24o9;分子量408;1hnmr(dmso,400mhz)δppm:6.23(d,j=9.2hz,h-3),7.95(d,j=9.2hz,h-4),7.49(s,h-5),6.83(s,h-8),4.84(t,j=4.8hz,h-2'),3.17(2h,dd,j=15.6,4.8hz,h2-3'),1.24(3h,s,h3-5'),1.27(3h,s,h3-6'),4.41(d,j=7.6hz,h-1");13cnmr(dmso,100mhz)δppm:161.0(c-2),112.7(c-3),145.2(c-4),124.4(c-5),126.1(c-6),163.6(c-7),97.3(c-8),155.5(c-9),111.8(c-10),90.6(c-2'),29.3(c-3'),77.4(c-4'),23.0(c-5'),23.6(c-6'),97.8(c-1"),74.0(c-2"),77.0(c-3"),70.6(c-4"),77.4(c-5"),61.4(c-6")。
化合物9:分子式:c13h18o6;分子量270;1hnmr(meod,400mhz)δppm:4.89(d,j=12.0hz,h-1a),4.62(d,j=12.0hz,h-1b),7.37(2h,d,j=7.2hz,h-3,7),7.28(2h,t,j=7.2hz,h-4,6),7.23(d,j=7.2hz,h-5),4.31(d,j=7.6hz,h-1'),3.18–3.30(4h,m,2',3',4',5'),3.86(dd,j=12.0,2.0hz,h-6'a),3.65(dd,j=12.0,5.6hz,h-6'a);13cnmr(meod,100mhz)δppm:71.8(c-1),139.1(c-2),129.2(c-3),129.3(c-4),128.7(c-5),129.3(c-6),129.2(c-7),103.3(c-1'),75.1(c-2'),78.1(c-3'),71.7(c-4'),78.0(c-5'),62.8(c-6')。
化合物10:分子式:c11h20o6;分子量248;1hnmr(meod,400mhz)δppm:5.36(td,j=6.4,1.2hz,h-2a),4.32(dd,j=11.6,6.4hz,h-1a),4.27(d,j=7.6hz,h-1'),4.21(dd,j=11.6,7.6hz,h-1b),3.86(dd,j=12.0,2.0hz,h-6'a),3.66(dd,j=12.0,5.6hz,h-6'b),3.23(m,h-5'),3.30(2h,m,h-3',h-4'),3.16(t,j=8.4hz,h-2'),1.75(3h,s,h3-4),1.69(3h,s,h3-5)。
实施例4:糖苷类化合物组分制备方法及组分中活性成分11和12的分离鉴定方法,化学式如图11和12所示。
1)花椒用50%的乙醇/水为提取溶剂进行渗漏提取,将花椒在提取溶剂中浸泡20h,花椒与提取溶剂的质量比为1:15,合并提取液,再进行浓缩,干燥,得到提取物a;
2)将总浸膏a溶于水后,利用石油醚、乙酸乙酯、正丁醇分别萃取。首先,将总浸膏a溶于水后,用等体积的石油醚萃取三次,合并石油醚萃取液,浓缩,得到石油醚相(g);水相用等体积的乙酸乙酯萃取三次,合并乙酸乙酯萃取液,浓缩,得到乙酸乙酯相(h);萃取后的水相继续用等体积的正丁醇萃取三次,合并正丁醇萃取液,浓缩,得到正丁醇相(i),水相浓缩得到水相(j)。
3)浸膏组分g、h、i、j分别进行hplc-ms/ms分析,寻找糖苷类化合物所在部位。实验发现,浸膏组分i为糖苷类化合物部位。
4)对浸膏组分g、h、i和j进行sirt1抑制活性实验测试,实验证实i具有较好的sirt1抑制活性。
5)对浸膏组分i进行硅胶柱层析,用氯仿-甲醇为洗脱剂梯度洗脱,氯仿与甲醇的体积比为15:1、8:1、4:1、2:1、1:1、0:1,等份收集洗脱液,每份洗脱液采用tlc定性检测,合并含相同成分的洗脱液,得到六个不同的浸膏组分i-1~i-6;
6)对浸膏i-5进行制备hplc分离纯化,i-5(450mg)经半制备hplc分离(20%甲醇-水,benetnachc18柱)分离,得到两个组份:i-5-1—i-5-2,i-5-1经半制备hplc(20%甲醇-水,benetnachc18柱)纯化,得到化合物11;i-5-2经半制备hplc(20%甲醇-水,benetnachc18柱)纯化,得到化合物12。经核磁共振波谱解析确定化合物11和12的结构,数据如下:
化合物11:分子式:c17h24o9;分子量372;1hnmr(meod,400mhz)δppm:6.74(2h,s,h-3,5),6.54(d,j=15.6hz,h-7),6.32(dt,j=15.6,5.2hz,h-8),4.86(m,h-1′),4.22(2h,brd,j=5.2hz,h-9),3.82(6h,2,6-och3×2);13cnmr(meod,100mhz)δppm:154.3(c-2,6),135.9(c-1),135.2(c-4),131.3(c-8),130.0(c-7),105.4(c-3,5),105.3(c-1′),78.3(c-3′),77.8(c-5′),75.7(c-2′),71.3(c-4′),63.6(c-9),62.6(c-6′),57.1(2,6-och3×2)。
化合物12:分子式:c18h27o8;分子量371;1hnmr(meod,400mhz)δppm:2.16(d,j=17.2hz,h-2a),2.61(d,j=17.2hz,h-2b),5.86(s,h-4),5.85(d,j=15.6,hz,h-7),5.72(dd,j=15.2,7.2hz,h-8),4.53(dd,j=7.2,6.4hz,h-9),1.27(3h,d,j=6.4hz,h-10),1.01(3h,s,h3-11),1.03(3h,s,h3-12),1.94(3h,s,h3-13),4.26(d,j=7.6hz,h-1'),3.16(dd,7.6,8.8,h-2'),3.18(dd,8.8,7.6,h-3'),3.25(t,7.6hz,h-4'),3.24(m,h-5'),3.62(dd,j=12.0,6.4hz,h-6a'),3.84(dd,j=11.6,1.6hz,h-6b');13cnmr(meod,100mhz)δppm:42.4(c-1),50.8(c-2),101.3(c-3),127.1(c-4),167.1(c-5),80.0(c-6),133.7(c-7),133.8(c-8),74.6(c-9),22.2(c-10),23.5(c-11),24.7(c-12),19.6(c-13),101.3(c-1'),75.0(c-2'),78.4(c-3'),71.7(c-4'),78.2(c-5'),62.8(c-6')。
实施例5:糖苷类化合物组分制备方法及组分中活性成分13和14的分离鉴定方法,化学式如图13和14所示。
1)将花椒用70%的甲醇/水室温加热回流提取3次,每次加热温度为80℃,提取2.0小时,合并提取液,减压浓缩至无甲醇味,得总浸膏a;
2)将总浸膏a溶于水后,进行d101大孔吸附树脂柱层析,用甲醇/水为洗脱溶剂梯度洗脱,洗脱溶剂体积比为水、30%、60%、80%、100%,不同体积比的洗脱溶剂洗脱体积均为3倍柱体积,分别将不同体积比的洗脱液浓缩,得到五个不同的浸膏组分b(水)、c(30%)、d(60%)、e(80%)、f(100%);
3)浸膏组分b、c、d、e、f分别进行uplc-ms/ms分析,寻找糖苷类化合物所在部位。实验发现,浸膏组分c为糖苷类化合物部位。
4)对浸膏组分b、c、d、e和f进行sirt1抑制活性实验测试,实验证实c具有较好的sirt1抑制活性。
5)对浸膏组分c进行硅胶柱层析,用氯仿-甲醇为洗脱剂梯度洗脱,氯仿与甲醇的体积比为10:1、5:1、3:1、2:1、1:1、0:1,等份收集洗脱液,每份洗脱液采用tlc定性检测,合并含相同成分的洗脱液,得到六个不同的浸膏组分c-1~c-6;
6)对浸膏c-6进行制备hplc分离纯化,c-6经半制备hplc分离(45%甲醇-水,benetnachc18柱)分离,得到三个组份:c-6-1—c-6-3,c-6-1经半制备hplc(45%甲醇-水,benetnachc18柱)纯化,得到化合物13;c-6-2经半制备hplc(40%甲醇-水,benetnachc18柱)纯化,得到化合物14。经核磁共振波谱解析确定化合物13和14的结构,数据如下:
化合物13:分子式:c15h20o6;分子量296;1hnmr(meod,400mhz)δppm:3.31(2h,m,h2-7),3.35-3.46(4h,m,h-2',h-3',h-4',h-5'),3.69(dd,j=11.6,5.2hz,h-6'a),3.88(dd,j=11.6,1.2hz,h-6'b),4.84(d,j=7.2hz,h-1'),5.00(dd,j=8.8,4.4hz,h-9a),5.02(dd,j=12.0,1.6hz,h-9b),5.92(m,h-8),7.02(2h,d,j=8.8hz,h-2,6),7.09(2h,d,j=8.8hz,h-3,5);13cnmr(meod,100mhz)δppm:157.6(c-1),139.2(c-2,6),130.5(c-3,5),135.3(c-4),40.4(t,c-7),117.8(c-8),115.7(c-9),102.5(c-1'),75.0(c-2'),78.1(c-3'),71.4(c-4'),78.0(c-5'),62.5(c-6')。
化合物14:分子式:c28h36o13;分子量580;1hnmr(meod,400mhz)δppm:6.71(2h,s,h-2,6),4.76(1h,d,j=3.2hz,h-7),3.14(m,h-8),3.91(d,j=6.0hz,h-9a),4.28(d,j=8.4hz,h-9b),6.65(2h,s,h-2',6'),4.71(1h,d,j=3.6hz,h-7'),3.14(m,h-8'),(d,j=6.0hz,h-9'a),4.28(d,j=8.4hz,h-9'b),3.85(6h,s,3,5-och3),3.84(6h,s,3',5'-och3),4.85(m,h-1"),3.46(m,h-2"),3.40(2h,m,h-3",h-4"),3.19(1h,m,h-5"),3.77(d,j=12.0hz,h-6"a),3.65(dd,12.0,5.2hz,h-6"b);13cnmr(meod,100mhz)δppm:139.6(c-1),104.9(c-2),154.4(c-3),135.6(c-4),154.4(c-5),104.9(c-6),87.2(c-7),55.5(c-8),72.9(c-9),56.8(2x-och3),133.1(c-1'),104.6(c-2'),149.4(c-3'),135.6(c-4'),149.4(c-5'),104.6(c-6'),87.6(c-7'),55.7(c-8'),72.9(c-9'),57.1(2x-och3),105.4(c-1"),75.7(c-2"),77.8(c-3"),71.4(c-4"),78.4(c-5"),62.6(c-6")。
- 还没有人留言评论。精彩留言会获得点赞!