启动子的制作方法
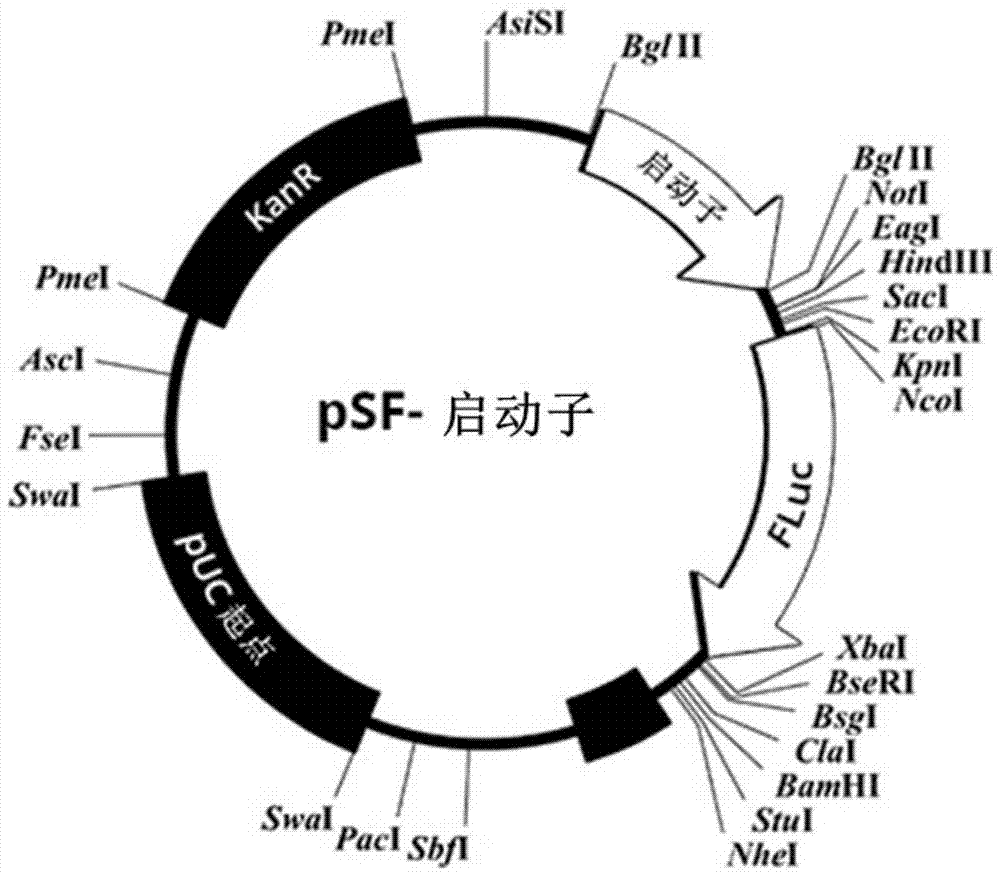
本发明涉及能够促进哺乳动物细胞中可操作连接的异源多核苷酸的转录的核酸分子。本发明还涉及包括本发明的核酸分子的表达载体和宿主细胞。这样的表达载体可用于产生重组蛋白,例如抗体和慢病毒多肽。
背景技术:
为了发生基因的转录,rna聚合酶必须与基因启动子结合并起始转录。通常,rna聚合酶i转录编码核糖体rna的基因;rna聚合酶ii转录编码信使rna、一些小核rna和微小rna的基因;而rna聚合酶iii转录编码转移rna和其它小rna的基因。调节转录以控制转录何时发生以及产生多少rna。rna聚合酶对基因的转录可以通过至少五种机制进行调节:(i)特异性因子改变rna聚合酶对给定启动子或启动子组的特异性,使其或多或少地可与它们结合(例如在原核转录中使用的σ因子)。(ii)阻遏子与操纵子(dna链上的与启动子区域接近或重叠的编码序列)结合以阻碍rna聚合酶沿着链的进展,从而阻碍基因的表达。(iii)转录因子在蛋白编码序列的起始处定位rna聚合酶,然后释放聚合酶以转录mrna。(iv)激活子增强rna聚合酶和特定启动子之间的相互作用,以促进基因的表达。增强子是dna螺旋上由激活子结合的位点,从而使dna环化以使特定的启动子进入起始复合物。(v)沉默子是dna序列的区域,当其被特定的转录因子结合时,可以使基因的表达沉默。典型的哺乳动物启动子由与基本转录机构结合的50-100碱基对核心区域和可以与一个或多个转录激活蛋白(反式激活子)结合的增强子区域组成。能够在增强子处结合的反式激活子的数量和类型取决于存在哪些特异性结合位点。起始速率取决于实际上在启动子的增强子处结合的反式激活子的数量和类型。除了增强子之外,还有当被不同的转录因子结合时降低基因表达的沉默子。核心启动子由各种不同的元件组成,其中有两种类别:典型的和非典型的。典型的核心启动子元件包括:tata盒、起始子(inr)、tfiib识别元件(bre)、下游启动子元件(dpe)和下游核心元件(dce)。这些元件可以在许多但不是所有蛋白质编码基因的核心启动子内发现。tata盒(序列tataa)通常在转录起始位点(tss)上游20-30bp处发现,并且用作tfiid一般转录因子的结合位点。当inr元件(共有序列yyant/ayy)存在时,它包括tss,其中共有序列的第一a是转录物的第一个碱基。bre元件可以在tata盒的上游(breu共有g/cg/cg/acgcc)或下游(bred共有g/att/at/gt/gt/gt/g)两者中发现。虽然在技术上不是典型的核心启动子元件,但ccaat盒(位于tss上游在50和100bp之间)通常包括在该类别中。ccaat盒也有助于一般转录因子(tf)结合。非典型的核心启动子元件包括cpg岛、atg缺乏区和转录起始平台(tip)。cpg岛通常跨越500-2000bp的dna片段,其含有相对高比例的cpg二核苷酸。cpg二核苷酸通常会在c残基上甲基化,以减少转录,但在cpg岛内它们保持未甲基化,以促进转录。atg缺乏区是比周围区域具有更低频率的atg三核苷酸的dna区域。它们在tss的上游和下游延伸约1000bp,并且通常与不含tata盒的启动子相关联。强启动子是以高频率起始转录的启动子,并且可以是非常有用的工具。例如在生物化学中,强启动子可用于研究转录过程或驱动重组蛋白的产生。强启动子也可用于遗传学中:例如,它们可用于驱动基因敲除的shrna表达或用于cdna过表达以演绎蛋白质的功能。特别有效的启动子也可具有医学应用:例如在重组病毒疫苗中,较高的抗原表达引起更好的免疫应答。哺乳动物系统中使用的最强启动子通常来自组成型表达的细胞基因或来自病毒基因。然而,在相关基因的表达水平方面最强的启动子通常是最依赖细胞类型的启动子,即它们在它们将起作用的细胞类型方面受到限制。技术实现要素:因此,本发明的一个目的是提供核酸分子,其能够以高水平和/或在一系列哺乳动物细胞中促进可操作连接的异源多核苷酸的转录。本发明的另一个目的是提供包括本发明的核酸分子的表达载体。这样的表达载体可用于产生高水平的重组多肽,例如抗体和慢病毒多肽。在一个实施方式中,本发明提供了一种核酸分子,其包括:(a)与seqidno:1、seqidno:2或seqidno:3所示的核苷酸序列具有至少80%核苷酸序列同一性的第一多核苷酸,或该第一多核苷酸的功能片段;和(b)与seqidno:4所示的核苷酸序列具有至少80%核苷酸序列同一性的第二多核苷酸,或该第二多核苷酸的功能片段;其中(a)和(b)以此顺序5'-3'连接,并且其中所述核酸分子能够促进哺乳动物细胞中可操作连接的异源多核苷酸的转录。在另一个实施方式中,本发明提供了包括本发明的核酸分子的表达载体。在又一个实施方式中,本发明提供了包括本发明的核酸分子的表达载体,其中核酸分子与异源多核苷酸可操作地连接。本发明还提供了包括本发明的表达载体的哺乳动物宿主细胞。本发明还提供了包括本发明的表达载体的试剂盒。在一些实施方式中,核酸分子是分离的核酸分子。本发明的核酸分子能够促进哺乳动物细胞中可操作连接的异源多核苷酸的转录,即它用作启动子。在一些实施方式中,本发明的核酸分子用作组成型启动子。本发明的核酸分子包括:(a)与seqidno:1、seqidno:2或seqidno:3所示的核苷酸序列具有至少80%核苷酸序列同一性的第一多核苷酸。seqidno:1-3在所附的“序列”部分中给出。第一多核苷酸优选与seqidno:1、seqidno:2或seqidno:3所示的核苷酸序列中之一具有至少85%、90%、95%、96%、97%、98%、99%或100%核苷酸序列同一性。最优选地,第一多核苷酸具有seqidno:1、seqidno:2或seqidno:3的核苷酸序列。或者,本发明的核酸分子可以包括第一多核苷酸的功能片段。如本文所用,术语“第一多核苷酸的功能片段”是指第一多核苷酸的一部分,其保留至少20%(例如至少30%、40%、50%、60%、70%、75%、80%、85%、90%、95%、98%、99%或100%)的完整第一多核苷酸在促进可操作连接的异源多核苷酸的表达中的活性。测量和比较核酸序列的启动子活性的方法是本领域熟知的,如下所述。优选地,第一多核苷酸的功能片段是seqidno:1、seqidno:2或seqidno:3所示的多核苷酸序列长度的至少50%、60%、70%、80%、90%或95%。本发明的核酸分子还包括:(b)与seqidno:4所示的核苷酸序列具有至少80%核苷酸序列同一性的第二多核苷酸,或该第二多核苷酸的功能片段。seqidno:4的序列在所附的“序列”部分中给出。优选地,第二多核苷酸与seqidno:4所示的多核苷酸序列具有至少85%、90%、95%、96%、97%、98%、99%或100%核苷酸序列同一性。最优选地,第二多核苷酸具有seqidno:4的多核苷酸序列。或者,本发明的核酸分子可以包括第二多核苷酸的功能片段。如本文所用,术语“第二多核苷酸的功能片段”是指第二多核苷酸的一部分,其保留至少20%(例如至少30%、40%、50%、60%、70%、75%、80%、85%、90%、95%、98%、99%或100%)的完整第二多核苷酸在促进可操作连接的异源多核苷酸的表达中的活性。测量和比较核酸序列的启动子活性的方法是本领域熟知的,如下所述。优选地,第二多核苷酸的功能片段是seqidno:4所示的多核苷酸序列长度的至少50%、60%、70%、80%、90%或95%。seqidno:4包括转录起始位点(tss):+1位点(即待转录的第一碱基)是序列tcagatc中的第一个t;这发生在seqidno:4的3'末端。tss下游的所有内容都将被转录到rna中。因此,优选第二多核苷酸或其功能片段包括序列tcagatc。在一些优选的实施方式中,核酸分子包括:(a)具有seqidno:1、seqidno:2或seqidno:3所示的核苷酸序列的第一多核苷酸;和(b)具有seqidno:4所示的核苷酸序列的第二多核苷酸;其中(a)和(b)5'-3'连接,并且其中所述核酸分子能够促进哺乳动物细胞中可操作连接的异源多核苷酸的转录。在一些优选的实施方式中,核酸分子包括:(a)具有seqidno:1所示的核苷酸序列的第一多核苷酸;和(b)具有seqidno:4所示的核苷酸序列的第二多核苷酸;其中(a)和(b)以此顺序连续地5'-3'连接,并且其中所述核酸分子能够促进哺乳动物细胞中可操作连接的异源多核苷酸的转录。在一些优选的实施方式中,核酸分子包括:(a)具有seqidno:2所示的核苷酸序列的第一多核苷酸;和(b)具有seqidno:4所示的核苷酸序列的第二多核苷酸;其中(a)和(b)以此顺序连续地5'-3'连接,并且其中所述核酸分子能够促进哺乳动物细胞中可操作连接的异源多核苷酸的转录。在一些优选的实施方式中,核酸分子包括:(a)具有seqidno:3所示的核苷酸序列的第一多核苷酸;和(b)具有seqidno:4所示的核苷酸序列的第二多核苷酸;其中(a)和(b)以此顺序连续地5'-3'连接,并且其中所述核酸分子能够促进哺乳动物细胞中可操作连接的异源多核苷酸的转录。本发明还提供了一种核酸分子,其包括:(a)与seqidno:1、seqidno:2或seqidno:3所示的核苷酸序列具有至少80%核苷酸序列同一性的第一多核苷酸,或该第一多核苷酸的功能片段;(b)与seqidno:4所示的核苷酸序列具有至少80%核苷酸序列同一性的第二多核苷酸,或该第二多核苷酸的功能片段;和(c)与seqidno:5、seqidno:6或seqidno:7所示的核苷酸序列具有至少80%核苷酸序列同一性的第三多核苷酸,或该第三多核苷酸的功能片段;其中(a),(b)和(c)以此顺序5'-3'连接,并且其中所述核酸分子能够促进哺乳动物细胞中可操作连接的异源多核苷酸的转录。seqidno:5-7的序列在所附的“序列”部分中给出。第三多核苷酸优选与seqidno:5、seqidno:6或seqidno:7所示的核苷酸序列中之一具有至少85%、90%、95%、96%、97%、98%、99%或100%核苷酸序列同一性。最优选地,第三多核苷酸具有seqidno:5、seqidno:6或seqidno:7的核苷酸序列。或者,本发明的核酸分子可以包括第三多核苷酸的功能片段。如本文所用,术语“第三多核苷酸的功能片段”是指第三多核苷酸的一部分,其保留至少20%(例如至少30%、40%、50%、60%、70%、75%、80%、85%、90%、95%、98%、99%或100%)的完整第三多核苷酸在促进可操作连接的异源多核苷酸的表达中的活性。测量和比较核酸序列的启动子活性的方法是本领域熟知的,如下所述。优选地,第三多核苷酸的功能片段是seqidno:5、seqidno:6或seqidno:7所示的多核苷酸序列长度的至少50%、60%、70%、80%、90%或95%。在一些优选的实施方式中,核酸分子包括:(a)具有seqidno:1、seqidno:2或seqidno:3所示的核苷酸序列的第一多核苷酸;(b)具有seqidno:4所示的核苷酸序列的第二多核苷酸;和(c)具有seqidno:5、seqidno:6或seqidno:7所示的核苷酸序列的第三多核苷酸;其中(a),(b)和(c)以此顺序5'-3'连接,并且其中所述核酸分子能够促进哺乳动物细胞中可操作连接的异源多核苷酸的转录。在一些优选的实施方式中,核酸分子包括:(a)具有seqidno:1所示的核苷酸序列的第一多核苷酸;(b)具有seqidno:4所示的核苷酸序列的第二多核苷酸;和(c)具有seqidno:5所示的核苷酸序列的第三多核苷酸;其中(a),(b)和(c)以此顺序连续地5'-3'连接,并且其中所述核酸分子能够促进哺乳动物细胞中可操作连接的异源多核苷酸的转录。在一些优选的实施方式中,核酸分子包括:(a)具有seqidno:2所示的核苷酸序列的第一多核苷酸;(b)具有seqidno:4所示的核苷酸序列的第二多核苷酸;和(c)具有seqidno:6所示的核苷酸序列的第三多核苷酸;其中(a)、(b)和(c)以此顺序连续地5'-3'连接,并且其中所述核酸分子能够促进哺乳动物细胞中可操作连接的异源多核苷酸的转录。在一些优选的实施方式中,核酸分子包括:(a)具有seqidno:3所示的核苷酸序列的第一多核苷酸;(b)具有seqidno:4所示的核苷酸序列的第二多核苷酸;和(c)具有seqidno:7所示的核苷酸序列的第三多核苷酸;其中(a)、(b)和(c)以此顺序连续地5'-3'连接,并且其中所述核酸分子能够促进哺乳动物细胞中可操作连接的异源多核苷酸的转录。如本文所用,术语“异源多核苷酸”是指编码所需mrna或多肽的多核苷酸。异源多核苷酸的实例包括编码多肽(例如病毒或哺乳动物多肽)的那些。在一些优选的实施方式中,异源多核苷酸编码进入分泌途径的蛋白质,例如膜连接蛋白、分泌抗体或其它分泌蛋白。表达这种异源多核苷酸的细胞将特别适合于在生物反应器或悬浮培养容器中连续生产重组分泌蛋白,其中可以从培养基中收获产物而不裂解细胞。其它优选的异源多核苷酸是编码保持细胞相关性的蛋白(例如膜蛋白或胞质蛋白)的那些,其可以在全细胞的情况下使用或通过细胞裂解收获。在一些实施方式中,异源多核苷酸编码抗体。在本发明的一些其它优选实施方式中,异源多核苷酸编码病毒多肽。优选地,病毒多肽是表面糖蛋白,例如vsvg。vsvg多肽是源自水泡性口炎病毒的单程膜糖蛋白。它介导广泛的传染性趋性。在其它实施方式中,病毒多肽是gag-pol、rev或tat。术语“gag-pol”是指逆转录病毒蛋白,其被蛋白水解切割以产生功能性逆转录酶、整合酶和蛋白酶以及至少两种对于病毒组装具有结构重要性的蛋白。优选地,gag-pol序列来自慢病毒,最优选来自hiv。rev蛋白有助于将病毒基因组转运到细胞质中。优选地,rev多肽序列来自慢病毒,最优选来自hiv。tat蛋白增强病毒转录的效率。优选地,tat多肽序列来自慢病毒,最优选来自hiv。第一多核苷酸、第二多核苷酸、第三多核苷酸(当存在时)和异源多核苷酸(当存在时)以此顺序在5'-3'方向上连接。一个或多个连接子核苷酸(例如1、2、3、4、5、6、7、8、9或10个连接子核苷酸)可以存在于第一和第二多核苷酸、第二和第三多核苷酸、第二和异源多核苷酸、以及第三和异源多核苷酸之间。当存在时,此类连接子多核苷酸不应对启动子片段的功效具有显著的不利影响(例如在荧光素酶测定中所测量的)。优选地,没有连接子核苷酸,即优选第一多核苷酸、第二多核苷酸、第三多核苷酸(当存在时)和异源多核苷酸(当存在时)以此顺序连续地在5'-3'方向上连接。核酸分子能够促进哺乳动物细胞中可操作连接的异源多核苷酸的转录。异源多核苷酸将可操作地位于本发明的第一多核苷酸、第二多核苷酸、第三多核苷酸(当存在时)下游(即3')的位置。在本发明的上下文中,术语“促进转录”是指当异源多核苷酸可操作地连接或插入本发明的第一多核苷酸、第二多核苷酸和第三多核苷酸(当存在时)的下游时,得到异源多核苷酸的表达产物。在本发明的一些实施方式中,核酸分子能够以诱导型方式促进哺乳动物细胞中可操作连接的异源多肽的转录,即核酸分子是诱导型启动子。因此,核酸分子可以包括可抑制或可活化的元件。例如,可以将本文公开的启动子的版本改性为包含可以抑制或激活转录的蛋白的结合位点,以产生可诱导形式。在一个这样的实例中,本文公开的启动子(优选p565或p565i)可以改性为包含2-7个四环素阻遏蛋白的结合位点,最优选2-3个位点。通过插入所述结合位点,四环素阻遏蛋白将能够与启动子结合,并且这样做可以阻止基因转录因子机构在启动子上的组装,从而阻止转录和翻译。这会终止蛋白表达。在强力霉素或四环素存在下,四环素阻遏蛋白不再能够结合dna,因此阻遏子不再能够与启动子结合,并且转录和翻译可以无阻碍地进行。因此,所产生的启动子的转录活性可以说是由强力霉素或四环素的存在所诱导的,因此可归类为诱导型启动子。如本文所用的术语“表达产物”意指(i)作为异源多核苷酸的转录产物的rna(例如hnrna、mrna、sirna或mirna)和(ii)作为异源多核苷酸多肽的翻译产物中的一者或两者。异源多核苷酸可以可操作地插入本发明的核酸分子的下游,使得异源多核苷酸的5'末端位于从本发明核酸分子的3'末端起500bp、400bp、300bp、200bp、100bp、50bp、30bp或10bp的区域内。可以通过任何合适的方法测定已由本发明的核酸分子促进的转录水平。例如,对于这样的测定,异源多核苷酸可以是选择标记基因(例如新霉素抗性基因或潮霉素b磷酸转移酶基因)或表达报告基因(例如lacz、gfp(绿色荧光蛋白)、荧光素酶基因等)。优选地,可以通过使用fluc基因来完成对启动子活性的确认。本发明的核酸分子的转录活性可以通过在本发明的核酸分子的下游可操作地插入报告基因(例如fluc基因)来测量。然后可以使用萤火虫荧光素酶蛋白的表达水平来指示获得的转录水平。为了实现这一点,可以将所需的dna(包括fluc基因上游的本发明核酸)引入质粒中,然后将质粒转染到合适的受体细胞(例如293a细胞)中并使其表达萤火虫荧光素酶蛋白。24小时后,可以裂解细胞,并且可以使用光度计通过在其荧光素底物存在下测量其光输出来监测细胞裂解物中的荧光素酶。核酸分子能够促进哺乳动物细胞中可操作连接的异源多核苷酸的转录。优选的哺乳动物细胞包括小鼠细胞、大鼠细胞、仓鼠细胞、猴细胞和人细胞。此类细胞的实例包括hek细胞和衍生物(例如hek293、hek293t、hek293a)、perc6细胞、911细胞、cho细胞、hct116细胞、hela细胞、cos细胞和vero细胞;癌细胞例如hepg2、a549和mcf7;从人或动物活检分离的原代细胞;和干细胞(包括多能细胞,例如胚胎干细胞和诱导性多能干(ips)细胞;以及多能干细胞,例如造血干细胞、间充质干细胞等)。优选的人细胞包括hek293、hek293t和hek293a细胞;和人干细胞(包括多能细胞,例如胚胎干细胞和诱导性多能干(ips)细胞;以及多能干细胞,例如造血干细胞、间充质干细胞等)。在另一个实施方式中,本发明提供了包括本发明的核酸分子的表达载体。优选地,表达载体是质粒或病毒载体。哺乳动物表达载体的实例包括腺病毒载体、psv和pcmv系列的质粒载体、牛痘载体和逆转录病毒载体、以及杆状病毒。在一些实施方式中,表达载体是慢病毒载体。表达载体还可以包括以下一种或多种:复制起点、选择性标记和多克隆位点。在又一个实施方式中,本发明提供了包括本发明核酸分子的表达载体,其中核酸分子与异源多核苷酸可操作地连接。本发明还提供了包括本发明的表达载体的哺乳动物宿主细胞。可以通过任何合适的方法将表达载体转染到宿主细胞中。优选地,宿主细胞是哺乳动物细胞(例如人细胞),例如上面提到的那些。这些宿主细胞可以是分离细胞。本发明还提供了一种哺乳动物,其基因组包括本发明的核酸分子或本发明的表达载体。优选地,本发明的核酸分子或本发明的表达载体插入哺乳动物的基因组中,使得与本发明的所述核酸分子可操作地连接或可操作地插入本发明的所述表达载体中的异源多核苷酸在哺乳动物的一个或多个细胞中表达。优选地,哺乳动物是小鼠或大鼠。在一些实施方式中,哺乳动物是非人哺乳动物。本发明还提供了一种试剂盒,其包括本发明的表达载体和/或宿主细胞,任选地以及选自由以下组成的组中的一种或多种其它组分:(i)辅助质粒(例如含有在本发明启动子的调控下编码慢病毒多肽的核苷酸序列的辅助质粒);(ii)病毒基因组质粒(例如具有可适于简单插入所需转基因的包装信号的病毒基因组质粒);(iii)缓冲溶液;(iv)限制酶;(v)转染培养基;和(vi)哺乳动物细胞。使用blast比对方法可以得到百分比氨基酸序列同一性和核苷酸序列同一性(altschul等(1997),"gappedblastandpsi-blast:anewgenerationofproteindatabasesearchprograms",nucleicacidsres.25:3389-3402;和http://www.ncbi.nlm.nih.gov/blast)。优选地,使用标准或默认比对参数。标准蛋白-蛋白blast(blastp)可用于在蛋白数据库中查找相似的序列。与其它blast程序一样,blastp旨在查找相似的局部区域。当序列相似性跨越整个序列时,blastp还将报告总体比对,这是蛋白识别目的的优选结果。优选地,使用标准或默认比对参数。在某些情况下,可以去除“低复杂度过滤器”。blast蛋白搜索也可以用blastx程序进行,评分=50,字长=3。为了获得用于比较目的的空位比对,可以如altschul等(1997)nucleicacidsres.25:3389中所述使用空位blast(在blast2.0中)。或者,psi-blast(在blast2.0中)可用于执行检测分子之间的远距离关系的迭代搜索。(参见altschul等(1997)同上)。当使用blast、空位blast、psi-blast时,可以使用各个程序的默认参数。关于核苷酸序列比较,可以使用megablast、不连续的megablast和blastn来实现该目标。优选地,使用标准或默认比对参数。megablast专门设计用于有效地查找非常相似序列之间的长比对。不连续的megablast可用于查找与本发明的核酸相似但不相同的核苷酸序列。blast核苷酸算法通过将查询分解为被称为字的短的子序列来查找相似的序列。该程序首先识别与查询字的完全匹配(字命中)。然后,blast程序以多个步骤扩展这些字命中,以生成最终的空位比对。在一些实施方式中,blast核苷酸搜索可以用blastn程序进行,评分=100,字长=12。控制blast搜索灵敏度的重要参数之一是字大小。blastn比megablast更灵敏的最重要原因是它使用更短的默认字大小(11)。因此,blastn在对来自其它有机体的相关核苷酸序列的查找比对方面优于megablast。字大小可以在blastn中调整,并且可以从默认值减少到最小值7以提高搜索灵敏度。通过使用新引入的不连续的megablast页面(www.ncbi.nlm.nih.gov/web/newsltr/fallwinter02/blastlab.html),可以实现更灵敏的搜索。该页面使用与ma等(bioinformatics.2002mar;18(3):440-5)报告的算法类似的算法。并非要求精确的字匹配作为比对扩展的种源,不连续的megablast在较长的模板窗口内使用非连续的字。在编码模式中,通过集中于在第一密码子位置和第二密码子位置处查找匹配而忽略第三位置处的错配来考虑第三碱基摆动。与使用相同字大小的标准blastn相比,使用相同的字大小在不连续的megablast中搜索更灵敏和有效。不连续的megablast独有的参数是:字大小:11或12;模板:16、18或21;模板类型:编码(0)、非编码(1)或两者(2)。附图说明图1:psf-snapfastfluc报告载体背景图谱。图2:将重组启动子片段与一系列标准启动子进行比较的图表。错误条显示标准错误。实验一式三份地进行。图3:在时间过程测定中将最高性能的三种重组启动子(p565、p567和p576)与一系列标准高表达启动子进行比较的图。图4:由重组启动子p565驱动的蛋白表达水平。图5:使用质粒载体pcdna3.1和snapfastpro1v分别在来自cmv启动子和oxfordgenetics“杂种”prom-565启动子的hek293细胞中过表达蛋白质。(pcdna3.1是可从lifetechnologies获得的蛋白表达载体。质粒载体包括立即早期cmv启动子、t7启动子、伴随用于形成单链dna的f1起点的牛生长因子(bgh)多腺苷酰化信号、以及驱动新霉素-卡那霉素磷酸转移酶(氨基糖苷-3'-磷酸转移酶)的表达的sv40启动子和sv40多腺苷酰化信号。如果pcdna3.1载体用于表达感兴趣的外源蛋白,则需要在5'到3'方向上将所述蛋白的编码序列插入到cmv和t7启动子的下游(3')但是bgh多腺苷酰化信号的上游(5')。质粒还含有氨苄青霉素抗性基因,用于在细菌细胞中进行选择。snapfastprov1是由oxfordgeneticsltd设计的蛋白表达载体,其在sv40多腺苷酰化信号之前含有本文称为p565i的启动子。如果snapfastprov1载体要用于表达感兴趣的外源蛋白,则需要在5'至3'方向上将所述蛋白的编码序列插入p565i启动子的下游(3')但是插入sv40多腺苷酰化信号的上游(5')。质粒还含有卡那霉素抗性基因,用于在细菌细胞中进行选择。用表达各种flag标记的融合蛋白的pcdna3.1或snapfastpro1v转染hek293细胞。使用proteinsimplewestm自动western印迹系统在转染后72小时通过western印迹测定培养上清液或细胞裂解物的蛋白水平。用小鼠抗-flag一级抗体和二级兔抗-小鼠-igg-hrp检测flag标记的融合蛋白。图6:使用质粒载体pcdna3.1和snapfastpro1v分别在来自cmv启动子和oxfordgenetics“杂种”prom-565启动子的hek293细胞中过表达蛋白质。用表达各种flag标记的融合蛋白的pcdna3.1或snapfastpro1v转染hek293细胞。使用proteinsimplewestm自动western印迹系统在转染后72小时通过western印迹测定培养上清液或细胞裂解物的蛋白水平。用小鼠抗-flag一级抗体和二级兔抗-小鼠-igg-hrp检测flag标记的融合蛋白。图7:使用质粒载体pcdna3.1和snapfastpro1v分别在来自cmv启动子和oxfordgenetics“杂种”prom-565启动子的中国仓鼠卵巢(cho)细胞中过表达蛋白质。用表达各种flag标记的融合蛋白的pcdna3.1或snapfastpro1v转染cho细胞。使用proteinsimplewestm自动western印迹系统在转染后72小时通过western印迹测定培养上清液或细胞裂解物的蛋白水平。用小鼠抗-flag一级抗体和二级兔抗-小鼠-igg-hrp检测flag标记的融合蛋白。图8:使用质粒载体pcdna3.1和snapfastpro1v分别在来自cmv启动子和oxfordgenetics“杂种”prom-565启动子的中国仓鼠卵巢(cho)细胞中过表达蛋白质。用表达各种flag标记的融合蛋白的pcdna3.1或snapfastpro1v转染cho细胞。使用proteinsimplewestm自动western印迹系统在转染后72小时通过western印迹测定培养上清液或细胞裂解物的蛋白水平。用小鼠抗-flag一级抗体和二级兔抗-小鼠-igg-hrp检测flag标记的融合蛋白。图9:在hct116细胞中由本发明的启动子驱动的gfp的表达水平。图10:在a549细胞中由本发明的启动子驱动的gfp的表达水平。具体实施方式实施例通过以下实施例进一步说明本发明,除非另有说明,其中份数和百分比均以重量计,度数为摄氏度。应当理解,这些实施例虽然表示了本发明的优选实施方式,但仅以说明的方式给出。从以上讨论和这些实施例中,本领域技术人员可以确定本发明的本质特征,并且在不脱离其精神和范围的情况下,可以对本发明进行各种改变和修改以使其适应各种用途和条件。因此,除了本文所示和所述的那些之外,本发明的各种修改对于本领域技术人员而言根据前面的描述是显而易见的。这些修改也旨在落入所附权利要求的范围内。本文所述的每篇参考文献的公开内容均通过引用整体并入本文。实施例1:重组启动子片段产生由表1中认定的序列组成的重组启动子片段。表1:重组启动子片段的序列启动子名称第一多核苷酸第二多核苷酸第三多核苷酸p567seqidno:3seqidno:4p567iseqidno:3seqidno:4seqidno:7p576seqidno:2seqidno:4p576iseqidno:2seqidno:4seqidno:6p565seqidno:1seqidno:4p565iseqidno:1seqidno:4seqidno:5第一多核苷酸、第二多核苷酸和第三多核苷酸(当存在时)在上述启动子片段中连续地连接。实施例2:构建包括启动子的表达载体如下构建用于萤火虫荧光素酶测定的报告载体。制备载体使用图1中所示的snapfast(sf)载体。snapfast载体的骨架由puc细菌复制起点、氨苄青霉素抗性基因和多克隆位点组成。将萤火虫荧光素酶编码序列克隆到ncoi限制性位点和xbai限制性位点之间的多克隆位点中(参见图1)。荧光素酶编码序列包括kozak核糖体结合位点。用bglii将报告质粒线性化,然后去磷酸化以防止载体骨架的再连接。通过凝胶提取然后进行基于柱的纯化从未切割的载体中分离切割载体。然后将重组启动子片段(来自实施例1)连接到bglii切割载体中。将载体转化到标准的大肠杆菌克隆菌株中并置于lb卡那霉素选择平板上,使得每个菌落产生一个重组启动子。挑取菌落用于微小规模质粒制备。这些启动子克隆物用于转染到hek293细胞中并进行随后的荧光素酶表达测定。实施例3:启动子活性的测定材料和方法从每个重组启动子的菌落中纯化质粒dna。将含有重组启动子的报告载体分别转染到多个96孔板中的hek293细胞中。将转染的细胞在37℃下培养24小时。使用荧光素酶测定系统试剂盒(promega,wisconsin,usa)测定每个孔的荧光素酶活性。简而言之,每个测定如下进行:从每个孔中取出培养基。向每个孔中的细胞加入100μl报告裂解缓冲液。将微量滴定板在-20℃温育30分钟以裂解细胞,然后通过在室温下温育30分钟将板解冻。通过上下吸移使细胞裂解物均质化。将25μl每种裂解物的样品转移到光度计管中。通过向其中添加荧光素酶测定缓冲液来重构荧光素酶测定试剂。在lumatlb9507光度计(eg&gberthold)上分析样品。将光度计设置为注入25μl荧光素酶测定试剂,然后记录发射的光(持续时间2秒)。光度计的输出以相对光单位给出。将重组启动子与标准高表达启动子的选择进行比较。结果结果显示在图2中。重组启动子片段p567和p576在该测定中比cmv(当前的金标准)表现更好。实施例4:时间过程实验选择三个重组启动子(p565、p567和p576)进行时间过程实验。结果如图3所示。结果显示重组启动子在转染后24小时至72小时的过程内产生高度一致的高荧光素酶表达。实施例5:来自重组启动子的表达水平由本发明的重组启动子p565驱动的蛋白表达水平示出在图4中,其中cmv启动子表达示出为对照。将p565启动子与标准cmv启动子对4种不同的商业上有用的抗原(蛋白质“w”、“x”、“y”和“z”)的表达进行比较。对于每种抗原,将编码序列克隆到等同于图1中所示载体的载体中的cmv或p565启动子的下游。在第1天,将48孔微量滴定板在体积为300μl无血清培养基中以每孔30000个细胞的密度用hek293ad细胞接种。在第2天,对于每种表达载体,用0.75μgdna转染每个孔中的细胞。使用支链聚乙烯亚胺(pei)以每μgdna3μg的比例转染细胞。在将dna加入细胞之前,将其用pei在室温下温育20分钟以形成dna:pei复合物。在发生转染3天后,从每个孔收获上清液并通过western印迹分析表达的抗原量。实施例6:hek293细胞中的表达水平通过使用支链pei(25kda)的瞬时转染方法在人胚胎肾细胞(hek293)中从cmv启动子或启动子p565i过表达各种人基因(参见表2)。表2:在hek293细胞中过表达的人基因在质粒dna转染之前,将hek293细胞以25000个细胞/孔的密度接种在48孔板形式(sigmaaldrich)的组织培养物中24小时。将来自cmv启动子或启动子p565i的表达flag标记的人基因的每个质粒dna(750ng)与支链pei(25kda)以1:3的比例混合,并将dna:pei复合物瞬时转染到接种有hek293细胞的48孔板的每个孔中。使用小鼠抗-flag第一抗体和第二兔抗-小鼠-igg-hrp,通过转染后72小时的自动western印迹(westmproteinsimple)分析来自瞬时转染的每种flag标记的人蛋白的表达。结果显示在图5和图6中。实施例7:cho细胞中的表达水平通过使用支链pei(25kda)的瞬时转染方法,在chok1细胞中从cmv启动子或启动子p565i过表达各种人基因(参见表3)。表3:在cho细胞中过表达的人基因在质粒dna转染之前,将chok1细胞以20000个细胞/孔的密度接种在48孔板形式(sigmaaldrich)的组织培养物中24小时。将来自cmv启动子或启动子p565i的表达flag标记的人基因的每个质粒dna(750ng)与支链pei(25kda)以1:3的比例混合,并将dna:pei复合物瞬时转染到接种有chok1细胞的48孔板的每个孔中。使用小鼠抗-flag第一抗体和第二兔抗-小鼠-igg-hrp,通过转染后72小时的自动western印迹(westmproteinsimple)分析来自瞬时转染的每种flag标记的人蛋白的表达。结果显示在图7和图8中。实施例8:hct116细胞中的表达水平通过使用支链pei(25kda)的瞬时转染方法,在hct116细胞中从cmv、p565i、p565、p576、p567启动子表达绿色荧光蛋白(gfp)。在质粒dna转染之前,将hct116细胞以25000个细胞/孔的密度接种在处理的48孔板形式(sigmaaldrich)的组织培养物中24小时。将来自cmv、p565i、p565、p576或p567启动子的表达增强型绿色荧光蛋白的每个质粒dna(750ng)与支链pei(25kda)以1:3的比例混合,并且将dna:pei复合物瞬时转染到hct116细胞中。通过转染后48小时的流式细胞术测量hct116细胞的由mfi决定的增强绿色蛋白表达。结果如图9所示。实施例9:a549细胞中的表达水平通过使用支链pei(25kda)的瞬时转染方法,在a549细胞中从cmv、p565i、p565、p576、p567启动子表达绿色荧光蛋白(gfp)。在质粒dna转染之前,将a549细胞以25000个细胞/孔的密度接种在处理的48孔板形式(sigmaaldrich)的组织培养物中24小时。将来自cmv、p565i、p565、p576或p567启动子的表达增强型绿色荧光蛋白的每个质粒dna(750ng)与支链pei(25kda)以1:3的比例混合,并且将dna:pei复合物是瞬时转染到a549细胞中。通过转染后48小时的流式细胞术测量a549细胞的由mfi决定的增强绿色蛋白表达。结果如图10所示。序列seqidno:3agtaatcaattacggggtcattagttcatagcccatatatggagttccgcgttacataacttacggtaaatggcccgcctggctgaccgcccaacgacccccgcccseqidno:2ctaccgggtaggggaggcgcttttcccaaggcagtctggagcatgcgctttagcagccccgctgggcacttggcgctacacaagtggcctctggcctcgcacacattccacatccaccggtaggcgtcaatggaaagtccctattggcgttactatgggaacatacgtcattseqidno:1cgtgaggctccggtgcccgtcagtgggcagagcgcacatcgcccacagtccccgagaagttggggggaggggtcggcaattgaaccggtgcctagagaaggtggcgcggggtaaactgggaaagtgatgtcgtgtactggctccgcctttttcccgagggtgggggagaaccgtatataagtgcactagtcgccgtgaacgtcaatggaaagtccctattggcgttactatgggaacatacgtcattattgacgtcaatgacggtaaatggcccgcctggcattatgcccagtacatgaccttatgggactttcctacttggcagtacatctacgtattagtcatcgctattaccatgctgatgcggttttggcagtacatcaatgggcgtggatagcggtttgactcacggggatttccaagtctccaccccseqidno:4attgacgtcaatgggagtttgttttggcaccaaaatcaacgggactttccaaaatgtcgtaacaactccgccccattgacgcaaatgggcggtaggcgtgtacggtgggaggtctatataagcagagctggtttagtgaaccgtcagatcseqidno:7gttgttcgctttgataaacttccaggattcggagacagtattgaagctcaggtacagaaataatttcacctttctttctctttctattcagtgtggcacatctgtaaacgttcactcttcacttagagacatcctcaaccaaatcaccaaaccaaseqidno:6gcccaggaagtacacgagaagctccgaggattggctgaagtccaacgtctctgattgcggtggctcagagcacccgtatcattttggaggtgagtggctttggttcccggctgaggtggagtgggctgaggactagactgagccctcggacatggaggtggggatggggcagactcatcccattcttgaccaagcccttgttctgctcccttcccaggctctgtgactggggcaacctgcaaggagctggccagccagcctgacgtggacggcttccttgtgggtggtgcttccctcaagcccgaattcgtggacatcatcaacgccaaacaaseqidno:5tgaagttggtggtgaggccctgggcaggttggtatcaaggttacaagacaggtttaaggagaccaatagaaactgggcatgtggagacagagaagactcttgggtttctgataggcactgactctctctgcctattggtctattttcccacccttag无序列表文本<223>合成的启动子元件。序列表<110>牛津遗传学有限公司<120>启动子<130>fp1v181522zx<160>7<170>patentinversion3.5<210>1<211>433<212>dna<213>人工序列(artificialsequence)<220><223>合成的启动子元件<400>1cgtgaggctccggtgcccgtcagtgggcagagcgcacatcgcccacagtccccgagaagt60tggggggaggggtcggcaattgaaccggtgcctagagaaggtggcgcggggtaaactggg120aaagtgatgtcgtgtactggctccgcctttttcccgagggtgggggagaaccgtatataa180gtgcactagtcgccgtgaacgtcaatggaaagtccctattggcgttactatgggaacata240cgtcattattgacgtcaatgacggtaaatggcccgcctggcattatgcccagtacatgac300cttatgggactttcctacttggcagtacatctacgtattagtcatcgctattaccatgct360gatgcggttttggcagtacatcaatgggcgtggatagcggtttgactcacggggatttcc420aagtctccacccc433<210>2<211>172<212>dna<213>人工序列(artificialsequence)<220><223>合成的启动子元件<400>2ctaccgggtaggggaggcgcttttcccaaggcagtctggagcatgcgctttagcagcccc60gctgggcacttggcgctacacaagtggcctctggcctcgcacacattccacatccaccgg120taggcgtcaatggaaagtccctattggcgttactatgggaacatacgtcatt172<210>3<211>106<212>dna<213>人工序列(artificialsequence)<220><223>合成的启动子元件<400>3agtaatcaattacggggtcattagttcatagcccatatatggagttccgcgttacataac60ttacggtaaatggcccgcctggctgaccgcccaacgacccccgccc106<210>4<211>150<212>dna<213>人工序列(artificialsequence)<220><223>合成的启动子元件<400>4attgacgtcaatgggagtttgttttggcaccaaaatcaacgggactttccaaaatgtcgt60aacaactccgccccattgacgcaaatgggcggtaggcgtgtacggtgggaggtctatata120agcagagctggtttagtgaaccgtcagatc150<210>5<211>157<212>dna<213>人工序列(artificialsequence)<220><223>合成的启动子元件<400>5tgaagttggtggtgaggccctgggcaggttggtatcaaggttacaagacaggtttaagga60gaccaatagaaactgggcatgtggagacagagaagactcttgggtttctgataggcactg120actctctctgcctattggtctattttcccacccttag157<210>6<211>333<212>dna<213>人工序列(artificialsequence)<220><223>合成的启动子元件<400>6gcccaggaagtacacgagaagctccgaggattggctgaagtccaacgtctctgattgcgg60tggctcagagcacccgtatcattttggaggtgagtggctttggttcccggctgaggtgga120gtgggctgaggactagactgagccctcggacatggaggtggggatggggcagactcatcc180cattcttgaccaagcccttgttctgctcccttcccaggctctgtgactggggcaacctgc240aaggagctggccagccagcctgacgtggacggcttccttgtgggtggtgcttccctcaag300cccgaattcgtggacatcatcaacgccaaacaa333<210>7<211>155<212>dna<213>人工序列(artificialsequence)<220><223>合成的启动子元件<400>7gttgttcgctttgataaacttccaggattcggagacagtattgaagctcaggtacagaaa60taatttcacctttctttctctttctattcagtgtggcacatctgtaaacgttcactcttc120acttagagacatcctcaaccaaatcaccaaaccaa155当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1