一种用于检测氯吡格雷个体化用药相关的基因多态性位点的核酸质谱检测试剂盒及应用的制作方法
本发明属于生物技术领域,涉及一种用于确定氯吡格雷个体化用药相关的基因多态位点的检测方法及产品,具体而言是利用多重pcr技术、单碱基延伸技术和质谱技术,对氯吡格雷个体化用药相关的15个基因多态性位点进行检测的方法及相应的试剂盒。
背景技术:
氯吡格雷是一种噻吩并吡啶类化合物,它能不可逆地抑制血小板聚集,其作用机理是选择性抑制位于血小板表面的、与腺苷酸环化酶偶联的adp受体,进而抑制纤维蛋白原与血小板的结合,从而阻止了血小板聚集。
氯吡格雷是最广泛使用的抗血小板聚集药物之一,可抑制动、静脉内血栓形成,或使形成的血栓的体积减小,并抑制血小板脱颗粒反应,用于预防和治疗因血小板高聚集引起的心、脑及其他动脉循环障碍疾病。氯吡格雷可延长出血时间,它有防止动脉粥样硬化病人的缺血性中风、心肌梗死和血管性死亡的作用。据统计,临床在使用氯吡格雷时,多达30%的患者未能达到预期药效。造成氯吡格雷药效的个体差异的原因很多,可分为非遗传因素和遗传因素。非遗传因素主要有体重、高密度脂蛋白和甘油三酯水平、药物的相互作用以及合并疾病等。近年的研究表明,遗传因素在氯吡格雷药效的个体差异的表现中起到一定的作用。影响氯吡格雷药效的个体差异的遗传因素是指与氯吡格雷的药动学和药效学有关的蛋白或酶的基因发生变异,影响蛋白的表达或酶的活性,从而增强或降低氯吡格雷的疗效,使不同个体间的用量产生差异,这些遗传因素包括cyp2c19、cyp2c9、irs1、p2ry12、pon1、ces1等基因上的基因多态性位点。
氯吡格雷为前体药,需经肝细胞色素p450酶系主要是cyp2c19和cyp2c9代谢生成活性代谢产物,发挥抗血小板疗效。cyp2c19基因存在多态性,其酶有三种不同的代谢类型:快速代谢型(um,*17/*17)、中间代谢型(im,*1/*2,*1/*3,*17/*2,*17/*3)、慢代谢型(pm,*2/*2,*2/*3,*3/*3)。常规剂量的氯吡格雷,在慢代谢型患者中产生的活性代谢物减少,抑制血小板聚集作用下降,形成血栓风险增加;在快代谢型患者中产生活性代谢物增加,抑制血小板聚集作用增强。还有研究表明,基因型为cyp2c19*8与一个功能缺失等位基因*2,*3,*4,*5,*8或功能等位基因*1结合的个体相比于基因型为*1/*1的个体,对氯吡格雷的代谢活性弱,同时会降低活性药物代谢物的形成,对氯吡格雷的反应较弱,发生心血管二次事件的风险较高。cyp2c9酶功能缺失的*2和*3突变,降低了氯吡格雷的体内代谢和抗血小板活性。
临床中应用常规剂量的氯吡格雷,有部分患者不能达到预期的抗血小板的目的,导致不良心血管事件的发生,这种现象称为氯吡格雷抵抗。irs1rs13431554位点gg基因型与冠心病合并ⅱ型糖尿病患者氯吡格雷抵抗的发生呈明显相关性,gg基因型是冠心病合并ⅱ型糖尿病患者氯吡格雷抵抗的独立危险因素。pon-1是由肝脏合成的糖蛋白,在人体组织中广泛分布。有研究发现,pon-1是氯吡格雷代谢物形成活性硫醇基的限速酶,pon-1基因的q192多态性影响氯吡格雷活性代谢物的形成速率。近年来研究发现ces1是氯吡格雷转化为活性代谢产物过程中又一种重要的酶,ces1的snp位点g143e与氯吡格雷活性代谢物水平升高有关。冠心病并发ⅱ型糖尿病患者中,irs1基因多态性位点rs13431554gg型个体在接受氯吡格雷治疗时,有较高的血小板反应性。p2ry12受体是氯吡格雷的作用靶点,在adp诱导的血小板聚集中发挥重要的作用,p2ry12基因多态性位点rs6785930、rs3732759、rs2046934与氯吡格雷的反应性及发生不良心血管事件的风险相关。
综上所述,基因多态性位点是导致氯吡格雷药效个体差异的因素之一,用药前进行相关的基因多态性检测,结合临床因素,有助于患者有效使用氯吡格雷,降低不良反应的发生率。目前存在的问题是缺乏一次能同时检测多个与氯吡格雷个体化用药相关的基因多态位点的方法和产品,综合判断多个多态性位点结果,更加准确的指导个体化用药,而常见的检测技术,如测序、实时荧光定量等,均需对位点逐一进行检测,当位点较多时操作复杂,实验周期长,费用较高,因此,目前已有的检测方案,大多数仅针对cyp2c19*2、*3、*17等少数几个基因多态位点。因此,目前需要一种能检测尽量多位点、且能在同一体系中针对同一个个体的多个snp的技术,通过该技术的检测,可为确定氯吡格雷个体化用药提供更加精准的参考依据。
技术实现要素:
本发明原理在于:提供了一种联合多重pcr技术、单碱基延伸技术和质谱检测技术,检测氯吡格雷个体化用药相关基因多态位点的检测方案。其中在多重pcr中同时扩增多达15个含snp的dna片段;在单碱基延伸过程中,对多重pcr的纯化产物进行多重单碱基延伸,延伸引物在15个snp处分别延伸一个碱基,使得所延伸的碱基类型,分别与snp处的基因型相关;单碱基延伸产生由延伸引物和延伸产物组成的待检混合物,以质谱对待检混合物进行检测,通过质谱峰确定待检混合物中各物质的分子量,并与预先计算的各延伸引物和延伸产物的理论分子量进行比对,从而确定各处的基因型。
因此,本发明第一个目的是提供一种检测15个与氯吡格雷个体化用药相关的基因多态性位点的引物系统或引物组,其序列如表1所示。
其中,所述15个与氯吡格雷个体化用药相关的基因多态性位点分别是cyp2c19基因rs4986893(*3)位点、rs4244285(*2)位点、rs28399504(*4)位点、rs12248560(*17)位点、rs41291556(*8)位点、rs56337013(*5)位点,cyp2c9基因rs1799853(*2)位点、rs1057910(*3)位点,irs1基因rs13431554位点,p2ry12基因rs6785930位点、rs3732759位点、rs2046934位点,pon1基因rs662位点,ptgs1基因rs1330344位点,ces1基因rs8192950位点。
其中,各snp位点对应的延伸引物及延伸产物分子量如表2所示。
在一个实施方案中,上述pcr引物序列在5’段加入10bp的tag(5’-acgttggatg-3’),例如,pcr引物seqidno:1为5’acgttggatggtgaattaagaccttggcgg-3’。在另一个具体实施方案中,延伸引物的5’端也可以增加0-10bp作为接头的碱基序列。例如,在延伸引物seqidno:35的5'端加入4bp的接头cccc,为与原始序列区分,接头用小写字母表示。
本发明第二个目的是提供了由上述引物系统所制备的用于氯吡格雷个体化用药相关的基因多态性位点的检测试剂盒,具体如下。
(1)用于pcr反应的试剂,包括所述的特异性pcr引物,pcr反应mix(耐高温的dna聚合酶,dntps,缓冲液)。
(2)用于pcr产物纯化的试剂,包括碱性磷酸酶,缓冲液。
(3)用于单碱基延伸反应的试剂,包括权利要求1所述的延伸引物,延伸反应mix(耐高温的单碱基延伸酶,ddntps,缓冲液)。
(4)阴性质控品、阳性质控品、纯化用树脂、点样及质谱检测用靶片等。
本发明第三个目的是使用上述引物、产品或试剂盒来检测氯吡格雷个体化用药相关基因多态位点的方法,包括如下步骤。
(1)多重pcr反应:在一个反应体系中,通过特异性的pcr引物,对15处与氯吡格雷个体化用药相关的基因多态性位点所在的dna区域同时进行扩增,得到含15处基因多态性位点所在dna区域的pcr产物。
(2)pcr产物纯化:对步骤(1)得到的pcr产物进行纯化,以消除dntps对单碱基延伸反应的干扰。
(3)单碱基延伸:在一个反应体系中,使用15条特异性的延伸引物,对步骤(2)得到的纯化后pcr产物进行多重单碱基延伸,15条延伸引物在各自对应的snp位点处延伸一个碱基。
(4)延伸产物纯化:通过树脂,对步骤(3)得到的单碱基延伸产物进行纯化,避免盐离子等杂质对最终检测的影响。
(5)质谱仪检测:将步骤(4)得到的纯化的单碱基延伸产物通过点样仪点在含有基质的靶片上,将靶片放入质谱仪中进行检测,得到不同snp位点延伸产物的核酸图谱,经过质谱仪配套软件分析后,确认snp位点的碱基,从而判定这15处snp位点的基因型。
其中,所述15个与氯吡格雷个体化用药相关的基因多态性位点分别是cyp2c19基因rs4986893(*3)位点、rs4244285(*2)位点、rs28399504(*4)位点、rs12248560(*17)位点、rs41291556(*8)位点、rs56337013(*5)位点,cyp2c9基因rs1799853(*2)位点、rs1057910(*3)位点,irs1基因rs13431554位点,p2ry12基因rs6785930位点、rs3732759位点、rs2046934位点,pon1基因rs662位点,ptgs1基因rs1330344位点,ces1基因rs8192950位点。
本发明第四个目的是提供前述试剂盒在检测15个氯吡格雷个体化用药相关的snp的用途。
本发明优势如下。
1.简便、快速:操作简单、速度快、通量高,可在8小时内完成数百个样本的15处snp检测。
2.灵敏、特异:本发明综合了多重pcr、单碱基延伸、质谱检测等技术为一体,远远优于单独使用pcr检测snp;单碱基延伸使用特异性延伸引物对dna分子进行识别,较测序技术延伸数百个碱基,该技术仅延伸单个碱基,出错概率更低。
3.本发明可对15处snp进行检测,同时得到各处snp位点的检测结果,其中可以是单个snp位点发生突变,也可以是多个snp位点发生突变。这表示患者可以携带一个或多个突变,从而为选择合适剂量提供参考信息。
上述所检测的位点在中国人群中的突变频率存在较大的差异,有个别位点的突变型极其稀有,如rs1799853,因此,在15个位点同时发生多处的突变概率极低。然而,由于以上研究涉及的样本量较低,远远低于预期的数量,例如对于发生频率较低时,如1%,理论上需要检测50人的100条染色体,才能出现预期的结果。因此,以上数据仅仅表明同时发生多个snp位点突变的情况,其发生频率极低,但并非意味着本发明不能检测同时发生15个位点突变的情况。通常sanger测序法或实时荧光pcr法,每增加一个snp位点的反应,就要增加相应的费用和时间。相比之下,质谱法检测优势在于多个位点可在单管反应液中操作则花费的试剂和时间是不变的,这也是本发明同时检测多个位点突变的优势。
然而,鉴于核酸质谱方法的特殊性,例如,其需先通过pcr反应扩增出含snp位点的片段,然后通过延伸引物延伸出snp位点的碱基;各个snp位点的pcr反应、延伸反应间须无明显干扰;各snp的延伸引物、延伸产物间分子量要有足够大的差异以便实现区分等,因此,并非所有的已知snp位点均可以用核酸质谱的方法进行检测,也并不是所有针对snp位点设计的引物均可用以进行多重pcr反应和多重单碱基延伸反应。
应当指出的是,本发明涉及如何确定氯吡格雷用药相关的snp的检测方法,并不涉及如何确定氯吡格雷用药剂量。由于氯吡格雷主要通过选择性抑制位于血小板表面的与腺苷酸环化酶偶联的adp受体,进而抑制纤维蛋白原与血小板的结合,从而阻止了血小板聚集。使用本方案仅能为临床用药提供参考,一些非遗传因素如用药者的体重等都有可能影响药效和用药剂量,本方法不属于疾病的诊断方法。
附图说明
为了更清楚地说明本申请实施例中的技术方案,下面将对实施例中所需要使用的附图作简单地介绍,显而易见地,下面描述中的附图仅仅是本申请中记载的一些实施例。
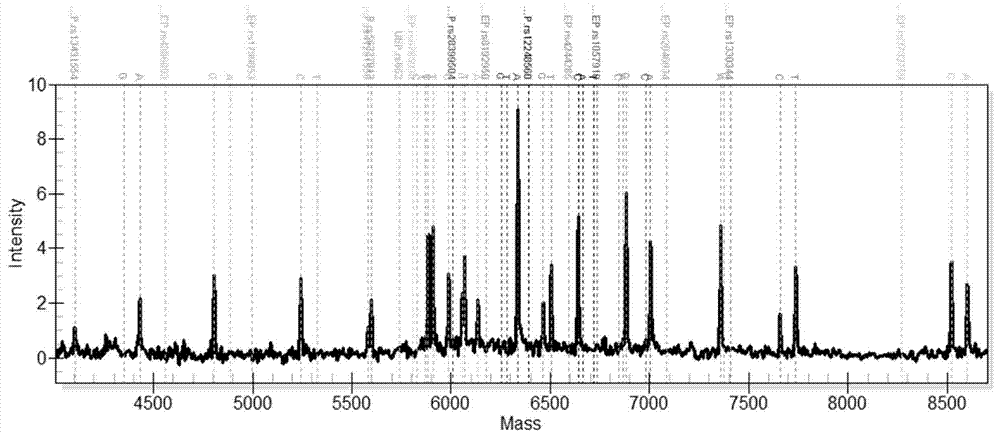
附图1:空白对照核酸质谱分型结果图。
附图2:a1样本核酸质谱分型结果图。
附图3:a2样本核酸质谱分型结果图。
附图4:a3样本核酸质谱分型结果图。
附图5:a4样本核酸质谱分型结果图。
附图6:a5样本核酸质谱分型结果图。
附图7:a6样本核酸质谱分型结果图。
附图8:a7样本核酸质谱分型结果图。
附图9:a8样本核酸质谱分型结果图。
附图10:a9样本核酸质谱分型结果图。
附图11:a10样本核酸质谱分型结果图。
附图12:a11样本核酸质谱分型结果图。
附图13:a12样本核酸质谱分型结果图。
附图14:a12样本rs13431554质谱结果与一代测序结果对比图。
附图15:a12样本rs1799853质谱结果与一代测序结果对比图。
附图16:a12样本rs56337013质谱结果与一代测序结果对比图。
附图17:a12样本rs6785930质谱结果与一代测序结果对比图。
附图18:a12样本rs28399504质谱结果与一代测序结果对比图。
附图19:a12样本rs1057910质谱结果与一代测序结果对比图。
附图20:a12样本rs3732759质谱结果与一代测序结果对比图。
附图21:a12样本rs4986893质谱结果与一代测序结果对比图。
附图22:a12样本rs41291556质谱结果与一代测序结果对比图。
附图23:a12样本rs4244285质谱结果与一代测序结果对比图。
附图24:a12样本rs12248560质谱结果与一代测序结果对比图。
附图25:a12样本rs8192950质谱结果与一代测序结果对比图。
附图26:a12样本rs1330344质谱结果与一代测序结果对比图。
附图27:a12样本rs662质谱结果与一代测序结果对比图。
附图28:a12样本rs2046934质谱结果与一代测序结果对比图。
具体实施方式
下面结合具体实施例对本发明作进一步详细说明。
实施例1:氯吡格雷个体化用药相关基因核酸质谱检测。
一、引物设计及合成。
针对yp2c19基因rs4986893(*3)位点、rs4244285(*2)位点、rs28399504(*4)位点、rs12248560(*17)位点、rs41291556(*8)位点、rs56337013(*5)位点,cyp2c9基因rs1799853(*2)位点、rs1057910(*3)位点,irs1基因rs13431554位点,p2ry12基因rs6785930位点、rs3732759位点、rs2046934位点,pon1基因rs662位点,ptgs1基因rs1330344位点,ces1基因rs8192950位点等15个与氯吡格雷个体化用药相关的基因多态位点,设计对应特异性pcr引物核心序列(seqidno:1至seqidno:30)和特异性延伸引物核心序列(seqidno:31至seqidno:45)。
其中,为了避免pcr引物进入质谱仪检测窗口而干扰检测效果,在每条pcr引物的5'端增加一定数目的碱基,常见如10bp的tag(acgttggatg),以增大每条pcr引物的分子量,从而超出质谱仪检测窗口。
以上相关引物在生工生物工程(上海)有限公司进行合成。
二、样本dna的提取。
采用商业化的核酸提取试剂盒进行基因组dna提取。从每位患者的200μl全血中提取人基因组dna,以nanodropone(thermo公司)进行定量,并标化至10ng/μl,分别为a1-a10。按要求,在2-8℃保存不超过一周,-20℃保存不超过两年,-80℃可长期保存,应避免反复冻融,如需进行运输,请用冰盒。
三、质谱检测。
在本实施例中,用于pcr、pcr产物纯化和单碱基延伸的组分见表3。
pcr扩增反应。
1.在pcr配液区,准备一个384孔板,并根据待测样品编号(包括阳性质控品、阴性对照、空白对照)在记录表上相应的位置进行标记。
2.从试剂盒中取出pcr引物混合液、pcr反应混合液、pcr酶,使其自然解冻,涡旋振荡充分混匀,瞬时离心至管底。
3.根据样本数目,按下表的比例吸取pcr引物混合液、pcr反应混合液和pcr酶,置于一个离心管中混匀,按每pcr反应孔加入4μl混合物进行分装。由于分装过程中,移液器吸头残留等因素可能造成不足以分装出所需的份数,建议适当放大混合物的配制体积。例如有12份待测样品时,可按12.5-13份样品配制混合物。
4.在pcr扩增区内向每孔混合物中加入1μl待测dna样品,使每份pcr反应体系总体积为5μl。其中,阴性对照为超纯水,空白对照为不加dna模板。轻轻混匀后,离心,1000rpm,1min。
5.将加好样的384孔板置于pcr扩增仪中,按下表的程序进行pcr扩增反应。
sap酶处理。
1.待pcr反应结束后,向每孔pcr产物加入2μlsap混合液。轻轻混匀后,离心,1000rpm,1min。
2.将384孔板置于pcr扩增仪中,按下表的程序对pcr产物进行sap酶处理。
单碱基延伸。
1.在pcr配液区,根据之前反应数目,按下表的比例吸取延伸引物混合液、延伸反应混合液和延伸反应酶,置于一个离心管中混匀。由于分装过程中,移液器吸头残留等因素可能造成不足以分装出所需的份数,建议适当放大混合物的配制体积。例如有12个反应孔时,可按12.5-13个反应孔配制混合物。
2.向每孔sap处理过的pcr产物加入2μl配好的延伸混合液。轻轻混匀后,离心,1000rpm,1min。
3.将384孔板置于pcr扩增仪中,按下表的程序进行单碱基延伸。
四、纯化。
1.在pcr扩增区向每孔延伸产物中加入16μl超纯水。
2.取适量的树脂于6mg的384板上,用塑料盖板将树脂压开,然后反复推平,制得每孔含量均匀的树脂。
3.将含量均匀的树脂加入具有延伸产物的384孔板中,贴上封板膜,360°旋转仪旋转5min后,离心,2300g,10min。
4.点样
用massarraynanodispenserrs1000点样,将待测样本点至靶片。
五、上机检测及结果判读。
用massarrayanalyzer4对点样后的靶片进行检测和结果判断。
如前述表2所示,15条延伸引物及它们在15个基因多态位点上根据各自基因型产生的延伸产物具有不同的分子量,这些分子量对应各自的质谱峰,若在某分子量处出现质谱峰,则判断为存在与该分子量对应的物质(延伸引物或产物):
判断标准如下。
若野生型和突变型对应的质谱峰均未出现,无论延伸引物对应的质谱峰是否存在,均判断为实验失败。
若野生型或突变型对应的质谱峰仅出现一个,则判断为所出现质谱峰对应的基因型的纯合型。
若野生型或突变型对应的质谱峰均出现,则判断为杂合型。
质谱结果如图1-13所示,其中,图1为空白对照的质谱图,图2-13为a1-a12样本的质谱图。根据前述表2中的延伸引物及延伸产物的分子量检查样本a1-a12的质谱结果(图2-13),确定snp位点的基因型,结果如表4和图1-13所示。a13为野生型阳性质控品、a14为突变型阳性质控品的质谱结果。
一、根据实施例1,采用以下表10所示引物,对各位点进行测序。
二、样本来源。
测序验证采用实施例1中从12例患者体内采集的静脉血中提取的人基因组dna(a1-a12)。
三、测序鉴定。
1.反应体系为50μl,具体如下表所示。
2.反应条件。
使用abi公司2720pcr仪进行pcr反应。反应程序如下所示。
3.将pcr产物送至生工生物工程(上海)有限公司进行序列测序。
四.结果分析。
将各测序得到的序列,在ncbi上进行blast,确定所测序列确实为目的序列后,用seqman进行比对,分别确定所测12例样本15个位点的基因型,如表13和图14-28所示。在此仅以a12样本的测序图谱为例,其余未显示。
经过比较,表13与质谱检验结果表9完全一致,证明本发明方法的准确性100%。
- 还没有人留言评论。精彩留言会获得点赞!