重组大肠杆菌zjut-ho1及其在制备胆绿素中的应用的制作方法
本发明涉及一株表达藻类来源的血红素加氧酶-1的基因重组大肠杆菌,以及该菌株在生物转化血红素制备胆绿素中的应用。
(二)
背景技术:
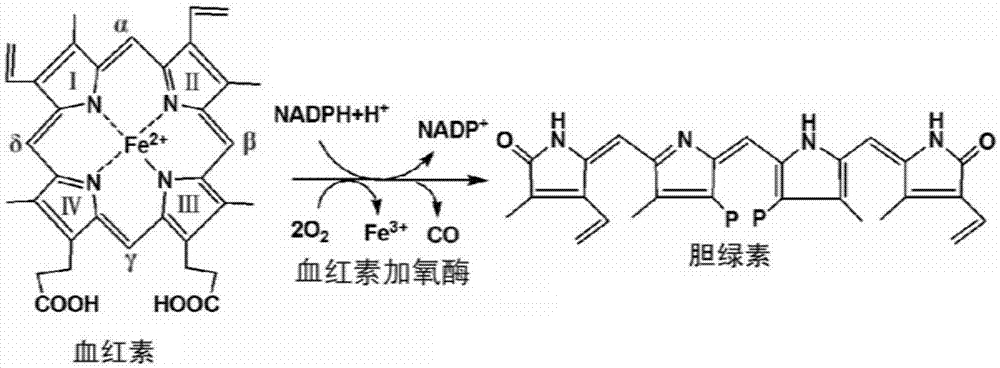
胆绿素(biliverdin,cas:114-25-0)是由血红素经血红素加氧酶(hemeoxygenase-1,ho-1)水解开环而得到的一种线性四吡咯环物质(反应式见图1),因其呈深绿色而得名。在脊椎动物细胞内,血红素在ho-1的水解作用下,在α-亚甲基桥处开环形成胆绿素ixα异构体,因此,胆绿素一般就是指胆绿素ixα。
胆绿素不仅仅是血红素代谢循环系统的一个中间代谢物,更重要的是它能启动一系列的抗炎、抗氧化和免疫调节等生理作用,如可以改善肝功能、降低丙氨酸转氨酶、减轻因肝脏移植导致的缺血再灌注损伤,抑制新生血管内膜形成的血管重塑,以及抑制牛腹泻病毒复制等功能。因此,胆绿素作为临床药物使用的潜力巨大。所以,近年来,如何高效制备胆绿素一直是科研人员关注的热点。
目前,制备胆绿素主要有提取法、化学转化法、酶转化法和生物合成法。提取法是直接从三文鱼胆汁或鸸鹋蛋壳中提取胆绿素,存在的问题是原料来源不足,难以工业化应用;化学转化法是利用胆红素脱氢制备,但该方法存在2个问题:①需要价格高的胆红素作为底物,原料来源困难;②胆红素提取自哺乳动物的胆汁,而且需在酸性条件下,这使胆红素形成多种异构体,从而导致产物胆绿素ixα的收率和纯度较低;也有采用化学氧化血红素法制备胆绿素的报道,同样产生较多的异构体,收率较低;酶转化法制备胆绿素的报道是美国的一项专利,将来自蓝藻的ho-1基因重组到酵母细胞中,表达ho-1,再以血红素作为底物,全细胞生物转化制备胆绿素,该方法的优点是异构体少,但该专利未报道产率情况。生物合成法的报道是于2012年,美国犹他州立大学的chen和takemoto将蓝藻的ho-1基因重组到大肠杆菌,重组大肠杆菌全细胞能够合成胆绿素,胆绿素产率可达23.5mg/l,即便如此,产率仍然相对较低。可以看出,目前缺乏经济有效的胆绿素制备方法。
(三)
技术实现要素:
本发明的目的是提供一株表达集胞藻(synechocystissp.)的胞内活性血红素加氧酶-1基因(ho-1)的基因重组大肠杆菌,经诱导表达培养后,在培养液中加入氯化血红素作为底物,在胞内ho-1的催化作用下,用于生物转化法制备胆绿素,获得相对较高的胆绿素收率,为胆绿素的生产提供新方法。
本发明的采用的技术方案是:
本发明提供一株表达胞内活性血红素加氧酶-1基因(ho-1)的重组大肠杆菌(escherichiacoli)zjut-ho1菌株,保藏于广东省微生物菌种保藏中心,保藏编号:gdmccno:60372,保藏日期2018年5月18日,地址:广州市先烈中路100号大院59号楼5楼,邮编:510075。
所述大肠杆菌zjut-ho1菌株的构建方法包括以下步骤:
(1)以集胞藻(synechocystissp.)pcc6803总rna逆转录得到的双链cdna为模板,设计引物p1和p2,引入限制性内切酶ndeⅰ和xhoⅰ的酶切位点,pcr扩增获得目的基因ho1序列,所述的基因ho1的核苷酸序列见seqidno:1。
所述的引物p1和p2分别为:
p1:5′-gggaattccatatgagtgtcaacttagc-3′
p2:5′-ccgctcgagctagccttcggag-3′
(2)pcr产物3′端加碱基a后连接pucm-t质粒载体,转化大肠杆菌dh5α菌株,提取阳性克隆的质粒,经双酶切和测序验证,成功构建克隆载体pucm-t-ho1。
(3)pucm-t-ho1与pet-28a质粒分别经ndei和xhoi双酶切后,目的基因ho1和开环pet-28a经t4dna酶连接后,转化大肠杆菌bl21(de3)菌株,提取阳性克隆的质粒,经双酶切和测序验证,成功构建表达载体pet-28a-ho1。
(4)重组ho1的大肠杆菌bl21(de3)菌株,于50μg/ml卡那霉素的lb培养基中培养2h(od600≈0.8),加入终浓度为0.5mmol/l的异丙基-β-d-硫代半乳糖苷(iptg)诱导培养20h,收集菌体,经sds-page蛋白电泳分析,重组菌表达了分子量为29kd的蛋白,与ho-1分子量大小一致;经分离纯化获得ho-1,酶活测定表明具有转化血红素为胆绿素活力,表达ho-1的基因重组大肠杆菌构建成功。
本发明还涉及一种重组大肠杆菌zjut-ho1在生物转化血红素制备胆绿素中的应用,具体所述的应用方法为:以重组大肠杆菌zjut-ho1经诱导培养获得的培养液为反应介质,以氯化血红素为底物构成反应体系,于25~40℃、100~200r/min(优选37℃、180r/min)恒温振荡摇床中培养至转化完全,将反应液分离纯化,获得胆绿素;所述培养液od600=1.40~1.65,所述底物在培养液中的终浓度为100-200mg/l(优选200mg/l);所述氯化血红素以2g/l氯化血红素水溶液的形式加入,所述2g/l氯化血红素水溶液的配制方法为:100mg氯化血红素微热溶解50ml质量浓度0.25%na2co3水溶液,即得2g/l的氯化血红素水溶液。
进一步,所述反应液分离纯化的方法为:反应结束后,将反应液经8000~1000g离心5~10min(优选1000g,10min),收集菌体,菌体用等同反应体系体积的酸性甲醇悬浮,于40℃、100khz、200w条件下超声30min,8000~1000g离心5~10min(优选1000g离心5min),收集上清液;上清液于45℃下减压蒸干后,加入原反应体系1/4~1/5体积的酸性甲醇溶解残留物,用滤纸过滤后,于45℃下减压干燥,即得胆绿素;所述的酸性甲醇是在体积浓度95%甲醇水溶液中,加入1/1000体积比的质量浓度36%浓盐酸制成。
进一步,所述重组大肠杆菌zjut-ho1诱导培养方法为:
(1)将重组大肠杆菌zjut-ho1接种于含50μg/ml卡那霉素的lb斜面培养基,于37℃恒温培养24h,获得斜面菌体;所述的lb斜面培养基终浓度组成为:酵母浸出粉5g/l,蛋白胨10g/l,nacl10g/l,琼脂20g/l,溶剂为去离子水,ph7.4,121℃灭菌15min;
(2)挑取斜面菌体2环,接种到含50μg/ml卡那霉素的lb液体培养基,于30~35℃、150~200r/min的恒温振荡摇床培养10~12h(优选30℃、180r/min、12h),获得种子液;所述的lb培养基终浓度组成为:酵母浸出粉5g/l,蛋白胨10g/l,nacl10g/l,溶剂为去离子水,ph7.4,121℃灭菌15~20min;
(3)按体积浓度1%~5%(优选3%)的接种量,将步骤(1)种子液接种至含50μg/ml卡那霉素甘油培养基(gy),35~37℃、100~200r/min(优选37℃、180rmp)培养至菌浓od600=0.5~1.2时,加入终浓度为0.1~0.5mmol/l(优选0.5mmol/l)的iptg,25~30℃、100~150r/min培养4~8h(优选30℃、100rpm、6h),至od600=1.40~1.65,获得培养液;所述的gy培养基终浓度组成为:甘油15~20g/l,酵母浸出粉15~20g/l,nh4so43~5g/l,nacl3~5g/l,na2hpo410~15g/l,kh2po43~5g/l,mgso40.3~0.5g/l,溶剂为去离子水,ph自然,121℃灭菌15~20min;优选所述的gy培养基组成为:甘油20g/l,酵母浸出粉20g/l,nh4so45g/l,nacl5g/l,na2hpo415g/l,kh2po43g/l,mgso40.5g/l,溶剂为去离子水,ph自然。
与现有技术相比,本发明的有益效果主要体现在:本发明克隆了集胞藻的ho-1编码基因,与表达载体连接,构建得到含该基因的重组质粒pet-28a-ho1,再转入大肠杆菌bl21(de3)菌株中,获得重组大肠杆菌。该重组大肠杆菌表达胞内活性的ho-1,可以利用重组大肠杆菌为ho-1酶源,以氯化血红素为底物,生物转化法制备胆绿素,为胆绿素的生产提高新途径。相比于现有的同类技术,本发明将原核生物来源的ho1在原核生物的大肠杆菌中表达,具有ho-1活性高、培养周期短等优点,并以氯化血红素为底物,使胆绿素的产率有大幅度提高,是重组大肠杆菌全细胞合成法的2.6倍。
(四)附图说明
图1血红素生物转化为胆绿素的反应式示意图。
图2pcr扩增ho1的电泳图(m:marker;1,2:pcr产物)。
图3阳性克隆载体pucm-t-ho1经ndeⅰ和xhoⅰ双酶切后电泳图(m:marker;1:载体经双酶切)。
图4阳性表达载体pet-28a-ho1经ndeⅰ和xhoⅰ双酶切后电泳图(m:marker;1:载体经双酶切)。
图5zjut-ho1菌株诱导表达ho-1的sds-page电泳图(m:marker;1:bl21(de3)/pet-28a;2:bl21(de3)/pet-28a-ho1)。
图6氯化血红素的质量浓度-a610标准曲线。
图7zjut-ho1菌株在优选条件下表达ho-1的sds-page电泳图(m:marker;1:阴性对照;2:细胞裂解液;3:经ni-nta柱分离的ho-1)。
图8zjut-ho1菌株生物转化氯化血红素为胆绿素的hplc分析图谱。
图9制备的胆绿素样品紫外吸收光谱图。
图10制备的胆绿素的ls-ms分析图谱。
(五)具体实施方式
下面结合具体实施例对本发明进行进一步描述,但本发明的保护范围并不仅限于此。
下列实施例中,如未说明具体的实验方法,均按照常规分子生物学实验方法操作,如f.m.奥斯伯主编《精编分子生物学实验指南》(马学军译,第五版,科学出版社,2008)中所述的方法,或按照试剂盒生产商建议方法操作。
实施例1表达ho-1的基因重组大肠杆菌构建
本发明所述的表达ho-1的重组大肠杆菌zjut-ho1菌株,按以下步骤构建:
(1)用“trizoluniver总rna提取试剂”,提取集胞藻pcc6803的总rna后,用“amv第一链cdna合成试剂盒”,rt-pcr法合成第一链cdna。
(2)以步骤(1)获得的cdna为模板,设计引物p1和p2,引入限制性内切酶ndeⅰ和xhoⅰ酶切位点,pcr扩增ho-1的基因(ho1)序列,pcr产物经“sanprep柱式pcr产物纯化试剂盒”纯化,获得目的基因ho1序列,所述的基因ho1的核苷酸序列见seqidno:1。
所述的引物p1和p2分别为:
p1:5′-gggaattccatatgagtgtcaacttagc-3′
p2:5′-ccgctcgagctagccttcggag-3′。
所述的pcr扩增目的基因ho1的体系见表1。
表1扩增ho1基因的pcr体系
所述的prc扩增反应过程为:94℃预变性4min,94℃变性30s,60℃退火1min,72℃延伸1min,共30个循环后,72℃延伸10min。
pcr扩增产物经电泳检测(图2),在750bp左右可以观察到单一的条带,与目的片段(723bp)大小一致。
(2)因primestarmaxdna聚合酶扩增出的pcr产物为平末端,用“平端dna片段添da试剂盒”为pcr产物3′端加碱基a后,连接pucm-t载体,转化大肠杆菌dh5α菌株,提取阳性克隆的质粒,经ndei和xhoi双酶切鉴定,电泳图见图3,可以观察到在750bp处切下了条带单一明显的片段,经测序验证,成功构建了克隆载体pucm-t-ho1。
(3)pucm-t-ho1与pet-28a质粒分别经ndei和xhoi双酶切后,目的基因ho1和开环pet-28a经t4dna连接酶连接,转化大肠杆菌bl21(de3)菌株,提取阳性克隆的质粒,电泳图见图4,可以观察到在750bp处切下了条带单一明显的片段,经测序验证,成功构建表达载体pet-28a-ho1,获得重组大肠杆菌bl21(de3)菌株(表示为bl21(de3)/pet-28a-ho1)。
(4)重组大肠杆菌bl21(de3)/pet-28a-ho1菌株,用lb培养基37℃培养2h(od600为0.767),加入终浓度为0.5mmol/l的iptg,30℃诱导培养20h,收集菌体,经sds-page蛋白电泳分析(图5),重组菌表达了分子量为29kd的蛋白,与ho-1分子量大小一致。经分离纯化获得ho-1,酶活测定表明其具有转化血红素为胆绿素活力,比活力为2.68×104u/mg蛋白,说明表达ho-1的基因重组大肠杆菌构建成功。
表达ho-1的基因重组大肠杆菌编号为zjut-ho1,保藏于广东省微生物菌种保藏中心,保藏编号:gdmccno:60372,保藏日期2018年5月18日,地址:广州市先烈中路100号大院59号楼5楼,邮编:510075。
所述的trizoluniver总rna提取试剂、amv第一链cdna合成试剂盒、t载体pcr产物克隆试剂盒、平端dna片段添da试剂盒、限制性内切酶ndeⅰ和xhoⅰ、t4dna连接酶、质粒载体pucm-t和pet-28a、大肠杆菌dh5α菌株和bl21(de3)菌株、primestarmaxdna聚合酶、sanprep柱式pcr产物纯化试剂盒、dna凝胶回收试剂盒、质粒小量制备试剂盒等,均购自生工生物工程(上海)股份有限公司。
所述的ho-1分离方法,按以下步骤操作:
(1)重组大肠杆菌bl21(de3)/pet-28a-ho1的培养液,于4℃、8000g离心10min,弃上清,用pbs缓冲液(20mmol/l)悬浮菌体,再次离心收集菌体,重复2次。
(2)每100ml培养液的菌体用5ml结合缓冲液(20mmol/lpbs缓冲液,ph8.0,添加500mmol/lnacl和10mmol/l咪唑),冰浴条件下超声破碎细胞(工作2s,间隔3s,共进行200次,功率200w)。细胞破碎后4℃、10000g离心5min,上清经millex-hv0.45μm微孔滤膜过滤后,收集滤液,作细胞裂解液。
(3)ni-nta柱(1cm×5cm)经蒸馏水冲洗后,用平衡缓冲液(20mmol/lpbs缓冲液,ph8.0,添加500mmol/lnacl)平衡30min,确定流出液a280为0开始上样(步骤(2)滤液),流速为1ml/min。
(4)上样结束后,用洗脱缓冲液(20mmol/lpbs缓冲液,ph6.5,添加500mmol/lnacl和200mmol/l的咪唑)洗脱,收集流出峰,在ph6.5的pbs缓冲液(20mmol/l)中透析除去咪唑(透析袋截留分子量3.5kda),即得纯化的ho-1酶液。
所述的ho-1酶活测定方法为:在ep管中加入2g/l氯化血红素水溶液120μl,加入浓度为1g/lnadph水溶液200μl和大肠杆菌bl21(de3)细胞裂解液300μl(按照步骤(2)方法收集的大肠杆菌bl21(de3)滤液),加入经纯化的ho-1酶液1ml,补ph8.0的pbs缓冲液(20mmol/l)至3ml,轻轻混匀,以不加氯化血红素溶液的相同处理为参比,测定a610(a1)。ep管37℃避光水浴15min后,立刻测定a610(a2),a=a1-a2,依据氯化血红素质量浓度-a610的标准曲线,由a值计算被转化的氯化血红素质量,依据ho-1活力定义计算其酶活。所述的氯化血红素质量浓度-a610标准曲线以氯化血红素水溶液浓度为横坐标,以a610为纵坐标制成,见图6。
ho-1的活力定义:在上述条件下,以1min转化1μmol氯化血红素所需的酶量(ml)为一个活力单位(u)。
实施例2:重组大肠杆菌zjut-ho1菌株表达ho-1的优选条件
在实施例1获得能表达ho-1大肠杆菌zjut-ho1菌株的基础上,对该菌株表达ho-1的培养条件进行了优化,包括培养基的种类、诱导剂添加的时间、诱导培养的时间、诱导剂添加的浓度、诱导培养的温度。经过优化,ho-1的表达量显著提高,优选的zjut-ho1菌株表达ho-1工艺步骤如下:
(1)冷冻干燥或甘油冷冻保藏的zjut-ho1菌种,接种于含50μg/ml卡那霉素的lb斜面培养基,于37℃恒温培养24h,获得斜面菌体;所述的lb斜面培养基终浓度组成为:酵母浸出粉5g/l,蛋白胨10g/l,nacl10g/l,琼脂20g/l,溶剂为去离子水,ph7.4,121℃灭菌15min。
(2)挑取zjut-ho1菌株斜面培养的菌体2环,接种到含50μg/ml卡那霉素的lb液体培养基,于30℃、180r/min的恒温振荡摇床培养12h,获得种子液。所述的lb培养基终浓度组成为:酵母浸出粉5g/l,蛋白胨10g/l,nacl10g/l,溶剂为去离子水,ph7.4,250ml三角烧瓶装50ml培养基,八层纱布扎口,121℃灭菌20min。
(3)按体积分数3%的接种量,将步骤(2)种子液接种至含50μg/ml卡那霉素甘油(gy)培养基,37℃、180r/min培养时间2h,菌浓od600=0.8±0.3时,加入终浓度为0.5mmol/l的iptg,于30℃、100r/min继续培养6h,至od600=1.40~1.65,获得含重组大肠杆菌zjut-ho1湿菌体的培养液(即zjut-ho1培养液)。所述的gy培养基组成为:甘油20g/l,酵母浸出粉20g/l,nh4so45g/l,nacl5g/l,na2hpo415g/l,kh2po43g/l,mgso40.5g/l,溶剂为去离子水,ph自然(实测7.2),250ml三角烧瓶装100ml培养基,八层纱布扎口,121℃灭菌20min。
按实施例1中所述的方法,采用ni-nta柱分离纯化重组大肠杆菌zjut-ho1表达的ho-1,培养液的ho-1活力为65.0u/ml。蛋白收率占细胞总蛋白的10.9%,表明zjut-ho1菌株,在上述优选的培养条件下,能高效地表达ho-1,sds-page分析图见图7。
实施例3大肠杆菌zjut-ho1应用于生物转化血红素制备胆绿素
在实施例2的基础,培养表达ho-1的zjut-ho1菌体,用于生物转化血红素制备胆绿素,具体步骤如下:
(1)按实施例2方法,经ho-1表达培养的zjut-ho1培养液(od600=1.40~1.65)中,加入2g/l的氯化血红素水溶液使氯化血红素终浓度为200mg/l,继续于37℃、180r/min恒温振荡摇床中培养5h。氯化血红素水溶液的配制方法为:100mg氯化血红素微热溶解50ml质量浓度0.25%na2co3水溶液,即得2g/l的氯化血红素水溶液。
(2)步骤(1)的反应体系经1000g离心10min,收集菌体,此时菌体呈深绿色。菌体用等同反应体系体积的酸性甲醇悬浮,于40℃、100khz、200w条件下超声30min,再1000g离心5min,收集上清液。
(3)上清液于45℃下减压蒸干,加入原反应体系1/4~1/5体积的酸性甲醇溶解残留物;酸性甲醇溶液经滤纸过滤后,再于45℃下减压干燥,即得胆绿素。
所述的酸性甲醇是在95%甲醇中,加入1/1000体积比的质量浓度36%浓盐酸。
按上述方法,zjut-ho1菌株生物转化血红素为胆绿素,单位反应液获得胆绿素的得率为61.7mg/l,氯化血红素的摩尔转化率为34.5%。
制备的胆绿素样品hplc分析图谱见图8,紫外吸收光谱图见图9,lc-ms分析图谱见图10。
序列表
<110>浙江工业大学
<120>重组大肠杆菌zjut-ho1及其在制备胆绿素中的应用
<160>1
<170>siposequencelisting1.0
<210>1
<211>723
<212>dna
<213>集胞藻(synechocystissp.)
<400>1
atgagtgtcaacttagcttcccagttgcgggaagggacgaaaaaatcccactccatggcg60
gagaacgtcggctttgtcaaatgcttcctcaagggcgttgtcgagaaaaattcctaccgt120
aagctggttggcaatctctactttgtctacagtgccatggaagaggaaatggcaaaattt180
aaggaccatcccatcctcagccacatttacttccccgaactcaaccgcaaacaaagccta240
gagcaagacctgcaattctattacggctccaactggcggcaagaagtgaaaatttctgcc300
gctggccaagcctatgtggaccgagtccggcaagtggccgctacggcccctgaattgttg360
gtggcccattcctacacccgttacctgggggatctttccggcggtcaaattctcaagaaa420
attgcccaaaatgccatgaatctccacgatggtggcacagctttctatgaatttgccgac480
attgatgacgaaaaggcttttaaaaatacctaccgtcaagctatgaatgatctgcccatt540
gaccaagccaccgccgaacggattgtggatgaagccaatgacgcctttgccatgaacatg600
aaaatgttcaacgaacttgaaggcaacctgatcaaggcgatcggcattatggtgttcaac660
agcctcacccgtcgccgcagtcaaggcagcaccgaagttggcctcgccacctccgaaggc720
tag723
- 还没有人留言评论。精彩留言会获得点赞!