高灵敏度DNA甲基化分析方法与流程
相关申请的交叉引用
本申请要求2017年3月8日提交的美国临时专利申请第62/468,907号的优先权,其整体内容通过引用并入此文。
发明背景
本发明是在由美国国立卫生研究院授予的批准号ar048177下利用政府支持完成的。政府拥有本发明的一定权利。
1.技术领域
本发明一般涉及分子生物学。更具体地,在一些实施方案中,本发明涉及用于定量或单碱基分辨率分析有限生物样品中的dna甲基化(5-甲基胞嘧啶,5mc)的组合物和方法,所述有限生物样品包括来自低细胞数细胞或单细胞的dna和来自血液或其他体液样品的无细胞dna(cfdna),所述方法在全基因组扩增过程中或在通过定量pcr或高通量测序检测之前扩增特定dna片段或基因座的过程中使用与链置换dna聚合酶偶联的dnmt1,以保存5mc信息。
2.
背景技术:
胞嘧啶-鸟嘌呤(cpg)二核苷酸中胞嘧啶碱基的基因组甲基化是涉及细胞类型特异性转录模式调节的关键表观遗传机制。因此,以单碱基分辨率绘制dna甲基化组的图谱为表观遗传调控在发育和疾病中的参与提供了许多有力的见解。由于给定群体内细胞的甲基化谱之间通常具有显著的差异程度,来自大量组织样品的信息可能无法解释由细胞间变异引起的表观基因组的组织异质性;因此,大量数据可能掩盖单个细胞对生化过程的不同贡献。因此,以高准确度和cpg覆盖率进行单细胞全甲基化组分析的能力将能够对大量样品进行反卷积,以更深入地研究dna甲基化发挥作用的各种生物活性,包括但不限于早期胚胎发育和细胞分化、诱导多能干细胞的产生、癌症进展和转移、免疫宿主防御反应和神经元可塑性。
另一方面,源自癌症患者肿瘤的血浆中的循环cfdna的发现为基于血液的非侵入性癌症检测测试开辟了新的途径。然而,由于从血浆中提取的cfdna的经降解的小尺寸和低浓度,cfdna中的5mc模式的表征在技术上的要求一直很苛刻。因此,可测量有限细胞数或甚至单细胞水平的甲基化组测定方法另外可用于表征小的或少量细胞群和dna的微小样品例如皮克水平量的cfdna以及来自活组织检查或患者样品的基因组dna。目前的方法提供了从基因组dna或cfdna如实地扩增甲基化组的方法。
目前用于绘制基因组甲基化图谱的最广泛使用的技术是全基因组亚硫酸氢盐测序,其提供胞嘧啶甲基化的单碱基分辨率,同时覆盖范围广泛,涵盖人类基因组中近2900万个cpg位点的90%以上。然而,虽然常规的亚硫酸氢盐处理程序能够实现有效的甲基化图谱绘制,但它们同时引发了目标样品的广泛降解,因此需要微克量的输入dna。因此,标准的全基因组亚硫酸氢盐测序很难扩展到少量细胞的水平或用于单细胞分析。例如,lorthongpanich等人(2013)完全避免了亚硫酸氢盐处理,而是将甲基化特异性限制酶与定量pcr结合。虽然该技术能够测量单个细胞中的dna甲基化,但其适用性仅限于几十种候选cpg。guo等人(2013)在单个细胞中证明了一种结合亚硫酸氢盐测序法和限制酶处理的更有效的方法,称为还原型亚硫酸氢盐测序(rrbs)。尽管这样的工作流程更有前景,但仅证明了有限的50到100万个cpg位点的覆盖率。最近,smallwood等人(2014)将单细胞分析改编为一种改良亚硫酸氢盐测序方案,其采用后亚硫酸氢盐衔接子标记,通过预扩增步骤延伸,最终实现每个细胞约20%的cpg覆盖率。虽然用报道的方法获得的cpg覆盖率可以提高到48.4%,但这需要使用导致高pcr重复率的深度测序,并组合从两个不同细胞的基因组dna获得的序列数据。此外,文献中尚未建立用于对无细胞dna的皮克级样品进行彻底和简便的全基因组甲基化分析的可靠方案。因此,在扩增基因组dna或cfdna的同时使它们保持甲基化状态的能力对于进行涉及单个细胞或微量起始dna量的表观基因组学研究是至关重要的。
技术实现要素:
提供了专门设计用于通过利用扩增步骤来扩大dna样品的有限扩增来解决低原料量的问题的试剂盒、组合物和方法,其中保留5mc信息是关键方面。如实施例中所示,在一些实施方案中,使用dna甲基转移酶以及链置换dna聚合酶以实现扩增的半甲基化产物的同时dna扩增和甲基化,从而产生完全甲基化的产物。
此外,本文显示了这些实施方案针对有限量的不同生物样品的广泛和各种适用性,这些生物样品包括少量纯化的人类基因组dna、来自少量或单个人类细胞的dna、和从人类血液或其他体液中纯化的无细胞dna。根据用于初始处理的各个方案和针对这些不同样品而调整的条件进行开发。
在其他实施方案中,提供:扩增目标dna分子同时保留5mc信息的方法,该方法包括:使目标dna分子变性以除去二级结构的步骤、与产生产物时通过dna甲基转移酶向半甲基化产物中加入5mc的过程相偶联的全基因组扩增步骤、纯化产物以提取扩增的具有从原料中如实地复制的5mc信息的dna的步骤。
其他实施方案包括如前一段所述扩增5mcdna,然后对产物dna进行超声处理,并使用5mc抗体或甲基-cpg结合蛋白来富集dna片段,例如使用来自thermofisher的methylminertm甲基化dna富集试剂盒,并通过下游qpcr或高通量测序来分析的方法。
在另一个实施方案中,存在如段落[0009]中所述的扩增5mcdna,然后进行亚硫酸氢盐处理和随后的纯化,例如使用来自zymo的ezdnamethylation-directtm试剂盒,并使用基因特异性引物通过pcr和sanger测序进行分析以研究单个基因的甲基化状态,或进行亚硫酸氢盐文库构建和高通量测序,例如使用来自illumina的truseqdna甲基化试剂盒的方法。
在另一个实施方案中,存在如段落[0009]中所述的扩增5mcdna,在此之前进行从含有细胞群的样品中提取单细胞或少量细胞的步骤,以及破碎细胞膜以暴露dna内容物用于直接下游扩增的细胞裂解步骤的方法。
在另一个实施方案中,存在如段落[0009]中所述的扩增5mcdna,在此之前进行从人血液或其他体液样品中提取cfdna的步骤,在扩增步骤之前定量和计算精确的酶比例和用量的方法。
在另一个实施方案中,存在如段落[0009]中所述的扩增5mcdna,在扩增步骤期间还向其中掺入引发酶的方法。引发酶具有合成dna引物的强效活性。引发酶的一个实例是嗜热栖热菌(thermusthermophilus)(tth)primpol。在实施方案中,引发酶降低了在引发步骤期间可能引入的偏差并且使得能够接近完全的全基因组扩增。
此外,除了全基因组扩增之外,还有一些方法应用5mc保留系统以用相应的引物扩增特定基因座,并获得特定片段的甲基化信息。这对于扩增具有大量甲基化的特定基因座尤其重要。在一些实施方案中,可以用简单的检测方法例如elisa检测扩增产物与对照。应用包括新生儿筛查或涉及一些疾病中基因座特异性甲基化的其他筛查。
在另一个实施方案中,存在一种扩增5mcdna的方法,其类似于段落[0009]中所述,添加针对特定目标区域的相应引物,在此之前进行从人组织、血液或其他体液样品中提取基因组dna的步骤,然后进行甲基化水平的纯化和定量,例如使用酶联免疫吸附测定(elisa)。
存在涉及物理加工或操纵甲基化dna以便评估或分析特定区域或在全基因组水平上物理加工或操纵甲基化dna的方法。在一些实施方案中,方法可以涉及1个、2个、3个、4个、5个、6个、7个、8个、9个、10个、11个、12个或多于12个以下步骤(或其中可衍生的任何范围),可以涉及至少1个、2个、3个、4个、5个、6个、7个、8个、9个、10个、11个、12个或多于12个以下步骤(或其中可衍生的任何范围),或可以涉及至多1个、2个、3个、4个、5个、6个、7个、8个、9个、10个、11个、12个或多于12个以下步骤(或其中可衍生的任何范围):获得生物样品,从生物样品中分离dna,处理生物样品以从样品中获得dna;使dna变性;使dna暴露在碱性条件下;将dna与其他核酸分离;将甲基化dna与未甲基化的dna分离,将基因组dna与非基因组dna分离,富集或汇集甲基化dna或核酸;分离甲基化dna,纯化甲基化dna;丢弃或不使用除基因组dna以外的非甲基化dna或核酸;将甲基化dna与一种或多于一种核酸探针或引物一起孵育;将甲基化dna与聚合酶一起孵育;将甲基化dna与链置换聚合酶一起孵育;选择甲基化dna;选择甲基化dna并将所选择的甲基化dna与链置换聚合酶一起孵育;在允许聚合的条件下将甲基化dna与聚合酶一起孵育;将甲基化dna与甲基转移酶一起孵育;在允许dna,特别是复制的未甲基化或半甲基化dna甲基化的条件下将甲基化dna与甲基转移酶一起孵育;产生或复制甲基化dna分子;分离或纯化所产生或复制的甲基化dna分子;合并所产生或复制的甲基化dna分子,定量甲基化dna或dna的甲基化;比较甲基化dna或dna的甲基化;定量甲基化dna或dna的甲基化;和/或,测量dna的甲基化或鉴定甲基化的核苷酸或区域。特别考虑的是,可以排除这些步骤中的一个或多于一个作为实施方案的一部分。
在其他实施方案中,可以使用以下步骤中的1个、2个、3个、4个、5个、6个、7个、8个或多于8个来随后处理或操作扩增的或富集的或产生的甲基化dna:变性、杂交、片段化、切割、测序、克隆、插入质粒或其他载体中、连接、固定、附着或缀合。可以涉及接头、引物和探针,但方法不限于此。特别考虑的是,可以排除这些步骤中的一个或多于一个作为实施方案的一部分。
在一些实施方案中,甲基化dna暴露于以下试剂中的一种或多于一种或与以下试剂中的一种或多于一种一起孵育:聚合酶,链置换聚合酶,phi29,phi29类似物或同源物,甲基转移酶,dnmt1或相关家族成员、类似物或同源物,dntp,s-腺苷甲硫氨酸(sam),连接酶,核酸引物或引物组,核酸探针,核酸缓冲液,聚合酶缓冲液,甲基转移酶缓冲液,限制酶,甲基化特异性限制酶或限制酶缓冲液。特别考虑的是,可以排除这些试剂中的一种或多于一种作为实施方案的一部分。
在一些实施方案中,存在扩增目标甲基化基因组dna的方法,其包括:a)使目标甲基化基因组dna变性;b)在用于复制目标甲基化基因组dna并产生扩增的基因组甲基化dna分子的条件下,将目标甲基化基因组dna与聚合酶和甲基转移酶一起孵育;和c)分离扩增的基因组甲基化dna分子。预期甲基化dna可以扩增或富集1倍、2倍、3倍、4倍、5倍、6倍、7倍、8倍、9倍、10倍、11倍、12倍、13倍、14倍、15倍、16倍、17倍、18倍、19倍、20倍、21倍、22倍、23倍、24倍、25倍、26倍、27倍、28倍、29倍、30倍、31倍、32倍、33倍、34倍、35倍、36倍、37倍、38倍、39倍、40倍、41倍、42倍、43倍、44倍、45倍、46倍、47倍、48倍、49倍、50倍、51倍、52倍、53倍、54倍、55倍、56倍、57倍、58倍、59倍、60倍、61倍、62倍、63倍、64倍、65倍、66倍、67倍、68倍、69倍、70倍、71倍、72倍、73倍、74倍、75倍、76倍、77倍、78倍、79倍、80倍、81倍、82倍、83倍、84倍、85倍、86倍、87倍、88倍、89倍、90倍、91倍、92倍、93倍、94倍、95倍、96倍、97倍、98倍、99倍、100倍、110倍、120倍、130倍、140倍、150倍、160倍、170倍、180倍、190倍、200倍、210倍、220倍、230倍、240倍、250倍、260倍、270倍、280倍、290倍、300倍、310倍、320倍、330倍、340倍、350倍、360倍、370倍、380倍、390倍、400倍、410倍、420倍、430倍、440倍、441倍、450倍、460倍、470倍、480倍、490倍、500倍、510倍、520倍、530倍、540倍、550倍、560倍、570倍、580倍、590倍、600倍、610倍、620倍、630倍、640倍、650倍、660倍、670倍、680倍、690倍、700倍、710倍、720倍、730倍、740倍、750倍、760倍、770倍、780倍、790倍、800倍、810倍、820倍、830倍、840倍、850倍、860倍、870倍、880倍、890倍、900倍、910倍、920倍、930倍、940倍、950倍、960倍、970倍、980倍、990倍、1000倍、1100倍、1200倍、1300倍、1400倍、1500倍、1600倍、1700倍、1800倍、1900倍、2000倍、2100倍、2200倍、2300倍、2400倍、2500倍、2600倍、2700倍、2800倍、2900倍、3000倍、3100倍、3200倍、3300倍、3400倍、3500倍、3600倍、3700倍、3800倍、3900倍、4000倍、4100倍、4200倍、4300倍、4400倍、4500倍、4600倍、4700倍、4800倍、4900倍、5000倍、6000倍、7000倍、8000倍、9000倍、10000倍(或其中可导出的任何范围)。就分子数量或重量而言,最终的dna产物可能更多。预期最终产物的量可以是1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、21、22、23、24、25、26、27、28、29、30、31、32、33、34、35、36、37、38、39、40、41、42、43、44、45、46、47、48、49、50、51、52、53、54、55、56、57、58、59、60、61、62、63、64、65、66、67、68、69、70、71、72、73、74、75、76、77、78、79、80、81、82、83、84、85、86、87、88、89、90、91、92、93、94、95、96、97、98、99、100、110、120、130、140、150、160、170、180、190、200、210、220、230、240、250、260、270、280、290、300、310、320、330、340、350、360、370、380、390、400、410、420、430、440、441、450、460、470、480、490、500、510、520、530、540、550、560、570、580、590、600、610、620、630、640、650、660、670、680、690、700、710、720、730、740、750、760、770、780、790、800、810、820、830、840、850、860、870、880、890、900、910、920、930、940、950、960、970、980、990、1000、1100、1200、1300、1400、1500、1600、1700、1800、1900、2000、2100、2200、2300、2400、2500、2600、2700、2800、2900、3000、3100、3200、3300、3400、3500、3600、3700、3800、3900、4000、4100、4200、4300、4400、4500、4600、4700、4800、4900、5000、6000、7000、8000、9000、10000μg或mg或μm或mm。
在另一个实施方案中,存在富集甲基化基因组dna的方法,其包括:a)使甲基化基因组dna变性;b)在复制甲基化基因组dna并产生扩增的基因组甲基化dna分子的条件下,将甲基化基因组dna与聚合酶和甲基转移酶一起孵育;和c)使用特异性结合甲基化dna的抗体或结合蛋白来富集扩增的基因组甲基化dna分子。
在另一个实施方案中,存在分析目标甲基化基因组序列的方法,其包括:a)使包含目标序列的甲基化基因组dna变性;b)在复制目标甲基化基因组序列的条件下,将目标甲基化基因组dna与聚合酶和甲基转移酶一起孵育;c)扩增和/或测序目标甲基化基因组序列。
其他实施方案包括用于分析来自患者的生物样品中的至少一种细胞的甲基化基因组dna的方法,其包括:a)从至少一种细胞中提取甲基化基因组dna并使其变性;b)在用于复制提取的甲基化基因组dna并产生扩增的基因组甲基化dna分子的条件下,将提取的甲基化基因组dna与聚合酶和甲基转移酶一起孵育,其中聚合酶和甲基转移酶以约1单位:5单位至约1单位:20单位的比例存在;和,c)分离扩增的基因组甲基化dna分子。
在另一个实施方案中,存在用于分析来自患者的无细胞生物样品的甲基化无细胞dna的方法,其包括:a)使来自无细胞生物样品的甲基化无细胞dna(cfdna)变性;b)在用于复制甲基化的cfdna并产生扩增的基因组甲基化dna分子的条件下,将甲基化cfdna与聚合酶和甲基转移酶一起孵育,其中聚合酶和甲基转移酶以约1单位:5单位至约1单位:20单位的比例存在;和c)分离扩增的基因组甲基化dna分子。
在其他实施方案中,将扩增的甲基化dna掺入文库的载体中或应用于阵列或微阵列以进一步筛选或分析。预期扩增的甲基化dna可以固定在阵列或其他物理支持物上。或者,可将材料施加到孔中并用于包括测序在内的一个或多于一个后续反应。亚硫酸氢盐测序是特定的实施方案。
另一个实施方案包括扩增有限量的目标甲基化基因组dna的方法,其包括:a)使小于约1000皮克的目标甲基化基因组dna变性;b)在用于复制目标甲基化基因组dna并产生扩增的基因组甲基化dna分子的条件下,将目标甲基化基因组dna与聚合酶和甲基转移酶一起孵育,其中聚合酶和甲基转移酶以约1单位:5单位至约1单位:20单位的比例存在;和c)分离扩增的基因组甲基化dna分子。
在一些实施方案中,存在扩增甲基化基因组dna的方法,其包括:a)使甲基化基因组dna变性;b)在用于产生扩增的且甲基化的滚环产物的条件下,通过将变性的甲基化基因组dna与聚合酶、甲基转移酶以及探针一起孵育来进行滚环扩增;和,c)检测扩增的且甲基化的滚环产物的甲基化。特别预期探针是可环化的探针或锁式探针或龟式探针(turtleprobe)。
所包含或添加的酶的量可以是至少或至多约0.01、0.02、0.03、0.04、0.05、0.06、0.07、0.08、0.09、0.1、0.2、0.3、0.4、0.5、0.6、0.7、0.8、0.9、1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、21、22、23、24、25、26、27、28、29、30、31、32、33、34、35、36、37、38、39、40、41、42、43、44、45、46、47、48、49、50、51、52、53、54、55、56、57、58、59、60、61、62、63、64、65、66、67、68、69、70、71、72、73、74、75、76、77、78、79、80、81、82、83、84、85、86、87、88、89、90、91、92、93、94、95、96、97、98、99、或100单位(u)或微摩尔(或其中可衍生的任何范围)。适用但不限于聚合酶和甲基转移酶。可以加入或处于反应中的酶体积为至少或至多约1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、21、22、23、24、25、26、27、28、29、30、31、32、33、34、35、36、37、38、39、40、41、42、43、44、45、46、47、48、49、50、51、52、53、54、55、56、57、58、59、60、61、62、63、64、65、66、67、68、69、70、71、72、73、74、75、76、77、78、79、80、81、82、83、84、85、86、87、88、89、90、91、92、93、94、95、96、97、98、99、100、110、120、130、140、150、160、170、180、190、200、210、220、230、240、250、260、270、280、290、300、310、320、330、340、350、360、370、380、390、400、410、420、430、440、441、450、460、470、480、490、500、510、520、530、540、550、560、570、580、590、600、610、620、630、640、650、660、670、680、690、700、710、720、730、740、750、760、770、780、790、800、810、820、830、840、850、860、870、880、890、900、910、920、930、940、950、960、970、980、990、或1000微升、毫升、厘升或升(或其中可导出的任何范围)。
在一些实施方案中,聚合酶单位(u)与甲基转移酶单位(u)的比例为约1:5至约1:20。聚合酶与甲基转移酶的单位比例可以为约,至少约,或至多约1:50、1:45、1:40、1:35、1:30、1:25、1:24、1:23、1:22、1:21、1:20、1:19、1:18、1:17、1:16、1:15、1:14、1:13、1:12、1:11、1:10、1:9、1:8、1:7、1:6、1:5、1:4、1:3、1:2、1:1、2:1、3:1、4:1、5:1、6:1、7:1、8:1、9:1、10:1、11:1、12:1、13:1、14:1、15:1、16:1、17:1、18:1、19:1、20:1、21:1、22:1、23:1、24:1、25:1或更大、或其中可衍生的任何范围。在一些实施方案中,添加的聚合酶:甲基转移酶的单位比例为约1:15。该比例还可以应用于摩尔数(皮摩尔、纳摩尔或微摩尔)或重量(皮克、纳克或微克)。预期该比例暂时指的是当一种或两种酶首先与底物在活性条件下接触时的比例。另外,可以在稍后的时间点及时添加酶以增加或维持酶的比例。在一些实施方案中,可以添加额外的酶,其为先前添加的量或相对于先前添加或当时添加的另一种酶的量的约、至少约或至多约0.01倍、0.02倍、0.03倍、0.04倍、0.05倍、0.06倍、0.07倍、0.08倍、0.09倍、0.1倍、0.2倍、0.3倍、0.4倍、0.5倍、0.6倍、0.7倍、0.8倍、0.9倍、1.0倍、1.1倍、1.2倍、1.3倍、1.4倍、1.5倍、1.6倍、1.7倍、1.8倍、1.9倍、2.0倍、2.1倍、2.2倍、2.3倍、2.4倍、2.5倍、2.6倍、2.7倍、2.8倍、2.9倍、3.0倍、3.1倍、3.2倍、3.3倍、3.4倍、3.5倍、3.6倍、3.7倍、3.8倍、3.9倍、4.0倍、4.1倍、4.2倍、4.3倍、4.4倍、4.5倍、4.6倍、4.7倍、4.8倍、4.9倍、5.0倍、5.1倍、5.2倍、5.3倍、5.4倍、5.5倍、5.6倍、5.7倍、5.8倍、5.9倍、6.0倍、6.1倍、6.2倍、6.3倍、6.4倍、6.5倍、6.6倍、6.7倍、6.8倍、6.9倍、7.0倍、7.1倍、7.2倍、7.3倍、7.4倍、7.5倍、7.6倍、7.7倍、7.8倍、7.9倍、8.0倍、8.1倍、8.2倍、8.3倍、8.4倍、8.5倍、8.6倍、8.7倍、8.8倍、8.9倍、9.0倍、9.1倍、9.2倍、9.3倍、9.4倍、9.5倍、9.6倍、9.7倍、9.8倍、9.9倍、10.0倍、11倍、12倍、13,倍、14倍、15倍、16倍、17倍、18倍、19倍、20倍、21倍、22倍、23倍、24倍、或25倍。预期可以在10分钟、20分钟、30分钟、40分钟、50分钟、60分钟,或1小时、2小时、3小时、4小时、5小时、6小时、7小时、8小时、9小时、10小时、11小时、12小时、13小时、14小时、15小时、16小时、17小时、18小时、19小时、20小时、21小时、22小时、23小时、24小时或24小时或多于24小时(或其中可衍生的任何范围)之内或之后向反应混合物中添加额外的酶。后续添加的量包括本文描述的任何量。在暂停或停止反应之前,可以添加额外的酶1次、2次、3次、4次、5次、6次、7次、8次、9次、10次或多于10次(或其中可衍生的任何范围)。
在一些实施方案中,与聚合酶和甲基转移酶一起孵育的基因组甲基化dna的量为约5皮克(pg)至约1微克(μg)。在具体的实施方案中,酶反应开始时基因组甲基化dna的量为约,至少约,或至多约1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、21、22、23、24、25、26、27、28、29、30、31、32、33、34、35、36、37、38、39、40、41、42、43、44、45、46、47、48、49、50、51、52、53、54、55、56、57、58、59、60、61、62、63、64、65、66、67、68、69、70、71、72、73、74、75、76、77、78、79、80、81、82、83、84、85、86、87、88、89、90、91、92、93、94、95、96、97、98、99、100、110、120、130、140、150、160、170、180、190、200、210、220、230、240、250、260、270、280、290、300、310、320、330、340、350、360、370、380、390、400、410、420、430、440、441、450、460、470、480、490、500、510、520、530、540、550、560、570、580、590、600、610、620、630、640、650、660、670、680、690、700、710、720、730、740、750、760、770、780、790、800、810、820、830、840、850、860、870、880、890、900、910、920、930、940、950、960、970、980、990、1000或多于1000皮克、纳克、微克或毫克(或其中可衍生的任何范围)。或者,反应混合物中基因组甲基化dna或总dna的量可表示为约,至少约或至多约0.01、0.02、0.03、0.04、0.05、0.06、0.07、0.08、0.09、0.1、0.2、0.3、0.4、0.5、0.6、0.7、0.8、0.9、1.0、1.1、1.2、1.3、1.4、1.5、1.6、1.7、1.8、1.9、2.0、2.1、2.2、2.3、2.4、2.5、2.6、2.7、2.8、2.9、3.0、3.1、3.2、3.3、3.4、3.5、3.6、3.7、3.8、3.9、4.0、4.1、4.2、4.3、4.4、4.5、4.6、4.7、4.8、4.9、5.0、5.1、5.2、5.3、5.4、5.5、5.6、5.7、5.8、5.9、6.0、6.1、6.2、6.3、6.4、6.5、6.6、6.7、6.8、6.9、7.0、7.1、7.2、7.3、7.4、7.5、7.6、7.7、7.8、7.9、8.0、8.1、8.2、8.3、8.4、8.5、8.6、8.7、8.8、8.9、9.0、9.1、9.2、9.3、9.4、9.5、9.6、9.7、9.8、9.9、10.0、10.5、11.0、11.5、12.0、12.5、13.0、13.5、14.0、14.5、15.0、15.5、16.0、16.5、17.0、17.5、18.0、18.5、19.0、19.5、20.0、1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、21、22、23、24、25、26、27、28、29、30、31、32、33、34、35、36、37、38、39、40、41、42、43、44、45、46、47、48、49、50、51、52、53、54、55、56、57、58、59、60、61、62、63、64、65、66、67、68、69、70、71、72、73、74、75、76、77、78、79、80、81、82、83、84、85、86、87、88、89、90、91、92、93、94、95、96、97、98、99、100、105、110、115、120、125、130、135、140、145、150、155、160、165、170、175、180、185、190、195、200、205、210、215、220、225、230、235、240、245、250、255、260、265、270、275、280、285、290、295、300、305、310、315、320、325、330、335、340、345、350、355、360、365、370、375、380、385、390、395、400、410、420、425、430、440、441、450、460、470、475、480、490、500μg/μl或pg/μl或其中可导出的任何范围的浓度。加入到反应中的体积量可以是约,至少约或至多约0.01、0.02、0.03、0.04、0.05、0.06、0.07、0.08、0.09、0.1、0.2、0.3、0.4、0.5、0.6、0.7、0.8、0.9、1.0、1.1、1.2、1.3、1.4、1.5、1.6、1.7、1.8、1.9、2.0、2.1、2.2、2.3、2.4、2.5、2.6、2.7、2.8、2.9、3.0、3.1、3.2、3.3、3.4、3.5、3.6、3.7、3.8、3.9、4.0、4.1、4.2、4.3、4.4、4.5、4.6、4.7、4.8、4.9、5.0、5.1、5.2、5.3、5.4、5.5、5.6、5.7、5.8、5.9、6.0、6.1、6.2、6.3、6.4、6.5、6.6、6.7、6.8、6.9、7.0、7.1、7.2、7.3、7.4、7.5、7.6、7.7、7.8、7.9、8.0、8.1、8.2、8.3、8.4、8.5、8.6、8.7、8.8、8.9、9.0、9.1、9.2、9.3、9.4、9.5、9.6、9.7、9.8、9.9、10.0、10.5、11.0、11.5、12.0、12.5、13.0、13.5、14.0、14.5、15.0、15.5、16.0、16.5、17.0、17.5、18.0、18.5、19.0、19.5、20.0、1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、21、22、23、24、25、26、27、28、29、30、31、32、33、34、35、36、37、38、39、40、41、42、43、44、45、46、47、48、49、50、51、52、53、54、55、56、57、58、59、60、61、62、63、64、65、66、67、68、69、70、71、72、73、74、75、76、77、78、79、80、81、82、83、84、85、86、87、88、89、90、91、92、93、94、95、96、97、98、99、100、105、110、115、120、125、130、135、140、145、150、155、160、165、170、175、180、185、190、195、200、205、210、215、220、225、230、235、240、245、250、255、260、265、270、275、280、285、290、295、300、305、310、315、320、325、330、335、340、345、350、355、360、365、370、375、380、385、390、395、400、410、420、425、430、440、441、450、460、470、475、480、490、500、510、520、525、530、540、550、560、570、575、580、590、600、610、620、625、630、640、650、660、670、675、680、690、700、710、720、725、730、740、750、760、770、775、780、790、800、810、820、825、830、840、850、860、870、875、880、890、900、910、920、925、930、940、950、960、970、975、980、990、或1000μl、ml或升或其中可衍生的任何范围。这些体积也适用于来自患者的体液样品的量,该样品可以包含无细胞dna。
在一些实施方案中,样品中细胞的数量可能非常有限。预期不超过1个、2个、3个、4个、5个、6个、7个、8个、9个、10个、11个、12个、13个、14个、15个、16个、17个、18个、19个、20个、21个、22个、23个、24个、25个、26个、27个、28个、29个、30个、31个、32个、33个、34个、35个、36个、37个、38个、39个、40个、41个、42个、43个、44个、45个、46个、47个、48个、49个、50个、51个、52个、53个、54个、55个、56个、57个、58个、59个、60个、61个、62个、63个、64个、65个、66个、67个、68个、69个、70个、71个、72个、73个、74个、75个、76个、77个、78个、79个、80个、81个、82个、83个、84个、85个、86个、87个、88个、89个、90个、91个、92个、93个、94个、95个、96个、97个、98个、99个、100个、110个、120个、130个、140个、150个、160个、170个、180个、190个、200个、210个、220个、230个、240个、250个、260个、270个、280个、290个、300个、310个、320个、330个、340个、350个、360个、370个、380个、390个、400个、410个、420个、430个、440个、441个、450个、460个、470个、480个、490个、500个、510个、520个、530个、540个、550个、560个、570个、580个、590个、600个、610个、620个、630个、640个、650个、660个、670个、680个、690个、700个、710个、720个、730个、740个、750个、760个、770个、780个、790个、800个、810个、820个、830个、840个、850个、860个、870个、880个、890个、900个、910个、920个、930个、940个、950个、960个、970个、980个、990个、或1000个细胞(或其中可衍生的任何范围)的基因组dna可以被扩增。
在其他实施方案中,方法涉及基因组甲基化dna,其获自组织样品、血清样品、血液样品、粪便样品、尿液样品、或面颊或口腔拭子。在其他实施方案中,基因组甲基化dna从新鲜制备的生物样品中获得,或者从可以以任何方便的方式例如通过固定或冷冻进行过预处理的生物样品中获得。在一些情况下,可以使用新鲜的、冷冻的或固定的细胞或组织,例如ffpe的组织(福尔马林固定石蜡包埋的)。因此,可以使用处理的或未处理的组织切片。替代地,可以使用组织的触摸印记样品,但也可以使用其他细胞学制剂,例如固定或生长在载玻片上的细胞或为流式细胞术准备的细胞。
在一些实施方案中,核酸是变性的。在一些情况下,变性涉及碱性变性。
方法和试剂盒可以涉及一种或多于一种聚合酶。在大多数实施方案中,聚合酶是链置换聚合酶。可将phi29和phi29变体用作链置换聚合酶。变体包括在美国专利公开20170015980中鉴定的变体,其通过引用并入本文。bst聚合酶是另一种使用的聚合酶。
方法和试剂盒的一些实施方案涉及甲基转移酶,其可以在半甲基化dna上安置5-甲基胞嘧啶(5mc)以达到完全甲基化状态。在一些实施方案中,甲基转移酶是dnmt1(dna(胞嘧啶-5)-甲基转移酶1),其可以是人dnmt1,或者其可以来自另外的哺乳动物来源,例如小鼠。另一个实施方案可以包括m.sssidnmt。美国专利申请公开20140363815提供了关于dnmt的附加信息,其通过引用具体地并入。
在一些方面,试剂盒包括含有引发酶和聚合酶功能的酶,以在dna扩增步骤中合成引物。这种酶的一个实例是来自嗜热栖热菌的双重引发酶/聚合酶(primpol)。其他酶如引发酶是本领域技术人员已知的。
在一些情况下,方法涉及在甲基化dna与酶处于聚合和使核酸甲基化的条件下之前,制备与包含聚合酶和甲基转移酶的酶混合物分离的主混合物。在其他实施方案中,将引发酶添加到主混合物中以在扩增步骤期间合成引物。试剂盒可包括与酶混合物分开的主混合物。在一些实施方案中,聚合酶与甲基转移酶一起孵育不超过1分钟、2分钟、3分钟、4分钟、5分钟、6分钟、7分钟、8分钟、9分钟、10分钟或多于10分钟(或其中可衍生的任何范围)。可维持或保持试剂、主混合物、一种或多于一种酶或酶混合物的温度包括-70、-20、0、1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、21、22、23、24、25、26、27、28、29、30、31、32、33、34、35、36、37、38、39、40、41、42、43、44、45、46、47、48、49、50、51、52、53、54、55、56、57、58、59、60、61、62、63、64、65、66、67、68、69、70、71、72、73、74、75、76、77、78、79、80、81、82、83、84、85、86、87、88、89、90、91、92、93、94、95、96、97、98、99、100摄氏度或华氏度,持续30秒、1分钟、2分钟、3分钟、4分钟、5分钟、10分钟、15分钟、20分钟、25分钟、30分钟、35分钟、40分钟、45分钟、50分钟、55分钟、1小时、2小时、3小时、4小时、5小时、6小时、7小时、8小时、9小时、10小时、11小时、12小时、13小时、14小时、15小时、16小时、17小时、18小时、19小时、20小时、21小时、22小时、23小时、24小时、1天、2天、3天4、5天、6天、7天或其中可衍生的任何范围。
在一些实施方案中,反应在、在至少或在至多15℃、16℃、17℃、18℃、19℃、20℃、21℃、22℃、23℃、24℃、25℃、26℃、27℃、28℃、29℃、30℃、31℃、32℃、33℃、34℃、35℃、或40℃或高于40℃的温度下进行,但特别预期温度可以为30℃至40℃,特别是约37℃。
在一些实施方案中,反应或酶混合物包含甲基辅因子。在一些情况下,甲基辅因子是s-腺苷甲硫氨酸(sam)。在另外的实施方案中,试剂盒和/或主混合物包含dntp、dna缓冲液和/或镁或镁盐。在其他实施方案中,在将主混合物与酶混合物混合之前,将基因组甲基化dna和随机引物加入到主混合物中。在试剂盒中,可以存在一种或多于一种探针、引物、引物组,其可以是随机引物。
在一些实施方案中,方法还可以包括在孵育开始超过3小时后添加更多的甲基辅因子。在一些实施方案中,最初添加或后续添加的甲基辅因子的量为约,至少约,或至多约1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、21、22、23、24、25、26、27、28、29、30、31、32、33、34、35、36、37、38、39、40、41、42、43、44、45、46、47、48、49、50、51、52、53、54、55、56、57、58、59、60、61、62、63、64、65、66、67、68、69、70、71、72、73、74、75、76、77、78、79、80、81、82、83、84、85、86、87、88、89、90、91、92、93、94、95、96、97、98、99、100、110、120、130、140、150、160、170、180、190、200微升或厘升,其中辅助因子浓度为约0.01、0.02、0.03、0.04、0.05、0.06、0.07、0.08、0.09、0.1、0.2、0.3、0.4、0.5、0.6、0.7、0.8、0.9、1.0、1.1、1.2、1.3、1.4、1.5、1.6、1.7、1.8、1.9、2.0、2.1、2.2、2.3、2.4、2.5、2.6、2.7、2.8、2.9、3.0、3.1、3.2、3.3、3.4、3.5、3.6、3.7、3.8、3.9、4.0、4.1、4.2、4.3、4.4、4.5、4.6、4.7、4.8、4.9、5.0、5.1、5.2、5.3、5.4、5.5、5.6、5.7、5.8、5.9、6.0、6.1、6.2、6.3、6.4、6.5、6.6、6.7、6.8、6.9、7.0、7.1、7.2、7.3、7.4、7.5、7.6、7.7、7.8、7.9、8.0、8.1、8.2、8.3、8.4、8.5、8.6、8.7、8.8、8.9、9.0、9.1、9.2、9.3、9.4、9.5、9.6、9.7、9.8、9.9、10.0、10.5、11.0、11.5、12.0、12.5、13.0、13.5、14.0、14.5、15.0、15.5、16.0、16.5、17.0、17.5、18.0、18.5、19.0、19.5、20.0、1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、21、22、23、24、25、26、27、28、29、30、31、32、33、34、35、36、37、38、39、40、41、42、43、44、45、46、47、48、49、50、51、52、53、54、55、56、57、58、59、60、61、62、63、64、65、66、67、68、69、70、71、72、73、74、75、76、77、78、79、80、81、82、83、84、85、86、87、88、89、90、91、92、93、94、95、96、97、98、99、100、105、110、115、120、125、130、135、140、145、150、155、160、165、170、175、180、185、190、195、200、205、210、215、220、225、230、235、240、245、250、255、260、265、270、275、280、285、290、295、300、305、310、315、320、325、330、335、340、345、350、355、360、365、370、375、380、385、390、395、400、410、420、425、430、440、441、450、460、470、475、480、490、500μm或mm或m(或其中可衍生的任何范围)。
在另外的实施方案中,方法还可以包括使聚合酶和/或甲基转移酶失活。
不限制甲基化dna的来源。在一些实施方案中,甲基化dna来自患者,该患者可以是人或另一种哺乳动物或动物。在一些情况下,生物样品可以来自人或其他哺乳动物或鸟类或鱼类或其他动物,但甲基化dna分子来自差异来源,例如微生物。在一些方法中,存在从患者获得包含基因组甲基化dna的生物样品的额外步骤。生物样品可以是组织样品、血液或血清样品、粪便样品、尿液样品或面颊或口腔拭子。
在一些实施方案中,方法包括用亚硫酸氢盐处理复制的甲基化dna分子。分子可以是,也可以不是分离的。在一些实施方案中,可以对甲基化dna产物进行测序。在其他情况下,方法可涉及检测或鉴定分离的复制的甲基化dna分子中的5-甲基胞嘧啶。
在一些情况下,方法涉及使扩增的基因组甲基化dna分子变性。在其他实施方案中,方法包括超声处理甲基化dna分子,其可以被扩增和/或纯化或分离。在另外的情况下,还存在富集基因组甲基化dna分子的步骤,其可以是扩增的分子库和/或可以是变性的。在一些情况下,富集变性的扩增的基因组甲基化dna分子涉及5mc抗体或甲基-cpg结合蛋白。
需要本文所公开的实施方案的原因之一是为了能够分析基因组甲基化dna。实施方案包括分析所富集的经变性和扩增的基因组甲基化dna分子。可以以多种方式分析或评估甲基化dna,包括但不限于根据美国专利申请公开20160115525、20140178881、20150056616、20150056616、20140004511所述的那些,其通过引用并入本文。另外地或替代地,可以使用其他可商购获得的甲基化定量或检测试剂盒/试剂,例如由thermofisher、enzolifesciences、epigentek提供的甲基化定量或检测试剂盒/试剂。可以使用abcam、sigman-aldrich、zymo(以及其他)或bioanalyxer(agilent)。分析富集的经变性和扩增的基因组甲基化dna分子包括但不限于这些程序或测定:定量pcr、测序或基于阵列的分析。其他实例包括使用qpcr、阵列、测序、甲基化敏感的限制酶消化、smrt、高通量测序或纳米孔。在一些实施方案中,检测富集的甲基化dna可以用qpcr、阵列、测序(亚硫酸氢盐后)或其他方法完成,包括但不限于甲基化敏感的限制酶消化(使用在特定的未甲基化的胞嘧啶残基处切割dna的限制酶而同时使甲基化胞嘧啶残基保持完整,该限制酶例如为用于在ccgg识别位点内检测5mc的hpaii和mspi);smrt测序(由pacificbiolab开发的单分子实时测序,其在dna聚合酶产生天然dna链的同时,使用零模式波导和磷酸连接的核苷酸以检测dna碱基);和纳米孔测序(在控制dna链通过纳米孔并引起离子电流水平变化的同时,检测dna核苷酸的顺序)。
在一些实施方案中,方法涉及使用特定针对目标基因组区域的至少一对引物扩增和/或测序一个或多于一个目标基因组区域。在一些实施方案中,引物是七聚体。在其他实施方案中,向扩增步骤添加酶如引发酶或引发酶/聚合酶组合酶以合成引物。
另外的实施方案涉及由扩增的基因组甲基化dna分子制备文库。在其他实施方案中,方法涉及裂解来自患者生物样品的一个或多于一个细胞。在其他情况下,方法涉及从患者的生物样品中提取dna。
实施方案还包括一种或多于一种试剂盒,其在合适的容器中包含1种、2种、3种、4种、5种、6种、7种、8种或8种以上以下物质:链置换聚合酶、phi29或其变体、dnmt1、人或小鼠dnmt1、s-腺苷甲硫氨酸、dntp、随机引物、和一种或多于一种核酸缓冲液、镁或镁盐、或bsa。在一些情况下,试剂盒包括含有引发酶和聚合酶功能的酶,以在dna扩增步骤中合成引物。这种酶的一个实例是来自嗜热栖热菌的双重引发酶/聚合酶(primpol)。
当在权利要求和/或说明书中与术语“包含”一起使用时,要素前面不使用数量词可以表示“一个”,但是其也符合“一个或更多个”、“至少一个”和“一个或多于一个”的意思。
预期本文所讨论的任何实施方案可以针对本发明的任何方法或组合物实施,反之亦然。此外,本发明的组合物和试剂盒可以用于实现本发明的方法。
在本申请全文中,术语“约”用于表明,数值包含用于确定数值所使用的装置或方法的标准差。
术语“或”在权利要求中的使用用于表示“和/或”,除非明确地说明是仅指选择,或选择是相互排斥的,但是本公开支持仅指选择和“和/或”的定义。还预期使用术语“或”所列出的任何事物也可以特别地排除在外。
如本说明书和权利要求所使用的,单词“包含”、“具有”、“包括”或“含有”是包括性的或开放式的,并且不排除另外的、未列举的元素或方法步骤。
本发明的其他目的、特征和优点通过下面的详细描述会变得明显。然而,应该理解的是,详细描述和具体实施例虽然表明了本发明的具体实施方案,但仅以说明的方式给出,因为根据本详细描述在本发明的精神和范围内的各种变化和修改对于本领域技术人员将变得显而易见。
附图说明
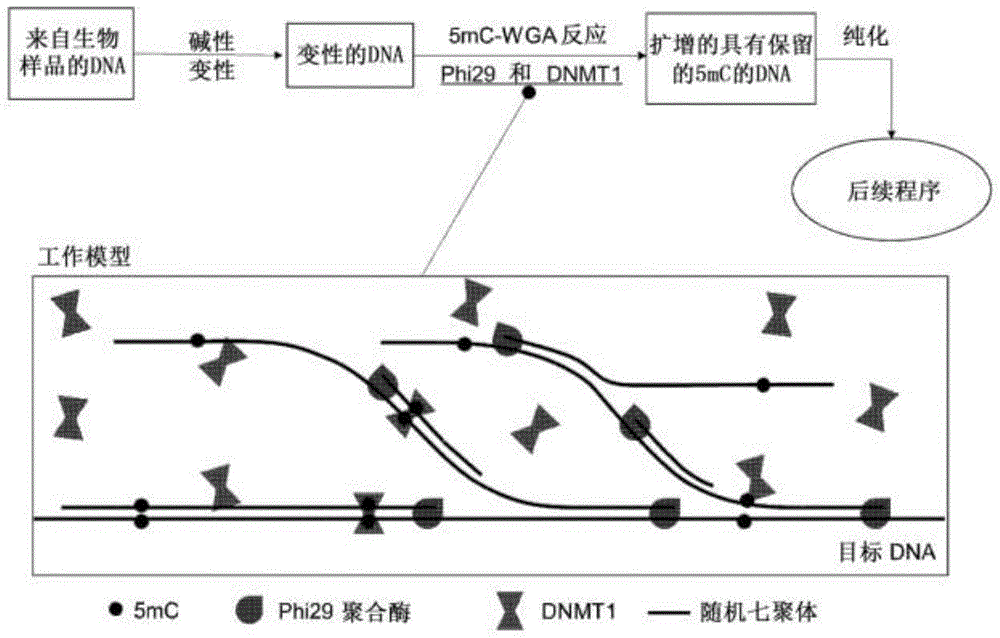
图1.显示5mc-wga的处理步骤的流程图,其为具有phi29和dnmt1共同功能的模型。如模型所示,dnmt1在由phi29合成的双链dna区域基于模板5mc模式添加新的5mc,因此在dna扩增期间如实地复制5mc标记。phi29和dnmt1之间的最佳酶比例确保dnmt1在由新作用的phi29替换双链之前有充足的时间加入5mc。
图2.测试区域的选择和引物的设计。显示具有不同甲基化模式的两个基因组区域以及互补引物结合区域(如箭头所示)。选择nfatc1基因座作为具有20个经确认的5mcpg位点的高甲基化测试区域,而选择mapk8ip2基因座作为具有21个经确认的未甲基化cpg位点的未甲基化测试区域。
图3.扩增的测试区域的亚硫酸氢盐处理和sanger测序数据。在高甲基化区域中已知的5mcpg位点(显示nfatc基因座的最后6个位点)处,与wga对照组不同,所有5mcpg位点都保留在5mc-wga组的扩增产物中(蓝色峰),这表明该方法的有效的5mc复制活性。在未甲基化区域中已知的未甲基化cpg位点(显示mapk8ip2基因座的最后5个位点)处,wga对照和5mc-wga组均显示完全的c至t转化,这表明该方法的最小假阳性重新甲基化活性。此处显示的每个反应使用5pg人脑gdna作为模板和优选实施方案部分中描述的相同反应组成,唯一的不同在于wga对照组不使用dnmt1。黑色星号表示未转化的gdna序列中的非cpg胞嘧啶碱基;粉红色星号表示未转化的gdna序列中的cpg胞嘧啶。
图4a至4b.使用不同酶比例(a)和输入dna量(b)的5mc-wga反应的优化数据。除了优化反应组分外,所有其余反应组分保持与优选实施方案部分中描述的相同。使用亚硫酸氢盐处理和sanger测序评估结果。高甲基化基因座中的‘c’读数表示5mc复制的准确度;而未甲基化基因座中的‘t’读数表示重新5mc掺入的消除率。
图5a至5b.通过bioanalyzer分析5mc-wga反应后超声处理的gdna(a)和无细胞dna(b)扩增谱。紫色和绿色表示上分子标记和下分子标记。在两组中5mc-wga之后的主要产物都大部分地汇集到或超过上标记区域,从而表明成功的>10kb扩增。
图6.在5mc-wga样品和模板dna样品中识别的实例位点处的medip峰模式。在两组中观察到类似的模式,从而表明在5mc-wga期间有效的全基因组5mc复制。
图7a至7b.对于10pg基因组dna扩增样品和作为阳性对照的大量样品,cpg(cg)和非cpg(chh/g)背景下的总体dna甲基化水平(a)证实了在扩增过程中甲基化组的可保持性。(b)10pg基因组dna扩增样品和对照样品bs-seq数据集的甲基化cpg位点的皮尔逊相关性。对于扩增样品和阳性对照的bs-seq数据集的皮尔逊分析证明了通过高通量测序获得的甲基化cpg位点的高度相关性。
具体实施方式
本公开涉及用于对核酸,特别是基因组dna的甲基化进行操作、制备、产生、扩增、纯化、分离、分析、测定、测量、测序和评估的方法和试剂盒。所提供的是从非常有限的生物样品(例如来自少量细胞、体液或活组织检查样品)扩增dna,同时从原料中如实地复制dna甲基化(5-甲基胞嘧啶,5mc)信息的方法。该方法包括将来自各种生物样品的dna加工成非结构化形式同时与随后的酶促反应相容的步骤;扩增模板dna分子同时将模板的5mc模式复制到产物dna分子中的步骤;纯化酶促反应并制备用于下游应用的扩增产物的步骤。酶促反应体系包括盐、s-腺苷甲硫氨酸(sam)、三磷酸脱氧核苷酸(dntp)、随机引物、和精确比例的具有链置换活性的dna聚合酶与dna甲基化维持酶混合的混合物。
一般希望的是在样品中,包括例如在固定的或新鲜的细胞或组织中能够灵敏地、特异性地、定性地和/或定量地检测甲基化dna,特别是基因组dna。特别希望在单个细胞中对甲基化dna进行检测、测序或评估。例如,在分析许多细胞内容物的基于群体的测定中,由于要评估的材料的低丰度,稀少量的细胞中的分子可能无法检测。对于无细胞生物样品也是如此。
例如,样品可以来源于身体的组织或器官,或者来源于体液。这种样品将有利地是或包括细胞或细胞组,例如组织。例如,样品可以是结肠、肺、胰腺、前列腺、皮肤、甲状腺、肝、卵巢、子宫内膜、肾、脑、睾丸、淋巴液、血液、血浆、膀胱或乳房样品,或者包括结肠、肺、胰腺、前列腺、皮肤、甲状腺、肝、卵巢、子宫内膜、肾、脑、睾丸、淋巴液、血液、膀胱或乳房细胞、细胞组或组织部分。样品可以是培养的或收获的或活检的细胞或组织样品,例如如上所述的那些,其中可以检测甲基化基因组dna以揭示其存在的甲基化的定性或定量性质,或在一个或多于一个特定基因、区域、cpg岛等处的甲基化核酸的核苷酸序列。细胞样品可以是新鲜制备的,或者可以以任何方便的方式预处理,例如通过固定或冷冻进行预处理。相应地,可以使用新鲜的、冷冻的或固定的细胞或组织,例如ffpe组织(福尔马林固定石蜡包埋的组织)。因此,可以使用处理的或未处理的组织切片。
如本文所用的“cpg岛”是指相对于感兴趣生物体的全基因组具有高g/c含量和高频率的cpg二核苷酸的dna区域。在本领域中也可互换使用术语“cg岛”。“cpg岛”中的“p”指胞嘧啶核苷酸和鸟嘌呤核苷酸之间的磷酸二酯键。
可以从感兴趣生物体中分离dna,该生物体包括但不限于真核生物和原核生物,优选哺乳动物生物体,例如人。
在多种原核生物和真核生物中发现了将甲基从s-腺苷甲硫氨酸转移到腺嘌呤或胞嘧啶残基的dna甲基转移酶(mt酶)。
在一些方面,富集样品的包含cpg岛的序列的步骤可以以不同的方式进行。一种富集技术是使用甲基-胞嘧啶特异性抗体对甲基化dna进行免疫沉淀(weber等人,2005)。或者,富集步骤可包括使用一种或多于一种限制酶消化样品,该限制酶更频繁地切割不包含cpg岛的dna区域并且不太频繁地切割包含cpg岛的区域。术语“目标”、“目标序列”、“目标区域”和“目标核酸”、“目标dna”等在本文中作同义使用,指的是待检测的核酸或其区域或序列,或所述方法中使用的试剂所结合的核酸或其区域或序列,例如待检测的甲基化dna,或更具体地是探针杂交或引物杂交或扩增的区域。因此,目标序列可以位于基因内或基因外或在编码区或非编码区中。如上所述,甲基化可以是包括一个或多于一个cpg岛的基因组dna。在一些实施方案中,靶向多个cpg岛。
如本文所使用的术语“杂交”是指两个单链核酸由于互补碱基配对形成双链体结构。杂交可以在完全互补的核酸链之间或含有少数错配区域的“基本互补的”核酸链之间发生。非常优选的是在完全互补核酸杂交的条件下,其被称为“严格杂交条件”或“序列特异杂交条件”。基本互补序列的稳定双链体可以在较不严格的杂交条件下获得;可以通过适当调整杂交条件控制可接受的错配程度。核酸技术领域技术人员可以按照技术(参见例如sambrook等人,1989;wetmur,1991;和owczarzy等人,2008,其通过引用并入本文)提供的指导经验地考虑许多变量,例如寡核苷酸的长度和碱基对组成、离子强度和错配碱基对的发生率,来确定双链体稳定性。因此,适当引物和探针以及它们与其各自目标杂交的条件的设计完全在本领域技术人员的常规技术范围内。
方法涉及复制甲基化基因组dna的聚合酶。在一些实施方案中使用链置换聚合酶。可以使用dna聚合酶,例如phi29(φ29)聚合酶、克莱努片段(klenowfragment)、嗜热脂肪芽孢杆菌(bacillusstearothermophilus)dna聚合酶(bst)、t4dna聚合酶、t7dna聚合酶或dna聚合酶i。
在一些方面,方法还涉及在扩增步骤中掺入具有强效活性的引发酶例如来自嗜热栖热菌(tth)的引发酶/聚合酶primpol以合成dna引物,从而降低在引发步骤中引入的偏差并使得能够进行接近完全的全基因组扩增。
在一些实施方案中,方法涉及使用特定针对目标基因组区域的至少一对引物扩增和/或测序一个或多于一个目标基因组区域。在一些实施方案中,引物是七聚体。在其他实施方案中,向扩增步骤添加酶如引发酶或引发酶/聚合酶组合酶以合成引物。
具有双重活性的酶的实例是获自嗜热栖热菌的具有引发酶和聚合酶功能的酶(primpol)。该酶以单独热稳定蛋白的形式组合了两种不同的互补活性:引发酶和聚合酶。该酶产生自己的引物序列。
来自嗜热栖热菌的primpol显示出对受损dna的极大耐受性。dna在细胞内经历化学修饰。primpol具有将多种底物核苷酸(例如荧光核苷酸)引入dna和rna模板分子的能力。primpol在多重置换扩增(mda)反应中起作用,从而产生随后由phi29dna聚合酶使用的引物,因此不必使用随机合成引物并可能导致更均匀的dna扩增。
引发酶是本领域已知的酶,例如细菌t7引发酶。t7用于扩增基因组dna。然而,其已被用于涉及低通量测序和qpcr的方法,并且其中原料为至少1nggdna。这比本公开中教导的体积大得多。
滚环扩增在本领域中是已知的。基于锁式探针末端区域与互补cdna序列的杂交,锁式探针通过连接而“环化”。锁式探针的环化可以通过直接地或间接地连接所述锁式探针的末端来实施。其过程、试剂和条件在本领域中是众所周知的并且进行了描述,可以根据选择挑选。在具体的实施方案中,在锁式探针环化的步骤中,锁式探针的末端区域可以与cdna的非邻接区域杂交,使得所述末端区域之间有间隙。
术语“文库”是指包含扩增的基因组甲基化dna分子的媒介物(例如,多个媒介物)的集合。媒介物可以是载体、构建体、阵列或其他物理媒介物。“载体”或“构建体”(有时称为基因递送或基因转移“媒介物”)是指大分子、分子复合物或病毒颗粒,其包含将会在体外或体内被递送至宿主细胞的多核苷酸。多核苷酸可以是线性或环状分子。本领域技术人员应当有能力通过标准重组技术构建载体(参考,例如maniatis等人,1988;ausubel等人,1994,两者都通过引用并入本文)。阵列包含固体支持物,其中核酸探针附着于支持物。阵列通常包含多个不同的核酸探针,其在不同的已知位置结合于基质表面。这些阵列,也称为“微阵列”或俗称“芯片”,已在本领域中进行了一般性描述,例如,美国专利第5143854号、第5445934号、第5744305号、第5677195号、第6040193号、第5424186号和fodor等人(1991),其全部内容通过引用而并入本文用于所有目的。使用机械合成方法合成这些阵列的技术描述于例如美国专利第5384261号,其全部内容通过引用而并入本文用于所有目的。尽管在一些方面使用平面阵列表面,但是阵列可以制造在几乎任何形状的表面或甚至多个表面上。阵列可以是珠子、凝胶、聚合物表面、纤维如光纤、玻璃或任何其他合适的基质上的核酸,参见美国专利第5770358号、第5789162号、第5708153号、第6040193号和第5800992号,其全部内容并入本文用于所有目的。
实施例1:
反应设置
本发明涉及一种扩增目标dna分子同时保留5mc信息的方法,该方法包括:
(a)使目标dna分子变性以去除二级结构的步骤,
(b)与产生产物时通过dna甲基转移酶向半甲基化产物加入5mc的过程相偶联的全基因组扩增步骤,
(c)纯化产物以提取扩增的具有从原料如实地复制的5mc信息的dna的步骤。
工作流程的设计如图1所示,并在下面详细描述:
(a)基因组dna的碱性变性,例如使用来自qiagen的repli-g迷你试剂盒。
首先制备缓冲液:通过向4.5μl缓冲液dlb中加入16μl水来制备缓冲液d1,并通过向7.5μl终止溶液中加入42.5μl水来制备缓冲液n1。
然后将脑基因组dna稀释至200pg/μl的浓度。向1μl经稀释的基因组dna(200pg)中加入9μl水。向基因组dna中加入10μl缓冲液d1,对混合物进行涡旋和短暂离心,在室温下孵育3分钟。
向变性的基因组dna中加入20μl缓冲液n1,然后对混合物进行涡旋并短暂离心。
溶液的最终dna浓度为5pg/μl。对于每个5pg输入的反应,向1μl变性的gdna中加入5μl随机七聚体引物储液(例如,来自thermofisher)并置于冰上。
(b)与dna甲基转移酶偶联的全基因组扩增步骤,例如使用phi29作为聚合酶,使用人dnmt1作为甲基转移酶,两者均来自neb。
首先根据以下单反应体积在冰上制备wga主混合物:5μl10xdnmt1缓冲液、1.67μl10mmdntp、0.5μl100xbsa、0.5μl1mmgcl2、0.5μl1m(nh4)2so4、17.83μl水,总计26.00μl。
然后将主混合物等分成适当数量的反应,并向每个反应中加入6μl基因组dna/引物混合物。
接下来基于以下单反应体积在冰上制备wga酶混合物:15μldnmt1[30单位];1.0μl32mmsam;2μl的10xphi29稀释液[2单位]。注意,不要将酶混合物与上述主混合物合并,因为phi29聚合酶的最大活性温度低于dnmt1的最大活性温度,并且可能使反应偶联失败。
通过首先在37℃下平衡无酶反应混合物和酶混合物持续5分钟,然后将反应混合物加入相应的酶混合物中,来最后完成5mc-wga反应的设置。在37℃孵育反应10小时,5小时后向每个反应中加入0.5μl32mm新鲜sam。然后在65℃下将dnmt1和phi29聚合酶加热灭活20分钟,完成后在4℃保持反应。
(c)产物的纯化。使用基于珠子的方案优于基于柱的方法,因为产物的尺寸大于10kb。例如,使用beckman的ampurexp珠。以1:1的体积比加入反应珠,充分混合并在室温下孵育15分钟,用200μl的80%乙醇洗涤两次而不破坏珠,在室温下干燥珠5分钟,然后用20μl无核酸酶的水洗脱。现在,纯化的产品已准备好用于下游应用。下面将通过实施例更具体地描述本发明,这些实施例不应解释为限制本发明。
(d)假设系统包括引发酶。在碱性变性和纯化保持不变的情况下,工作流程的改变仅在于扩增步骤期间添加引发酶。例如,使用trueprimewga试剂盒,用1.0μl变性的dna;1.0μl10mmdntp;2.0μl提供的反应缓冲液;0.5μl32mmsam;dnmt1[20单位];0.3μl10x酶2稀释液和1.0μl20x酶2稀释液,用水补充来制备20μl反应。在37℃下孵育反应5小时,然后在65℃下将dnmt1和phi29聚合酶加热灭活20分钟,完成后在4℃保持反应。
(1)亚硫酸氢盐处理和sanger测序,以在皮克级人gdna的5mc-wga扩增后检测差异甲基化基因的5mc模式。
在该实施例中,评估了5mc-wga的基因组5mc扩增的效率和准确度。
实施例2:
5mc-wga产物的亚硫酸氢盐处理
使用商业试剂盒,例如使用zymo的ezdnamethylation-directtm试剂盒进行亚硫酸氢盐处理。将20μl5mc-wga产物与新制备的ct转化试剂溶液在pcr管中混合,在98℃煮沸8分钟,然后在64℃孵育3.5小时,然后恢复至4℃。然后使用试剂盒中提供的标准柱纯化反应。注意,在该步骤中,可以使用qubitssdna试剂盒(thermofisher)对产物进行定量。对于输入<50pg,典型扩增可超过1000倍。
实施例3:
通过sanger测序检测差异甲基化基因的5mc模式
使用热启动dna聚合酶,例如来自zymo的zymotaqtmdna聚合酶,使纯化的亚硫酸氢盐转化产物进一步经历特定基因组区域的pcr扩增。实施例基因组区域、其甲基化模式和亚硫酸氢盐特异性引物设计如图2所示。引物的序列如下。
nfatc1-正向引物ttttttgtaataagaggaagtatagtttta(seqidno:1)
nfatc1-反向引物atctcccaaatccaaactactatc(高甲基化)(seqidno:2)
mapk8ip2-正向引物ggttgtgtagtttttattgagtgttta(seqidno:3)
mapk8ip2-反向引物aatccccccaaaaaccctaac(未甲基化)(seqidno:4)
将1μl至4μl转化的产物用作pcr扩增的模板,伴随25μlzymotaqtmpremix、5μl基因特异性引物混合物(10μm)和无核酸酶的水,总体积达到50μl。pcr反应按以下方案进行:在95℃下初始变性10分钟,然后将在95℃下变性30秒、在55℃下退火30秒、在72℃下延伸60秒进行总共40个至50个循环;和在72℃下7分钟的最终延伸步骤,然后4℃保持>4分钟。然后使用基于核酸纯化柱或基于磁珠的清除方案纯化完成的pcr。使用相应的正向引物,用sanger测序分析纯化的产物。实施例结果示于图3中。作为‘c’的序列读取表示5mc甲基化位点,作为‘t’的读取表示未甲基化位点,而作为‘n’或‘y’的读取表示在扩增后未完全维持的5mc位点、或由dnmt1重新添加的位点。
实施例4:
dnmt1和phi29的最佳酶比例和输入量研究
为了优化dnmt1和phi29的偶联酶促反应,使用不同比例的两种酶进行5mc-wga反应,同时通过上述亚硫酸氢盐处理和sanger测序评估效率。使用10ng人脑gdna作为输入样品,使用1:4至1:15的不同酶比例,其余的实验步骤与先前描述的方案相同。结果示于图4a中。结果表明phi29:dnmt1=1:15为最佳酶比例。
为了评估不同输入dna量所导致的5mc-wga的多功能性,在5mc-wga中在最佳酶比例下使用5pg至10ng人脑gdna。结果示于图4b中。结果表明,5mc-wga适用于10ng(及大于10ng)至5pg(来自单个细胞的dna量)的不同输入dna量同时保持稳定的性能。
(2)使用其他形式的生物样品进行5mc-wga。
在该实施例中讨论了直接用于5mc-wga扩增的其他形式生物样品的适用性。更具体地,证明了直接使用细胞作为5mc-wga的输入样品的选项,以及使用从体液(例如血液)提取的无细胞dna作为5mc-wga的输入样品的选项。
实施例5:
使用无细胞dna作为5mc-wga输入样品
从体液中提取的无细胞dna通常以非常低的丰度存在并且部分降解,从而为检测其甲基化模式带来巨大的技术困难,该甲基化模式包含有价值的诊断信息。证明了直接使用无细胞dna作为5mc-wga输入样品的适用性。首先,将使用经超声处理至约300bp的1ng小鼠gdna的对照组用作5mc-wga反应的输入样品,以确保片段化dna的扩增效率。使用bioanalyzer(agilent)纯化和分析产物,结果显示有效扩增(图5a)。接下来,在5mc-wga反应中使用从胰腺癌患者血液中提取的100pg无细胞dna(约200bp)。用bioanalyzer(agilent)分析纯化的产物。图5b中所示的图谱类似于经超声处理的gdna谱,这表明无细胞dna可以直接用作5mc-wga的输入样品以进行有效扩增。
实施例6:
使用细胞作为5mc-wga输入样品
除了使用纯化的dna作为5mc-wga的输入样品之外,经处理的细胞可以直接用于5mc-wga,跳过额外的纯化步骤并便于低细胞数或单细胞检测应用。
在加入到反应中之前,需要首先裂解提取的细胞。此处描述了兼容的裂解方案:制备裂解方案中使用的两种缓冲液,缓冲液l(400mmkoh,10mmedta,100mmdtt)和缓冲液n(200mmhcl,300mmtrisph7.5)。向提取的细胞(1个至15个细胞,按比例扩大至更多细胞)中加入5μl缓冲液l,在冰上孵育10分钟。然后加入5μl缓冲液n,充分混合。现在可以将裂解物加入到5mc-wga反应中以扩增dna和5mc模式。
(3)使用5mc-wga方法的皮克级人脑gdna的medip-seq
使用5mc-wga扩增的dna可以通过高通量测序进一步分析,以便以簇(通过medip-seq)或单碱基分辨率(通过全基因组亚硫酸氢盐测序,wgbs)显示全基因组5mc模式。
对于medip-seq,可以对纯化的dna进行超声处理并用商业medip和dnangs文库构建试剂盒对其进行处理。在这里,我们使用kapahyperplus和thermofishermethylminer试剂盒作为实例来演示工作流程。
实施例7:
样品制备
根据前述方案,将100pg人脑gdna用作5mc-wga扩增的输入样品。纯化产物并用nanodrop测量浓度。扩增的产物和模板dna(作为阳性对照)均用于medip-seq文库构建。
实施例8:
medip之前的dna处理
使用kapahyperplus试剂盒用于dna的medip预处理的实施例。
dna片段化:根据制造商的方案,将100ng纯化的5mc-wga产物和模板dna进行酶促片段化。将14μldna与2μl片段化缓冲液和4μl片段化酶混合物混合,在37℃下孵育30分钟,然后在冰上终止反应。
末端修复和a-加尾:向来自最后一步的20μl混合物补充2.8μl末端修复缓冲液和1.2μl酶混合物,在65℃下孵育30分钟,然后在室温下放置5分钟至10分钟以更好地进行修复。
衔接子连接:向来自最后一步的24μl混合物补充1.2μl标签(25μm,bioo)、12μl连接缓冲液、4μl连接酶和不含核酸酶的水至44μl。将反应在20℃下保持60分钟,然后以1:1的体积比进行ampure珠纯化。经处理的dna现在可以用medip进行富集。
实施例9
用medip进行5mcdna富集
使用thermofishermethylminer试剂盒用于甲基化dna片段的medip富集的实施例。
遵循制造商的方案,首先准备磁珠并偶联mbd-生物素蛋白。然后使用5ng至1μg输入dna的方案将mbd-珠与前述步骤产生的经处理的dna一起孵育。最后除去未捕获的dna并洗脱捕获的含5mc的dna片段。这些富集的产品现在可用于文库扩增。
实施例10
medip-seq文库扩增
使用kapahyperplus试剂盒用于dna文库的medip后扩增的实施例。
对富集的dna片段进行qpcr:为了确定扩增medip文库所需的pcr循环的准确数量,在含有10μlqpcr主混合物(例如rochefaststartsybrgreen)和2μl引物混合物的20μlqpcr反应中使用1μl模板dna或medip富集的dna。确定产生足够文库的循环数并用于随后的pcr反应。
扩增medip文库:基于qpcr确定的循环数,制备含有模板或富集的dna、25μlkapahifihotstartreadymix、和5μl引物混合物的50μl反应,并在热循环仪中扩增。将产物进一步纯化并进行ngs测序。
得到的数据证明了使用5mc-wgs对全基因组5mc模式的良好保持。一些示例区域如图6所示。
(4)来自有限生物样品的经5mc-wga扩增的dna的wgbs。
对于wgbs,首先对纯化的dna进行亚硫酸氢盐处理,然后使用商业wgbs文库构建试剂盒进行处理。在这里,我们使用illuminatruseqdna甲基化试剂盒作为实施例来演示工作流程。
实施例11
亚硫酸氢盐处理5mc-wga产物
与第一个实施例中描述的方案相同。注意来自zymo的ezdna甲基化-金和ezdna甲基化-lightning试剂盒可用作替代选择。
实施例12
wgbs文库构建
使用illuminatruseqdna甲基化试剂盒用于从亚硫酸氢盐处理的5mc-wgs产物构建wgbs文库的实施例。
遵循制造商的方案,首先将dna合成衔接子退火至变性的ssdna,然后合成互补的dna链以产生dsdna产物,然后在两端用已知的衔接子序列标记dsdna,最后用具有用于多重ngs测序的特定标签序列扩增文库。
实施例13
来自有限生物样品的特定基因座的5mc保留扩增
具有保留的甲基化位点的特定基因座的反应与全基因组扩增反应的不同仅在于,其中加入4μl感兴趣区域的正向和反向引物(10nm)。实施例使用的是作为脆性x综合征的潜在诊断的fmr1基因的扩增。相应的引物是:
fmr1_正向引物gctcagctccgtttcggtttcacttccggt(seqidno:5)
fmr1_反向引物cctccatcttctcttcagccct(seqidno:6)
还用8μl引物对(每个引物5nm)制备反应,并基于相同的热循环进行孵育。
本文描述了本发明的优选实施方案,包括发明人已知的用于本发明应用的适当实施例。上述应用仅是示例性的,不应视为限制本发明的范围。
参考文献
lorthongpanich,c.,cheow,l.f.,balu,s.,quake,s.r.,knowles,b.b.,burkholder,w.f.,solter,d.andmesserschmidt,d.m.,2013.single-celldna-methylationanalysisrevealsepigeneticchimerisminpreimplantationembryos.science,341(6150),pp.1110-1112.
guo,h.,zhu,p.,wu,x.,li,x.,wen,l.andtang,f.,2013.single-cellmethylomelandscapesofmouseembryonicstemcellsandearlyembryosanalyzedusingreducedrepresentationbisulfitesequencing.genomeresearch,23(12),pp.2126-2135.
smallwood,s.a.,lee,h.j.,angermueller,c.,krueger,f.,saadeh,h.,peat,j.,andrews,s.r.,stegle,o.,reik,w.andkelsey,g.,2014.single-cellgenome-widebisulfitesequencingforassessingepigeneticheterogeneity.naturemethods,11(8),pp.817-820.
picher,a.j.,budeus,b.,wafzig,o.,kruger,c.,garcia-gomez,s.,martinez-jimenez,m.i.,diaz-talavera,a.,weber,d.,blanco,l.andschneider,a.,2016.trueprimeisanovelmethodforwhole-genomeamplificationfromsinglecellsbasedontthprimpol.naturecommunications,7:13296
- 还没有人留言评论。精彩留言会获得点赞!
- 一种新的多肽——dna甲基化酶13和编码这种多肽的多核苷酸的制作方法
- 具有治疗活性的环亚甲基-1,2-二羧酸酰胺,制备它们的方法和含它们的药物组合物的制作方法
- 组蛋白去乙酰化酶抑制剂的制作方法
- 基于dna聚合酶链反应的甲基化dna检测方法
- 检测Cre位点特异重组酶活性的转基因报告猪及培养方法
- 一种多肽——人含胞嘧啶特异性dna甲基化酶特征性序列片段的蛋白-9.35和编码这种 ...的制作方法
- 一种多肽——脱氧核糖核酸甲基化酶-9.35和编码这种多肽的多核苷酸的制作方法
- 利用酶活性的竞争性干扰和恢复检测被分析物的制作方法
- 一种基于化学发光反应的甲基化酶检测探针、检测试剂盒及检测方法
- 编码甲基化儿茶素生物合成酶的基因的制作方法