产量提高的转基因植物的制作方法
交叉引用
本申请要求于2018年2月16日提交的美国临时专利申请第62/710,603号的权益,该申请通过引用以其整体并入本文中用于所有目的。
背景技术:
通过操纵植物的遗传背景可以提高植物的产量。例如,对植物的遗传组成的操纵可以影响种子产量、植物高度、叶直立、每株植物的分蘖和穗的数量,并且可以通过对植物dna的操纵来影响种子大小。在作物植物的情况下,通过遗传修饰获得的植物产量的增加可以提供商业和社会优势。通过操纵dwf4基因途径或bri1基因途径在提高种子产量方面已经获得了一些成功,但是仍需要更强健的策略。
技术实现要素:
本文描述了工程化植物细胞中感兴趣的性状的方法。本文公开的一些方法包括增加作物田的产量,所述作物田包含具有影响信号传导途径的突变的植物,所述信号传导途径选自:细胞周期途径、激素途径和代谢途径。在一些情况下,突变影响激素信号传导。在一些情况下,突变影响br信号传导。在一些情况下,突变导致br信号传导增加。在一些实施方案中,突变影响细胞周期途径。在一些情况下,突变影响rb信号传导。在一些情况下,突变导致rb信号传导活性的下调。在一些情况下,突变改变了参与dp-e2f信号传导的至少一种基因的表达。在一些情况下,突变导致参与dp-e2f信号传导的至少一种基因的过表达。在一些情况下,突变包括外源核酸序列。在一些情况下,突变影响pzr1基因的表达。在一些情况下,突变导致pzr1基因的过表达。在一些情况下,突变是pzr1-d突变。在一些情况下,植物对于pzr1-d突变是纯合的。在一些情况下,所述至少一种基因选自:os11g0549665、os10g0381601、os11g0573100、os11g0549675、os11g0549680、os11g0639300、os01g0146101、os03g0629800、os11g0636050、os07g0159200、os12g0100100、os11g0606400、os03g0223301、os07g0486000、os02g0129000、os11g0540600、os07g0531900、os12g0431300、os03g0576200、os08g0203350、os11g0562100、os11g0701700、os12g0222650、os12g0172150、os12g0257450、os12g0247700、os12g0222300、os12g0255200、os12g0250900、os12g0254400、os10g0175500、os05g0202800、os11g0518900、os08g0255500、os11g0689800、os07g0543500、os12g0209800、os11g0255300、os12g0211500、os06g0254300、os11g0134300、os09g0467700、os01g0146101、os01g0148100、os07g0187001、os11g0640300、os12g0257400、os07g0159200、os01g0845950、os11g0691100、os07g0153150、os11g0605100、os03g0223301、os08g0367300、os11g0618700、os07g0162450、os02g0129000、os03g0299700、os11g0549680、os07g0486000、os11g0569800、os09g0467700、os12g0250900、os12g0406000、os11g0696600、os11g0532600、os01g0520180、os07g0297400、os07g0535200、os12g0425800、os11g0685200、os12g0204600、os12g0239300、os07g0677100、os07g0103000、os05g0414400、os11g0693800、os05g0369900、os11g0687100、os12g0425500、os08g0255500、os11g0689800、开花促进因子1样蛋白1、细胞周期蛋白-b1-1、类似于脂质转移蛋白、类似于细胞周期蛋白依赖性激酶b1-1、细胞周期蛋白依赖性激酶a-2、细胞周期蛋白依赖性激酶g-1、增殖细胞核抗原、细胞周期蛋白依赖性激酶调节亚基1、细胞周期蛋白依赖性激酶g-2、细胞周期蛋白-b2-1、细胞周期蛋白-p1-1、类似于细胞周期蛋白-d3-1、细胞周期蛋白b2-2、细胞周期蛋白d6-1、细胞周期蛋白d2-2、细胞周期蛋白依赖性激酶b2-1、细胞周期蛋白依赖性激酶b2-1和细胞周期蛋白a3-2。在一些情况下,植物的至少一个方面增加,所述方面选自:植物重量、分蘖数、穗数、总长度、根长度和胚芽鞘长度。在一些情况下,作物田的产量比用参考品系种植并在与包含植物的田地类似的条件下生长的作物田的产量高至少5%。在一些情况下,作物田的产量比用参考品系种植并在与包含植物的作物田类似的条件下生长的作物田的产量高至少5%。在一些情况下,作物田的植物的突变是pzr1-d突变。在一些情况下,用除草剂处理作物田。在一些情况下,作物田包含杂草,并且在一些情况下,除草剂在收获前抑制杂草中的油菜素类固醇合成。在一些情况下,除草剂选自芸苔素唑和丙环唑。在一些情况下,突变影响pzr1基因的表达。在一些情况下,突变导致pzr1基因的过表达。在一些情况下,所述突变是pzr1-d突变,本文公开的一些方法包括清除田地杂草,其包括:使用具有影响信号传导途径的突变的植物种植田地;和施用影响油菜素类固醇信号传导的除草剂,所述信号传导途径选自:细胞周期途径、激素信号传导途径和代谢途径。在一些情况下,突变影响激素信号传导途径。在一些情况下,突变影响br信号传导。在一些情况下,突变影响细胞周期途径。在一些情况下,突变影响rb信号传导。在一些情况下,突变改变了参与dp-e2f信号传导的至少一种基因的表达。在一些情况下,突变影响pzr1基因的表达。在一些情况下,突变导致pzr1基因的过表达。在一些情况下,突变是pzr1-d突变。在一些情况下,除草剂选自芸苔素唑和丙环唑。
附图的简要说明
本专利或申请文件包含至少一幅以颜色执行的附图。本专利或专利申请公开的带有彩色附图的副本将由办公室在请求和支付必要的费用时提供。
通过参考阐述说明性实施方案的以下详细描述,将获得对本文所公开的主题的特征和优点的一些理解。
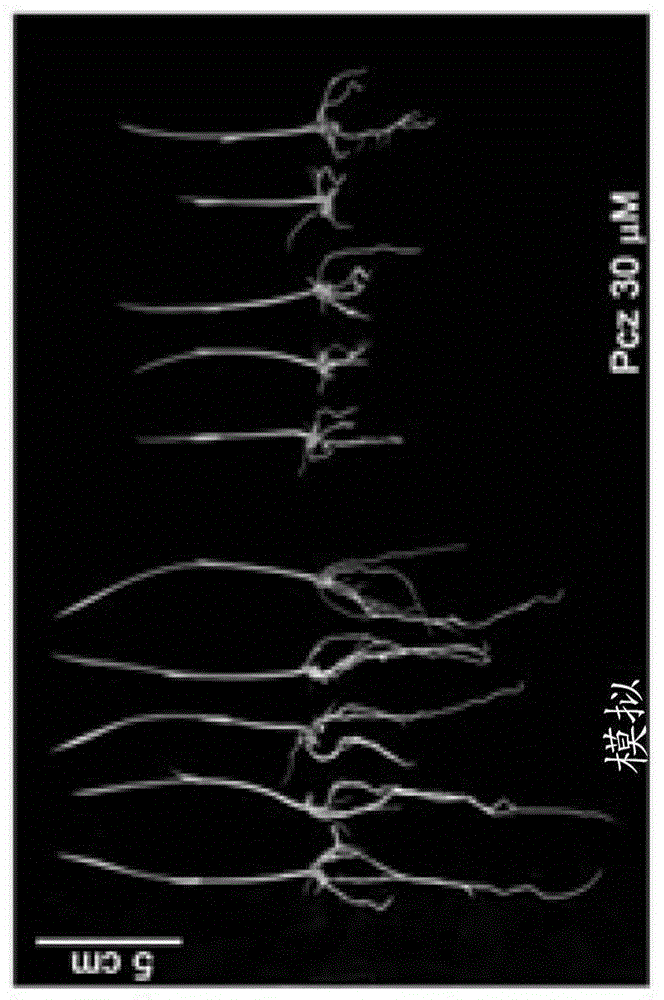
图1a-图1e说明pzr1-d突变体幼苗的丙环唑抗性。图1a显示了在黑暗中在模拟或30μmpcz处理下的10日龄稻幼苗的代表性形态。图1b显示了图1a所示幼苗的总长度和根长度。图1c显示了比较模拟和pcz处理中的dwf4表达的rt-pcr,其中肌动蛋白用作内部对照。图1d显示了在模拟或30μmpcz处理下10日龄野生型和突变体稻幼苗的代表性形态。图1e显示了在每种处理下野生型和pzr1-d幼苗的定量根长度。
图2a-图2i说明pzr1-d成年植物的表型。图2a显示了野生型和pzr1-d稻植物之间的植物高度的比较。图2b显示了野生型和pzr1-d稻植物之间的植物重量的比较。图2c显示了野生型和pzr1-d稻植植物之间的分蘖数的比较。图2d显示了在野生型和pzr1-d植物中观察到的穗数的比较。图2e显示了野生型和pzr1-d稻植物之间的成年植物形态的比较。图2f显示了野生型和pzr1-d稻植物之间的穗形态的比较。图2g显示野生型和pzr1-d稻植物之间的种子重量(克/株植物)的比较。图2h显示了在野生型和pzr1-d稻植物中观察到的初级分枝数的比较。图2i显示了在野生型和pzr1-d稻植物中观察到的次级分枝数的比较。
图3a-图3h说明pzr1-d突变体幼苗的br相关表型。图3a显示了野生型和pzr1-d突变体植物中对应于第二叶的节段的倾斜的代表性图像。图3b显示了野生型和pzr1-d植物的节段倾角的定量。图3c显示了在模拟或1μm油菜素内酯(bl)处理下的叶片倾斜生物测定测试中野生型和pzr1-d植物的代表性图像。图3d显示了叶片倾斜生物测定测试的倾角定量结果。图3e显示当用0μm、0.1μm或1μmbl处理时野生型(圆圈)和pzr1-d(正方形)植物的倾角的比较。图3f显示了在黑暗中生长的野生型和pzr1-d幼苗的总植物长度的比较。图3g显示了在bl(1μm)存在下和在黑暗中在野生型和pzr1-d植物中通过根抑制测试的bl敏感性。图3h显示了野生型和pzr1-d幼苗响应bl和黑暗处理的胚芽鞘生长的比较。
图4a-图4f说明pzr1-d和源自突变体和野生型种子的愈伤组织形态的显微镜分析。图4a显示了根的示意图。图4a中的红色正方形(60mm2)显示了拍摄图4b中所示的图像的点。图4c显示了通过分析产生愈伤组织的pzr1-d突变体种子和产生愈伤组织的野生型种子的图像获得的细胞计数。图4d显示了通过分析产生愈伤组织的pzr1-d突变体种子和产生愈伤组织的野生型种子的图像获得的细胞大小测量结果。图4b显示了7日龄野生型和pzr1-d幼苗的pi染色根的分生组织区的剖面图。图4c显示了野生型和pzr1-d幼苗的四个样品中平均细胞数的定量。图4d显示了每种基因型(野生型vspzr1-d突变体)的四个不同样品的平均细胞大小的比较。图4e显示了来源于野生型和pzr1-d植物的愈伤组织在16天,24天和32天的形态。图4f显示了野生型和pzr1-d愈伤组织的生长曲线,说明pzr1-d突变对愈伤组织发育的影响。
图5a-图5h说明在pzr1-d和pzr1过表达稻品系中的激活标记t-dna插入。图5a显示了pzr1野生型(wt)和突变体(pzr1-d)等位基因的示意图,包括含有四聚体camv35s启动子盒的pga2715插入片段。图5b显示了与t-dna插入紧密接近的三个基因的rt-qpcr分析结果(03g05750;03g05760,pzr1;和03g05770)。图5c显示了包含野生型(dongjin),分离野生型(pzr1),杂合(pzr1/pzr1-d)和突变体(pzr1-d)基因型的植物中的pzr1的转录水平。图5d显示了在丙环唑(30μm)处理后野生型(wt)植物中pzr1表达的rt-qpcr分析结果。图5e显示了来自野生型(wt)植物和来自过表达品系(35s::pzr1),即ox1、ox2、ox3、ox9、ox10、ox13、ox16的植物的1月龄植物的形态的代表性图像。图5f显示了在非转化(野生型)植物和来源于pzr1过表达品系的植物中pzr1表达的比较。图5g显示了非转化(野生型)植物和来源于pzr1过表达品系的植物中分蘖数的比较。图5g显示了非转化(野生型)植物和来源于pzr1过表达品系的植物中的穗数的比较。
图6a-图6e说明pzr1的系统发育和表达分析。图6a显示了使用来自人(uniprot蛋白idq14186和q14188),小麦(q9fet1),拟南芥(q9fny2和q9fny3)和推定的稻同源物(q84va0,q84vf4和q84vd5)的dp蛋白序列构建的系统发育树。图6b显示了7日龄稻幼苗形态的代表性图像,其显示了芽和根的区域。图6c显示了野生型幼苗的芽和根中pzr1表达的rt-qpcr分析。图6d显示了成年稻植物形态的代表性图像。图6e显示了rt-qpcr分析结果,其比较了7日龄幼苗中来自成年野生型和pzr1-d植物的不同组织中pzr1的表达。
图7a-图7e说明突变体和野生型幼苗中的差异表达基因(deg)和针对deg富集的go术语。图7a显示了在光照和黑暗条件下发现在野生型和突变体植物之间差异表达基因的维恩(venn)图。图7b显示了在deg中响应于光照或黑暗条件的基因表达变化的比较。图7c显示了通过基因本体(go)类别分离的deg(在黑暗条件下的幼苗中评价)的定量。图7d显示了通过基因本体(go)类别分离的deg(在光照条件下的幼苗中评价)的定量。图7e显示了通过基因本体(go)类别分离的deg(在光照和黑暗条件下的幼苗中观察到的)的定量。
图8a-图8d说明在稻中丙环唑作用的剂量反应和光研究。图8a显示了用0(模拟)、0.1μm、1μm、20μm和40μm油菜素类固醇(br)抑制剂pcz处理10天后植物的形态。图8b显示了用0(模拟)、0.1μm、1μm、20μm和40μm油菜素类固醇(br)抑制剂pcz处理10天后植物的根长度的比较。图8c显示了在光照条件下处理10天后野生型和pzr1-d植物的形态。图8d显示了在正常光照条件下用30μmpcz处理10天后幼苗根长度的比较。
图9a-图9f说明pzr1-d后代的丙环唑敏感性和表型。图9a显示了野生型和pzr-1d植物的形态。图9b显示了多种基因型植物的代表性图像,包括:野生型dongjin(w/w),分离野生型或pzr1(w/w),杂合pzr1/pzr1-d(w/t)和纯合突变体pzr1-d(t/t)。图9c是比较野生型植物(wt)和对pzr1-d过表达突变为杂合的植物(pzr1/pzr1-d)或纯合的植物(pzr1-d)中的植物高度的图。图9d显示了野生型,杂合(pzr1/pzr1-d)和纯合(pzr1-d)植物的穗数的比较。图9e显示了野生型,杂合(pzr1/pzr1-d)和纯合(pzr1-d)植物的分蘖数的比较。图9f显示了野生型(dongjin和pzr1),杂合(pzr1/pzr1-d#2和pzr1/pzr1-d#3)和纯合(pzr1-d)植物中pzr1表达的rt-qpcr分析。
图10a-图10d说明pzr1-d种子的分析。图10a显示了野生型和突变体种子的代表性图像。图10b显示了野生型和pzr1-d种子的平均种子长度的比较。图10c显示了野生型和pzr1-d种子的平均相对面积的比较。图10d显示了野生型和pzr1-d种子的平均重量的比较。
图11a-图11c说明来自野生型和pzr1-d突变体幼苗的叶的显微镜分析。图11a显示了在10倍放大倍数下观察到的沿中部横向剖开的7日龄幼苗野生型和突变型幼苗叶片的图像。图11b显示了在20x放大倍数下观察到的样品的图像。图11c显示了使用在20倍放大倍数下观察到的样品的图像测量的细胞大小。
图12a-图12e说明异源表达稻pzr1的拟南芥植物的表型和基因表达水平。图12a显示了未转化的col-0野生型植物和来自三种独立转基因品系的代表性幼苗的形态。图12b显示了从独立转基因品系的幼苗收集的rna样品产生的rna印迹,以测量稻pzr1的表达水平。图12c显示了使用过表达品系ox8作为参照的转基因植物中pzr1表达的rt-qpcr分析。图12d显示了四种个过表达品系(n=10)中初级根长度的定量。图12e显示了侧根数量的定量,表示为平均值(n=10)。
图13说明差异表达基因(deg)的启动子区。
图14说明dp蛋白的多序列比对。
详细描述
本公开提供了高产植物和用于产生高产植物的方法。本公开还提供了对除草剂表现出抗性的植物和用于产生对除草剂表现出抗性的植物的方法。高产植物可以通过与第二植物或第二植物品系相比增加植物高度、植物重量、分蘖数、穗数、种子数、种子重量、种子大小、初级分枝数、次级分枝数和/或生长速率来实现。除草剂抗性植物可以通过与在除草剂存在下的第二植物或第二植物品系相比,在相同或相似浓度的相同或相似除草剂存在下改善植物高度、植物重量、分蘖数、穗数、种子数、种子重量、种子大小、初级分枝数、次级分枝数、生长速率和/或植物存活中的至少一种来实现。高产植物或除草剂抗性植物可以通过使用本文公开的方法修饰至少一种基因的表达或改变至少一种信号传导途径(例如细胞周期途径,激素调节途径或代谢途径)的活性来产生,所述方法可以包括基因工程技术。第二植物或第二植物品系可以是参考植物或参考植物品系。参考植物或参考植物品系与本文公开的高产植物或除草剂抗性植物在除了本文公开的高产植物或除草剂抗性植物中修饰的基因组位置之外的基因组位置(或多个基因组位置)可以是等基因的。例如,除了在高产植物或除草剂抗性植物中的遗传修饰之外,参考植物或参考植物品系可以与本文描述的高产植物或除草剂抗性植物在遗传上相同。在一些情况下,参考植物或参考植物品系,例如野生型植物或野生型植物品系,可以缺少至少一种存在于本文所述的高产植物或除草剂抗性植物中的遗传修饰(例如插入或缺失的核酸序列)。
用于产生本文所述的高产植物的方法可产生对除草剂具有抗性的植物。在一些情况下,用于产生本文所述的除草剂抗性植物的方法可产生高产植物。
本文公开的方法包括改变基因的表达或生物信号传导途径的活性,例如与植物生长、代谢过程或细胞过程(例如细胞周期调节)相关的基因和信号传导途径,以产生高产植物或除草剂抗性植物。用于产生高产植物或除草剂抗性植物的方法可包括调节基因的表达或信号传导途径的活性,所述基因或信号传导途径可影响植物产量,可影响植物激素信号传导途径,或可参与除草剂抗性。例如,改变植物细胞中的e2f二聚化配偶体(dp)基因、e2f基因或参与dp-e2f-rb信号传导途径或油菜素类固醇(br)信号传导途径的基因的表达可产生高产植物或除草剂抗性植物。如本文所述,改变dp基因、e2f基因、参与dp-e2f-rb信号传导途径的基因或参与br信号传导途径的基因的表达可用于产生,与在相同或类似条件下生长的第二植物(例如野生型植物)相比,在正常生长条件下或在外源试剂存在下表现出高度、重量、分蘖数、穗数、种子数、种子重量、种子大小、初级分枝数、次级分枝数和/或生长速率增加的高产植物或除草剂抗性植物。
在一些情况下,操纵植物或植物细胞中至少一种基因的表达或调节植物或植物细胞中的至少一种信号传导途径用于产生高产作物田或用于清除田地杂草的方法中。例如,植物细胞中pzr1基因的过表达可用于增加植物产量和改善植物对除草剂如丙环唑和芸苔素唑的抗性。
植物或植物细胞中基因表达的调节或植物或植物细胞中信号传导途径活性的调节,如本文所述,可以相对于参考植物或参考植物品系进行评估。在一些情况下,参考植物、植物细胞或植物品系可包含野生型植物或植物细胞。参考植物、植物细胞或植物品系可以是未处理的植物或植物细胞。考虑本领域技术人员认为是野生型的植物或植物品系可包含至少一个突变。在一些情况下,参考植物或参考植物品系可缺少如本文所述的高产植物或除草剂抗性植物的遗传修饰,但可在其它方面在遗传学上类似于或等同于高产植物或除草剂抗性植物。例如,用于评价本文所述的高产植物或除草剂抗性植物的产量或除草剂抗性性状的参考植物或参考植物品系与高产植物或除草剂抗性植物在除了根据本文所述的方法修饰了的高产植物或除草剂抗性植物的位置之外的多个遗传位置处可以是等基因。
基因表达的调节
增加植物产量或植物对除草剂的抗性的一种方法是调节植物或植物细胞中至少一种基因的表达(例如,相对于参考植物或植物细胞)。如本文所述,调节植物或植物细胞中的基因表达可调节至少一种信号传导途径(例如激素信号传导途径、细胞周期调节途径、与细胞过程相关的途径或与代谢过程相关的途径)的活性。作为调节植物中至少一种基因表达的结果,本文所述的多种有益效果可以赋予植物例如增加的植物高度、植物重量、分蘖数、穗数、种子数、种子重量、种子大小、初级分枝数、次级分枝数、生长速率和/或对除草剂的抗性。在一些情况下,修饰基因的表达包括过表达该基因。修饰包含基因表达下调或抑制的基因表达的方法也与本文所述的实施方案一致。
产生高产植物或除草剂抗性植物的一种方法是在植物或植物细胞中过表达基因。基因的过表达可以以多种方式完成,包括增加至少一种dna序列的转录、降低dna序列的抑制、增加rna分子翻译成蛋白质、或以上的组合。增加dna序列的转录可包括将外源dna序列引入细胞的基因组dna。可以将外源dna序列稳定地或瞬时地引入细胞的基因组dna中。
产生高产植物或除草剂抗性植物的方法可包括下调植物或植物细胞中的基因。下调基因表达的方法包括抑制基因的表达或从细胞基因组中删除基因的至少一个等位基因(例如,通过将核酸序列引入细胞)。目的基因的抑制可包括上调抑制目的基因表达的基因。基因的至少一个等位基因的缺失是通过从细胞基因组中去除dna序列来完成的。在一些情况下,基因表达的下调包括将基因序列引入细胞的dna中,所述细胞的dna编码非功能性或部分功能性的rna分子或蛋白质。例如,缺少5’帽或聚-a尾的rna分子可以是非功能性或部分功能性rna。在一些情况下,基因表达的下调可包括将核酸序列引入编码截短蛋白的细胞中。
基因的表达可以直接或间接调节。在一些情况下,基因表达的直接调节导致比基因表达的间接调节更大程度的调节。基因表达的间接调节可以降低用一些基因表达的直接调节方法可能产生的脱靶效应的风险。
基因表达的直接调节可包括将核酸序列插入细胞基因组。例如,可以通过将编码基因或基因的一部分的核酸插入细胞的基因组dna来调节植物中基因的表达。另外或可选地,基因表达的直接调节可以包括从细胞的基因组dna中去除编码基因或基因的一部分的核酸序列的全部或一部分。基因表达的直接调节可导致基因表达增加(例如,过表达)或基因表达降低(例如,表达不足、敲除、沉默或缺失)。将至少一种核酸序列插入细胞的基因组dna可导致表达增加。例如,将编码内源基因的附加拷贝的核酸序列插入细胞的基因组dna可导致细胞中基因的总表达增加。将至少一种核酸序列插入内源基因的序列可导致基因表达降低。例如,将至少一种核酸序列插入内源基因的序列可干扰内源基因的转录。
在一些情况下,基因表达的直接调节可以包括从细胞的基因组dna中去除(例如,删除)核酸序列。从细胞的基因组dna中去除核酸序列(例如,去除编码目的基因的核酸序列的全部或一部分)可导致基因表达的表达降低。在一些情况下,基因表达的间接调节可以包括从细胞的基因组dna中去除(例如,删除)核酸序列。例如,去除影响目的基因表达的核酸序列(例如,增强子序列,启动子序列或沉默子序列)可以调节目的基因的表达。
基因表达的间接调节也可导致基因表达增加或基因表达降低。例如,将有助于基因转录的核酸序列(例如,启动子序列或增强子序列)插入到细胞的基因组dna中可以包括基因表达的间接调节。将抑制基因转录的核酸序列(例如,沉默子序列)插入到细胞的基因组dna中可以包括基因表达的间接调节。
在植物或植物细胞中调节一种基因的表达(例如,基因表达的直接或间接调节)可以足以增加植物或植物生长的田地的产量或除草剂抗性。可以调节与细胞周期调节,激素信号传导,细胞过程或代谢过程相关的基因以增加植物或植物生长的田地的产量或除草剂抗性。作为代表性的实例,改变参与dp、e2f或br信号传导的基因的表达可以改变至少一种另外的基因的表达。例如,改变br信号传导途径中第一基因的表达可以改变br信号传导途径中第二基因的表达。在一些情况下,改变参与第一信号传导途径的第一基因可影响参与第二信号传导途径的第二基因的表达。
植物或植物细胞中多种基因的表达的调节可以提供改进的对细胞信号传导途径的控制。例如,高产植物的产生可以包括调节第一基因的表达和调节第二基因的表达。在一些情况下,第一基因的表达和第二基因的表达在本文所述的方法中都增加。在一些情况下,第一基因的表达和第二基因的表达在本文所述的方法中都降低。增加第一基因的表达和减少第二基因的表达对于本文所述的方法也可以是有利的。例如,增加第一基因(例如,dp1)的表达同时降低第二基因(例如,rb)(其编码能够拮抗第一基因的表达的rna或蛋白质)的表达是可以用于本文公开的方法中的策略。在一些情况下,用于增加多种基因的表达的策略可用于激活或增强第一信号传导途径的活性,同时抑制第二信号传导途径的活性。
因此,可以改变2、3、5、10、20、30、40、50、60、70、80、90、100、200、300、400、500、1000、2至50、50至100、100至200、200至500、500至1000或超过1000种基因的表达。
在一些情况下,相对于未采用相同方法的植物(例如参考植物或参考植物品系)中的基因表达而言,本文所述的方法可导致基因表达改变1.1倍至1.2倍、1.2倍至1.3倍、1.3倍至1.4倍、1.4倍至1.5倍、1.5倍至1.6倍、1.6倍至1.7倍、1.7倍至1.8倍、1.8倍至1.9倍、1.9倍至2.0倍、2.0倍至2.4倍、2.4倍至2.6倍、2.6倍至2.8倍、2.8倍至3倍、3倍至3.5倍、3.5倍至4倍、4倍至5倍、5倍至10倍、10倍至20倍、20倍至30倍、30倍至40倍、40倍至50倍、50倍至60倍、60倍至70倍、70倍至80倍、80倍至90倍、90倍至100倍、100倍至200倍、200倍至500倍、500倍至1000倍、1000倍至2000倍、2000倍至5000倍、5000倍至10000倍、超过10000倍、5倍至10倍、1倍至20倍、或1倍至40倍。在一些情况下,相对于未采用相同方法的植物(例如参考植物或参考植物品系)中的基因表达而言,本文描述的方法可导致基因表达增加1.1倍至1.2倍、1.2倍至1.3倍、1.3倍至1.4倍、1.4倍至1.5倍、1.5倍至1.6倍、1.6倍至1.7倍、1.7倍至1.8倍、1.8倍至1.9倍、1.9倍至2.0倍、2.0倍至2.4倍、2.4倍至2.6倍、2.6倍至2.8倍、2.8倍至3倍、3倍至3.5倍、3.5倍至4倍、4倍至5倍、5倍至10倍、10倍至20倍、20倍至30倍、30倍至40倍、40倍至50倍、50倍至60倍、60倍至70倍、70倍至80倍、80至90倍、90至100倍、100至200倍、200至500倍、500至1000倍、1000至2000倍、2000至5000倍、5000倍至10000倍、超过10000倍、5倍至10倍、1倍至20倍、或1倍至40倍。
本文公开的植物和方法可包括调节至少一种基因的表达或调节至少一种信号传导途径的活性。例如,产生高产植物或除草剂抗性植物可以包括改变参与细胞过程,代谢过程,激素信号传导或细胞周期调节的基因,例如参与dp、e2f或br信号传导的基因的活性或表达。通过改变参与dp、e2f或br信号传导的基因的表达而可以受到影响的基因的代表性实例包括:开花促进因子1样蛋白1、细胞周期蛋白-b1-1、类似于脂质转移蛋白、类似于细胞周期蛋白依赖性激酶b1-1、细胞周期蛋白依赖性激酶a-2、细胞周期蛋白依赖性激酶g-1、增殖细胞核抗原、细胞周期蛋白依赖性激酶调节亚基1、细胞周期蛋白依赖性激酶g-2、细胞周期蛋白-b2-1、细胞周期蛋白-p1-1、类似于细胞周期蛋白-d3-1、细胞周期蛋白b2-2、细胞周期蛋白d6-1、细胞周期蛋白d2-2、细胞周期蛋白依赖性激酶b2-1、细胞周期蛋白依赖性激酶b2-1、细胞周期蛋白a3-2,以及以下稻基因的代表性实例:os11g0549665、os10g0381601、os11g0573100、os11g0549675、os11g0549680、os11g0639300、os01g0146101、os03g0629800、os11g0636050、os07g0159200、os12g0100100、os11g0606400、os03g0223301、os07g0486000、os02g0129000、os11g0540600、os07g0531900、os12g0431300、os03g0576200、os08g0203350、os11g0562100、os11g0701700、os12g0222650、os12g0172150、os12g0257450、os12g0247700、os12g0222300、os12g0255200、os12g0250900、os12g0254400、os10g0175500、os05g0202800、os11g0518900、os08g0255500、os11g0689800、os07g0543500、os12g0209800、os11g0255300、os12g0211500、os06g0254300、os11g0134300、os09g0467700、os01g0146101、os01g0148100、os07g0187001、os11g0640300、os12g0257400、os07g0159200、os01g0845950、os11g0691100、os07g0153150、os11g0605100、os03g0223301、os08g0367300、os11g0618700、os07g0162450、os02g0129000、os03g0299700、os11g0549680、os07g0486000、os11g0569800、os09g0467700、os12g0250900、os12g0406000、os11g0696600、os11g0532600、os01g0520180、os07g0297400、os07g0535200、os12g0425800、os11g0685200、os12g0204600、os12g0239300、os07g0677100、os07g0103000、os05g0414400、os11g0693800、os05g0369900、os11g0687100、os12g0425500、os08g0255500、os11g0689800。
用于产生高产植物或除草剂抗性植物的方法可以包括调节参与激素信号传导途径(例如,包括激素合成、激素降解或激素调节)的基因,例如pzr1基因。例如,稻植物细胞中过表达pzr1基因可产生高产植物或除草剂抗性植物。pzr1基因的调节可包括将载体核酸序列的全部或一部分掺入到pzr1基因的0千碱基(kb)至0.5kb、0.5kb至1.0kb、1.8kb至3.8kb、1.0kb至5.0kb、5.0kb至10kb、0kb至2.0kb、1.0kb至4.0kb、0kb至5kb或超过10kb的距离内的基因组位置,从而导致导致pzr1基因表达的调节。在一些情况下,可通过将t-dna载体引入到pzr1基因的0kb至0.5kb、0.5kb至1.0kb、1.8kb至3.8kb、1.0kb至5.0kb、5.0kb至10kb、0kb至2.0kb、1.0kb至4.0kb、0kb至5kb或超过10kb的距离内的基因组位置,从而导致pzr1基因表达的调节来产生高产植物。在一些情况下,可将至少一个camv35s启动子引入pzr1基因的距离为0kb至0.5kb、0.5kb至1.0kb、1.8kb至3.8kb、1.0kb至5.0kb、5.0kb至10kb、0kb至2.0kb、1.0kb至4.0kb、0kb至5kb或超过10kb的基因组位置,以引起pzr1基因表达的调节。通过将基因与外源启动子如花椰菜花叶病毒启动子(camv35s)功能性连接,可以如上所述过表达基因。在一些情况下,可将1、2、3、4、5、6、7、8、9、10个或多于10个拷贝的camv35s启动子引入到pzr1基因的距离为0kb至5kb的基因组位置,以引起pzr1基因表达的调节。
与外源启动子功能性连接的基因的表达改变的植物的实例是pzr1-d。pzr1-d突变体植物或植物细胞可以包括至少一种基因的过表达。pzr1-d植物或植物细胞的多个实施方案可以包括pzr1基因的过表达。与拟南芥二聚化伴侣(dpb)同源的推定的转录因子基因的表达在pzr1-d植物中被激活。pzr1-d植物(例如pzr1-d突变体)还表现出包括增加的种子产量、降低的高度、增加的分蘖数和增加的br敏感性的表型。pzr1-d植物可显示改变的细胞分裂表型,包括产生小愈伤组织。此外,突变体根和叶中的细胞数目和大小与相同年龄的野生型植物中的细胞数目和大小不同。通过在br生物合成抑制剂丙环唑(pcz)存在下,筛选稻的激活标记突变体群可以分离到稻丙环唑抗性1-d(pzr1-d)突变体。因此,可以操纵pzr1表达以增加经济上重要的稻品种的种子产量。
与拟南芥dpb一样,稻pzr1在植物的不同组织中差异表达。
来自其它植物物种的类似基因(例如,其在用于产生高产植物或除草剂抗性植物的方法中可以被调节)可以通过使用本文公开的基因(例如,本文公开的稻基因)的登录号或序列进行blast搜索和backblast搜索并比较这些搜索的结果来鉴定。在两个方向上返回最强相关性的基因(例如,来自blast和backblast搜索的最接近的匹配)可以被合理地假定为与本文公开的基因同源。发现与本文公开的基因同源或可能同源的基因可用于产生高产植物或除草剂抗性植物。
在本公开的全文中,参考特定的基因、基因座、转录物或编码的基因产物。经常参考特定物种的特定等位基因。然而,本领域技术人员应理解,存在多种在植物系统发育的相关物种,相关属的成员,共同家族成员,或共同或相关分支的成员中鉴定同源基因,基因座,转录物或编码基因产物的方法。例如,可以将基因序列与包含另一种物种的序列的序列数据库进行比对,从而可以鉴定最强的命中。这种命中可以仔细检查指示感兴趣的同源物的特定基序的存在和/或可以针对源生物体的基因组或其它序列信息进行搜索,使得识别原始起始序列的‘反向比对(back-blast)’指示第二物种命中可能是同源物。用于鉴定物种间的同源基因或蛋白质的替代方法是本领域技术人员已知的,使得特定序列,基因名称,蛋白质名称或等位基因的公开能够在任何数量的作物物种,单子叶植物或双子叶植物亲属,或其它开花或非开花植物中找到同源基因,蛋白质或等位基因。
信号传导途径的调节
或者,除了植物或植物细胞中的基因表达的调节之外,或与植物或植物细胞中的基因表达的调节组合,或者作为植物或植物细胞中的基因表达的调节的结果,在产生高产植物或除草剂抗性植物的方法中,可以调节植物或植物细胞中的信号传导途径的活性。信号传导途径的调节可包括改变细胞过程、代谢过程、激素信号传导或细胞周期途径。在一些情况下,产生高产植物或除草剂抗性植物的方法改变信号传导途径的活性(例如,相对于参考植物的活性),而不改变基因表达的水平。例如,本文所述的基因工程方法可产生非功能性rna或蛋白质(例如,未成熟的rna或截短的蛋白质),而不改变从中产生rna或蛋白质的基因的转录。
植物的产量和植物响应环境变化的稳健性很大程度上依赖于控制植物生长特性的基因。例如,在多种情况下,植物通过改变其生长来响应环境诱因。本文描述的植物的许多生长特性依赖于植物细胞周期的调节。
细胞周期的调节在产生高产植物和高产作物田的策略中可以是重要的。植物生长的多个方面取决于细胞伸长和分裂,它们是由细胞周期调节的过程。细胞周期的进展具有两个主要检查点:从g1期到s期和从g2期到m期的转变。e2f家族的转录因子调节参与g1至s期转变的基因的转录。e2f的dna结合活性通过与二聚化配偶体(dp)蛋白结合而被刺激;e2f-dp异二聚体转录因子激活负责细胞周期控制的基因的表达,复制的起始,以及在s期期间dna合成所需的酶(kosugi和ohashi,2002)。e2f-dp途径在动物和植物中是保守的。在拟南芥中,已经鉴定了至少三种e2f(e2fa、e2fb和e2fc)和两种dp(dpa和dpb)以及它们的靶基因(magyar等人,2000;kosugi和ohashi,2002;vandepoele等人,2005)。拟南芥中e2f和dpa的过表达产生具有卷曲叶和子叶的矮化植物。全基因组分析鉴定了稻中的几种核心细胞周期基因,包括四种e2f和三种dp(osdp1、osdp2和osdp3)。然而,rt-pcr仅检测到dp1转录物,而检测dp2和dp3转录物的尝试没有成功(guo等人,2007)。
dp蛋白是广泛保守的蛋白,并参与细胞周期的调节。与e2f复合的dp能够启动s期特异性基因的转录。dp蛋白包含特征性的dna结合结构域和二聚化结构域。控制编码dp的核酸的表达可以提供差异的生长特征。例如,使用种子特异性启动子可以刺激细胞分裂速率并导致增加的种子生物量。类似地,使用根特异性启动子可以导致更大的根和更快的生长(例如,更多的生物量积累)。视网膜母细胞瘤蛋白rb负调节dp-e2f活性。因此,在某些情况下,rb的下调和dp的上调产生相似的结果。
与产量或除草剂抗性有关的基因(例如参与rb信号传导、dp/e2f信号传导和/或br信号传导的一种或多种基因)的表达的变化不同地导致,相对于未经历基因表达变化的相应植物(例如参考植物或参考植物品系),经历基因表达或信号传导途径活性的变化的植物或植物细胞的产量的增加。产量的增加可包括以下至少一项的改善(例如,增加):相对于参考植物或参考植物品系的根长度、植物重量、分蘖数、穗数、植物高度、种子重量、种子数、种子大小、初级分枝数、次级分枝数或叶角。产量的增加可以是相对于未经历基因表达变化的相应植物(例如,参考植物或参考植物品系),1%至5%、5%至10%、10%至30%、30%至50%、25%至75%、50%至80%、80%至100%、100%至150%、150%至160%、150%至200%、125%至175%、100%至200%、50%至150%、至少1%、至少2%、至少3%、至少5%、至少10%、至少15%、至少20%、至少30%、至少40%、至少50%、至少60%、至少70%、至少80%、至少90%、至少100%、至少110%、至少120%、至少130%、至少140%、至少150%、至少160%、至少170%、至少180%、至少190%、至少200%或超过200%。在一些实例中,产量的增加可以是至少5%。在其它实例中,产量的增加可以是至少10%或更高。
在一些情况下,使用本文公开的用于遗传修饰的方法改变基因的表达可导致参与rb信号传导、dp/e2f信号传导和/或br信号传导的基因的表达的变化。油菜素类固醇(br)在控制植物结构中起关键作用(clouse等人,1996;choe等人,1998;yamamuro等人,2000;sakamoto等人,2006)。在一些情况下,可通过改变参与dp信号传导途径、e2f信号传导途径或br信号传导途径的至少一种基因的表达来改善植物生长特性。植物生长特性可以包括增加的生物量,或与生长相关的其它特征。生物量可以指所产生的生物材料的量。生物量的增加可以是相对于相应参考植物的生物量(例如相对于相应野生型植物的生物量)在植物的一个或多个部分中。增加的生物量可用于描述增加的产量,特别是种子产量。
在引入遗传修饰后,可以选择具有增加的dp多肽活性的植物。增加的dp多肽活性可以与例如生长特性改善,种子产量高相关。增加的信号传导活性可以通过增加dp表达水平或活性来实现。增加dp激动剂如e2f的表达水平或活性(例如在植物细胞内)也可以增加dp多肽的活性。或者或另外,降低dp拮抗剂如rb的表达水平或活性可导致dp多肽的活性增加。细胞周期调节剂如细胞周期蛋白或cdk的表达或活性可以在用于产生高产植物或除草剂抗性植物的方法中调节,如本文所公开的。
编码dp的核酸或其功能变体可以来源于多种天然或人工来源,例如真核基因组。来源可以是微生物来源,例如酵母或真菌,或植物,藻类或动物(包括人)来源。核酸可以通过有意的人类操纵或随机诱变在组成和/或基因组环境中从其天然形式修饰。核酸优选是植物来源的,不管是来自相同的植物物种(例如,与其被引入的植物物种)还是来自不同的植物物种。核酸可以从双子叶物种例如拟南芥(arabidopsisthaliana)中分离。核酸可以从单子叶物种,例如稻(oryzasativa)或玉米中分离。
与改变植物中dp或e2f的表达有关的其他公开可以在2005年12月15日公开的pct公开wo2005/117568和2000年8月17日公开的wo00/47614中找到。通过引用将wo2005/117568和wo00/4761整体并入本文用于所有目的。
油菜素类固醇(br)生物合成或信号传导途径有缺陷的突变体通常表现出半矮化,这同能够实现绿色革命的高产赤霉素突变体一样。然而,br突变体中营养生长的减少不一定对应于种子产量的增加。
稻中典型的br缺陷型突变体表现出矮化表型,包括生长早期营养阶段的暗绿色,直立叶和缩短的叶鞘。在开花后,突变体植株仅为野生型植株高度的约40%,节间伸长,尤其是第二节间伸长与野生型不同,穗畸形,枝条和小穗数量减少(hong等人,2003;tanabe等人,2005;nakamura等人,2006)。相反,过表达br生物合成基因的植物或具有增加的br敏感性的植物通常具有大的身高,花和种子的数量增加,从叶片的垂直轴向近轴侧弯曲增加(wu等人,2008;tanaka等人,2009;zhang等人,2009)。调节参与调节内源br水平或影响br敏感性的基因的表达是一种有前途的改善农业性状的技术。迄今为止,关键br生物合成基因dwf4在拟南芥、稻(oryzasativa)、番茄、油菜(brassicanapus)和玉米中的表达已经改变(choe等人,2001;sakamoto等人,2006;liu等人,2007;li等人,2016;sahni等人,2016)。类似地,已经报道了稻中br受体brassinosteroidinsensitive1(bri1)突变体d61和玉米中zmbri1-rnai植物的研究(morinaka等人,2006;kir等人,2015)。在这些实例中,dwf4或bri1的过表达或破坏导致具有所需性状如增加的种子产量的植物。因此,鉴定与br生物合成或作用相关的新突变体可揭示增强种子产量表型的新方法。
相对于缺乏基因表达改变的相应植物,改变基因表达的方法可以在以下任何一项或多项中增加:(i)植物的一个或多个部分,特别是地上(可收获的)部分的生物量(重量)增加,任何其它可收获部分的根生物量增加或生物量增加;(ii)种子产量增加,其可以由种子生物量(种子重量)的增加引起,并且其可以是每株植物的种子重量的增加或基于单个种子的种子重量的增加,并且其种子重量的增加可以是由于改变的种子大小,例如种子长度和/或种子宽度和/或种子面积;(iii)(饱满的)种子的数目增加;(iv)种子大小增加,其也可以影响种子的组成;(v)种子体积增加,其也可以影响种子的组成;(vi)收获指数增加,其表示为可收获部分(例如种子)的产量与总生物量的比率;和(vii)千粒重(tkw)增加,其从计数的饱满的种子的数量和它们的总重量外推。
以稻为例,产量增加可以通过以下一种或多种增加来体现:每公顷或每英亩的植物数,每株植物的穗数,每穗的小穗数,每穗的花数,种子饱和率的增加,千粒重的增加等。例如,突变体植物中的千粒重可以是20g、24g、28g、30g、33g、36g、40g、45g、50g、55g、60g、20g至24g、24g至28g、30g至33g、33g至36g、36g至40g、40g至45g、45g至50g、50g至55g、55g至60g或超过60g。产量的增加也可能导致修改的结构,或者可能作为修改的结构而发生。
本文公开的高产植物和/或除草剂抗性植物相对于相应的野生型植物,相对于鉴定的一种或多种基因的表达不同或相关蛋白或途径的活性不同的近等基因品系可具有增加的产量。增加的产量可以伴随有相对于相应野生型植物在生命周期的相应阶段的生长速率,增加的生长速率(在生命周期的至少一部分期间)。生长速率的增加可以是植物的一个或多个部分(包括种子)特异性的,或者可以基本上遍布整个植物。生长速率的增加可以是相对于如本文所述的未经历基因表达变化或信号传导途径活性变化的相应植物(例如,参考植物或参考植物品系),1%至5%、5%至10%、10%至30%、30%至50%、25%至75%、50%至80%、80%至100%、100%至150%、150%至160%、150%至200%、125%至175%、100%至200%、50%至150%、至少1%、至少2%、至少3%、至少5%、至少10%、至少15%、至少20%、至少30%、至少40%、至少50%、至少60%、至少70%、至少80%、至少90%、至少100%、至少110%、至少120%、至少130%、至少140%、至少150%、至少160%、至少170%、至少180%、至少190%、至少200%或超过200%。具有增加的生长速率的植物可以表现出早期开花。生长速率的增加可以在植物生命周期中的一个或多个阶段或在基本上整个植物生命周期期间发生。在植物生命周期的早期阶段增加的生长速率可以反映增强的活力。生长速率的增加可以改变植物的收获周期,允许植物比其它可能的更晚播种和/或更早收获。如果生长速率充分增加,则其可允许播种相同植物物种的其它种子(例如播种和收获稻植物,然后播种和收获其它稻植物,所有这些都在一个常规生长时期内)。类似地,如果生长速率充分增加,则其可允许播种不同植物物种的其它种子(例如播种和收获稻植物,随后例如播种和任选收获大豆、马铃薯或任何其它合适的植物)。在一些植物的情况下,从同一根茎收获额外的次数也是可能的。改变植物的收获周期可导致每英亩年生物量产生的增加(由于任何特定植物可生长和收获的次数的增加)。生长速率的增加还可以允许在比它们的野生型对应物更宽的地理区域中栽培转基因植物,因为生长作物的地域限制通常由种植时(早季)或收获时(晚季)的不利环境条件决定。如果缩短收获周期,则可以避免这种不利条件。生长速率可以通过从绘制生长实验的生长曲线导出各种参数来确定,这些参数可以是:t-mid(植物达到其最大尺寸的50%所花费的时间)和t-90(植物达到其最大尺寸的90%所花费的时间)等。
任何生长特性的改善可以为植物提供改善的胁迫耐受性。这些胁迫可以是植物所暴露的生物和/或非生物(环境)胁迫。典型的非生物或环境胁迫包括由非典型的热或冷/冷冻温度引起的温度胁迫;盐胁迫;水胁迫(干旱或过量的水)。非生物胁迫也可以由化学物质引起。生物胁迫通常是由病原体如细菌、病毒、真菌和昆虫引起的那些胁迫。
修饰基因表达的方法
用于改变植物中基因或信号传导途径的表达的有效方法是将遗传序列引入植物的至少一个细胞中。在一些情况下,遗传修饰用于改变参与rb信号传导、dp/e2f信号传导和/或br信号传导的一种基因或多种基因的表达。例如,将核酸序列,如启动子序列引入植物细胞可引起植物细胞或植物中或由植物细胞产生的多株植物中基因表达的增加。如本文所述,遗传修饰的方法可用于产生高产植物,增加植物中的种子产量,提高用除草剂处理的作物田中的产量,以及用于清除田地杂草的方法中。
核酸序列可以稳定地或瞬时地存在于其被引入的细胞中。掺入细胞基因组dna中的核酸序列稳定地存在于细胞中。易受细胞降解或从细胞输出的核酸是瞬时存在于细胞中的核酸的实例。
可以使用整合载体将核酸序列稳定地引入细胞的基因组dna中。整合载体可以是病毒的或非病毒的。病毒整合载体包括逆转录病毒、腺相关病毒和慢病毒。非病毒整合策略可包括附加型载体和注射裸dna。
核酸可以在通过非整合载体引入细胞后瞬时存在于细胞中。非整合载体可以是病毒的或非病毒的。病毒非整合载体包括腺病毒、腺相关病毒、整合缺陷逆转录慢病毒、痘病毒和仙台病毒。用于将核酸引入细胞的非病毒非整合策略包括将附加型载体引入植物细胞和将裸dna注射入植物细胞。
遗传修饰方法的代表性实例包括:激活标记(例如t-dna激活)、基因组中靶向诱导的局部损伤(tilling)、crispr-cas系统、定点诱变、定向进化、同源重组或通过将编码dp的核酸或其编码dp多肽或dp多肽的同源物的功能变体引入植物。在多种情况下,遗传修饰的方法包括使用载体将核酸序列递送至细胞。
使用遗传修饰以将核酸序列递送至细胞的方法可导致将序列的全部或一部分掺入细胞基因组中。将载体递送至细胞可导致将载体序列的全部或一部分掺入细胞基因组中的目的基因中,并可引起目的基因表达的调节。将载体的核酸序列的全部或一部分并入到目的基因的0千碱基(kb)至0.5kb、0.5kb至1.0kb、1.8kb至3.8kb、1.0kb至5.0kb、5.0kb至10kb、0kb至2.0kb、1.0kb至4.0kb、0kb至5kb或超过10kb的距离内的基因组位置,可导致对目的基因的编码区(例如,包含目的基因外显子的细胞dna的区域)表达的调节。当被引入细胞基因组中基因(例如,目的基因)的编码区的上游或下游时,载体的序列可以改变细胞中基因的表达。在一些情况下,可以使用翻译增强子或内含子代替载体中的启动子或除了载体中的启动子之外还可以使用翻译增强子或内含子。通过其天然启动子对靶基因表达的调节可以被破坏,并且在将核酸序列插入细胞后,该基因可以由新引入的启动子指导。
激活标记可以包括将t-dna序列(例如,通过载体,如含有pga2715插入片段的ti质粒)或其它插入激活标记载体插入细胞中。用于激活标记的载体通常包含核酸序列,并且可以在目的基因的基因组附近包含启动子序列或增强子序列。将激活标记载体递送至细胞可导致激活标记载体的序列的全部或部分并入细胞的基因组中。将激活标记载体的核酸序列的全部或一部分递送至目的基因的0千碱基(kb)至0.5kb、0.5kb至1.0kb、1.0kb至5.0kb、1.8kb至3.8kb、5.0kb至10kb、0kb至2.0kb、1.0kb至4.0kb、0kb至5kb或超过10kb的距离内的基因组位置,可导致对目的基因的编码区(例如,包含目的基因外显子的细胞dna的区域)的表达的调节。当被引入细胞基因组中基因(例如,目的基因)的编码区的上游或下游时,激活标记载体的序列可以改变细胞中基因的表达。在一些情况下,可以使用翻译增强子或内含子代替激活标记载体中的启动子或除了激活标记载体中的启动子之外还可以使用翻译增强子或内含子。通过其天然启动子对靶基因表达的调节可以被破坏,并且在将核酸序列插入细胞后,该基因可以由新引入的启动子指导。启动子通常编码在t-dna的序列中,尽管其它插入片段也是合适的。该t-dna或其它区段随机插入植物基因组中,例如通过农杆菌感染并导致插入的t-dna附近基因的过表达。由于接近引入的启动子的基因的过表达,所得到的转基因植物可以表现出显性表型。在一些情况下,在基因组中插入t-dna载体可引起插入t-dna侧翼的基因的转录激活,并可导致显性功能获得性突变。待引入的启动子可以是能够指导基因在所需生物体(在这种情况下为植物)中表达的任何启动子。例如,组成型,组织优选,细胞类型优选和诱导型启动子都适用于t-dna激活。
tilling可用于在dp基因座中引入遗传修饰。tilling是一种用于产生和/或鉴定和分离dp编码核酸(表现出dp活性)的诱变变体的诱变技术。tilling还可以允许选择携带这种突变变体的植物。这些突变变体相对于其天然形式的基因所表现出的活性可以表现出更高的dp活性。tilling将高密度诱变与高通量筛查方法相结合。tilling中的步骤可以包括:(a)ems诱变;(b)个体的dna提取和合并;(c)目的区域的pcr扩增;(d)变性和退火以允许形成异源双链体;(e)检测池中的作为色谱图中的额外峰的异源双链体;(f)鉴定突变个体;和(g)突变pcr产物的测序。
靶向诱变系统如crispr-cas9系统可用于产生编码dp的核酸的变体或其编码活性蛋白的功能变体。例如,可以设计指导rna以将dcas9激活剂引导至目的基因(例如编码dp的基因)的启动子或调节区。转录激活因子可以与dcas9融合,dcas9又可以激活目的基因的表达。可以使用单一和/或多种不同的激活因子来扩增表达。crispr-cas9系统也可用于产生基因表达改变的等位基因变体。例如,可以使用crispr-cas9系统产生过表达dp的编码dp的基因的等位基因变体。
定点诱变可用于产生编码dp的核酸的变体或其编码活性蛋白的功能变体。有几种方法可用于实现定点诱变;最常见的是基于pcr的方法。
定向进化可用于产生编码dp的核酸的变体。这包括dna改组,随后是适当的筛查和/或选择的重复,以产生编码dp的核酸或其部分的变体,其编码具有修饰的生物活性的dp多肽或其部分。
同源重组允许在基因组中的特定位置引入选定的核酸。待靶向的核酸,即编码dp的核酸或其变体可以被引入例如高表达区域中。待靶向的核酸可以是用于替代内源基因的改进的等位基因,或者可以被另外引入或被引入内源基因。
至少一种基因(例如参与产量或除草剂抗性的基因,例如参与细胞周期信号传导、激素调节或代谢途径的一种或多种基因(例如参与rb信号传导、dp/e2f信号传导和/或br信号传导的一种或多种基因)的表达的变化不同地导致,相对于未经历表达变化的相应植物,经历基因表达或信号传导途径活性变化的植物的产量增加。产量的增加可以是相对于未经历表达变化的一种或多种相应植物(例如,参考植物或参考植物品系),1%至5%、5%至10%、10%至30%、30%至50%、25%至75%、50%至80%、80%至100%、100%至150%、150%至160%、150%至200%、从125%至175%、100%至200%、50%至150%、至少1%,至少2%、至少3%、至少5%、至少10%、至少15%、至少20%、至少30%、至少40%、至少50%、至少60%、至少70%、至少80%、至少90%、至少100%、至少110%、至少120%、至少130%、至少140%、至少150%、至少160%、至少170%、至少180%、至少190%、至少200%、或超过200%。在一些实例中,产量的增加可以是至少5%。在其它实例中,产量的增加可以是至少10%或更高。
参与产量或除草剂抗性的至少一种基因(例如,参与rb信号传导、dp/e2f信号传导和/或br信号传导的一种或多种基因)的表达变化不同地导致,相对于未经历表达或信号传导途径活性变化的相应植物,植物的除草剂抗性增加。例如,当两种植物都暴露于除草剂,例如,芸苔素唑或丙环唑(例如,以类似的浓度)时,至少一种基因,例如参与产量或除草剂抗性的基因,例如参与细胞周期信号传导、激素调节或代谢途径的一种或多种基因(例如参与rb信号传导、dp/e2f信号传导和/或br信号传导的一种或多种)的表达的变化不同地导致,相对于未经历表达变化的相应植物,根长度、植物重量、分蘖数、穗数、植物高度、种子重量、种子数、种子大小、初级分枝数、次级分枝数或叶角的改善。
载体
载体可用于将核酸序列引入植物或植物细胞,例如,在产生高产植物或除草剂抗性植物的方法中。本文所述的方法可包括将核酸或多肽序列引入细胞中的多种不同的策略。将序列引入细胞可包括将细胞与载体接触。在许多情况下,载体包括病毒,例如慢病毒,逆转录病毒,腺病毒,腺相关病毒,疱疹病毒,痘病毒,痘苗病毒或仙台病毒。在一些情况下,载体是非病毒载体,例如裸质粒或附加体。
在多种情况下,在产生高产植物或除草剂抗性植物的方法中引入植物细胞的核酸序列是外源dna序列。载体可以包含线性化或环化的核酸(dna或rna)序列。载体还可以包括附加体。在一些情况下,裸核酸(例如,线性化或环化的dna或rna)或多肽以质粒的形式引入细胞中。将裸序列递送至细胞可包括去除细胞壁和/或用于膜透化的策略,如电穿孔,声穿孔,弹道核酸引入,以及用化学物质如聚凝胺或皂苷处理细胞膜。
用化学物质处理植物
根据本文公开的一些方法,用外源试剂如化学物质或激素处理植物。在本文公开的方法中有用的化学物质包括调节植物或植物细胞中基因表达或信号传导途径活性的化学物质。在一些情况下,可用于产生高产植物或除草剂抗性植物的化学物质可调节细胞过程、代谢过程、激素信号传导途径或细胞周期途径。除草剂和植物激素是用于调节植物或植物细胞中基因表达或信号传导途径活性的化学物质的代表性实例。
已知在杂草控制和作物生长中有价值的多种化学物质可用于产生如本文所公开的高产植物、高产作物田或除草剂抗性植物。在一些情况下,用于杂草控制(例如除草剂)或作物生长(例如激素如油菜素类固醇)的化学物质经常影响细胞周期途径或激素调节途径。例如,调节性化学物质如激素(例如油菜素类固醇)可用于作物生长。作物田的产量可以通过去除不希望的植物如杂草来提高。用一种化学物质(例如除草剂)或多种化学物质处理作物田中的植物通常导致比人工去除不希望的植物更有效地从作物田中去除不希望的植物。在一些情况下,除草剂的使用可能对田地中的期望植物(例如,作物植物如稻或玉米)具有有害影响,降低了它们在从作物田地中去除不期望的植物如杂草的方法中的使用益处。
如本文所述,产生高产植物的方法可赋予使用那些方法产生的植物对除草剂的抗性。例如,包含影响dp表达或dp-e2f信号传导的突变的植物可以赋予植物对某些除草剂的抗性。用于产生高产植物的这种策略可以减轻除草剂在作物田的维持中的有害作用。因此,用于调节dp的表达或影响dp-e2f信号传导(例如,通过引入pzr1-d突变)的方法可用于清除田地杂草的方法中。
可用于田地作物或杂草管理的化学物质包括芸苔素唑(brz)、丙环唑(pcz)和ycz-18。芸苔素唑(brz)是一种br生物合成抑制剂,其已用于帮助鉴定拟南芥中br生物合成和信号传导途径的新组分(wang等人,2002;kim等人,2014;maharjan等人,2014)。丙环唑(pcz)是一种三唑类抑制剂,可用于稻br敏感性筛查(corvalan和choe,2017)。与brz(其可能是昂贵的)相比,pcz是一种易于获得和廉价的商业使用的杀真菌剂,允许其用于大规模化学基因组学和田地测试。丙环唑(pcz)是一种有效的、特异性的br抑制剂,并且其在玉米和短梗霉属(brachypodium)中的应用已在以前已得到证实(hartwig等人,2012;corvalan和choe,2017)。与其昂贵的对应物,即芸苔素唑(brz)相比,pcz的低成本允许进行大规模试验以筛选t-dna激活标记突变体群。pcz处理产生典型的br缺陷型表型,如偏上生长、暗绿色子叶以及下胚轴和初级根的生长减少(hartwig等人,2012)。遗传破坏的dwf4-1突变体幼苗的pcz处理表明dwf4可能是pcz的靶标(asami等人,2001;chung等人,2011;hartwig等人,2012)。
参与rb、dp、e2f或br信号传导的基因的表达的变化可赋予植物对除草剂、杀真菌剂、杀线虫剂、杀细菌剂或生物合成途径抑制剂的抗性。例如,与相应的未改变植物相比,dp表达增加的植物可以表现出对br生物合成抑制剂如pcz、油菜素唑或ycz-18的增加的抗性。例如,当两种植物都暴露于除草剂,例如,芸苔素唑或丙环唑(例如,以类似的浓度)时,至少一种基因,例如参与产量或除草剂抗性的基因,例如参与细胞周期信号传导、激素调节或代谢途径的一种或多种基因(例如参与rb信号传导、dp/e2f信号传导和/或br信号传导的一种或多种基因)的表达的变化不同地导致,相对于未经历表达变化的相应植物,根长度、植物重量、分蘖数、穗数、植物高度、种子重量、种子数、种子大小、初级分枝数、次级分枝数或叶角的改善。在一些情况下,与参考植物或参考植物品系相比,这些结果中的任一个或这些结果的组合的改善可被认为是对除草剂的抗性增加。与相应植物(例如,参考植物或参考植物品系,如野生型植物)相比,对给定化学物质的抗性的增加可以是1%至5%、5%至10%、10%至30%、30%至50%、25%至75%、50%至80%、80%至100%、100%至150%、150%至160%、150%至200%、125%至175%、100%至200%、50%至150%、至少1%、至少2%、至少3%、至少5%、至少10%、至少15%、至少20%、至少30%、至少40%、至少50%、至少60%、至少70%、至少80%、至少90%、至少100%、至少110%、至少120%、至少130%、至少140%、至少150%、至少160%、至少170%、至少180%、至少190%、至少200%或超过200%。在一些实例中,抗性的增加可以是至少5%。在其它实例中,抗性的增加可以是至少10%。
在一些情况下,可以相对于在除草剂存在下被杀死的非作物植物(例如,杂草)的百分比,而作物植物(例如,存在于处理的、和/或用相同除草剂和/或以相同除草剂浓度处理的相同田地中的作物植物)不被杀死,测量对除草剂的抗性的增加。在一些情况下,至少100%、至少99.9%、至少99.5%、至少99.0%、至少98%、至少97%、至少96%、至少95%、至少90%、至少85%、至少80%、至少75%、至少70%、至少65%、至少60%、至少55%、至少50%、至少45%、至少40%、100%至95%、95%至90%、90%至85%、85%至80%、80%至70%、70%至60%、60%至50%、50%至40%、40%至30%、30%至20%,20%至10%,20%至1%的非作物植物(例如,杂草)可以在除草剂存在下被杀死,而作物植物(例如,存在于处理的、和/或用相同除草剂和/或以相同除草剂浓度处理的相同田地中的作物植物)不被杀死。
植物或植物品系对除草剂的抗性的增加可以导致植物或作物田的产量增加。在一些情况下,如本文所述的除草剂抗性植物可在除草剂存在下存活,而非除草剂抗性植物(例如杂草)在除草剂存在下无法存活。在一些情况下,除草剂抗性植物或包含除草剂抗性植物的作物田表现出增加的产量,因为在除草剂存在下除草剂抗性植物能够超越非除草剂抗性植物(例如杂草)。
一些抗性植物品系在处理过的和未处理过的植物之间没有表现出显著的表型差异。例如,pcz抗性品系对于处理过的和未处理过的植物都可以表型相似。或者,其它抗性植物品系在处理过的和未处理过的植物之间确实表现出表型差异。在一些情况下,抗性品系在处理的和未处理过的植物之间在生长特性方面可能不同。例如,抗性品系在处理过的和未处理过的植物之间可表现出高度差异。相对于未处理过的植物,处理过的植物可以是矮化的。
在一些情况下,抗性和非抗性品系可以暴露于不同剂量的给定化学物质以产生不同的生长特性。例如,可以用浓度为1μm-5μm、5μm-20μm、20μm-30μm、30μm-90μm、1μm、2μm、3μm、4μm、5μm、10μm、15μm、20μm、25μm、30μm、40μm、50μm、60μm、70μm、80μm、90μm、100μm、110μm、120μm、130μm、140μm、150μm、高于150μm、10μm至20μm、20μm至30μm、30μm至50μm、50μm至90μm、90μm至100μm、100μm至110μm、110μm至130μm,或130μm至150μm的pcz处理抗性和非抗性稻品系,以产生生长特性的差异。在一些实例中,抗性品系相对于非抗性品系可在约10μmpcz下表现出表型差异,例如根生长。在一些实例中,抗性品系相对于非抗性品系可在约20μmpcz下表现出表型差异。在一些实例中,抗性品系相对于非抗性品系可在约30μmpcz下表现出表型差异。在一些实例中,抗性品系相对于非抗性品系可在约40μmpcz下表现出表型差异。在一些实例中,抗性品系相对于非抗性品系可在约50μmpcz下表现出表型差异。在一些实例中,抗性品系相对于非抗性品系可在约60μmpcz下表现出表型差异。在一些实例中,抗性品系相对于非抗性品系可在约70μmpcz下表现出表型差异。在一些实例中,抗性品系相对于非抗性品系可在约80μmpcz下表现出表型差异。在一些实例中,抗性品系相对于非抗性品系可在约90μmpcz下表现出表型差异。在一些实例中,抗性品系相对于非抗性品系可在约100μmpcz下表现出表型差异。
在一些情况下,在暴露于给定化学物质时,抗性和非抗性品系之间的生长特性的差异可被利用来清除田间的杂草。在这种情况下,给定的化学物质可用作除草剂。例如,dp、e2f或br信号传导中的突变可赋予对br抑制剂,如芸苔素唑、pcz或ycz-18的抗性。例如,可以用浓度为1nm-5nm、5nm-10nm、10nm-20nm、20nm-50nm、50nm-100nm、100nm-200nm、200nm-500nm、500nm-1μm、1μm-2μm、2μm-3μm、3μm至5μm、5μm至10μm,或高于10μm的芸苔素唑处理抗性和非抗性稻品系,以产生生长特性的差异。具有至少一种杂草的田地中的抗性品系可暴露于br抑制剂。在暴露于br抑制剂时(例如在从田地收获作物之前),与参考植物或参考植物品系(例如非抗性植物品系,如野生型植物如杂草)相比,除草剂抗性品系在生长特性方面没有显著变化。然而,参考植物或参考植物品系(例如野生型植物如杂草)可表现出显著降低的生长特性,包括导致矮化表型的较慢的根生长。
可以单独使用br抑制剂或与其它化学物质如其它除草剂组合使用br抑制剂。例如,单一的br抑制剂,例如pcz,可用于具有至少一种杂草的田地以清除杂草。在其它实例中,可以使用br抑制剂与其它除草剂的组合。组合或“叠加”一定水平的对br抑制剂和其他除草剂的抗性可以将这些除草剂组合用于有效的杂草控制而不会损害作物和/或降低作物产量。此外,将br抑制剂与其他除草剂(例如草甘膦)组合可导致对杂草谱(例如,一年生和多年生的草、荨麻、茄属植物、猪草、牵牛花等)的更广泛水平的保护。在这种情况下,br抑制剂和其它除草剂可共同施用以清除田地中的至少一种杂草。
在抗性作物品系(例如除草剂抗性植物)和非抗性杂草之间的生长特性的差异可用于收获高产作物而不收获杂草。与非抗性杂草相比显示产量增加的对br抑制剂具有抗性的作物品系可以被喷br抑制剂。br抑制剂可以阻碍杂草的生长,赋予杂草矮化表型,同时抗性高产作物不受影响。收获方法可选择性地仅收获作物同时将杂草留在田地中。
本文公开的方法还可以包括用激素如油菜素类固醇(br)处理植物或植物细胞。在一些情况下,植物或植物细胞的处理可导致基因表达或信号传导途径的活性(例如,与生长、代谢过程或细胞过程(例如,细胞周期调节)相关的基因或信号传导途径)的调节。例如,用油菜素类固醇(例如油菜素内酯(bl))处理植物可导致基因表达增加或与生长,代谢过程或细胞过程相关的信号传导途径活性增加。在一些情况下,用类固醇处理植物或植物细胞的效果是处理过的植物超越未处理过的第二植物(例如杂草或来自参考植物品系的植物)的能力的改善。例如,用激素(例如bl)处理的植物(例如植物细胞)可以改善植物超越第二、未处理过的植物(例如杂草)的能力,例如通过增加植物产量。
植物
多种植物可用于产生本文公开的高产植物或除草剂抗性植物的方法。高产植物可以包含遗传修饰。在多种情况下,高产植物可包含过表达的基因,下调的基因或过表达的基因与下调的基因的组合。
如本文所述,基因表达的修饰可以在多种植物物种中完成。在本文公开的方法和植物中特别有用的植物和植物细胞包括属于植物界(viridiplantae)超家族的植物和植物细胞。特别地,单子叶植物和双子叶植物可用于本文公开的方法和用于产生本文描述的植物。单子叶植物和双子叶植物包括饲用豆类(fodderlegume)、豆科饲用植物(foragelegume)、观赏植物、粮食作物、树木和灌木。在一些情况下,可用于本文公开的方法(包括产生本文描述的植物)中的植物或植物细胞是金合欢属物种(acaciaspp.)、槭树属物种(acerspp.)、猕猴桃属物种(actinidiaspp.)、七叶树属物种(aesculusspp.)、新西兰贝壳杉(agathisaustralis)、苦味合欢(albiziaamara)、三色黄杨(alsophilatricolor)、须芒草属物种(andropogonspp.)、落花生属物种(arachisspp.)、槟榔(arecacatechu)、asteliafragrans、鹰嘴黄芪(astragaluscicer)、baikiaeaplurijuga、桦木属(betulaspp.)、芸苔属(brassicaspp.)、木榄(bruguieragymnorrhiza)、非洲伯克木(burkeaafficana)、紫铆(buteafrondosa)、cadabafarinosa、朱缨花属物种(calliandraspp.)、大叶茶(camelliasinensis)、美人蕉(cannaindica)、辣椒属物种(capsicumspp.)、决明属物种(cassiaspp.)、距豌豆(centroemapubescens)、木瓜属物种(chaenomelesspp.)、肉桂(cinnamomumcassia)、小果咖啡(coffeaarabica)、可乐豆木(colophospermummopane)、小冠花(coronilliavaria)、cotoneasterserotina、山楂属物种(crataegusspp.)、香瓜属物种(cucumisspp.)、柏木属物种(cupressusspp.)、银蕨(cyatheadealbata)、榅桲(cydoniaoblonga)、日本柳杉(cryptomeriajaponica)、香茅属物种(cymbopogonspp.)、银背番桫椤(cyntheadealbata)、榅桲(cydoniaoblonga)、金钱黄檀(dalbergiamonetaria)、大叶骨碎补(davalliadivaricata)、山马蟥属物种(desmodiumspp.)、粗糙蚌贝蕨(dicksoniasquarosa)、diheteropogonamplectens、diocleaspp、镰扁豆属物种(dolichosspp.)、直矛豆(dorycniumrectum)、echinochloapyramidalis、ehrartiaspp.、龙爪稷(eleusinecoracana)、画眉草属物种(eragrestisspp.)、刺桐属物种(erythrinaspp.)、桉属物种(eucalyptusspp.)、eucleaschimperi、eulaliavillosa、荞麦属物种(fagopyrumspp.)、费约果(feijoasellowiana)、草莓属物种(fragariaspp.)、千斤拔属物种(flemingiaspp)、freycinetiabanksii、童氏老鹳草(geraniumthunbergii)、银杏(ginkgobiloba)、野黄豆(glycinejavanica)、毒鼠豆属物种(gliricidiaspp)、陆地棉(gossypiumhirsutum)、银桦属物种(grevilleaspp.)、鞘籽古夷苏木(guibourtiacoleosperma)、岩黄芪属物种(hedysarumspp.)、牛鞭草(hemarthiaaltissima)、扭黄茅(heteropogoncontortus)、大麦(hordeumvulgare)、红苞茅草(hyparrheniarufa)、小连翘(hypericumerectum)、hypertheliadissoluta、白花庭蓝(indigoincarnata)、鸢尾属物种(irisspp.)、leptarrhenapyrolifolia、胡枝子属物种(lespedizaspp.)、lettucaspp.、银合欢(leucaenaleucocephala)、loudetiasimplex、罗顿豆(lotonusbainesii)、百脉根属物种(lotusspp.)、macrotylomaaxillare、苹果属物种(malusspp.)、木薯(manihotesculenta)、紫苜蓿(medicagosativa)、水杉(metasequoiaglyptostroboides)、粉芭蕉(musasapientum)、烟草属物种(nicotianumspp.)、驴食豆属物种(onobrychisspp.)、鸟足豆属物种(ornithopusspp.)、稻属物种(oryzaspp.)、非洲海棠(peltophorumafficanum)、狼尾草属物种(pennisetumspp.)、鳄梨(perseagratissima)、碧冬茄属物种(petuniaspp.)、菜豆属物种(phaseolusspp.)、槟榔竹(phoenixcanariensis)、山麻兰(phormiumcookianum)、石楠属物种(photiniaspp.)、白云杉(piceaglauca)、松属物种(pinusspp.)、豌豆(pisumsativum)、新西兰罗汉松(podocarpustotara)、pogonarthriafleckii、pogonarthriasquarrosa、杨属物种(populusspp.)、牧豆树(prosopiscineraria)、花旗松(pseudotsugamenziesiio)、pterolobiumstellatum、西洋梨(pyruscommunis)、栎属物种(quercusspp.)、rhaphiolepsisumbellata、美味棒花棕(rhopalostylissapida)、rhusnatalensis、欧洲醋果(ribesgrossularia)、茶藨子属物种(ribesspp.)、洋槐(robiniapseudoacacia)、蔷薇属物种(rosaspp.)、悬钩子属物种(rubusospp.)、柳属物种(salixspp.)、schyzachyriumsanguineum、金松(sciadopitysverticillata)、北美红杉(sequoiasempervirens)、巨杉(sequoiadendrongiganteum)、两色蜀黍(sorghumbicolor)、菠菜属物种(spinaciaspp.)、sporobolusfimbriatus、stiburusalopecuroides、stylosanthoshumilis、葫芦茶属物种(tadehagispp.)、落羽松(taxodiumdistichum)、阿拉伯黄背草(themedatriandra)、车轴草属物种(trifoliumspp.)、小麦属物种(triticumspp.)、异叶铁杉(tsugaheterophvlla)、越桔属物种(vacciniumspp.)、野豌豆属物种(viciaspp.)、葡萄(vitisvinifera)、锥穗沃森花(watsoniapyramidata)、马蹄莲(zantedeschiaaethiopica)、玉米(zeamays)、苋菜(amaranth)、洋蓟(artichoke)、芦笋、西兰花、球芽甘蓝(brusselssprouts)、卷心菜、卡诺拉(canola)、胡萝卜、花椰菜、芹菜、羽衣甘蓝(collardgreens)、亚麻、无头甘蓝、小扁豆、油菜、秋葵、洋葱、马铃薯、稻、大豆、草莓、甜菜、甘蔗、向日葵、番茄、南瓜、茶、树、草(包括牧草)或藻类。
在一些情况下,植物是谷物植物。在一些情况下,植物是稻植物,如稻属的植物,如籼稻(oryzasativassp.indica)或粳稻(oryzasativassp.japonica)。稻既作为主食又作为分子研究的模型植物。
稻植物可以在稻田或温室中生长。在一些实施方案中,在5月下旬移植田地中的3周龄的幼苗,并在10月中下旬收获。
在一些情况下,植物可以在播种之前进行表面灭菌。例如,野生型植物和/或转基因植物可以在播种到含有0.5xmurashige和skoog(ms)盐和1%蔗糖的0.8%琼脂固化培养基上之前进行表面灭菌。植物可以在黑暗中在4℃分层48小时。然后可以将板转移到植物可以生长的生长室中。植物可以在18℃至25℃、23℃至25℃、25℃至27℃、27℃至30℃、30℃至35℃或35℃至45℃的温度下生长。植物可以维持在总黑暗中,或在长日条件(14小时光照/10小时黑暗的光周期)下维持在光照(80-100μmolm-2s-1强度)中。例如,植物可以在22℃下在16小时光照/8小时黑暗的光周期下在白光(80μmolm-2s-1)中生长。如果需要,可以在ms培养基中生长1、2、3、4、5、6、7、8、9、10或超过10天后将幼苗转移到土壤中。
转到附图,可以看到以下内容:
图1a显示了来自模拟处理组的五株稻植物的图像,每株植物具有芽和根。在这些图像的右边是来自30μmpcz处理组的稻植物的五个图像,每一株的芽长度短于模拟处理组的任何芽,根长度短于pcz处理组的任何根。比例尺在图的左上角,标记表示其在图像中代表5cm。
图1b显示了模拟处理和pcz处理的植物的总植物长度和根长度的柱状图。y轴指示以5的增量从0至25的以厘米(cm)计的长度。显示在x轴上的是测试的不同组,它们是从左到右为“模拟总的”、“pcz总的”、“模拟根”和“pcz根”。柱状图中的每个柱包括误差棒,并且标记为“pcz总的”和“pcz根”的柱在误差棒之上具有三个星号(***),而标记为“模拟总的”和“模拟根”的柱在误差棒之上没有任何星号。图1b中所示的值表示从至少10个样品平均的结果,并且误差棒表示标准偏差。
图1c显示了具有两行的凝胶印迹,每行具有两列的每一列中的一个蛋白条带。图顶部的凝胶上方显示了两列的每一列的处理条件。左列被标记为“模拟”。右列被标记为“pcz”。凝胶左边显示的是每行中印迹的蛋白质的名称。上面的一行被标记为“osdwf4”。下面的一行被标记为“肌动蛋白”。
图1d显示了两幅图,每幅图具有被分成左组(标记为“模拟”)和右组(标记为“pcz30μm”)的植物图像。在左侧的图的上方是这样的标记,其指示其中所示的植物具有wt基因型。四株植物的图像在左图中被标记为“模拟”的组中,并且三株植物的图像在左图中被标记为“pcz30μm”的组中。在右侧的图的上方是这样的标记,其指示其中所示的植物具有pzr1-d基因型。三株植物的图像在右图中被标记为“模拟”的组中。三株植物的图像在右侧图中被标记为“pcz30μm”的组中。在每幅图的左上角是比例尺,表示其代表2cm。
图1e显示了具有四个柱的柱状图,其沿着x轴从左到右标记为“模拟”、“pcz”、“模拟”和“pcz”。图左边的两个柱(标记为“模拟”和“pcz”)是白色的,而图右边的两个柱(标记为“模拟”和“pcz”)是黑色的。在柱状图的顶部是两个框,表示白色柱是“wt”,黑色柱是“pzr1-d”。每个柱在顶部具有误差棒。在标记为“pcz”的白柱上的误差棒之上是两个星号(**)。在标记为“pcz”的黑柱上的误差棒之上是“ns”。y轴指示以2的增量从0至10的以厘米(cm)计的根长度。图1e所示的值代表每个处理12个样品的平均值。误差棒代表标准偏差。在两幅图中,使用学生t检验确定处理之间的显著性差异。**,p<0.001;***,p<0.0001;ns,无显著性。
图2a显示了具有两个柱的柱状图,其沿x轴从左到右标记为“wt”和“pzr-1d”。每个柱都有一个误差棒。在pzr-1d柱的误差棒之上是一个星号(*)。y轴指示以20的增量从0至100的以厘米(cm)计的植物高度。
图2b显示了具有两个柱的柱状图,其沿x轴从左到右标记为“wt”和“pzr-1d”。每个柱都有误差棒。在pzr-1d柱的误差棒之上是三个星号(***)。y轴指示以20的增量从0至100的以克(g)计的植物重量。
图2c显示了具有两个柱的柱状图,其沿x轴从左到右标记为“wt”和“pzr-1d”。每个柱都有误差棒。在pzr-1d柱的误差棒之上是一个星号(*)。y轴指示以10的增量从0至50的每株植物(植物-1)的分蘖数。
图2d显示了具有两个柱的柱状图,其沿x轴从左到右标记为“wt”和“pzr-1d”。每个柱都有误差棒。在pzr-1d柱的误差棒之上是一个星号(*)。y轴指示以10的增量从0至50的每株植物(植物-1)的穗数。
图2e显示了成年野生型(wt)和pzr1-d突变体植物的图像。指示10厘米(cm)的比例尺位于图像的左上角。
图2f显示了来自野生型和pzr1-d植物的穗的图像。指示2厘米(cm)的比例尺位于图像的左上角。
图2g显示了具有两个柱的柱状图,其沿x轴从左到右标记为“wt”和“pzr-1d”。每个柱都有误差棒。在pzr-1d柱的误差棒之上是两个星号(**)。y轴指示以20的增量从0至60的种子重量(g/植物)。
图2h显示了具有两个柱的柱状图,其沿x轴从左到右标记为“wt”和“pzr-1d”。每个柱都有误差棒。在pzr-1d柱的误差棒之上是三个星号(***)。y轴指示以5的增量从0至15的初级分枝数。
图2i显示了具有两个柱的柱状图,其沿x轴从左到右标记为“wt”和“pzr-1d”。每个柱都有误差棒。在pzr-1d柱的误差棒之上是三个星号(***)。y轴指示以10的增量从0至30的次级分枝数。
图2a-图2d和图2g-图2i的图表示平均值(n>7),并且误差棒表示样品之间的标准偏差。使用学生t检验确定处理之间的显著性差异。*,p<0.05;**,p<0.001;和***,p<0.0001。
图3a显示了分别标记为“wt”和“pzr1-d”的野生型和pzr1-d植物中对应于第二叶的节段的倾斜图像。在图的左侧存在比例尺,表示长度为1厘米(cm)。
图3b显示了具有两个柱的柱状图,其沿x轴从左到右标记为“wt”和“pzr-1d”。每个柱都有误差棒。在pzr-1d柱的误差棒之上是两个星号(**)。y轴指示以10的增量从0至40的以度计的节段角。
图3c显示了在模拟或1μm油菜素内酯(bl)处理下在叶片倾斜生物测定测试中野生型和pzr1-d植物的代表性图像。
图3d显示了具有两个柱的柱状图,其沿x轴从左到右标记为“wt”和“pzr-1d”。每个柱都有误差棒。在pzr-1d柱的误差棒之上是三个星号(***)。y轴指示以50的增量从0至200的以度计的节段角。
图3e显示了具有两条线的线图。图例将具有圆点的线确定为野生型(“wt”)组。具有正方形点的线被标识为“pzr-1d”组。下面的线是标记为“wt”的线。三种浓度的油菜素内酯(在其下进行节段角测量)沿x轴从左到右被列为“bl0”、“bl0.1μm”和“bl1μm”,其中“bl0”表示油菜素内酯浓度为0μm。每条线上的每个数据点具有误差棒。y轴指示以50的增量从0至200的以度计的节段角。图代表平均值(n=15),误差棒代表样品之间的标准偏差。
图3f显示了具有两个柱的柱状图,其沿x轴从左到右标记为“wt”和“pzr-1d”。每个柱都有误差棒。在pzr-1d柱的误差棒之上是三个星号(***)。y轴指示以50的增量从0至150的以毫米(mm)计的总长度。
图3g显示了具有四个柱的柱状图。图的第一和第二柱(沿x轴从左到右)被标记为“wt”,而图的第三和第四柱(沿x轴从左到右)被标记为“pzr-1d”。图的第一和第三柱(沿x轴从左到右)是白色的,而图的第二和第四柱(沿x轴从左到右)是黑色的。图区左上方的图例表示白色柱对应于模拟处理,黑色柱对应于bl处理。每个柱都有误差棒。标记为“wt”的白色和黑色柱上方的括号用两个星号(**)标记,这表明这两个处理组之间的显著性差异。标记为“pzr-1d”的白色和黑色柱上方的括号用三个星号(***)标记,表明这两个处理组之间的显著性差异。y轴指示以10的增量从0至50的以毫米(mm)计的根长度。
图3h显示了具有四个柱的柱状图。图的第一和第二柱(沿x轴从左到右)被标记为“wt”,而图的第三和第四柱(沿x轴从左到右)被标记为“pzr-1d”。图的第一和第三柱(沿x轴从左到右)是白色的,而图的第二和第四柱(沿x轴从左到右)是黑色的。图区左上方的图例表示白色柱对应于模拟处理,黑色柱对应于bl处理。每个柱都有误差棒。标记为“wt”的白色和黑色柱上方的括号用“ns”标记,这表明这两个处理组之间无显著性差异。标记为“pzr-1d”的白色和黑色柱上方的括号用三个星号(***)标记,表明这两个处理组之间的显著性差异。y轴指示以10的增量从0至50的以毫米(mm)计的根长度。
图3b和图3d至图3h中所示的处理之间的显著性差异使用学生t检验来确定。**,p<0.001;***,p<0.0001;ns,无显著性。
图4a显示了植物根的示意图。根尖被分成三个部分,在图的左侧的标记指示这些部分从上到下为伸长区,分生区和根尖。代表60μm区域的红框位于图像中心正下方的标记为“分生区”的部分中。从红框到根尖部分的下端的距离被指示为300μm。
图4b显示了从与图4a中的红框所示区域相对应的区域获取的植物细胞的两个代表性显微照片图像。图像顶部的标记表明左边的图像是来自野生型(“wt”)植物的细胞,右边的图像是来自pzr1-d植物的细胞。在每个图像的右下角存在比例尺,表示距离为25μm。
图4c显示了具有两个柱的柱状图,其沿x轴从左到右标记为“wt”和“pzr-1d”。每个柱都有误差棒。在pzr-1d柱的误差棒之上是两个星号(**)。y轴指示以20的增量从0至80的每60μm2的平均细胞数。
图4d显示了具有两个柱的柱状图,其沿x轴从左到右标记为“wt”和“pzr-1d”。每个柱都有误差棒。在pzr-1d柱的误差棒之上是三个星号(***)。y轴指示以50的增量从0至20的以微米(μm)计的平均细胞大小。在垂直方向上测量细胞大小。
图4e显示了排列成两行和四列的愈伤组织的图像。上面的行在图的左侧被标记为“wt”,而下面的行被标记为“pzr1-d”。图像的前三列从左到右被标记为“16d”、“24d”和“32d”。左下角的比例尺表示1厘米(cm)的长度。第四列中的上图像和下图像位于单独的子图中,包括与前三列的放大倍数相比指示放大倍数为10x的标记。
图4f显示了具有两条线的线图。图例表示包含上线的圆形数据点代表来自野生型(“wt”)愈伤组织的数据,包含下线的正方形数据点代表来自pzr1-d愈伤组织的数据。x轴从左到右被标记为8、12、16、20、24、28和32天。y轴指示以0.1的增量从0.0到0.4的以克(g)计的愈伤组织重量。
在图4c、4d和4f中,误差棒代表标准偏差,并且使用学生t检验确定显著性差异。*,p<0.05;**,p<0.001;和***,p<0.0001。
图5a显示了植物基因组部分的两个示意图。上面的示意图在左边被标记为“wt”,并且包括在示意的线上方和下方指示目的序列的标记。从左到右,序列标记是“3′utr”、“tga”、“os03go5750”、“atg”、“5′utr”、“5′utr”、“atg”、“pzr1,os03g05760”、“tag”和“3′utr”。下面的示意图标记为“pzr1-d”。从左到右标记为“f”的红色箭头和从右到左标记为“r”的第二红色箭头分别位于上面的示意图的最左“atg”的左边和最左“utr”标签的右边的上方。下面的示意图的最左边部分表示包含标记为“4×camv35s”和“lb”的序列的pga2715盒。白色框代表5′和3′utr,蓝色框代表外显子,红色框代表t-dna中的四聚体camv35s启动子,黑色线代表内含子。红色箭头表示用于基因型分型的正向和反向引物的位置。灰色框代表pzr1上游基因的外显子。虚线从pga2715的任一侧引向上面的示意图的最左5′utr序列右侧的区域,表明pga2715序列存在于pzr1-d突变体中对应于上面的示意图的最左5′utr右侧位置的基因座中。下面的示意图的其余部分(例如,pga2715盒的“lb”区段的右侧)上的框与上面的示意图的框相匹配。在下面的示意图中存在比例尺,表示从pga2715盒的“lb”序列的最右边缘到最右边的5′utr序列的最左边缘的距离为1.8kb。下面的示意图中存在第二比例尺,表示从pga2715盒的“lb”序列的最右边缘到对应于上面的示意图的最右边atg的序列符号的最左边缘的距离为3.8kb。在图的右下方是指示500bp的比例尺。
图5b是具有三组每组三个柱的柱状图。x轴上的标记表明最左边的三个柱的组对应于03g05750基因的表达,中间的三个柱的组对应于03g05760基因的表达,最右边的三个柱的组对应于03g05770基因的表达。图像顶部的图例指示每一组柱的最左边的柱对应于野生型pzr1样品数据,每一组柱的中间的柱对应于dongjin野生型样品数据,并且每一组柱的最右边的柱对应于pzr1-d样品数据。y轴指示以5的增量从0至15的以任意单位计的相对表达。
图5c是四个柱的柱状图,在x轴上从左到右标记为dangjin、pzr1、pzr1/pzr1-d和pzr1-d。y轴指示以5的增量从0到15的03g05760基因表达。
图5d显示了具有两个柱的柱状图,其沿x轴从左到右标记为“模拟”和“pcz”。pcz柱具有误差棒。y轴指示以0.5的增量从0.0至1.5的以任意单位计的相对基因表达。
图5e显示了来自野生型(wt)植物和来源于过表达品系(35s::pzr1),即ox1、ox2、ox3、ox9、ox10、ox13、ox16的植物的1月龄植物的形态的代表性图像。图5f显示了非转化(野生型)植物和来源于pzr1过表达品系的植物中pzr1表达的比较。图5g显示了非转化(野生型)植物和来源于pzr1过表达品系的植物中分蘖数的比较。图5g显示了非转化(野生型)植物和来源于pzr1过表达品系的植物中穗数的比较。
图5e显示了来自野生型(wt)植物和来源于过表达品系(35s::pzr1),即ox1、ox2、ox3、ox9、ox10、ox13、ox16的植物的1月龄植物的形态的代表性图像。
图5f显示了具有八个柱的柱状图,其沿着x轴从左到右标记为“wt”、“ox1”、“ox2”、“ox3”、“ox9”、“ox10”、“ox13”和“ox16”。每个柱都有误差棒。y轴指示以20的增量从0到80的以相对于wt的倍数表达计的相对pzr1基因表达。棒高度从最高到最低是“ox2”、“ox9”、“ox3”、“ox1”、“ox10”、“ox13”、“ox16”和“wt”。
图5g显示了具有八个柱的柱状图,其沿着x轴从左到右标记为“wt”、“ox1”、“ox2”、“ox3”、“ox9”、“ox10”、“ox13”和“ox16”。每个柱都有误差棒。在“ox1”、“ox2”和“ox3”柱的每一个的误差棒之上是一个星号(*)。在“ox9”和“ox16”柱的每一个的误差棒之上是“ns”,表示相对于wt没有显著性差异。y轴指示以5的增量从0至20的以每株植物(植物-1)的分蘖计的分蘖数。棒高度从最高到最低是“ox10”、“ox1”、“ox3”、“ox9”、“ox2”、“ox13”、“ox16”和“wt”。
图5h显示了具有八个柱的柱状图,其沿着x轴从左到右标记为“wt”、“ox1”、“ox2”、“ox3”、“ox9”、“ox10”、“ox13”和“ox16”。每个柱都有误差棒。在“ox1”、“ox2”和“ox3”柱的每一个的误差棒之上是一个星号(*)。在“ox9”和“ox16”柱的每一个的误差棒之上是“ns”,表示相对于wt没有显著性差异。y轴指示以5的增量从0至15的以每株植物(植物-1)的穗计的穗数。棒高度从最高到最低是“ox10”、“ox1”、“ox3”、“ox9”、“ox2”、“ox13”、“ox16”和“wt”。
在图5b-图5d和图5f-图5h中,误差棒代表标准偏差,并且使用学生t检验确定显著性差异。*,p<0.05;ns,不显著。图显示来自进行的三次生物重复中的代表性实验的数据。
图6a显示了系统发育树。第一二分法的上臂指向第二二分法。第二二分法的上臂表示at1g47870e2f2。第一次二分法的下臂指向第三二分法,其上臂表示at5g22220e2f1,其下臂表示at2g36010e2f3。第一二分法的下臂指向第四二分法。第四二分法的下臂指向第五二分法,其上臂表示小麦dp,其下臂表示loc_os01g48700。第四二分法的上臂指向第六二分法。第六二分法的上臂指向第七二分法,其上臂表示人dp2,其下臂表示人dp1。第六二分法的下臂指向第八二分法。第八二分法的上臂表示at5g02470dpa,第八二分法的下臂指向第九二分法。第九二分法的上臂表示at5g03415dpb,而第九二分法的下臂指向第十二分法。第十二分法的上臂表示loc_os10g30420。第十二分法的下臂表示loc_os03g05760。图像左下方的比例尺表示0.5的相对距离。
图6b显示了植物的图像。图像右侧的标记表示植物的芽部分,图像左侧的标记表示植物的根部分。
图6c显示了具有两个柱的柱状图,其沿着x轴从左到右标记为“芽”和“根”。每个柱都有误差棒。y轴指示以0.5的增量从0.0至1.5的相对pzr1表达。
图6d显示了鉴定在rt-qpcr分析中分析的植物的部分的图像。图像顶部的标记指示旗叶、小穗和叶片。该图像包括两个插入图像,上面的插图表示鞘,下面的插图表示节。
图6e显示了具有12个柱的柱状图,其以6组、每组两个柱排列。每组的两个柱包括黑柱和左侧的白柱。6组的柱沿着x轴从左到右标记为“幼苗”、“叶片”、“鞘”、“节”、“小穗”和“旗叶”。图顶部的标记表明白色柱代表来自野生型(“wt”)样品的数据,黑色柱代表来自pzr1-d样品的数据。每个柱都有误差棒。y轴指示以10的增量从0至40的相对pzr1表达。
图7a是差异表达基因(deg)的维恩图。图左上角的标记表示,左圆圈代表在黑暗条件下的912种deg。图右上角的标记表示,右圆圈代表在光照条件下的463种deg。图的三个区域上的标记表明,234种基因在光照和黑暗条件下均差异表达,678种基因在黑暗条件下而不是光照条件下差异表达,229种基因在光照条件下而不是黑暗条件下差异表达。
图7b是具有两个柱的柱状图,其沿着x轴从左到右标记为“黑暗”和“光照”。每个柱被分成上蓝色部分和下红色部分。图例显示每个柱的下部红色部分表示上调的基因,而上部蓝色部分表示下调的基因。y轴指示以200的增量从0到1000的deg的数目。在黑暗条件下鉴定的678种deg中,481种基因上调,431种基因下调。在光照条件下,252种上调,211种下调。
图7c显示了在黑暗条件下的deg的柱状图。柱状图沿着y轴具有九个柱,从上到下标记为“对刺激的响应”、“繁殖”、“多细胞有机体过程”、“代谢过程”、“定位”、“发育过程”、“细胞过程”、“细胞成分组织”、“生物调节”。y轴标记指示每个柱代表的基因本体术语。x轴指示在每个go术语组中以50的增量从0至200的deg数。
图7d显示了在光照条件下的deg的柱状图。柱状图沿着y轴具有九个柱,从上到下标记为“对刺激的响应”、“繁殖”、“多细胞有机体过程”、“代谢过程”、“定位”、“发育过程”、“细胞过程”、“细胞成分组织”、“生物调节”。y轴标记指示每个柱代表的基因本体术语。x轴指示在每个go术语组中以10的增量从0至30的deg数。
图7e显示了在黑暗和光照条件下的deg的柱状图。柱状图沿着y轴具有九个柱,从上到下标记为“对刺激的响应”、“繁殖”、“多细胞有机体过程”、“代谢过程”、“定位”、“发育过程”、“细胞过程”、“细胞成分组织”、“生物调节”。y轴标记指示每个柱代表的基因本体术语。x轴指示在每个go术语组中以10的增量从0至50的deg数。
图8a显示了标记为“模拟”、“0.1pcz(μm)”、“1pcz(μm)”、“20pcz(μm)”、“40pcz(μm)”的五株植物的图像。图8a中的幼苗是在黑暗中生长的稻幼苗。
图8b显示了具有五个柱的柱状图,其沿着x轴从左到右标记为“模拟”、“0.1pcz(μm)”、“1pcz(μm)”、“20pcz(μm)”、“40pcz(μm)”。每个柱都有误差棒。y轴指示以2的增量从0至12的以厘米(cm)计的根长度。误差棒代表每次处理10个或更多个样品的标准偏差。
图8c显示了四株植物的图像。在图像的左上角是指示长度为2厘米(cm)的比例尺。图8c中的幼苗是在光照下生长的稻幼苗。
图8d显示了在两个黑色柱(沿着x轴从左到右标记为“模拟”和“pcz”)的左边具有两个白色柱(从左到右标记为“模拟”和“pcz”)的柱状图。图顶部的标记表明,白色柱表明来自野生型样品的数据,黑色柱表明来自pzr1-d样品的数据。每个柱都有误差棒。y轴指示以5的增量从0至15的以厘米(cm)计的根长度。误差棒代表每次处理10个或更多个样品的标准偏差。
图9a显示了在补充pcz的培养基中生长的7日龄幼苗的14幅图像,从左到右标记为“w/w”“w/w”“w/w”“t/t”“t/t”“t/t”“w/t”“t/t”“w/t”“w/t”“w/w”“w/t”“w/t”和“w/w”。图像上方的条表示两个最左边的图像是野生型(“wt”)植物,其余12个图像是pzr1-d植物。对于野生型,不同的基因型表示为野生型的w/w,纯合突变体的t/t(其中t表示通过t-dna引入的pzr1-d等位基因),和w/t的杂合子。
图9b显示了四株植物的图像,其从左到右标记为“dongjin(w/w)”、“pzr1(w/w)”、“pzr1/pzr1-d(w/t)”、“pzr1-d(t/t)”。图左上角的比例尺表示10厘米(cm)的长度。
图9c显示了具有三个柱的柱状图,其沿着x轴从左到右标记为“wt”、“pzr1/pzr1-d”和“pzr-1d”。每个柱都有误差棒。“wt”和“pzr1/pzr1-d”柱之间的线表示组之间没有显著性差异(“ns”)。“wt”和“pzr1-d”柱之间的线表示组之间没有显著性差异(“ns”)。y轴指示以50的增量从0至150的以厘米(cm)计的植物高度。
图9d显示了具有三个柱的柱状图,其沿着x轴从左到右标记为“wt”、“pzr1/pzr1-d”和“pzr-1d”。每个柱都有误差棒。“wt”和“pzr1/pzr1-d”柱之间的线表示组之间没有显著性差异(“ns”)。比较“wt”和“pzr1-d”柱的线包括星号(*)。y轴指示以20的增量从0至80的穗数。
图9e显示了具有三个柱的柱状图,其沿着x轴从左到右标记为“wt”、“pzr1/pzr1-d”和“pzr-1d”。每个柱都有误差棒。比较“wt”和“pzr1/pzr1-d”柱的线包括星号(*)。比较“wt”和“pzr1-d”柱的线包括星号(*)。y轴指示以20的增量从0至80的分蘖数。
图9f显示了具有五个柱的柱状图,其沿着x轴从左到右标记为“dongjin”、“prz1”、“prz1/prz1-d#2”、“prz1/prz1-d#3”和“pzr-1d”。每个柱都有误差棒。y轴指示以2的增量从0至6的相对pzr1表达。
图10a显示了6个野生型种子(上排)和6个pzr1-d种子(下排)的图像。比例尺表示5mm的参考长度。
图10b显示了具有两个柱的柱状图,其沿着x轴从左到右标记为“wt”和“pzr-1d”。每个柱都有误差棒。在pzr-1d柱的误差棒之上是一个星号(*)。y轴指示以0.2的增量从0至1.0的以厘米(cm)计的平均种子长度。
图10c显示了具有两个柱的柱状图,其沿着x轴从左到右标记为“wt”和“pzr-1d”。每个柱都有误差棒。在pzr-1d柱的误差棒之上是字母“ns”,表示与野生型数据没有显著性差异。y轴指示以10000的增量从0到50000的以任意单位计的相对种子面积。
图10d显示了具有两个柱的柱状图,其沿着x轴从左到右标记为“wt”和“pzr-1d”。每个柱都有误差棒。在pzr-1d柱的误差棒之上是字母“ns”,表明与野生型数据没有显著性差异。y轴指示以0.5的增量从0至1.5的种子重量(克/50粒种子)。
在图10b-图10d中对每种基因型测量了总共200粒种子。图10b-图10d中的误差棒表示标准偏差,并且使用学生t检验确定显著性差异。*,p<0.05;ns,无显著性差异。
图11a显示了来自野生型幼苗(上图)和pzr1-d幼苗(下图)的叶的光学显微镜图像,放大倍数为10x。
图11b显示了来自野生型幼苗(左图)和pzr1-d幼苗(右图)的叶的光学显微镜图像,放大倍数为20x。
图11c显示了具有两个柱的柱状图,其沿着x轴从左到右标记为“wt”和“pzr-1d”。每个柱都有误差棒。在pzr-1d柱的误差棒之上是三个星号(***)。y轴指示以20的增量从0至100的以微米(μm)计的平均细胞大小。在图11c中对每种基因型分析6个载玻片,每个包含20-30个细胞。图11c的柱状图表示测量的细胞的平均值和标准偏差。使用学生t检验确定各组之间的统计学显著性。***,p<0.0001。
图12a显示了四株植物的图像,其从左到右标记为col-0、ox2、ox3和ox5。ox2、ox3和ox5植物下的线将这三种植物标记为“35s::pzr1”。图像左上角的比例尺表示1厘米(cm)的距离。
图12b显示了两行rna印迹。在图像上方,rna印迹的泳道从左到右被标记为“ox1”、“ox2”、“ox3”、“ox5”、“ox8”、“col-0”“+”和“d.w”。印迹的上行在图的右侧被标记为“pzr1”,印迹的下行被标记为“ubq10”。阳性和阴性对照分别用符号+和d.w(蒸馏水)表示。产生对应于pzr1的非常低水平的片段的过表达品系ox1和ox8被用作参照。
图12c显示了具有四个柱的柱状图,其沿着x轴从左到右标记为“ox8”、“ox2”、“ox3”和“ox5”。每个柱都有误差棒。y轴指示以100的增量从0至400的相对pzr1表达。
图12d显示了具有四个柱的柱状图,其沿着x轴从左到右标记为“col-0”、“ox2”、“ox3”、“ox5”。每个柱都有误差棒。在“ox2”柱的误差棒之上是一个星号(*)。在“ox3”柱的误差棒之上是一个星号。在“ox2”柱的误差棒之上是两个星号。y轴指示以1的增量从0至4的以厘米(cm)计的主根长度。
图12e显示了具有四个柱的柱状图,其沿着x轴从左到右标记为“col-0”、“ox2”、“ox3”、“ox5”。每个柱都有误差棒。在“ox2”柱的误差棒之上是一个星号(*)。在“ox3”柱的误差棒之上是两个星号。在“ox2”柱的误差棒之上是两个星号。y轴指示以2的增量从0至10的平均侧根数。
使用拟南芥ubiquitin10作为内部对照。图12c-图12e中的误差棒表示标准偏差,并且使用学生t检验确定显著性差异。*,p<0.05;**,p<0.001;和***,p<0.0001。
图13显示了与差异调节基因相关的基因组的四个不同区域以及e2f/dp和bzr1/bes1共有顺式作用元件在这些区域中的位置的示意图。每幅示意图顶部的比例尺表示距离转录起始位点(在比例尺上标记为tss)的相对遗传距离为-1000、-500、1和+100个碱基对。在每幅示意图底部的标记表明,示意图上的红色菱形符号代表bzr1/bes1序列的位置,绿色三角形代表e2f10pcna序列的位置,灰色正方形代表e2fconsensus序列。顶部示意图被标记为loc_os10g2004(在光照中上调),表明该基因在光照条件下被上调。顶部示意图在示意图上从左到右具有三个绿色三角形,一个红色菱形,一个灰色正方形,以及一个绿色三角形。第二个示意图被标记为loc_os11g39190(在黑暗中上调),表明该基因在黑暗条件下被上调。第二个示意图在示意图上从左到右具有一个灰色正方形,三个绿色三角形,一个红色菱形,五个绿色三角形,一个红色菱形和一个绿色三角形。第三个示意图被标记为loc_os12g14840(在光照中下调),表明该基因在光照条件下被下调。第三个示意图从左到右具有一个灰色正方形和一个绿色三角形,一个灰色正方形,一个红色菱形,一个灰色正方形,一个绿色菱形,一个灰色正方形和一个绿色三角形,一个灰色正方形和一个绿色菱形。底部示意图被标记为loc_os11g32810(在黑暗中下调),表明该基因在黑暗条件下被下调。底部示意图具有一个红色菱形,一个绿色三角形,一个灰色正方形,一个绿色三角形,一个灰色正方形和一个绿色三角形。tss定义转录起始位点,红色菱形表示bzr1/bes1位点的位置,绿色三角形表示e2f10pcna,紫色正方形表示e2f共有位点。
图14显示了拟南芥dpb和稻同源物pzr1蛋白的多序列分析。在dpb中,第一条黑色下划线界定dna结合结构域(氨基酸101-184),而下方的黑线代表异二聚化结构域(182-263)。星号表示遵循被bin2和同源物磷酸化的s/txxxs/t模式的丝氨酸和苏氨酸残基。7个比对行中的每一个的最左边部分列出了样品标识符,其中q9fny20/dpb样品出现在图中每行的上半部分,而q84va092/pzr1出现在图中每行的下半部分。第一条黑线从q9fny20/dpb残基101和q84va092/pzr1残基122延伸至q9fny20/dpb残基184和q84va092/pzr1残基210。下方的黑线从q9fny20/dpb残基182和q84va092/pzr1残基208延伸至q9fny20/dpb残基263和q84va092/pzr1残基2。出现在比对行1、2、3、6和7中的星号代表遵循被bin2和同源物磷酸化的s/txxxs/t模式的丝氨酸和苏氨酸。
编号的实施方案
下面的实施方案记载了本文公开的特征的组合的排列。在一些情况下,本文公开的特征的组合的排列是非限制性的。在其它情况下,本文公开的特征的组合的排列是限制性的。还考虑特征的组合的其它排列。具体地,这些编号的实施方案中的每一个都被考虑为从属于或涉及每个先前或后续编号的实施方案,而与它们所列出的顺序无关。1.在dp基因座具有突变的高产量稻植物,其中所述高产植物表现出选自以下的至少一种基因的改变的表达:os11g0549665、os10g0381601、os11g0573100、os11g0549675、os11g0549680、os11g0639300、os01g0146101、os03g0629800、os11g0636050、os07g0159200、os12g0100100、os11g0606400、os03g0223301、os07g0486000、os02g0129000、os11g0540600、os07g0531900、os12g0431300、os03g0576200、os08g0203350、os11g0562100、os11g0701700、os12g0222650、os12g0172150、os12g0257450、os12g0247700、os12g0222300、os12g0255200、os12g0250900、os12g0254400、os10g0175500、os05g0202800、os11g0518900、os08g0255500、os11g0689800、os07g0543500、os12g0209800、os11g0255300、os12g0211500、os06g0254300、os11g0134300、os09g0467700、os01g0146101、os01g0148100、os07g0187001、os11g0640300、os12g0257400、os07g0159200、os01g0845950、os11g0691100、os07g0153150、os11g0605100、os03g0223301、os08g0367300、os11g0618700、os07g0162450、os02g0129000、os03g0299700、os11g0549680、os07g0486000、os11g0569800、os09g0467700、os12g0250900、os12g0406000、os11g0696600、os11g0532600、os01g0520180、os07g0297400、os07g0535200、os12g0425800、os11g0685200、os12g0204600、os12g0239300、os07g0677100、os07g0103000、os05g0414400、os11g0693800、os05g0369900、os11g0687100、os12g0425500、os08g0255500、os11g0689800、开花促进因子1样蛋白1、细胞周期蛋白-b1-1、类似于脂质转移蛋白、类似于细胞周期蛋白依赖性激酶b1-1、细胞周期蛋白依赖性激酶a-2、细胞周期蛋白依赖性激酶g-1、增殖细胞核抗原、细胞周期蛋白依赖性激酶调节亚基1、细胞周期蛋白依赖性激酶g-2、细胞周期蛋白-b2-1、细胞周期蛋白-p1-1、类似于细胞周期蛋白-d3-1、细胞周期蛋白b2-2、细胞周期蛋白d6-1、细胞周期蛋白d2-2、细胞周期蛋白依赖性激酶b2-1、细胞周期蛋白依赖性激酶b2-1和细胞周期蛋白a3-2。2.增加稻植物的种子产量的方法,包括改变稻植物中参与dp-e2f信号传导的至少一种基因的表达。3.如实施方案2所述的方法,其中所述至少一种基因选自:os11g0549665、os10g0381601、os11g0573100、os11g0549675、os11g0549680、os11g0639300、os01g0146101、os03g0629800、os11g0636050、os07g0159200、os12g0100100、os11g0606400、os03g0223301、os07g0486000、os02g0129000、os11g0540600、os07g0531900、os12g0431300、os03g0576200、os08g0203350、os11g0562100、os11g0701700、os12g0222650、os12g0172150、os12g0257450、os12g0247700、os12g0222300、os12g0255200、os12g0250900、os12g0254400、os10g0175500、os05g0202800、os11g0518900、os08g0255500、os11g0689800、os07g0543500、os12g0209800、os11g0255300、os12g0211500、os06g0254300、os11g0134300、os09g0467700、os01g0146101、os01g0148100、os07g0187001、os11g0640300、os12g0257400、os07g0159200、os01g0845950、os11g0691100、os07g0153150、os11g0605100、os03g0223301、os08g0367300、os11g0618700、os07g0162450、os02g0129000、os03g0299700、os11g0549680、os07g0486000、os11g0569800、os09g0467700、os12g0250900、os12g0406000、os11g0696600、os11g0532600、os01g0520180、os07g0297400、os07g0535200、os12g0425800、os11g0685200、os12g0204600、os12g0239300、os07g0677100、os07g0103000、os05g0414400、os11g0693800、os05g0369900、os11g0687100、os12g0425500、os08g0255500、os11g0689800、开花促进因子1样蛋白1、细胞周期蛋白-b1-1、类似于脂质转移蛋白、类似于细胞周期蛋白依赖性激酶b1-1、细胞周期蛋白依赖性激酶a-2、细胞周期蛋白依赖性激酶g-1、增殖细胞核抗原、细胞周期蛋白依赖性激酶调节亚基1、细胞周期蛋白依赖性激酶g-2、细胞周期蛋白-b2-1、细胞周期蛋白-p1-1、类似于细胞周期蛋白-d3-1、细胞周期蛋白b2-2、细胞周期蛋白d6-1、细胞周期蛋白d2-2、细胞周期蛋白依赖性激酶b2-1、细胞周期蛋白依赖性激酶b2-1和细胞周期蛋白a3-2。4.增加稻植物的种子产量的方法,包括改变稻植物中参与油菜素类固醇信号传导的至少一种基因的表达。5.如实施方案4所述的方法,其中所述至少一种基因选自:os11g0549665、os10g0381601、os11g0573100、os11g0549675、os11g0549680、os11g0639300、os01g0146101、os03g0629800、os11g0636050、os07g0159200、os12g0100100、os11g0606400、os03g0223301、os07g0486000、os02g0129000、os11g0540600、os07g0531900、os12g0431300、os03g0576200、os08g0203350、os11g0562100、os11g0701700、os12g0222650、os12g0172150、os12g0257450、os12g0247700、os12g0222300、os12g0255200、os12g0250900、os12g0254400、os10g0175500、os05g0202800、os11g0518900、os08g0255500、os11g0689800、os07g0543500、os12g0209800、os11g0255300、os12g0211500、os06g0254300、os11g0134300、os09g0467700、os01g0146101、os01g0148100、os07g0187001、os11g0640300、os12g0257400、os07g0159200、os01g0845950、os11g0691100、os07g0153150、os11g0605100、os03g0223301、os08g0367300、os11g0618700、os07g0162450、os02g0129000、os03g0299700、os11g0549680、os07g0486000、os11g0569800、os09g0467700、os12g0250900、os12g0406000、os11g0696600、os11g0532600、os01g0520180、os07g0297400、os07g0535200、os12g0425800、os11g0685200、os12g0204600、os12g0239300、os07g0677100、os07g0103000、os05g0414400、os11g0693800、os05g0369900、os11g0687100、os12g0425500、os08g0255500、os11g0689800、开花促进因子1样蛋白1、细胞周期蛋白-b1-1、类似于脂质转移蛋白、类似于细胞周期蛋白依赖性激酶b1-1、细胞周期蛋白依赖性激酶a-2、细胞周期蛋白依赖性激酶g-1、增殖细胞核抗原、细胞周期蛋白依赖性激酶调节亚基1、细胞周期蛋白依赖性激酶g-2、细胞周期蛋白-b2-1、细胞周期蛋白-p1-1、类似于细胞周期蛋白-d3-1、细胞周期蛋白b2-2、细胞周期蛋白d6-1、细胞周期蛋白d2-2、细胞周期蛋白依赖性激酶b2-1、细胞周期蛋白依赖性激酶b2-1和细胞周期蛋白a3-2。6.如实施方案4所述的方法,其中所述基因参与dp-e2f信号传导。7.如实施方案6所述的方法,其中所述基因由dp调节。8.如实施方案6所述的方法,其中所述基因在dp突变品系中表现出改变的表达。9.增加稻田的产量的方法,包括使用具有影响dp表达的突变的稻品系种植所述稻田。10.如实施方案9所述的方法,其中所述突变是crispr定向突变。11.如实施方案9所述的方法,其中测量相对于缺少突变的dp基因座的参考品系的增加的产量。12.包含丙环唑抗性1-d(pzr1-d)突变的植物。13.如实施方案12所述的植物,其中所述植物对于pzr1-d突变是杂合的。14.如实施方案12所述的植物,其中所述植物对于pzr1-d突变是纯合的。15.如实施方案12所述的植物,其中与缺乏pzr1-d突变的植物相比,所述植物过表达pzr1基因。16.高产作物田,其产量高于在与所述高产稻田相似的条件下生长的野生型作物田至少5%,其中所述高产作物田在收获前用抑制油菜素类固醇活性的除草剂处理。17.如实施方案16所述的高产作物田,其中所述除草剂包含油菜素类固醇合成抑制剂。18.如实施方案16所述的方法,其中所述除草剂是芸苔素唑。19.如实施方案16所述的方法,其中所述除草剂是丙环唑。20.如实施方案16所述的高产作物田,其中所述高产作物田的产量高于在与所述高产作物田相似的条件下生长的野生型作物田至少10%。21.如实施方案16所述的高产作物田,其中所述高产作物田包含稻植物。22.如实施方案21所述的高产作物田,其中所述稻植物包含丙环唑抗性1-d(pzr1-d)突变。23.如实施方案22所述的高产作物田,其中所述稻植物对于pzr1-d突变是杂合的。24.如实施方案22所述的高产作物田,其中所述稻植物对于pzr1-d突变是纯合的。25.如实施方案21所述的高产作物田,其中所述稻植物与缺乏pzr1-d突变的植物相比过表达pzr1基因。26.清除田地杂草的方法,其包括使用具有影响dp表达的突变的植物品系种植田地并施用影响油菜素类固醇信号传导的除草剂。27.如实施方案26所述的方法,其中所述除草剂抑制油菜素类固醇信号传导。28.如实施方案26所述的方法,其中所述除草剂是油菜素类固醇合成抑制剂29.如实施方案26所述的方法,其中所述除草剂是芸苔素唑。30.如实施方案26所述的方法,其中所述除草剂是丙环唑。31.如实施方案26所述的方法,其使用稻植物品系。32.清除田地杂草的方法,其包括使用具有影响dp-e2f信号传导的突变的植物品系种植田地并施用影响油菜素类固醇信号传导的除草剂。33.如实施方案32所述的方法,其中所述除草剂抑制油菜素类固醇信号传导。34.如实施方案32所述的方法,其中所述除草剂是油菜素类固醇合成抑制剂。35.如实施方案32所述的方法,其中所述除草剂是芸苔素唑。36.如实施方案32所述的方法,其中所述除草剂是丙环唑。37.如实施方案32所述的方法,其使用稻植物品系。38.清除田地杂草的方法,包括使用在dp-e2f信号传导途径效应物中具有改变的表达的植物品系种植田地,并施用影响油菜素类固醇信号传导的除草剂。39.如实施方案38所述的方法,其中所述除草剂抑制油菜素类固醇信号传导。40.如实施方案38所述的方法,其中所述除草剂是油菜素类固醇合成抑制剂。41.如实施方案38所述的方法,其中所述除草剂是芸苔素唑。42.如实施方案38所述的方法,其中所述除草剂是丙环唑。43.如实施方案38所述的方法,其使用稻植物品系。44.如实施方案38所述的方法,其中所述dp-e2f信号传导途径效应物包含以下的至少一种:os11g0549665、os10g0381601、os11g0573100、os11g0549675、os11g0549680、os11g0639300、os01g0146101、os03g0629800、os11g0636050、os07g0159200、os12g0100100、os11g0606400、os03g0223301、os07g0486000、os02g0129000、os11g0540600、os07g0531900、os12g0431300、os03g0576200、os08g0203350、os11g0562100、os11g0701700、os12g0222650、os12g0172150、os12g0257450、os12g0247700、os12g0222300、os12g0255200、os12g0250900、os12g0254400、os10g0175500、os05g0202800、os11g0518900、os08g0255500、os11g0689800、os07g0543500、os12g0209800、os11g0255300、os12g0211500、os06g0254300、os11g0134300、os09g0467700、os01g0146101、os01g0148100、os07g0187001、os11g0640300、os12g0257400、os07g0159200、os01g0845950、os11g0691100、os07g0153150、os11g0605100、os03g0223301、os08g0367300、os11g0618700、os07g0162450、os02g0129000、os03g0299700、os11g0549680、os07g0486000、os11g0569800、os09g0467700、os12g0250900、os12g0406000、os11g0696600、os11g0532600、os01g0520180、os07g0297400、os07g0535200、os12g0425800、os11g0685200、os12g0204600、os12g0239300、os07g0677100、os07g0103000、os05g0414400、os11g0693800、os05g0369900、os11g0687100、os12g0425500、os08g0255500、os11g0689800、开花促进因子1样蛋白1、细胞周期蛋白-b1-1、类似于脂质转移蛋白、类似于细胞周期蛋白依赖性激酶b1-1、细胞周期蛋白依赖性激酶a-2、细胞周期蛋白依赖性激酶g-1、增殖细胞核抗原、细胞周期蛋白依赖性激酶调节亚基1、细胞周期蛋白依赖性激酶g-2、细胞周期蛋白-b2-1、细胞周期蛋白-p1-1、类似于细胞周期蛋白-d3-1、细胞周期蛋白b2-2、细胞周期蛋白d6-1、细胞周期蛋白d2-2、细胞周期蛋白依赖性激酶b2-1、细胞周期蛋白依赖性激酶b2-1和细胞周期蛋白a3-2。45.如实施方案38所述的方法,其中dp-e2f信号传导途径效应物是选自以下的基因:os11g0549665、os10g0381601、os11g0573100、os11g0549675、os11g0549680、os11g0639300、os01g0146101、os03g0629800、os11g0636050、os07g0159200、os12g0100100、os11g0606400、os03g0223301、os07g0486000、os02g0129000、os11g0540600、os07g0531900、os12g0431300、os03g0576200、os08g0203350、os11g0562100、os11g0701700、os12g0222650、os12g0172150、os12g0257450、os12g0247700、os12g0222300、os12g0255200、os12g0250900、os12g0254400、os10g0175500、os05g0202800、os11g0518900、os08g0255500、os11g0689800、os07g0543500、os12g0209800、os11g0255300、os12g0211500、os06g0254300、os11g0134300、os09g0467700、os01g0146101、os01g0148100、os07g0187001、os11g0640300、os12g0257400、os07g0159200、os01g0845950、os11g0691100、os07g0153150、os11g0605100、os03g0223301、os08g0367300、os11g0618700、os07g0162450、os02g0129000、os03g0299700、os11g0549680、os07g0486000、os11g0569800、os09g0467700、os12g0250900、os12g0406000、os11g0696600、os11g0532600、os01g0520180、os07g0297400、os07g0535200、os12g0425800、os11g0685200、os12g0204600、os12g0239300、os07g0677100、os07g0103000、os05g0414400、os11g0693800、os05g0369900、os11g0687100、os12g0425500、os08g0255500、os11g0689800、开花促进因子1样蛋白1、细胞周期蛋白-b1-1、类似于脂质转移蛋白、类似于细胞周期蛋白依赖性激酶b1-1、细胞周期蛋白依赖性激酶a-2、细胞周期蛋白依赖性激酶g-1、增殖细胞核抗原、细胞周期蛋白依赖性激酶调节亚基1、细胞周期蛋白依赖性激酶g-2、细胞周期蛋白-b2-1、细胞周期蛋白-p1-1、类似于细胞周期蛋白-d3-1、细胞周期蛋白b2-2、细胞周期蛋白d6-1、细胞周期蛋白d2-2、细胞周期蛋白依赖性激酶b2-1、细胞周期蛋白依赖性激酶b2-1和细胞周期蛋白a3-2。46.增加作物田的产量的方法,所述作物田包含具有影响信号传导途径的突变的植物,所述信号传导途径选自:细胞周期途径、激素信号传导途径和代谢途径。47.如实施方案46所述的方法,其中所述突变影响激素信号传导途径。48.如实施方案47所述的方法,其中所述激素信号传导途径包括br信号传导。49.如实施方案48所述的方法,其中所述突变导致br信号传导增加。50.如实施方案46所述的方法,其中所述突变影响细胞周期途径。51.如实施方案50所述的方法,其中所述突变影响rb信号传导。52.如实施方案51所述的方法,其中所述突变导致rb信号传导活性的下调。53.如实施方案50所述的方法,其中所述突变改变参与dp-e2f信号传导的至少一种基因的表达。54.如实施方案53所述的方法,其中所述突变导致参与dp-e2f信号传导的至少一种基因的过表达。55.如实施方案54所述的方法,其中所述突变包含外源核酸序列。56.如实施方案54所述的方法,其中所述突变影响pzr1基因的表达。57.如实施方案56所述的方法,其中所述突变导致pzr1基因的过表达。58.如实施方案57所述的方法,其中所述突变是pzr1-d突变。59.如实施方案58所述的方法,其中所述植物对于pzr1-d突变是纯合的。60.如实施方案50所述的方法,其中所述至少一种基因选自:os11g0549665、os10g0381601、os11g0573100、os11g0549675、os11g0549680、os11g0639300、os01g0146101、os03g0629800、os11g0636050、os07g0159200、os12g0100100、os11g0606400、os03g0223301、os07g0486000、os02g0129000、os11g0540600、os07g0531900、os12g0431300、os03g0576200、os08g0203350、os11g0562100、os11g0701700、os12g0222650、os12g0172150、os12g0257450、os12g0247700、os12g0222300、os12g0255200、os12g0250900、os12g0254400、os10g0175500、os05g0202800、os11g0518900、os08g0255500、os11g0689800、os07g0543500、os12g0209800、os11g0255300、os12g0211500、os06g0254300、os11g0134300、os09g0467700、os01g0146101、os01g0148100、os07g0187001、os11g0640300、os12g0257400、os07g0159200、os01g0845950、os11g0691100、os07g0153150、os11g0605100、os03g0223301、os08g0367300、os11g0618700、os07g0162450、os02g0129000、os03g0299700、os11g0549680、os07g0486000、os11g0569800、os09g0467700、os12g0250900、os12g0406000、os11g0696600、os11g0532600、os01g0520180、os07g0297400、os07g0535200、os12g0425800、os11g0685200、os12g0204600、os12g0239300、os07g0677100、os07g0103000、os05g0414400、os11g0693800、os05g0369900、os11g0687100、os12g0425500、os08g0255500、os11g0689800、开花促进因子1样蛋白1、细胞周期蛋白-b1-1、类似于脂质转移蛋白、类似于细胞周期蛋白依赖性激酶b1-1、细胞周期蛋白依赖性激酶a-2、细胞周期蛋白依赖性激酶g-1、增殖细胞核抗原、细胞周期蛋白依赖性激酶调节亚基1、细胞周期蛋白依赖性激酶g-2、细胞周期蛋白-b2-1、细胞周期蛋白-p1-1、类似于细胞周期蛋白-d3-1、细胞周期蛋白b2-2、细胞周期蛋白d6-1、细胞周期蛋白d2-2、细胞周期蛋白依赖性激酶b2-1、细胞周期蛋白依赖性激酶b2-1和细胞周期蛋白a3-2。61.如实施方案46所述的方法,其中所述植物的至少一个方面增加,所述方面选自:植物重量、分蘖数、穗数、总长度、根长度和胚芽鞘长度。62.如实施方案46所述的方法,其中所述作物田的产量比用参考品系种植并在与包含所述植物的作物田类似的条件下生长的作物田的产量高至少5%。63.如实施方案62所述的方法,其中所述突变是pzr1-d突变。64.如实施方案46所述的方法,其中用除草剂处理所述作物田。65.如实施方案64所述的方法,其中所述作物田包含杂草,且所述除草剂在收获前抑制所述杂草中的油菜素类固醇合成。66.如实施方案65所述的方法,其中所述除草剂选自芸苔素唑和丙环唑。66.如实施方案65所述的方法,其中所述突变影响pzr1基因的表达。67.如实施方案66所述的方法,其中所述突变导致pzr1基因的过表达。68.如实施方案67所述的方法,其中所述突变是pzr1-d突变。69.清除田地杂草的方法,包括:使用具有影响信号传导途径的突变的植物种植所述田地;和施用影响油菜素类固醇信号传导的除草剂,所述信号传导途径选自:细胞周期途径、激素信号传导途径和代谢途径。70.如实施方案69所述的方法,其中所述突变影响激素信号传导途径。71.如实施方案70所述的方法,其中所述突变影响br信号传导。72.如实施方案69所述的方法,其中所述突变影响细胞周期途径。73.如实施方案72所述的方法,其中所述突变影响rb信号传导。74.如实施方案72所述的方法,其中所述突变改变参与dp-e2f信号传导的至少一种基因的表达。73.如实施方案72所述的方法,其中所述突变影响pzr1基因的表达。74.如实施方案73所述的方法,其中所述突变导致pzr1基因的过表达。75.如实施方案74所述的方法,其中所述突变是pzr1-d突变。76.如实施方案69所述的方法,其中所述除草剂选自芸苔素唑和丙环唑。
当在标量值的上下文中使用时,术语“约”是指标量值的+或-10%。当在数值范围的上下文中使用时,术语“约”是指包括低于该范围的最低值10%至高于该范围的最高值10%的值的范围。
术语“至少一个(种)”后面跟着的列表,例如“a、b、c或d”,是指这样的列表,其单独地包括该列表的每个成员,或包括该列表的两个或更多个成员的任何组合,直到包括该列表的所有成员,并且任选地包括该列表中未列出的其它元素。
如本文所用,植物可包括完整植物,植物的祖先和后代以及植物部分,包括种子、芽、茎、根(包括块茎)和植物细胞、组织和器官。植物还可以包括悬浮培养物、胚胎、分生组织区域、愈伤组织、叶、种子、根、芽、配子体、孢子体、花粉和小孢子。
术语植物细胞广泛地指植物的组成部分或来源于植物的细胞。例如,植物细胞可以是原生质体或植物质。
实施例
提供这些实施例是为了说明的目的。实施例不一定限制所要求保护的主题,尽管可以从支持权利要求修改的这些实施例中的任何一个提取特定的元素,以便澄清审查中的一项或多项权利要求。
实施例1
高产植物品系的产生及筛查
本实施例描述了产生突变体植物品系和筛查高产植物的方法。通过本实施例的方法产生的突变体植物可以表现出增加的生长特性,例如增加的植物高度,植物重量,分蘖数,穗数,种子数,种子重量,种子大小,叶角,初级分枝数,次级分枝数和/或生长速率。如本文所公开的,使用本实施例的方法调节与dp-e2f信号传导相关的基因(例如,稻中pzr1基因的过表达)可以产生高产植物。
克隆和植物转化用于产生在camv35s启动子控制下过表达稻osdpb/pzr1的稻和拟南芥属植物的载体构建如下:提取rna,并用特异性引物从7日龄稻幼苗合成cdna(表5)。特异性引物用于扩增目的全长cds。将对应于目的基因的所得产物(696bp)进行纯化并克隆到进入载体pentr/sd/d-topo(invitrogen)中,然后克隆到目的载体pearleygate101(c-yfp-ha)中,其与gateway系统(thermofisherscientific)相容。为了转化拟南芥,用载体转化农杆菌菌株gv3101,并将lba4404菌株用于稻。使用常规农杆菌介导的技术将构建体转化到植物中,并且在补充有20mg/lbasta的ms培养基上选择转基因幼苗。鉴定到了basta抗性和basta敏感性植物,并进行卡方检验以测试单基因分离模式。
在pcz处理的存在下筛选t-dna激活标记突变体群以鉴定pcz抗性品系。使用含有4个拷贝的组成型camv35s增强子的pga2715t-dna载体开发这些突变体。在基因组中插入t-dna载体可引起插入t-dna侧翼的基因的转录活化,并可导致显性功能获得性突变(jeong等人,2002)。
在回收的17个丙环唑抗性品系中,进一步研究了丙环唑抗性1(pzr1-d)突变体的种子产量增加的表型。该突变体表现出几种特征性br表型,例如半矮化和更多的分蘖数以及增加的对br的敏感性。令人惊奇的是,尽管pzr1-d突变体植物显示出半矮化,但其仍显示出正常的种子大小。分子表征和系统发育分析表明,pzr1-d中的t-dna插入dp基因座并激活参与细胞周期调节的拟南芥dpb转录因子基因的同源物的表达。过表达pzr1的显性突变体和转基因品系显示出增加的分蘖数,穗数和穗的分枝数,所有这些都导致种子产量的显著增加。这些发现揭示了pzr1在介导br调节的细胞分裂控制和提高稻种子产量中的作用。
基因组dna和基因型分型进行在产生的植物品系中成功的核酸盒插入的验证和在产生的植物品系中的纯合性的评价。使用dnaprepkit(biofact)按照生产商的建议进行dna提取。使用用gen5数据分析软件界面控制的分光光度计系统(biotek)定量dna。在两组pcr中使用50ngdna模板进行基因型分型。在一组中,loc_os03g05760和周围区域的特异性引物用于扩增野生型等位基因。使用t-dna的左边界特异性的引物(pga2715lb)进行另一组,以扩增插入t-dna的突变等位基因。该分析允许鉴定每一品系的纯合和杂合突变体植物,以及分离的野生型植物。仅具有野生型等位基因的品系被认为是分离的野生型(w/w),并且仅具有扩增的突变等位基因的品系被认为是纯合的(t/t)。其中两个等位基因都被扩增的品系被认为是插入杂合的(w/t)。用于pcr的引物的序列列于表5中。
表5使用的引物
实施例2
赋予植物品系对br生物合成抑制剂丙环唑的抗性的方法
本实施例描述了产生对影响油菜素类固醇信号传导的除草剂具有抗性的植物或植物品系的方法。对除草剂具有抗性的植物的产生可用于产生高产作物田的方法中。例如,可以用除草剂处理包含对除草剂具有抗性的作物植物的作物田,以有效地从作物田中去除一种杂草或多种杂草,从而允许作物植物茁壮成长并增加作物田的总产量。
研究了稻对不同浓度抑制剂pcz的反应,以确定分离pcz抗性突变体的最佳条件。pcz以剂量依赖性方式影响稻植物生长和诱导矮化(图8a和图8b)。用30μmpcz处理使野生型幼苗的总大小降低高达47%,并且根的反应甚至更严重,生长抑制65%(图1a和图1b)。为了确保pcz有效抑制br,检测关键br生物合成基因osdwf4的表达水平。在用pcz处理的植物中,osdwf4mrna水平增加,这与br生物合成基因的负反馈调节相一致(图1c)。根据这些结果,可以对抗性幼苗进行视觉表型筛查,这可以通过与野生型幼苗相比,它们较长的根和/或叶来鉴定。
从通过激活标记产生的对处理具有不同程度的抗性的突变体群(如实施例1所述)中鉴定出17个品系。单独的品系被命名为丙环唑抗性(pzr)1-17。在这些品系中,分离了具有与t-dna插入共分离的可见抗性表型的显性突变体pzr1-d(图9a)。在30μmpcz处理下,纯合突变体幼苗的根长度与在模拟处理条件下的根长度几乎相同,这与野生型不同,野生型表现出45%的根生长抑制(图1d和图1e)。在黑暗条件下的pcz处理产生与在光照下获得的那些类似的抗性表型(图8c和图8d)。
化学处理与形态分析在种植之前将稻种子用50%次氯酸钠灭菌30分钟,并用水洗涤4-5次。在每次处理之前,使种子在用水浸泡2天的滤纸上发芽。在1cm的种植深度下对处于相似生长阶段的新萌发的种子进行处理。对于pcz处理,将种子种植在用补充有指示的pcz浓度的水浸泡的粗蛭石土壤中。将溶解在dmso中的pcz(100mm)用作工作溶液,并将单独的dmso加入水中作为对照或模拟处理。将植物保持在总黑暗中,或在长日条件(14小时光照/10小时黑暗的光周期)下保持光照(80-100μmolm-2s-1强度)中。处理7天后,拍摄图像,并使用imagej软件从图像测量生长参数。从根的末端至最高的叶测量总的植物高度,而主根的长度用于确定根的长度。使用imagej软件从数字照片计算种子长度和面积。使用graphpadprism5软件进行所有统计分析。使用学生t-检验评价显著性。
实施例3
对稻植物的植物结构及产量的评价
本实施例描述了评价通过本文公开的遗传修饰方法(例如实施例1中所述的那些)产生的植物中的植物结构和产量的方法。
检查田地和温室条件下的成年植物的表型,发现pzr1-d植物比野生型植物具有更高的产量(图2a至图2i)。突变体中的总植物重量比野生型中的高33%,尽管它们的总高度没有显著性差异。重量的增加可以解释为突变体中分蘖数的增加,以及每株植物中穗的数量的增加(图2a至图2f)。每株植物的种子重量从野生型的30g增加到突变体的50g,表明产量增加了约160%。检测了穗的形态,发现不仅在突变体中穗的数量增加,而且在pzr1-d中每穗的初级和次级分枝的数量也高于野生型(图2f至图2i)。激活标记突变体中总种子的较高的重量可能是由于每株植物增加的种子数而不是增加的种子大小。实际上,突变体种子的种子大小、面积和重量与野生型种子没有显著性差异。事实上,突变体种子略小于野生型种子(图10b)。
突变体植物对br显示出增加的敏感性由于pzr1-d突变体是基于其对br抑制剂的抗性而分离的,因此评价了该突变体对油菜素类固醇,油菜素内酯(bl)的外源处理的反应。稻叶弯曲对活性br敏感,这形成了众所周知的研究br反应的叶枕倾斜生物测定(lamina-jointinclinationbioassay)的基础(wada等人,1981)。在常规生长条件下,pzr1-d幼苗叶片的弯曲角大于野生型植物的弯曲角(图3a和图3b)。在叶片弯曲测定中,用bl处理导致pzr1-d植物中的叶角显著增加,而野生型植物表现出较温和的反应(图3c和图3d)。在较高的bl浓度下,叶角反应的差异更显著(图3e)。这些结果表明pzr1-d突变体对外源bl处理比野生型幼苗更敏感。
评价在黑暗条件下,响应bl处理,幼苗的根和胚芽鞘生长。在没有bl的情况下,当在黑暗中生长时,pzr1-d与其野生型对应物之间的根生长存在显著性差异(图3f)。此外,当用bl补充培养基时,pzr1-d中的根生长的抑制比野生型更显著,并且在胚芽鞘中观察到相反的反应(例如生长增加)(图3g和图3h)。因此,基于其响应bl的根生长减少和胚芽鞘伸长增加,证实了突变体幼苗的敏感性增加。
愈伤组织诱导将稻种子灭菌并置于滤纸上直至完全干燥。使种子(12-18)萌发并在含有duchefa的chu(n6)粉末(4gl-1)、蔗糖(30gl-1)、l-脯氨酸(2.9gl-1)、酪蛋白(0.3gl-1)、肌醇(0.1gl-1)、2.4-d(2mgl-1)和植物凝胶(phytagel)(4gl-1),ph5.8的2n6培养基板上培养。将板在生长室中在黑暗条件下在32℃下孵育指定的天数,然后称重并拍照以用imagej软件分析。
显微术在leicatcssp9共聚焦激光扫描显微镜下获得根图像。从7日龄幼苗切下根尖上方1cm的根样品,并浸没在10μg/ml碘化丙啶(pi)溶液中3分钟。在观察前将样品在蒸馏水中漂洗两次。使用3.0.2版lasx软件编辑和分析图像。为了进行细胞计数和尺寸测定,检查在根尖上方300μm的分生组织区中绘制的60μm2正方形内的细胞(图4a)。在primovert倒置显微镜(zeiss)下拍摄叶片,并使用imagej软件进行测量。将7日龄幼苗的每一叶横切下中部,并拍摄图像并用于比较基因型。
叶枕弯曲测定如之前所述并进行一些修改,来进行叶片弯曲生物测定(wada等人,1984;zhang等人,2012)。将种子灭菌并在滤纸上发芽并转移到0.5xms培养基中,然后在黑暗中孵育7天。从均匀生长的幼苗上切下含有第二叶叶枕的节段。使这些节段在黑暗中漂浮在蒸馏水中24小时,以从植物去除可能改变实验的任何化学残留物,并检查样品以确保在处理之前所有的叶角都是相似的。使具有相似叶角的均匀样品漂浮在含有指定浓度的油菜素内酯(bl)的蒸馏水中。所有程序,包括样品的切片和转移到各种溶液中,均在暗室中进行以尽可能避免暴露于光。在黑暗中在不同处理下孵育节段48小时并拍照。使用imagej软件将照片用于测量叶片和叶鞘之间的角度。使用graphpadprism5软件进行所有统计分析,并使用学生t-检验评估显著性。
pzr1-d突变体在不同组织中显示改变的细胞数目和大小在共聚焦显微镜下观察野生型和突变体幼苗的根和叶组织,并在pzr1-d样品中观察到异常。pzr1-d的根含有更多数量的细胞,大多数细胞比野生型根中的细胞小(图4a至图4d)。类似地,突变体叶片相对于野生型叶片更宽,并且具有更多但更小的细胞(图11a至11c)。因为在突变体中细胞分裂似乎被改变,所以在野生型和pzr1-d植物中检查愈伤组织萌生和形态。由突变体种子诱导的愈伤组织比由野生型种子诱导的愈伤组织小,并且表现出不定根形成,而野生型愈伤组织则没有(图4e和图4f)。
这些结果支持pzr1在调节稻的细胞分裂和生长中的作用。该结果还支持dp-e2f信号传导途径的调节,用于产生高产量稻植物和用于产生高产作物田。
实施例4
对用于鉴定高产植物的基因表达的评价
本实施例描述了评价植物中基因表达的方法。具体地,本实施例的方法可用于确定遗传修饰对基因的影响,用于鉴定高产植物或高产植物品系,或用于从通过本文所述的方法(例如,包括遗传修饰的方法)产生的多种植物或植物品系中选择高产植物或高产植物品系。
rna分离和基因表达分析用于rt-qpcr分析的总rna使用rneasy系统(qiagen)按照生产商的说明书从稻或拟南芥组织中分离。使用m-mlv逆转录酶(elpis)从2μgrna合成cdna。使用表5中所列的引物,使用powersybrgreenpcrmastermix,如前所述在appliedbiosystemsstepone实时pcr系统上进行rt-qpcr分析(corvalanandchoe,2017)。对于拟南芥ox品系,rt-qpcr中的基因表达数据相对于ox品系8归一化,ox品系8在rt-pcr分析中显示低转录物水平,因为loc_os03g05760是稻基因,因此在col-0对照植物中不存在。
拟南芥dpb的稻同源物的激活标记和过表达是pzr1-d中观察到的表型的基础对本研究中使用的激活标记突变体群的先前分析(jeong等人,2002)揭示,基因os03g05760位于t-dna插入上游的1.8kb(图5a)。研究了os03g05760及插入附近的其它两个基因(os03g05750和os03g05770)的表达水平。os03g05760在突变体中的表达水平是野生型中的约10倍,而其它两个基因的表达水平类似于野生型样品的表达水平(图5b)。因此,os03g05760mrna水平的增加似乎是pzr1-d中的突变体表型的原因。还在杂合和分离的野生型植物中检测了该基因的表达水平,发现其在突变体中的表达以基因剂量依赖性方式增加(图5c)。这与在杂合植物中观察到的中间表型一起,表明被命名为pzr1-d的突变是显性的(图9b至图9f)。
pzr1表达是否受bl水平影响的问题通过测量pcz处理后的幼苗中的转录物水平来研究。在进行该处理的植物中pzr1的表达下调(图5d)。
为了证实观察到的表型是由pzr1-d突变体中pzr1表达增加引起的,用表达在camv35s启动子控制下的pzr1编码序列(cds)的载体转化野生型稻和拟南芥植物。在稻植物中,如在pzr1-d中一样,在显著过表达pzr1的品系(ox1-10)中,尤其是在ox1、2、3、9和10中,分蘖数和穗数增加。这一基因在品系ox13和ox16中的表达水平与野生型没有非常大的不同,并且它们的表型与dongjin植物的表型相似(图5e至图5h)。对于过表达pzr1的拟南芥植物,具有高表达水平的pzr1的幼苗(例如,ox2、3和5)显示增加的侧根数(图12b和图12e),这可归因于dp在细胞周期中的作用。
系统发育分析使用phytozome网站(phytozome.jgi.doe.gov/pz/portal.html)上的blast服务器检索与pzr1显示相似性的蛋白质序列。从uniprot服务器(例如,通过网站uniprot.org)获得拟南芥、稻、小麦和人蛋白质的序列,并使用clustalomega(例如,通过网站ebi.ac.uk/tools/msa/clustalo/)和boxshade软件(例如,通过网站embnet.vital-it.ch/software/box_form.html)进行系统发育分析以鉴定和可视化保守序列。所得的系统发育树是用邻接法(clustalomega)产生的,并用figtreev1.4.3(图6a)修改。用作输入的蛋白质序列的列表可见表6。
表6用于系统发育分析的氨基酸序列列表
使用os03g05760(q84va0)产物的全长蛋白质序列,通过筛查tair拟南芥数据库的同源基因来研究pzr1/os03g05760的可能功能。最高得分对应于两种dp(q9fny2和q9fny3)和三种e2f(q9fv71,q9fv70和f4ilt1)蛋白,它们都来自在细胞周期中起作用的转录因子家族。在拟南芥和普通小麦(triticumaestivum)中已经鉴定了植物dp蛋白(magyar等人,2000;ramirez-parraandgutierrez,2000),并且使用全基因组分析已经在稻中发现了三种可能的dp同源物(guo等人,2007)。pzr1序列的系统发育分析以及植物中已知dp蛋白的系统发育分析支持pzr1可能是拟南芥dpb同源物的思想(图14)。研究了pzr1在来自稻幼苗和成年稻植物的各种组织中的表达模式(图6b至图6e)。该基因在幼苗中的表达水平相对较低,与地上组织相比,在根中的表达水平较低(图6b和图6c)。尽管如此,在所有检测的成年植物组织中检测到这些转录物,其中叶组织具有最高的表达水平。该表达模式在pzr1-d突变体中甚至更显著(图6d和图6e)。
实施例5
野生型和pzr1-d突变体幼苗之间的转录物组分析和deg的鉴定
本实施例描述了鉴定和分析植物和植物品系中差异表达基因(deg)的方法。可以使用这些方法评价已经经历遗传修饰(例如,如实施例1中所述)的植物和植物品系,以确定由遗传修饰引起的基因途径信号传导的变化。这些方法的应用包括确定特定遗传修饰对靶和脱靶信号传导途径的影响。当使用针对理解不佳的途径的基因修饰时(例如,在用于增加植物或植物品系的产量的方法中),这种方法是特别有用的。
使用trizol(sigma-aldrich)试剂按照生产商的说明书从幼苗中提取总rna。对生长在光照或总黑暗中的两种基因型,即野生型(wt)和pzr1-d(mut)的幼苗进行三次重复处理。制备总共12个样品并进行质量检查。其中,使用具有最佳纯度值的每种处理的两次重复来构建测序文库。进行质量检查、文库制备和原始数据处理。在agilentbioanalyzer2100上进行质量评价,其中rna完整指数(rin)>7(对于大多数样品>9)。使用illumina的ultratmrna文库制备试剂盒产生文库,并在illuminahiseq4000系统上测序。样品中差异表达基因(deg)被鉴定为生长在黑暗中的野生型幼苗对比生长在黑暗中的pzr1-d幼苗(wt黑暗vspzr1-d黑暗)以及生长在光照中的野生型幼苗对比生长在光照中的pzr1-d幼苗(wt光照vspzr1-d光照)。使用htseq软件计算每种基因的表达水平并归一化。deg基于log2(倍数变化)≥1和校正的p-值(q-值)≤0.05来鉴定。使用分别从网站pantherdb.org/,网站interactivenn.net/和网站plantpan2.itps.ncku.edu.tw/gene_group.php?#multipromoters可获得的工具进行基因本体(go)分析,维恩图构建和启动子分析。
为了阐明br与通过pzr1的细胞周期过程之间关系的可能的分子基础,对野生型和突变体pzr1-d幼苗进行了全基因组转录物组分析。为了避免检测植物之间的个体差异,每个处理(一个生物重复)取样3-4个幼苗,并且每个分析使用两个生物重复。
总之,考虑到所有样品的一致性,在野生型和突变体幼苗中鉴定出1,141种差异表达基因(deg)。其中,678种基因仅在黑暗条件下差异表达,229种基因在光照下生长的幼苗中差异表达,234种基因独立于光处理而差异表达(图7a)。鉴定与野生型相比在突变体中上调或下调的deg,并且列出在每种条件下前20种最显著的deg(图7b;表1和表2)。
表1在光照下与野生型(wt)相比,pzr1-d中前20种最显著的差异表达基因(deg)的列表
表2在黑暗中与野生型(wt)相比,pzr1-d中前20种最显著的差异表达基因(deg)的列表
为了鉴定这些基因共有的特征,进行基因本体(go)分析。在最丰富的go中,术语是包含202种deg的细胞过程(go:0009987)。在细胞过程类别中,富集go术语如细胞周期(go:0007049),细胞组分运动(go:0006928),染色体分离(go:0007059)和胞质分裂(go:0000910)。其它富集的术语包括细胞组分组织(go:0016043)和细胞组分组织或生物发生(go:0071840),它们主要参与细胞周期过程和调节(图7c至图7e)。
事实上,与野生型相比,几种已知的稻细胞周期基因在pzr1-d中差异表达(表3)。还富集了几个其它go术语,例如催化活性(go:0003824)、激酶活性(go:0016301)、蛋白丝氨酸/苏氨酸激酶活性(go:004674)、核酸结合(go:0003676)、核苷酸结合(0000166)和蛋白质结合(go:0005515)。
表3与野生型(wt)相比,pzr1-d中差异表达的稻细胞周期基因的列表
检查表1和表2中列出的前面的deg的启动子序列,发现80种中的77种含有e2f和e2f10spcna共有启动子结合序列,其与定义为tttc[cg]cgc的共有序列相匹配(vandepoele等人,2005)(表4)。rna测序表明,差异表达基因的启动子均富含bzr1和ef-dpb转录因子的同源序列,表明pzr1在稻br介导的细胞分裂中发挥作用。总之,这些结果提示pzr1-d突变影响参与细胞分裂的基因的表达。
对单子叶植物中br过程的相关信息的相对缺乏促进了新遗传工具和研究的发展。迄今为止,发现控制稻结构和产量的几种基因与br反应有关,并且已经鉴定出许多突变体具有用于农艺改良的潜在用途(sakamoto等人,2006;wu等人,2008;yang和hwa,2008;wu等人,2016)。与稻中其它br相关突变体一样,pzr1-d突变体表现出半矮化和增加的分蘖数,两个性状通常是相关的;矮化植物通常具有比野生型更多的分蘖。然而,与其它br突变体不同,pzr1-d中的矮化没有伴随种子大小的显著降低。相反,在该突变体中的种子大小几乎不受影响,而增加的分蘖数导致植物中穗的数量增加,所有这些都有助于提高每株植物的产量。
已经确定pzr1-d的突变体表型是由pzr1(其为拟南芥dp转录因子基因的同源物)的激活产生的(图5和图6)。dp是激活参与进展到s期的基因的转录的转录因子e2f的二聚化伴侣。发现稻中pzr1的过表达概述了t-dna激活标记品系的表型和产量增加(图2和图5)。e2f/dp异二聚体的功能在动物和植物中是非常保守的,并且系统发育分析显示异二聚化结构域在pzr1中是非常保守的,这表明pzr1如它们的拟南芥同源物一样可能与e2f一起参与稻中的细胞周期调节(图6)(deveylder等人,2002;delpozo等人,2006)。除系统发育分析结果外,该研究的其它结果还表明pzr1在细胞周期调节中起作用。首先,与野生型相比,突变体中根和叶中的细胞数目增加,而细胞大小可能由于在细胞生长之前加速细胞分裂而减小(图4a至图4d和图11b和图11c)。第二,衍生自pzr1-d种子的愈伤组织的总体形状更小,并且愈伤组织伴随根样结构,这表明细胞分裂和细胞分化之间的平衡在突变背景中明显改变(图4e和图4f)。另外,全基因组转录物组分析揭示了pzr1与参与细胞周期调节的多种基因的关联(表4)。与细胞过程相关的许多go类别富集在野生型和pzr1-d之间的deg中(图7)。有趣的是,大多数deg在其启动子中具有共有的e2f/dp结合序列,这再次证实了pzr1像拟南芥dp转录因子一样起作用的概念(图13;表4)。
表4来自各条件下的前20种最显著的差异表达基因(deg)的启动子中的转录因子结合位点(tfbs)
在br缺陷型或br不敏感型突变体中观察到的矮化表型主要由细胞伸长降低引起(kauschmann等人,1996;szekeres等人,1996),但在这种类型的突变体中细胞增殖也改变(hu等人,2000;gonzalez-garcia等人,2011;zhiponova等人,2013)。在拟南芥中,单独的e2f的过表达产生子叶增大的幼苗,但是e2f及其伴侣dp的过表达一起引起严重的矮化(deveylder等人,2002)。与在pzr1-d突变体的根中的观察结果相似,e2f-和dp-过表达品系的子叶和根含有比野生型更多但更小的细胞,并且这些细胞具有增大的核,这可能是由于增强的核内复制导致。e2f/dp转基因植物中的额外细胞可由细胞周期的延长的增殖期(这将细胞分化延迟)导致(deveylder等人,2002)。pzr1-d愈伤组织的特征性表型可由细胞周期缩短和过早分化引起(图4e)。pzr1转录因子可能作为决定细胞是否应该分裂的重要决策者。
有趣的是,单独的dp的过表达不会在拟南芥幼苗中引起任何改变的表型,并且单独的e2f的过表达导致较短的根(deveylder等人,2002;ramirez-parra等人,2004)。稻版本的pzr1在拟南芥中的过表达产生具有更长的初级根,增加的根毛密度和总体更高的根生物量的幼苗(图12a至图12e)。通过在稻和拟南芥中过表达pzr1产生的表型以及这种表型与对过表达e2f的转基因植物所述的表型相反的观察结果表明,稻pzr1和拟南芥dp可能不具有完全重叠的功能,并且pzr1可能除了仅作为e2f的二聚体伴侣外还起不同的作用。
磷酸接力传递(phosphorelay)信号传导途径在涉及bri1、bak1、bsk、bin2和bzr1的br信号传导途径中起重要作用(he等人,2002;li等人,2002;nam和li,2002;wang等人,2002;kim和wang,2010;tang等人,2011;wang等人,2011)。类似地,磷酸化在细胞周期控制中起重要作用,其中细胞周期蛋白依赖性激酶(cdk)和细胞周期蛋白形成通过细胞周期阶段的进展磷酸化靶标的复合物(inze和deveylder,2006)。观察到pzr1是在其序列中具有bin2激酶靶基序的细胞周期调节剂(图14),导致我们假设它可能是br级联的组分所磷酸化的靶标,这表明两个过程之间可能存在联系。br信号传导途径的最重要的组分之一是稻中的蛋白激酶bin2或osgsk2,其在不同水平上起作用并且甚至介导不同的途径(li等人,2001;he等人,2002;koh等人,2007;kim等人,2012;tong等人,2012;khan等人,2013)。在稻中描述了bin2介导的细胞周期调节的最近实例,其中bin2显示出与u-型细胞周期蛋白cycu4的相互作用并将其磷酸化(sun等人,2015)。大多数已知的bin2和其它gsk3底物含有短的共有序列s/txxxs/t,其中s/t对应于丝氨酸或苏氨酸,x代表任何其它残基(zhao等人,2002)。实际上,pzr1的序列含有许多典型的基序(例如t35xxxs39和s77t78xxs81),这提高了pzr1的调节涉及osgsk2的可能性(图14)。
可以操纵dp途径以指导植物中的细胞分裂,从而允许调节产量和结构。由于e2f和dp是保守性良好的蛋白质,dp同源物也可能存在于其它具有农艺学重要性的谷物中。因此,可以通过调节这些同源基因的表达以通过增加分蘖数和穗数来提高产量,或者通过扩增初级根产生和侧根产生来增加抗旱性,而将类似的方法应用于其它物种。
实施例6
创建高产作物田的方法
本实施例描述了用于产生高产作物田和从作物田中去除杂草的方法,所述作物田包括使用本文公开的方法包括用于遗传修饰(例如基因过表达)的方法产生的植物。
通过本文公开的方法产生的pzr1-d稻植物使用移植生长方法在稻田中生长。野生型植物在相邻的植物田地中生长。pzr-1d和野生型稻植物也可以通过移植或直接播种(如果稻田不可用)在温室中生长。
由用pzr1-d植物种植的田地和用野生型植物种植的田地产生的作物的比较表明,用pzr1-d植物种植的田地显示出比用野生型植物种植的田地高5%以上的产量。
实施例7
从作物田清除杂草的方法
本实施例描述了用于产生作物田和从作物田中去除杂草的方法,所述作物田包括使用本文公开的方法包括用于遗传修饰(例如基因过表达)的方法产生的植物。
通过本文公开的方法产生的植物(例如pzr1-d植物)在稻田中生长。用野生型稻植物种植相邻的田地。每块田地还播种杂草。用20m丙环唑处理每块作物田。
在播种了pzr1-d植物的田地中,杂草被清除并且pzr1-d植物能够产生用于收获的稻。在播种了野生型稻植物的田地中,杂草和野生型稻植物都被破坏。
- 还没有人留言评论。精彩留言会获得点赞!