一种荧光标记的糖分子及其制备方法和应用与流程
本发明属于生物医药技术领域,具体涉及一种荧光标记的糖分子及其制备方法和应用。
背景技术:
糖类化合物尤其是多糖由于结构复杂,没有特定的紫外吸收光谱,使得糖类药物的微量检测成为难点,进而限制了糖类分子体内药代动力学研究并成为糖药物开发的瓶颈。传统的糖类药物代谢动力学研究方法有同位素标记法、免疫学法、色谱分析法等,由于过程繁琐,灵敏度低,结果重复性差而受到限制。
荧光标记及活体成像检测技术由于灵敏度高,检测结果直观,已广泛用于生命科学研究及药物开发中。研究表明,cy7可对姜黄素进行荧光标记,并利用活体成像技术对姜黄素在小鼠体内分布情况进行实时检测,表明该技术可对姜黄素在小鼠体内代谢进行研究(孙永等,南京中医药大学学报,2011,27(6):539-541)。但是,对于糖类化合物是否能采用类似技术进行荧光标记,并研究其在活体内的药代动力学特点及组织和器官分布尚无专利或文献报道。
技术实现要素:
针对糖类分子体内代谢和组织器官分布研究方法不灵敏问题,本发明的目的在于提供一种荧光标记的糖分子及其制备方法和应用,本发明为糖类分子提供了简单的荧光标记技术,并利用活体成像技术检测荧光标记糖分子在活体动物体内的代谢动力学及组织器官分布,弥补了现有技术存在的不足之处。所提供的荧光标记及纯化方法简单,效率高,荧光信号强,检测灵敏度高,并且结果直观可视性好,尤其是对于未知结构的糖分子代谢研究更具有明显的优势,易在糖类药物开发及临床研究中应用。
为实现上述发明目的,本发明采用下述技术方案予以实现:
本发明提供了一种荧光标记的糖分子,所述荧光标记的糖分子经过如下标记过程获得:
其中所述r为多糖、低聚糖、寡糖或糖衍生物分子,n=2-10,所述荧光分子为n-羟基琥珀酰亚胺酯活化的花青染料cy3、cy5和cy7中的至少一种。
本发明还提供了所述的荧光标记的糖分子的制备方法,它包括以下步骤:
(1)还原胺化:将糖分子溶解在含有二氨基试剂的乙酸溶液中,再加入还原剂,形成反应体系,搅拌反应5h~24h,反应结束后用1kda~10kda透析袋透析,透析液减压浓缩后冷冻干燥,得到糖分子还原胺化产物;
(2)荧光标记:将步骤(1)糖分子还原胺化产物用磷酸盐缓冲液溶解后加入荧光标记试剂形成总反应溶液,避光反应,对糖分子进行荧光标记,获得所述荧光标记的糖分子。
进一步的:所述步骤(1)中二氨基试剂为1,5-戊二胺、1,6-己二胺、1,7-庚二胺、1,8-辛二胺、1,9-辛二胺和1,10-壬二胺中的至少一种,所述二氨基试剂在反应体系中的摩尔浓度为糖分子在反应体系中摩尔浓度的10~200倍。
进一步的:所述步骤(1)中加入的还原剂为硼氢化钠、氰基硼氢化钠、硼氢化锂、三甲胺硼烷、三乙胺硼烷、吗啉硼烷和4-甲基吗啉硼烷中的至少一种,所述还原剂在反应体系中的摩尔浓度为糖分子在反应体系中摩尔浓度的10~200倍。
进一步的:所述步骤(2)中荧光标记试剂在总反应溶液的最终摩尔浓度为糖分子在总反应溶液摩尔浓度的2~10倍。
进一步的:将步骤(2)所述荧光标记的糖分子进行如下纯化步骤:取所述荧光标记的糖分子用凝胶色谱柱纯化,以蒸馏水为流动相,收集示差检测器和荧光检测器重合的检测信号峰,减压浓缩干燥,得纯化后的荧光标记的糖分子。
进一步的:所述凝胶色谱柱填料为sephadexg-10、sephadexg-15、sephadexg-25或biogelp2、p4、p6。
本发明还提供了所述的荧光标记的糖分子在制备用于检测糖分子在体内代谢的检测剂中的应用。
本发明还提供了所述的荧光标记的糖分子在制备用于检测糖分子在组织器官中分布的检测剂中的应用。
进一步的:所述荧光标记的糖分子的检测时间为0.01~24h。
与现有技术相比,本发明的优点及积极效果是:本发明提供的糖分子的荧光标记技术操作简单,适用于任一具有还原端的多糖、低聚糖、寡糖及其衍生物分子,具有普遍适用性,且标记产物纯度高,标记后保持分子原型。本发明制备的荧光标记糖分子经动物活体成像技术检测在动物体内的组织及器官分布证实具有荧光信号强,检测灵敏度高,可视性强等优点,容易说明糖分子在动物体内的代谢时间及代谢类型、组织及器官分布特点,为糖类药物活体代谢研究提供了新的途径,在糖药物的开发中具有广阔的应用前景。
结合附图阅读本发明的具体实施方式后,本发明的其它优点和特点将变得更加清晰。
附图说明
图1为本发明低聚褐藻淀粉还原胺化产物高效薄层硅胶层析分析图,其中a、己二胺;b、还原胺化产物;c、荧光标记产物。
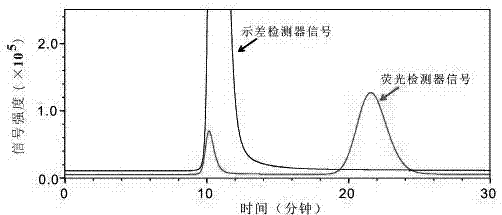
图2为本发明荧光标记的低聚褐藻淀粉纯化与高效液相色谱分析图。
图3为本发明低聚褐藻淀粉还原胺化及荧光标记产物分子量分析图。
图4为本发明荧光标记低聚褐藻淀粉在小鼠体内不同时间的组织器官分布图。
图5为本发明荧光标记灰树花多糖在小鼠体内不同时间的组织器官分布图。
图6位本发明荧光标记的灰树花多糖在小鼠器官的分布图。
具体实施方式
下面结合附图和具体实施方式对本发明的技术方案做进一步的详细说明。
本发明采用还原胺化的方法在糖分子还原端引入含氨基分子,再与含羧基荧光试剂偶联,获得荧光标记糖分子。具体标记过程如下所示:
其中所述r为具有还原端的多糖、低聚糖、寡糖或糖衍生物分子,所述n=2-10,所述荧光分子为n-羟基琥珀酰亚胺酯活化的花青染料cy3、cy5和cy7中的至少一种。
实施例1:低聚褐藻淀粉的荧光标记
1、取100mg低聚褐藻淀粉溶解在5ml含有2mol/l1,6-己二胺的5%-20%(体积比)乙酸溶液中,再加入5ml4mol/l氰基硼氢化钠搅拌反应5h,反应结束后用3kda透析袋透析24h,透析内液经减压浓缩后冷冻干燥得低聚褐藻淀粉还原胺化产物。
2、取步骤1的还原胺化产物1mg,加入0.1ml蒸馏水溶解,分别取0.2µl溶液分别点在2块高效薄层硅胶板上,在正丙醇/h2o=3/1(体积/体积)的体系中层析,层析结束后分别用茚三酮(0.2%茚三酮乙醇溶液)和苯胺-二苯胺液显色,两种显色方法均呈现阳性反应,表明还原胺化成功。
3、取步骤1所述的还原胺化产物用ph7.2磷酸盐缓冲液溶解,加入占低聚褐藻淀粉还原胺化产物3倍摩尔质量的n-羟基琥珀酰亚胺活化的cy7,在37℃恒温摇床中避光反应12h,反应结束后对产物进行冷冻干燥,获得荧光标记的低聚褐藻淀粉。
4、取步骤3所述荧光标记的低聚褐藻淀粉用2ml蒸馏水溶解,用sephadexg-10凝胶凝胶色谱柱纯化,以蒸馏水为流动相,示差检测器和荧光检测器同时检测,收集示差检测器和荧光检测器重合的检测信号峰,减压浓缩干燥,得纯化后的荧光标记的低聚褐藻淀粉。
5、取步骤1所述的低聚褐藻淀粉及其还原胺化产物,以及步骤4所述荧光标记产物进行分子量分析,色谱柱为ohpaksb-802hq凝胶色谱柱,以0.1mol/l硫酸钠水溶液为流动相,采用示差检测器-多角激光散射仪联用在线检测,计算多糖标记过程中的重均分子量(mw)和数均分子量(mn)。
本实施例所述的1,6-己二胺可改用1,5-戊二胺、1,7-庚二胺,1,8-辛二胺,1,9-辛二胺或1,10-壬二胺。所述的氰基硼氢化钠可改用硼氢化钠、硼氢化锂、三甲胺硼烷、三乙胺硼烷、吗啉硼烷或4-甲基吗啉硼烷。所述的n-羟基琥珀酰亚胺活化cy7可改用n-羟基琥珀酰亚胺酯活化的cy3、cy5或其它可用于动物成像检测的荧光试剂。所述的纯化用凝胶色谱柱填料可改用sephadexg-15、sephadexg-25或biogelp2、p4、p6。所述分子量测定用的凝胶色谱柱可改用ohpaksb-802.5hq、ohpaksb-804hq、ohpaksb-806hq、tsk-gelg3000pw/g3000pwxl或splaquagel-ohmixed中的一种或两种串联。
本发明利用糖分子还原端通过还原胺化反应与二氨基化合物反应引入游离氨基,进一步通过氨基与荧光试剂分子中的羧基发生缩合反应,从而将荧光分子引入糖分子实现糖分子的荧光标记,由于反应产物水溶性强,可以通过透析对还原胺化产物进行纯化,利用凝胶柱层析对荧光标记多糖进行纯化和检测,反应效率高,操作简单。
本发明中低聚褐藻淀粉还原胺化产物高效薄层色谱检测图如图1所示。其中,采用苯胺-二苯胺对糖显色时,低聚褐藻淀粉和其还原胺化产物均呈阳性反应,而采用茚三酮显色时,还原胺化产物显色呈阳性反应,表明分子中成功引入了氨基基团,同时以己二胺为对照,表明采用的透析技术可以成功的除去反应中多余的己二胺。
本发明中低聚褐藻淀粉荧光标记产物纯化及检测图如图2所示。其中,示差检测器信号只出现产物荧光标记多糖的信号,虽然糖分子中荧光标记物的含量较少,但荧光检测器可以同时检测到荧光标记糖分子与残留的荧光试剂信号,说明通过sephadexg-10柱可以成功的将荧光标记低聚褐藻淀粉与残留的荧光试剂及其它杂质去除。根据色谱图中出峰的顺序对产物进行回收,冻干后可获得目标产物荧光标记低聚褐藻淀粉。
本发明中低聚褐藻淀粉荧光标记过程中分子量分析图如图3所示。其中,低聚褐藻淀粉、其还原胺化产物及荧光标记低聚褐藻淀粉的激光检测器信号和示差检测器信号重叠性好,表明低聚褐藻淀粉在标记过程中未发生降解,保持了分子原型。
本发明中低聚褐藻淀粉荧光标记过程中分子量测定结果如表1所示。低聚褐藻淀粉分子量为5.54kda,分散指数为1.15,还原胺化产物的分子量为5.83kda,分散指数为1.15,荧光标记低聚褐藻淀粉分子量为6.23kda,分散指数为1.16,表明标记过程中分子量有少量增加,这是由于引入含有氨基的连接臂和荧光分子的缘故,由于分散指数未发生明显的变化,进一步表明本发明方法标记过程中糖分子未发生降解,保持了分子原型,适合糖类分子的荧光标记。
表1荧光标记过程中糖分子量及分子量分散指数
实施例2:荧光标记的低聚褐藻淀粉在检测糖分子代谢动力学和组织及器官分布中的应用
1、将所述荧光标记的低聚褐藻淀粉用生理盐水配制为1mg/ml溶液,生理盐水作为空白组,按照0.1ml/10g体重剂量裸鼠尾静脉注射。
2、步骤1注射后分别于0、0.5、1、2、4和8h麻醉实验鼠,使用小动物活体成像系统对各实验组受试药在小鼠体内的组织分布情况进行观察,分别拍照记录裸鼠腹部和背部不同时间的荧光信号。
本发明中荧光标记的低聚褐藻淀粉不同时间在实验鼠体内分布情况如图4所示,从图4可以看出标记的糖分子静脉注射进入小鼠体内后,0.5h~8h内均可以检测到荧光信号,0.5h时主要分布于肺部和肾脏,随着作用时间的增加,在1h~2h时逐渐向肾脏和膀胱聚集,呈现肾排泄的特点,4h后逐渐排出体外,8h在膀胱处有微弱的荧光信号。同时发现在标记的低聚褐藻淀粉在体内8h以内,糖分子与荧光分子未发生脱离,表明该荧光标记方法适合代谢过程中药物分子的示踪检测。根据需要,标记糖分子的代谢和组织器官分布情况可以连续检测24h。
实施例3:灰树花多糖的荧光标记及其在组织和器官分布检测中的应用
1、取50mg灰树花多糖溶解在2ml含有1mol/l1,7-庚二胺的10%(体积比)乙酸溶液中,再加入2ml2mol/l硼氢化钠搅拌反应8h,反应结束后用7kda透析袋透析36h,透析内液经减压浓缩后冷冻干燥得灰树花多糖还原胺化产物。
2、取步骤1所述灰树花多糖还原胺化产物用ph7.2磷酸盐缓冲液溶解,加入占灰树花多糖还原胺化产物5倍摩尔质量的n-羟基琥珀酰亚胺活化的cy7分子,在37℃恒温摇床中避光反应10h,反应结束后转移至截留分子量为10kda的透析袋中透析36h,透析内液经减压浓缩后冷冻干燥得灰树花多糖cy7荧光标记产物。
3、将步骤2所述灰树花多糖荧光标记产物用生理盐水溶解为5mg/ml溶液,以生理盐水作为空白对照组,按照0.05ml/10g体重剂量裸鼠尾静脉注射。
4、步骤3注射后分别于0、15min、30min、45min、60min、1.5h、2h、2.5h和3h麻醉实验鼠,使用小动物活体成像系统对各实验组受试药在小鼠体内的组织分布情况进行观察,分别拍照记录裸鼠腹部和背部不同时间的荧光信号。
5、将步骤4的实验鼠处死后解剖,分别取脑、心脏、肺脏、肝脏和肾脏采用活体成像系统观察拍照,记录不同器官荧光信号。
本实施例所述的1,7-庚二胺可改用1,5-戊二胺、1,6-己二胺、,1,8-辛二胺,1,9-辛二胺或1,10-壬二胺。所述的硼氢化钠可改用氰基硼氢化钠、硼氢化锂、三甲胺硼烷、三乙胺硼烷、吗啉硼烷或4-甲基吗啉硼烷。所述的n-羟基琥珀酰亚胺活化cy5可改用n-羟基琥珀酰亚胺酯活化的cy3、cy7或其它可用于动物成像检测的荧光试剂。
本实施例中荧光标记灰树花多糖静脉注射进入小鼠体内后,组织和器官分布检测结果如图5所示。15min~3h内均可以检测到荧光信号,30min时主要在肝脏和肾脏分布,随着时间的延长,60min以后逐渐向肾脏和膀胱聚集,呈现出神代谢的特诊。同时观察到标记的灰树花多糖在体内3h以内,多糖与荧光分子没有发生脱离,表明该荧光标记方法适合用于糖分子药物的体内代谢检测。
本发明标记灰树花多糖在各器官的荧光信号分布检测结果如图6所示。从图6结果可进一步说明标记灰树花多糖主要分布于小鼠的肝脏和肾脏,3h以后主要集中于肾脏和膀胱部位。根据需要,标记糖分子的代谢和组织器官分布情况可以连续检测24小时。
综上,本发明所述方法通过还原胺化反应在糖分子的还原端引入游离氨基,通过氨基与荧光分子中的羧基偶联反应,并通过透析及凝胶柱层析纯化,实现了对糖分子的快速荧光标记,利用动物活体成像技术检测了糖分子在活体动物中的药代动力学特征及组织和器官分布。
本发明建立的糖分子荧光标记方法适用于任何具有还原端的糖分子,具有普适性,利用糖分子的荧光标记技术实现了糖分子在活体动物中的代谢动力学及组织和器官分布研究,具有灵敏度高,结果直观可靠等特点,具有广阔的应用前景。
以上实施例仅用以说明本发明的技术方案,而非对其进行限制;尽管参照前述实施例对本发明进行了详细的说明,对于本领域的普通技术人员来说,依然可以对前述实施例中所记载的技术方案进行修改,或者对其中部分技术特征进行等同替换;而这些修改或替换,并不使相应技术方案的本质脱离本发明所要求保护的技术方案的精神和范围。
- 还没有人留言评论。精彩留言会获得点赞!