一种近红外荧光探针及基于该探针的多模态纳米造影剂及其制备和应用的制作方法
本发明属于生物与医学纳米材料技术领域,涉及一种近红外荧光探针和基于该探针的肿瘤多模态成像纳米造影剂,以及它们的制备方法和应用。
背景技术:
随着分子影像技术的发展,分子影像已广泛应用于细胞、组织及临床医学检验等学科。其中,临床上已使用11C标记的蛋氨酸(11C-Met)等作为PET/CT造影剂,对乳腺癌、肺癌、脑胶质瘤等进行诊断。尽管这些PET/CT造影剂有着各自的优点,但是也存在着许多不足,如对患者有损伤、容易受到体内骨骼等的影响、设备昂贵、操作复杂等。
除PET/CT成像外,常见的成像技术还有核磁共振成像(MRI)、光学成像和超声成像。核磁共振成像(MRI)是一种临床常用的成像手段,是一种无辐射损伤的安全检测手段。光学成像技术作为安全、无损、高效、低成本、实时、在位的成像诊断技术,已逐渐成为生物组织无损检测技术领域的另一研究热点。荧光分子成像技术作为光学成像领域的一门新兴技术,已成为研究基因表达、基因测序、临床诊断等方面的重要技术手段。光声成像(PAI)是近年来发展起来的一种采集光激发产生的超声信号为光声信号进行成像的技术。这种技术结合了光学成像的高选择特性和超声成像的深穿透特性两大优点,可得到高分辨率和高对比度的成像结果。
上述成像技术及采用的示踪剂已逐步应用于临床。四氧化三铁(Fe3O4)纳米粒子是一种已在临床获得应用的MRI造影剂。吲哚菁绿(ICG)是一种苯并吲哚七甲川菁染料,也是被美国FDA批准在临床上使用的近红外荧光染料。但ICG存在无靶向性的缺点。为了得到肿瘤靶向的荧光染料,研究者们已开发出一系列带有活性基团的ICG衍生物,以便修饰靶向配体。普鲁士蓝是一种FDA批准的临床药物,具有很好的体内生物安全性,其在近红外波长区域有强吸收,能有效增加近红外激光对组织的穿透,可作为一种高效的光声成像造影剂。
多模态成像技术是分子影像技术的重要发展方向之一,将光声成像、荧光成像、MRI成像等结合到一起,弥补了单一成像技术的不足,实现综合与更加精准的影像学诊断。多模态成像技术迫切需要开发与之相应的新型多模态造影剂。只需一次注射单一造影剂,便可实现两种或多种成像功能。
热疗是利用高温来杀伤肿瘤的一种治疗方法,其中磁热和光热是常用的两种热疗方式,即分别利用材料的磁热和光热转换性能有效地将磁和光能转换为热能,并产生高温杀伤肿瘤细胞。热疗可特异性的杀伤肿瘤细胞而对正常细胞无影响,因此被医学界称之为“绿色疗法”。比如,具有较高组织穿透能力的近红外光可以被广泛的应用于热疗中。其中,用于肿瘤的光热治疗被定义为能将近红外光的能量集中到肿瘤区域,使肿瘤区域升温达到43℃从而治疗肿瘤。而ICG等近红外染料可以在近红外光照射下达到热疗效果。
技术实现要素:
技术问题:
本发明的目的在于提供一种肿瘤靶向的近红外荧光探针及其制备方法,所述的荧光探针具有较强的荧光强度,稳定性好不易淬灭,且具有高效的光热转换效率。
本发明的另一目的在于针对单一影像技术单独使用的局限性可能造成疾病检测信息不全面等问题,基于所述的近红外荧光探针,提供一种肿瘤靶向的多模态纳米造影剂及其制备方法,作为示踪剂可同时实现MRI、荧光、光声成像中两种以上多模态成像功能,实现肿瘤的综合与精确诊断。
同时,本发明的另一目的还在于提供所述的多模态纳米造影剂的应用。
技术方案:
为实现上述发明目的,本发明采用如下技术方案:
一种肿瘤靶向的近红外荧光探针,其特征在于,具有如下式(Ⅰ)所示的结构,
所述的近红外荧光探针的制备方法,其合成路径如图1(以X=K为例)所示,包括以下步骤:
1)在氮气或氩气的保护下,以无水DMF或DMSO为溶剂,式(Ⅱ)结构的荧光染料(IR-782)和巯基乙胺反应,制得式(Ⅲ)中间产物(NH2-IR-782);
2)在氮气或氩气的保护下,以无水DMF或DMSO为溶剂,在偶联剂二环己基碳二亚胺(DCC)和N-羟基琥珀酰亚胺(NHS)的作用下,中间产物(NH2-IR-782)和甲硫氨酸(Met)反应后制得式(Ⅰ)结构的偶联产物(Met-IR-782),
所述的肿瘤靶向的近红外荧光探针(Met-IR-782)的发射波长为650-850nm,具有较强的荧光强度,具有较好的稳定性,不易淬灭,适合作为近红外荧光探针。且其中的甲硫氨酸(Met)可作为肿瘤靶向基团。
所述的NH2-IR-782的制备是,在氮气或氩气的保护下,将化合物IR-782和巯基乙胺反应后制得。具体地,IR-782和巯基乙胺的摩尔比为1:(1-10),反应温度为25-50℃,氮气或氩气保护,反应时间为12-24小时,反应体系的溶剂为无水DMF或DMSO。收集反应液并加入过量甲苯或乙醚,离心(1000-3000rpm,5-15min)一次以上取沉淀经柱层析后即得。所述层析柱可采用硅胶柱,硅胶的规格为200-300目,洗脱液为甲醇和乙酸乙酯的混合液,甲醇与乙酸乙酯体积比为1:(1-10)。
所述的Met-IR-782制备是,在氮气或氩气的保护下,将NH2-IR-782和Met反应后制得化合物Met-IR-782。具体地,Met与DCC和NHS的摩尔比为1:(3-15),NH2-IR-782和Met的摩尔比为1:(1-5),氮气或氩气保护,反应温度为25-50℃,反应时间为12-24小时,反应体系的溶剂为无水DMF或DMSO。收集反应液并加入过量甲苯或乙醚,离心(1000-3000rpm,5-15min)一次以上取沉淀经柱层析后即得。所述层析柱可采用硅胶柱,硅胶的规格为200-300目,洗脱液为甲醇和乙酸乙酯的混合液,甲醇与乙酸乙酯体积比为1:(1-10)。
基于上述肿瘤靶向的近红外荧光探针,本发明还提供了一种多模态纳米造影剂及其制备方法,在选择Fe3O4纳米粒子作为MRI(T2)造影剂部分的基础上,以普鲁士蓝作为光声成像及MRI(T1)造影剂部分,再采用所制备的近红外荧光探针Met-IR-782作为光学探针部分。
一种多模态纳米造影剂,其特征在于,包括Fe3O4纳米粒子、普鲁士蓝和近红外荧光探针Met-IR-782,所述多模态纳米造影剂具有核壳结构,以Fe3O4纳米粒子为核,普鲁士蓝包裹在Fe3O4纳米粒子表面为壳,Met-IR-782分布在核壳结构上并以酰胺键键合在Fe3O4纳米粒子上。
所述的Fe3O4纳米粒子为表面带有羧基的Fe3O4纳米粒子,优选为巯基丁二酸(DMSA)修饰的Fe3O4纳米粒子,即DMSA@Fe3O4纳米粒子,尺寸为5-30nm。所述的多模态纳米造影剂中Fe3O4纳米粒子具有MRI造影的功能,且具有肿瘤磁热疗功能。
所述的多模态纳米造影剂中,Fe3O4纳米粒子作为普鲁士蓝的反应原料及载体,其中的普鲁士蓝(PB)为包裹在Fe3O4纳米粒子表面的壳层,厚度优选为1-8nm。普鲁士蓝可作为所述的多模态纳米造影剂中的光声成像及MRI(T1)造影剂部分。
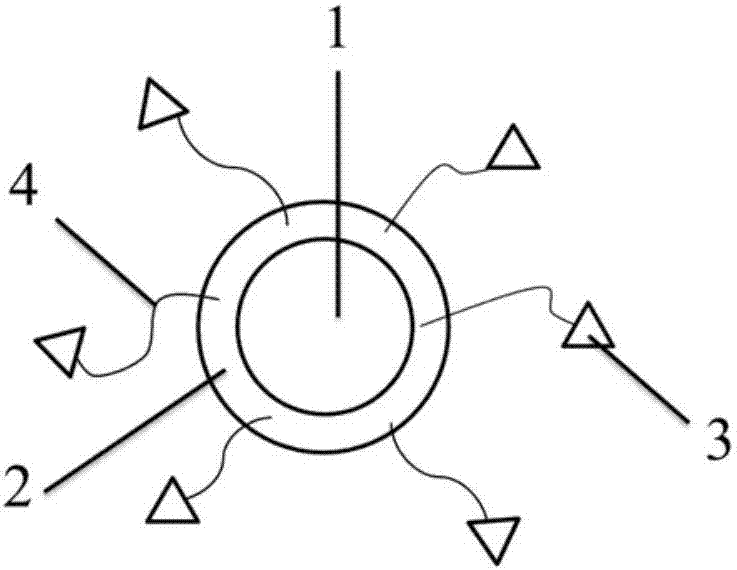
所述的多模态纳米造影剂中,作为光学探针部分的近红外荧光探针Met-IR-782具有肿瘤靶向功能(Met),且具有较高的光热转换效率。Met-IR-782以酰胺键(Met中的NH2-和Fe3O4纳米粒子表面的羧基)健合在Fe3O4纳米粒子上并分布在核壳结构上。所述多模态纳米造影剂的结构示意图如图2。
所述多模态纳米造影剂采用以下方法制备,包括以下步骤:
1)制备近红外荧光探针Met-IR-782,将Met-IR-782与表面带有羧基的Fe3O4纳米粒子进行偶联反应;
2)以步骤1)制得的Fe3O4纳米粒子作为铁源,在Fe3O4纳米粒子表面原位合成普鲁士蓝,制得所述的多模态纳米造影剂。
上述步骤1)也可以直接采用表面带有羧基的Fe3O4纳米粒子、Met及NH2-化荧光染料NH2-IR-782一步偶联。
所述表面带有羧基的Fe3O4纳米粒子优选DMSA@Fe3O4纳米粒子。
具体地,步骤1)是在氮气或氩气的保护下,以无水DMF或DMSO为溶剂,在偶联剂二环己基碳二亚胺(DCC)和N-羟基琥珀酰亚胺(NHS)的作用下,Met-IR-782(或Met和NH2-IR-782)和表面带有羧基的Fe3O4纳米粒子进行偶联反应,反应温度为25-50℃,反应时间为12-24小时。
当使用“一步法”直接偶联Fe3O4纳米粒子与Met和NH2-IR-782时,三者质量比为(20-100mg):(100-300mg):(5-20mg)。
当偶联Met-IR-782与Fe3O4纳米粒子时,二者质量比为(50-300mg):(20-100mg)。
具体地,步骤2)是在酸性条件下,步骤1)制得的Fe3O4纳米粒子中加入亚铁氰化钾(K4[Fe(CN)6]),搅拌12-24h反应制得所述的多模态纳米造影剂。
当在Fe3O4纳米粒子(如DMSA@Fe3O4纳米粒子)表面制备普鲁士蓝壳层的时候,反应体系的pH值优选为2.5-5.5,Fe3O4纳米粒子与亚铁氰化钾(K4[Fe(CN)6])的摩尔比优选为(3-10):1。
所述的多模态纳米造影剂通过静脉注射,可以累积到肿瘤部位,实现肿瘤的靶向多模态造影,亦可实现肿瘤的磁热及光热疗。
本发明还涉及所述的多模态纳米造影剂在制备造影剂中的应用。
进一步地,本发明还涉及所述的多模态纳米造影剂在制备肿瘤热疗中的磁热和/或光热制剂中的应用。
有益效果:根据本发明的肿瘤靶向的近红外荧光探针,具有较强的荧光强度,稳定性好不易淬灭,通过肿瘤细胞对Met的依赖性,偶联的Met实现肿瘤的靶向荧光成像。基于所述的荧光探针构建的多模态纳米造影剂,可实现荧光/MRI/光声两两组合的双模态造影,亦可实现肿瘤的荧光/MRI/光声三模态造影,以实现在体实时肿瘤成像,从而为肿瘤治疗提供更综合精确的信息,检测灵敏度高、检测成本低,特别适合代替放射性造影剂用于体内成像。同时,所述的多模态纳米造影剂具有磁热及光热转换性能,可实现肿瘤的磁热疗及光热疗,亦可实现肿瘤的磁热及光热协同治疗。所述的多模态纳米造影剂结构新颖,制备工艺简单,且水溶性、生物相容性好,灵敏度高,能准确靶向至肿瘤组织,具有较好的肿瘤成像及光热治疗效果。本发明的多模态纳米造影剂弥补了单一影像技术造影的不足,对肿瘤的诊疗具有重要意义。
附图说明
图1是甲硫氨酸偶联的IR-782近红外荧光染料的合成路径;
图2是IR-782近红外荧光染料偶联的PB-Fe3O4纳米探针结构。1、Fe3O4纳米粒子,2、普鲁士蓝,3、IR-782近红外荧光染料,4、甲硫氨酸;
图3为近红外荧光探针Met-IR-782的1H NMR图谱;
图4中的A图是IR-782,Met-IR-782和ICG的紫外可见吸收光谱;B图是IR-782,Met-IR-782和ICG的荧光光谱;C图是用60W的灯泡照射后,在782nm处的ICG,IR-782,Met-IR-782和NH2-IR-782的吸光度;D图是在25至60℃范围内的不同温度下,在782nm处的ICG,IR-782,Met-IR-782和NH2-IR-782的吸光度;
图5为多模态纳米造影剂的透射电镜图;
图6为多模态纳米造影剂体外MRI成像效果;
图7为多模态纳米造影剂应用于小鼠肿瘤近红外荧光成像照片,激发波长为780nm;
图8为多模态纳米造影剂的光热升温曲线;其中横坐标为时间,纵坐标为温度,不同的曲线代表不同的近红外光强度;
图9为多模态纳米造影剂的细胞毒性实验;
图10为多模态纳米造影剂对4T1乳腺癌荷瘤小鼠的磁热和光热协同治疗肿瘤生长曲线图。
具体实施方式
以下结合具体实施例,对本发明进行详细说明。但是需要指出的是,实施本发明并非限于实施例中所描述的具体方式,任何熟悉本专业的技术人员,在本发明范围内,可利用所揭示的技术内容作出更改或变动,从而得到效果基本相同的实施方式或方法。凡是未脱离本发明技术构思和宗旨,对所述实施例所作的任何修改、等同或等效的变化与修饰,均仍属于本发明技术方案。本发明的保护范围并不受这些具体实施方式的限制,而是由权利要求书来确定。
本发明的近红外荧光探针Met-IR-782以巯基乙胺为连接基团,将近红外荧光染料IR-782与肿瘤细胞对之具有依赖性的Met连接,所得化合物荧光强度强,稳定性好,且具有高效的光热转换效率。其制备方法是首先将IR-782和巯基乙胺反应,制得胺基化中间产物NH2-IR-782,再与甲硫氨酸酰胺化反应制得偶联产物Met-IR-782。
本发明的多模态纳米造影剂具有核壳结构,以Fe3O4纳米粒子为核,普鲁士蓝包裹在Fe3O4纳米粒子表面为壳,Met-IR-782以酰胺键健合在Fe3O4纳米粒子上。所述的多模态纳米造影剂在选择Fe3O4纳米粒子作为MRI(T2)造影剂部分的基础上,选择普鲁士蓝作为光声成像及MRI(T1)造影剂部分,再选择所制备的近红外荧光染料IR-782作为光学探针部分,将MRI、PAI和荧光成像结合成一个整体,实现肿瘤的多模态成像。同时,将Fe3O4纳米粒子的磁热性能和普鲁士蓝及IR-782的光热性能组装到一起,从而实现肿瘤的磁热和光热治疗。
本发明的多模态纳米造影剂的制备方法为:首先将Fe3O4纳米粒子、Met及氨基化近红外荧光染料(NH2-IR-782)进行“一步法”偶联,或者通过先制备Met-IR-782,再偶联Fe3O4纳米粒子的两步法将三者偶联到一起。再利用Fe3O4纳米粒子作为铁源,在Fe3O4纳米粒子表面原位合成普鲁士蓝;最终得到尺寸合适、均一性好、生物相容性高的多模态纳米造影剂。
实施例1近红外荧光探针Met-IR-782及其制备方法
1)NH2-IR-782的制备
IR-782(104.3mg,自制,其制备可参见S.A.Hilderbrand,et al.Bioconjugate Chem.2005,16:1275-1281.)和巯基乙胺(27.3mg)溶于5mL DMSO中,氮气或氩气保护,25℃下反应16h。反应结束后,向反应液中加入过量的甲苯30mL后离心(3000rpm/min,10min)得沉淀,再向反应液中加入过量的乙醚30mL后离心(3000rpm/min,10min)得沉淀,将沉淀加入300目硅胶层析柱,以乙酸乙酯/甲醇(体积比5:1)混合液为洗脱溶剂,得88.1mg产物中间产物NH2-IR-782,产率约为67%。
2)Met-IR-782的制备
甲硫氨酸(14.9mg)、DCC(103mg)和NHS(57.5mg)溶于5ml DMSO中,氮气或氩气保护,25℃下反应12h。离心去沉淀后,加入NH2-IR-782(109.6mg),25℃下反应24h。反应结束后,向反应液中加入过量的乙醚30mL后离心(3000rpm/min,10min)得深绿色沉淀。将深绿色沉淀在300目硅胶层析柱中以乙酸乙酯/甲醇为洗脱液(v/v 5:1)进行柱层析分离,减压挥发溶剂,得78.4mg近红外荧光探针Met-IR-836,产率约为51%,其1HNMR谱图见附图3。
1H NMR(300MHz,DMSO-d6),d(ppm):7.61-7.87CCHC(CH)S,CCHCHCS,CCHCHCS,6.01-6.17CCHCHC,5.41-5.54CCHCHC,3.97-4.10NCH2CH2CH2CH2,3.02-3.21 CH2CH(NH2)CO,SCH2CH2NH,SCH2CH2NH,CCH2CH2CH2C,CCH2CH2CH2C,2.58-2.81 NCH2CH2CH2,CH3SCH2CH2CH,2.27-2.40CH3SCH2CH2CH,CH3SCH2CH2CH,1.49-1.89 CH3C(CH3)C,CH3C(CH3)C,CCH2CH2CH2C,NCH2CH2CH2CH2,NCH2CH2CH2CH2。
实施例2近红外荧光探针Met-IR-782的紫外可见吸收光谱和荧光光谱
取Met-IR-782探针10μg溶解于1mL PBS(0.1M,pH 7.2)缓冲溶液中,混合均匀后加入石英比色皿中静置5min。随后,将比色皿放入UV-Vis紫外全波长分光光度仪(UV-3600,Shimadzu,Japan)中检测Met-IR-782探针的吸收光谱,结果如附图4A所示。另取一份Met-IR-782探针10μg于1mL PBS(0.1M,pH 7.2)缓冲溶液中,混合均匀并加入石英比色皿中静置5min。随后,使用荧光全波长检测仪(Hitachi F-4600,Japan)检测探针在782nm激发波长下的发射光谱,结果如附图4B。IR-782、Met-IR-782和ICG的吸收峰和发射峰分别出现在780nm和835nm左右,其中Met-IR-782的最大吸收峰比未连Met的IR-782红移了3nm,Met-IR-782中320-400nm处为Met的吸收峰。
实施例3近红外荧光探针Met-IR-782的光稳定性和热稳定性
取Met-IR-782探针10μg溶解于1mL PBS(0.1M,pH 7.2)缓冲溶液中,混合均匀后置于60W灯泡下30cm处持续照射6h,并在0,1,2,3,4,5,6h时间点检测探针的平均吸收强度,结果如附图4C。另取Met-IR-782探针10μg溶解于1mL PBS(0.1M,pH 7.2)缓冲溶液中,混合均匀后置于恒温混匀仪(Eppendorf Thermo Mixer C,Germany)中。在25,30,35,40,45,50,55,60℃下检测探针的平均吸收强度。结果如附图4D所示,可见Met-IR-782置于60W灯泡下照射1h后,其平均吸收强度在90%以上。同时,ICG与NH2-IR-782在照射1h后,其平均吸收强度为86%,并且在继续照射5h后降至63%。Met-IR-782在升温至60℃后仍有92%的平均吸收强度,而ICG在60℃时其平均吸收强度为75%。
实施例4多模态纳米造影剂的制备
1)DMSA@Fe3O4纳米粒子的制备
分别取28g FeCl3·6H2O和20g FeSO4·7H2O于80mL纯水中混匀,氮气保护下水浴加热至70℃,剧烈搅拌并加入氨水(25%)。搅拌10min后加入10mL油酸(OA)并在70℃下继续反应3h。反应结束后,水浴升温至90℃挥发氨水,冷却后磁分离并用乙醇和纯水分别清洗3次后置于正己烷中,得Fe3O4@OA的正己烷溶液。取含Fe3O4@OA的正己烷溶液40mL(Fe3O4@OA纳米颗粒5mg/mL),加入40mL的DMSA丙酮溶液(DMSA 2.5mg/mL)均匀混合,60℃加热冷凝回流反应5h,纯水清洗3次,磁分离后溶于去离子水中调pH至10,超声分散后调pH至7并置于透析带中透析72h,磁分离得Fe3O4纳米颗粒,4℃保存备用。
2)Fe3O4@Met-IR-782
DMSA@Fe3O4(100mg)、EDC(100mg)和NHS(50mg)溶于5mL MES缓冲液(pH5.5)中,氮气或氩气保护,室温反应12h。磁分离后,加入5mL含有Met-IR-782的碳酸盐缓冲液(4mg/mL,pH 8.0),室温反应24h。反应结束后,磁分离弃液体并加入乙醚洗涤3次,磁分离得Fe3O4@Met-IR-782置于4℃保存备用。
3)普鲁士蓝壳层的制备
在100mL的pH 3.0溶液中加入铁含量100mg的Fe3O4@Met-IR-782溶液混匀,随后逐滴加入铁含量10mg的亚铁氰化钾(K4[Fe(CN)6]),搅拌20min后,经过13000透析袋透析24h,最终得到所述的多模态纳米造影剂。上述制备的多模态纳米造影剂的透射电镜图见附图5,可见其形貌为类球形,尺寸在20nm左右。
实施例5多模态纳米造影剂的制备
DMSA@Fe3O4纳米粒子、普鲁士蓝壳层的制备同实施例4,其中近红外荧光探针Met-IR-782与Fe3O4纳米粒子采用“一步法”直接偶联。方法如下:
DMSA@Fe3O4(100mg)、DCC(100mg)和NHS(50mg)溶于5mL DMSO中,氮气或氩气保护,25℃下反应12h。磁分离后,向反应液中加入NH2-IR-782(20mg)和Met(10mg),25℃下反应24h。反应结束后,磁分离弃液体并加入乙醚30mL,洗涤、磁分离后得Fe3O4@IR-782@Met。
实施例6多模态纳米造影剂MRI应用
取实施例1制备的多模态纳米造影剂200μL(浓度为200μg/mL),以纯水作为对照,加入可拆卸96孔板孔中。室温下,通过磁共振扫描仪(Micro-7T,Bruker,德国),测定T1及T2值。结果如附图6所示,说明多模态纳米造影剂可实现MRI造影。
实施例7 Met-IR-782的小动物活体成像应用
取5周龄雌性BALB/c小鼠(体重18g)1只,于右后背部皮下接种1×106个4T1细胞。根据公式计算肿瘤尺寸,当肿瘤尺寸达到150mm3时,经尾静脉注射200μL的Met-IR-782(200μg/mL)。4h后,在小动物活体成像系统(IVIS Spectrum,PerkinElmer,美国)下,激发波长调至780nm,发射波长调至830nm,拍摄成像效果,结果如附图7所示,可见多模态纳米造影剂中的Met-IR-782可作活体荧光分子成像的示踪剂。
实施例8多模态纳米造影剂的光热转换效果
称取6mg实施例4所制备的多模态造影剂,用超纯水配置成浓度3mg/mL的溶液,通过780nm的近红外光探头(西安铭辉光学器件公司,中国)辐照10min,期间通过光纤温度传感器(FOT-M,FISO科技公司,加拿大)监测溶液温度。结果如附图8所示,可见多模态纳米造影剂具有显著的光热转换性能,并且其热转换效率与近红外光的强度呈正相关。
实施例9多模态纳米造影剂的细胞吞噬及释放
收集处于对数生长期的HUVECs和293细胞接种于96孔板中,加入实施例4制备的浓度梯度为12.5-100μg/mL的多模态纳米造影剂,共培养24h后,用常规MTT法检测细胞活性,结果如附图9所示,表明多模态纳米造影剂具有良好的生物相容性。
实施例10多模态纳米造影剂在肿瘤磁热及光热治疗中的应用
取4-5周龄雌性BALB/c小鼠(体重16-20g)12只,随机分为两组。其中一组的6只小鼠,分别于右后背部皮下接种1×106个4T1细胞。根据公式计算肿瘤尺寸,当肿瘤尺寸达到60mm3时,按照铁含量10mg/kg的浓度分别注射实施例4中多模态纳米造影剂。对实验组的小鼠进行磁场(深圳双平SPG-06-II,410kHz,1.8kA m-1)和近红外光(西安铭辉光学器件公司,780nm,2W/cm2)照射进行磁热及光热协同治疗。结果如附图10所示,表明所述多模态纳米造影剂可通过磁场及近红外光照射产生热效应,从而杀伤肿瘤组织。
- 还没有人留言评论。精彩留言会获得点赞!