心力衰竭疗法的选择中的生物标记物的制作方法
现代医学的目的是提供个性化或个体化治疗方案。这些是考虑到患者的个体需要或危险的治疗方案。个性化或个体化治疗方案甚至应考虑到其中需要就决定潜在治疗方案做出决定的测量。
心力衰竭(HF)是重大和日益严重的公共卫生问题。据估计美国大约5百万患者患有HF,每年超过500000名患者首次诊断有HF,并且在美国每年超过250000名患者死于作为首要原因的HF。心力衰竭 (HF)是发达国家的发病率和死亡率的主因之一。由于人口老龄化和患有心血管疾病的患者的更长寿命,HF的发生率和普遍率日益增加。
心力衰竭是可以产生于任何结构或功能心脏病症的复杂临床综合征,其损害心室充满或射出血液且确保机体的供血/供氧代谢需要的能力。在此类情况下,机体尝试通过旨在维持所需供应的心肌结构变化(例如肥大,最终导致纤维化、细胞凋亡、坏死)和神经介质刺激(交感神经系统和肾素血管紧张素醛固酮系统的活化)来补偿供应的缺乏。HF分类成不同程度的严重性。
一种分类是所谓的NYHA (纽约心脏协会(New York Heart Association))分类。心力衰竭患者分类为NYHA I、II、III和IV类,或者美国心脏病学会和美国心脏协会(American College of Cardiology and the American Heart Association) (ACC/AHA)阶段A、B、C和D。他不能完全恢复其健康,并且需要治疗处理。NYHA I类的患者没有心血管疾病的明显症状,但已具有功能损害的客观证据。NYHA II类的患者具有体力活动的轻微限制。NYHA III类的患者显示体力活动的显著限制。NYHA IV类的患者无法进行任何体力活动而没有不适感。他们在休息时显示心功能不全的症状。
该功能分类得到美国心脏病学会和美国心脏协会的更近期分类的增补(参见Am. Coll. Cardiol. 2001;38;2101-2113,2005年更新,参见J. Am. Coll. Cardiol. 2005;46;el-e82)。限定了4个阶段A、B、C和D。患有心力衰竭阶段B、C或D的患者已经经历心脏的结构和功能变化。他不能完全恢复其健康,并且需要治疗处理。
用于急性和慢性心力衰竭的药剂和治疗指南在ESC的急性和慢性心力衰竭的诊断和治疗指南(European Heart Journal (2008)29, 2388–2442)中得到描述。尽管可用的治疗选项可以降低患有心力衰竭(HF)的患者中的发病率和死亡率,但适合接受这些治疗的患者的相对数目仍是不能令人满意的低(O'Donoghue M. & Braunwald E., Nat. Rev. Cardiol. 2010;7:13-20)。此外,在适合治疗的患者中,疗法已主要由潜在疾病以及HF对最大药物耐受性的体征和症状(例如通过NYHA阶段、ACC/ AHA阶段或充血分数)主导和调整。
利钠肽标记物例如B型利钠肽(BNP)或其氨基末端片段N末端proBNP (NT-proBNP)的测量已作为用于指导患有收缩性HF的患者的疗法的重要工具出现(O’Donoghue M. & Braunwald E., Nat. Rev. Cardiol. 2010;7:13–20)。BNP/NT-proBNP指导的HF疗法可以鉴定需要疗法加强的患者,并且指示此类加强的时机。然而,BNP/NT-proBNP指导的HF疗法不指示患者可能获益于何种药物疗法。
例如,螺内酯对患有NYHA II、III或IV类的严重症状性HF的患者中的心血管疾病治疗的有利效应是众所周知的,然而,这些药物也因严重副作用(例如高钾血症、心律失常、猝死、低血压、阳痿、肌无力、男性乳房发育症和胃炎)而出名(Williams等人2006 Clin. Cardiol. 29, 149-153)。尤其地,发展高钾血症的危险是一个威胁(D.N. Juurlink等人NEJM 2004; 351 543)。
换言之,潜在疾病、临床判断和BNP/NT-proBNP指导的HF疗法无法单独提供关于一种或多种治疗的选择或疗法加强的足够信息。另外需要新生物标记物,并且特别是可以预测对疗法的应答或帮助选择适当疗法,加强特定疗法,或相反地避免特定疗法或其加强的那些。
因此,存在允许鉴定对象的生物标记物的需要,所述对象将获益于某些心力衰竭疗法或相反将经历来自某些心力衰竭疗法的伤害。
IGFBP系统对细胞生长和分化起重要作用。IGF结合蛋白7 (=IGFBP-7)是已知由内皮细胞、血管平滑肌细胞、成纤维细胞和上皮细胞分泌的30-kDa模块糖蛋白(Ono,Y.等人,Biochem Biophys Res Comm 202 (1994)1490-1496)。在文献中,该分子也已命名为FSTL2;IBP 7;IGF结合蛋白相关蛋白质I;IGFBP 7;IGFBP 7v;IGFBP rP1;IGFBP7;IGFBPRP1;胰岛素样生长因子结合蛋白7;胰岛素样生长因子结合蛋白7前体;MAC25;MAC25蛋白质;PGI2刺激因子;和PSF或前列环素刺激因子。在随机人血清中检测到低水平的IGFB-7,并且增加的血清水平与胰岛素抗性相关可见(Lopez-Bermejo,A.等人,J. Clinical Endocrinology and Metabolism 88 (2003)3401-3408,Lopez-Bermejo,A.等人,Diabetes 55 (2006)2333-2339)。
US20100285491公开了IGFBP-7在心力衰竭评价中的用途。它进一步公开了标记物IGFBP-7可以用于选择用于患有HF的患者的治疗方案。另外,它声称在HF患者的随访中,升高水平的IGFBP-7是HF的有效治疗的阳性指示剂。
WO2008/015254公开了鉴定适合于心力衰竭疗法的对象的基于GDF-15检测的方法,所述疗法优选使用如醛固酮拮抗剂包括螺内酯的药剂的基于药物的疗法。优选地,还有TnT或NT-proBNP的另外检测。此外,优选地,大于参考量的GDF- 15量(优选1200 pg/ml)指示对象适合于心力衰竭疗法。然而,该文件未公开应考虑何种药物疗法,或者是否应考虑药剂调整或疗法加强。
Mimecan (也称为骨甘蛋白聚糖(osteoglycin))是细胞外基质的多功能组分。Mimecan已显示涉及调节胶原原纤维生成,这是发育、组织修复和转移必需的过程(Tasheva等人,MoI. Vis. 8 (2002)407-415)。它与TGF-β-1或TGF-β-2结合在骨形成中起作用。在大鼠和人心脏组织中的转录组分析揭示mimecan与左心室质量以及扩张型心肌病中的细胞外重塑的高度关联(Petretto,E.等人,Nature Genetics 40 (2008)546-552。
WO2011/012268公开了在衍生自个体的体液样品中的mimecan用于评价心力衰竭的用途。它进一步涉及标记物Mimecan在选择用于患有HF的患者的治疗方案中的用途。另外,它公开了在HF患者的随访中,升高水平的Mimecan是HF的有效治疗的阳性指示剂。然而,该文件未公开应考虑何种药物疗法,或者是否应考虑药剂调整或疗法加强。
内皮抑素最初作为XVIII型胶原的20 kDA蛋白酶解片段从鼠血管内皮瘤分离(O'Reilly,M.S.等人,Cell 88 (1997)277-285)。胶原代表形成超分子聚集体,具有特征性三螺旋构象的细胞外基质蛋白质家族,其在维持组织结构完整性中起主导作用。过量胶原沉积导致破坏外围组织的正常功能的纤维化。内皮抑素通过多种蛋白水解酶的作用从胶原XVIII的α1链中释放(Ortega,N.和Werb,Z., Journal of Cell Science 115 (2002)4201-4214)。内皮抑素是血管生成和血管生长的有力抑制剂。然而,该文件未公开应考虑何种药物疗法,或者是否应考虑药剂调整或疗法加强。
WO2010/124821公开了测量内皮抑素以便评价心力衰竭。它进一步涉及标记物内皮抑素在选择用于患有HF的患者的治疗方案中的用途。另外,它声称在HF患者的随访中,升高水平的内皮抑素是HF的有效治疗的阳性指示剂。
生长分化因子15 (GDF-15)是转化生长因子β细胞因子超家族的成员,并且首先鉴定为巨噬细胞抑制细胞因子1 (MIC-1),并且以后也命名为胎盘转化生长因子β(Bootcov 1997, Proc Natl Acad Sci 94:11514-11519; Tan 2000, Proc Natl Acad Sci 97:109-114)。GDF-15也描述为心血管事件的强预测物和心血管并发症的指示剂(Brown,D. A.等人, 2002 The Lancet, 359: 2159-2163; US2003/0232385; Kempf 2006, Circ Res 98: 351-360)。Kempf等人显示GDF-15的循环水平与CHF的严重性相关,且预测患有慢性心力衰竭的患者中的死亡危险(Clinical Chemistry 53:2; 284–291 (2007); Am Coll Cardiol, 2007: 50:1054-1060)。
WO2012/025355不仅公开了用于诊断或监控在HF前的心脏的功能和/或结构异常的方法,还公开了用于选择治疗此类状况的适当药物的指导。所述标记物可以是IGFBP7。
WO2010/0070411公开了监控患有心力衰竭的表面上稳定的对象,基于GDF-15、NT-proANP、NT-proBNP和心肌肌钙蛋白检测的方法。此外,它公开了诊断和/或决定哪种疗法/药物治疗应用于表面上稳定的对象,所述对象患有心力衰竭且其生理状态正发生变化。
WO2009/047283描述了通过测定BNP、cTnT和至少一种炎症标记物骨桥蛋白(OPN)、GDF-15、CRP,判断何种治疗或治疗组合将应用于心肌梗死后的对象的重塑过程中的方法。它描述了>/= 500 pg/ml的骨桥蛋白水平作为ACE抑制剂、血管紧张素受体拮抗剂和醛固酮拮抗剂的指示。
Kubo等人2011 (Circulation J,75,919-926)公开了基于BNP和肌钙蛋白的检测的,患有肥厚性心肌病的患者的临床恶化的危险预测。许多评价的患者患有心力衰竭。推测两种标记物的组合测量可以用于监控患有肥厚性心肌病的患者。
Fonarow等人2008 (Am J Cardiol,101,231-237)公开了基于BNP和肌钙蛋白检测的患有心力衰竭的患者的死亡率危险预测。
Mentz等人2011 (Circ J,75 (9):2031-7)公开了用于心力衰竭患者中的疗法指导和监控的基于NTproBNP检测的方法,其中所述疗法选自用利尿剂、ACE抑制剂、β阻断剂、螺内酯、硝酸盐或地高辛的治疗。
Böhm等人2011 (Clin Res Cardiol,100:973-981)综述了用于心力衰竭患者中的疗法指导和监控的基于NTproBNP检测的方法。它还提及将BNP与肌钙蛋白组合用于指导心力衰竭疗法的可能性。
在本发明基础的研究的背景下,有利地显示GDF-15、内皮抑素、mimecan、IGFBP7、心肌肌钙蛋白、BNP型肽、尿酸、半乳糖凝集素-3、可溶性ST2、PlGF、sFlt-1、P1NP、胱抑素C、前白蛋白和/或转铁蛋白的测定允许鉴定将获益于某些心力衰竭疗法的对象。显示仅某些组的患者将获益于例如β阻断剂和醛固酮拮抗剂的施用,而其他组不获益于该施用。通过测定上述生物标记物的量,可能够区分将获益于疗法的对象和不获益于疗法的对象,或者甚至将在不存在有利效应的情况下,由于不必要的加强/剂量上调(uptitration)而经历来自疗法的副作用或伤害的对象。
本发明基础的技术问题可以视为提供顺应上述需要的手段和方法。
所述技术问题通过权利要求和本文下文中表征的实施方案得以解决。
相应地,本发明涉及用于鉴定适合于心力衰竭疗法的至少一种药剂的施用的对象的方法,其包括:
a)测定来自患有心力衰竭的对象的样品中的至少一种生物标记物的量,和
b)比较如步骤a)中测定的至少一种生物标记物的一个或多个量与一个或多个参考量,由此鉴定适合于所述至少一种药剂的施用的对象。
优选地,所述至少一种药剂选自β阻断剂、醛固酮拮抗剂、利尿剂和肾素-血管紧张素系统的抑制剂。
优选地,所述至少一种生物标记物选自IGFBP7 (IGF结合蛋白7)、mimecan、骨桥蛋白、内皮抑素、sFlt-1 (可溶性fms样酪蛋白激酶1)、PlGF (胎盘生长因子)、心肌肌钙蛋白、BNP型肽、尿酸、GDF-15 (生长分化因子15)、sST2 (可溶性ST2)、Gal-3 (半乳糖凝集素-3)、P1NP (前胶原1型N末端前肽)、胱抑素C、前白蛋白和转铁蛋白。
相应地,本发明涉及用于鉴定适合于选自下述的至少一种药剂的施用的对象的方法:β阻断剂、醛固酮拮抗剂、利尿剂和肾素-血管紧张素系统的抑制剂,所述方法包括:
a)测定来自患有心力衰竭的对象的样品中选自下述的至少一种生物标记物的量:IGFBP7 (IGF结合蛋白7)、mimecan、骨桥蛋白、内皮抑素、sFlt-1 (可溶性fms样酪蛋白激酶1)、PlGF (胎盘生长因子)、心肌肌钙蛋白、BNP型肽、尿酸、GDF-15 (生长分化因子15)、sST2 (可溶性ST2)、Gal-3 (半乳糖凝集素-3)、P1NP (前胶原1型N末端前肽)、胱抑素C、前白蛋白和转铁蛋白,和
b)比较如步骤a)中测定的一个或多个量与一个或多个参考量,由此鉴定适合于所述至少一种药剂的施用的对象。
在本发明的方法的一个优选实施方案中,至少一种药剂是醛固酮拮抗剂。在这种情况下,所述至少一种生物标记物选自IGFBP7、内皮抑素、尿酸、BNP型肽、心肌肌钙蛋白、sFlt-1、PlGF、sST2、Gal-3和胱抑素C。优选地,测定上述生物标记物中仅一种的量。然而,还考虑测定组合的超过一种生物标记物的量。优选组合是s-Flt-1和IGFBP7;s-Flt-1和心肌肌钙蛋白;s-Flt-1和Gal-3;心肌肌钙蛋白和Gal-3;心肌肌钙蛋白和IGFBP7;IGPBP7和Gal-3;以及这些标记物与BNP型肽的组合。特别优选的组合是IGFBP7和mimecan。进一步优选的组合是PlGF和sFlt-1的组合。进一步地,设想计算PlGF量与sFlt-1量的比(或sFlt-1与PlGF量的比)。在这种情况下,计算的比与参考比相比较。
在本发明的方法的另一个优选实施方案中,所述至少一种药剂是β阻断剂。在这种情况下,所述至少一种生物标记物优选选自IGFBP7、GDF-15、内皮抑素、mimecan、BNP型肽、心肌肌钙蛋白、骨桥蛋白、sFlt-1和P1NP。优选地,测定仅一种生物标记物的量。然而,还考虑测定组合的超过一种生物标记物的量。优选组合是GDF-15和内皮抑素;GDF-15和心肌肌钙蛋白;GDF-15和mimecan;GDF-15和sST2;内皮抑素和心肌肌钙蛋白;内皮抑素和mimecan;内皮抑素和IGFBP7;mimecan和心肌肌钙蛋白;mimecan和IGFBP7;心肌肌钙蛋白和IGFBP7。特别优选的组合是内皮抑素和sFlt-1。进一步优选的组合是内皮抑素和PlGF。
在本发明的方法的另一个优选实施方案中,至少一种药剂是肾素-血管紧张素系统的抑制剂。在这种情况下,所述至少一种生物标记物优选为骨桥蛋白、GDF-15、BNP型肽、sFlt-1、心肌肌钙蛋白、Gal-3、尿酸或IGFBP7。优选地,测定一种生物标记物的量。然而,还考虑测定组合的超过一种生物标记物的量。优选组合是心肌肌钙蛋白和Gal-3、心肌肌钙蛋白和尿酸、以及Gal-3和尿酸。进一步优选的组合是骨桥蛋白和sFlt-1、sFlt-1和心肌肌钙蛋白、以及骨桥蛋白和心肌肌钙蛋白。
在本发明的方法的另一个优选实施方案中,至少一种药剂是利尿剂。在这种情况下,所述至少一种生物标记物优选选自GDF-15、内皮抑素、mimecan、BNP型肽、尿酸、骨桥蛋白、IGFBP-7、Gal-3、转铁蛋白或前白蛋白。优选地,测定仅一种生物标记物的量。然而,还考虑测定组合的超过一种生物标记物的量。优选组合是GDF-15和内皮抑素;GDF-15和BNP型肽;GDF-15和mimecan;GDF-15和Gal-3;内皮抑素和BNP型肽;内皮抑素和mimecan;内皮抑素和Gal-3;mimecan和BNP型肽;mimecan和Gal-3;BNP型肽和Gal-3;BNP-型肽和尿酸;BNP型肽和IGFBP-7;BNP型肽和骨桥蛋白。特别地,设想了尿酸和GDF-15的组合。
相应地,本发明特别设想了下述方法:
考虑了用于鉴定适合于醛固酮拮抗剂的施用(即适合于初始施用或加强,特别是以更高剂量的施用)的对象的方法,其包括:
a)测定来自患有心力衰竭的对象的样品中选自下述的至少一种生物标记物的量:IGFBP7、内皮抑素、尿酸、BNP型肽、心肌肌钙蛋白、sFlt-1、PlGF、sST-2、Gal-3和胱抑素C,和
b)比较如步骤a)中测定的一个或多个量与一个或多个参考量,由此鉴定适合于所述醛固酮拮抗剂的施用的对象。
在一个实施方案中,在步骤a)中测定PlGF和sFlt-1的量,在进一步的步骤a1)中计算PlGF量与sFlt-1量的比(或sFlt-1与PlGF量的比),并且因此在步骤b)中比较计算的比与参考比。
相应地,该方法可以包括步骤:
a)测定来自患有心力衰竭的对象的样品中PlGF和sFlt-1的量,
a1)计算PlGF量与sFlt-1量的比(或反之亦然),和
b)比较步骤a1)中计算的比与参考比,由此鉴定适合于所述醛固酮拮抗剂的施用的对象。
还考虑的是用于鉴定适合于β阻断剂的施用(即适合于初始施用或施用加强,特别是以更高剂量的施用)的对象的方法,其包括:
a)测定来自患有心力衰竭的对象的样品中选自下述的至少一种生物标记物的量:IGFBP7、GDF-15、内皮抑素、mimecan、BNP型肽、心肌肌钙蛋白、骨桥蛋白、sFlt-1和P1NP,和
b)比较如步骤a)中测定的一个或多个量与一个或多个参考量,由此鉴定适合于所述β阻断剂的施用的对象。
进一步设想的是用于鉴定适合于肾素-血管紧张素系统抑制剂的施用(即适合于初始施用或施用加强,特别是以更高剂量的施用)的对象的方法,其包括:
a)测定来自患有心力衰竭的对象的样品中选自下述的生物标记物的量:骨桥蛋白、GDF-15、BNP型肽、sFlt-1、心肌肌钙蛋白、Gal-3、尿酸和IGFBP7,和
b)比较如步骤a)中测定的一个或多个量与一个或多个参考量,由此鉴定适合于所述肾素-血管紧张素系统抑制剂的施用的对象。
本发明还考虑了用于鉴定适合于利尿剂施用(即适合于初始施用或施用加强)的对象的方法,其包括:
a)测定来自患有心力衰竭的对象的样品中选自下述的至少一种生物标记物的量:IGFBP7、心肌肌钙蛋白、内皮抑素、mimecan、BNP型肽、尿酸、骨桥蛋白、Gal-3、前白蛋白和转铁蛋白,和
b)比较如步骤a)中测定的一个或多个量与一个或多个参考量,由此鉴定适合于所述利尿剂的施用的对象。
优选地,通过执行鉴定适合于所述至少一种药剂的施用的对象的进一步步骤c),将对象鉴定为适合于所述至少一种药剂的施用。
在一个实施方案中,通过使样品与特异性结合各自标记物的试剂接触,从而形成在试剂和所述标记物之间的复合物,检测所形成复合物的量,并且从而测量所述标记物的量,来测量至少一种生物标记物的量。如果生物标记物是尿酸,则所述生物标记物的水平可以通过使样品与酶或化合物接触进行测量,所述酶或化合物允许所述生物标记物的转化,例如允许尿酸的氧化。酶可以是催化尿酸至5-羟基异尿酸的氧化的尿素酶(EC 1.7.3.3)。化合物可以是磷钨酸。
下述生物标记物-药剂组合是最优选的组合:
在本发明的方法、用途、试剂盒、系统和装置的一个优选实施方案中,生物标记物是IGFBP-7,并且药剂是β阻断剂。
在另一个优选实施方案中,生物标记物是mimecan,并且药剂是β阻断剂。
在另一个优选实施方案中,生物标记物是骨桥蛋白,并且药剂是肾素-血管紧张素系统的抑制剂。还设想药剂是β阻断剂。
在另一个优选实施方案中,生物标记物是内皮抑素,并且药剂是醛固酮拮抗剂。
在另一个优选实施方案中,生物标记物是sFlt-1,并且药剂是醛固酮拮抗剂。还优选生物标记物是sFlt-1,并且药剂是肾素-血管紧张素系统的抑制剂。进一步地,设想药剂是β阻断剂。
在另一个优选实施方案中,生物标记物是PlGF,并且药剂是醛固酮拮抗剂。
在另一个优选实施方案中,生物标记物是心肌肌钙蛋白,并且药剂是肾素-血管紧张素系统的抑制剂。
在另一个优选实施方案中,生物标记物是BNP型肽,并且药剂是肾素-血管紧张素系统的抑制剂。还优选生物标记物是BNP型肽,并且药剂是β阻断剂。
在另一个优选实施方案中,生物标记物是尿酸,并且药剂是利尿剂。还优选生物标记物是尿酸,并且药剂是肾素-血管紧张素系统的抑制剂。
在另一个优选实施方案中,生物标记物是GDF-15,并且药剂是利尿剂。还优选生物标记物是GDF-15,并且药剂是肾素-血管紧张素系统的抑制剂。
在另一个优选实施方案中,生物标记物是sST2,并且药剂是醛固酮拮抗剂。还优选生物标记物是sST2,并且药剂是β阻断剂。
在另一个优选实施方案中,生物标记物是P1NP,并且药剂是β阻断剂。
在另一个优选实施方案中,生物标记物是胱抑素C,并且药剂是醛固酮拮抗剂。
在另一个优选实施方案中,生物标记物是前白蛋白,并且药剂是利尿剂,例如髓袢利尿剂。
在另一个优选实施方案中,生物标记物是IGFBP7,并且药剂是肾素-血管紧张素系统的抑制剂。
进一步优选的生物标记物/药剂组合在实施例中公开。
本发明的方法优选是离体或体外方法。此外,它可以包括除上文明确提及那些之外的步骤。例如,进一步的步骤可以涉及样品预处理或评估由方法获得的结果。该方法可以手动进行或通过自动化进行辅助。优选地,步骤(a)和/或(b)可以整个或部分通过自动化进行辅助,例如通过合适的机械和传感设备用于步骤(a)中的测定或基于步骤(b)中的所述比较的由计算机实现的比较和/或评价。
相应地,本发明还优选涉及鉴定适合于选自下述的至少一种药剂的施用的对象的系统:β阻断剂、醛固酮拮抗剂、利尿剂和肾素-血管紧张素系统的抑制剂,所述系统包括:
a)配置为在体外使来自对象的样品的一部分与配体(或如果测定超过一种生物标记物的量,则为多种配体)接触的分析仪单元,所述配体包含对于选自下述的至少一种生物标记物的特异性结合亲和力:GDF-15 (生长分化因子15)、内皮抑素、mimecan、IGFBP7 (IGF结合蛋白7)、心肌肌钙蛋白、BNP型肽、尿酸、半乳糖凝集素-3 (Gal-3)、可溶性ST2 (sST2)、PlGF、sFlt-1、P1NP、胱抑素C、前白蛋白和转铁蛋白,
b)配置为检测来自与配体(或多种配体)接触的来自对象的部分样品的信号的分析仪单元,
c)具有处理器且与所述分析单元可操作地通讯的计算装置,和
d)包括可由处理器执行的多个指令的非瞬态计算机可读介质,当执行时,所述指令计算至少一种生物标记物的量,并且比较至少一种生物标记物的量与参考量(或如果测定超过一种生物标记物的量,则为多个参考量),从而鉴定适合于至少一种药剂的施用的对象。
如本文使用的,术语“鉴定”意指评价对象是否适合于所述至少一种药剂的施用。应当理解适合于至少一种药剂的施用的对象将获益于至少一种药剂的施用,而不适合所述至少一种药剂的施用的对象可能经历来自至少一种药剂施用的不良副作用或伤害。特别地,如果特别在样品已获得后18个月或3年的窗口期内,所述至少一种药剂的施用降低所述对象的死亡率危险和/或降低所述对象的住院治疗危险,则对象获益于所述至少一种药剂的施用。优选地,所述危险(或多种危险)降低5%,更优选10%,甚至更优选15%,且最优选20%。优选地,本文提及的住院治疗应是由于心力衰竭。
相比之下,不适合于至少一种药剂的施用的对象将不获益于(特别是将不显著获益于)至少一种药剂的施用。特别地,如果特别在样品已获得后18个月或3年的窗口期内,所述至少一种药剂的施用不降低(特别是不显著降低)所述对象的死亡率危险和/或不降低(特别是不显著降低)所述对象的住院治疗危险和/或增加不需要的效应危险,则对象不获益于所述至少一种药剂的施用。在这种情况下,如果不施用药剂,则可以避免不必要的医疗保健成本。进一步地,可以避免可以起因于施用的不良副作用。
因此,通过鉴定适合于所述至少一种药剂的施用的对象,可以评价对象是否将获益于施用(即获益于初始施用或施用加强,特别是以更高剂量的施用)。相应地,本发明还涉及基于本文其他地方描述的步骤,鉴定将获益于所述至少一种药剂的施用的对象的方法。
如本领域技术人员应当理解的,对象是否适合于所述至少一种药剂的施用的评价通常不预期对于待评价的对象是100%正确的。然而,该术语要求评价对于统计上显著部分的对象(例如队列研究中的队列)是正确的。部分是否是统计上显著的可以通过本领域技术人员使用多种众所周知的统计评估工具进行测定而没有进一步的困扰,所述统计评估工具例如置信区间测定、p值测定、斯氏t检验、曼怀二氏检验等。细节可见于Dowdy和Wearden,Statistics for Research,John Wiley & Sons,New York 1983中找到。优选置信区间是至少90%、至少95%、至少97%、至少98%或至少99%。p值优选是0.1、0.05、0.01、0.005或0.0001。更优选地,群体的至少60%、至少70%、至少80%或至少90%的对象可以适当地通过本发明的方法进行鉴定。
在本发明的背景下,应鉴定适合于选自下述的至少一种药剂的施用的对象:β阻断剂、醛固酮拮抗剂、利尿剂和肾素-血管紧张素系统的抑制剂。
在本发明的方法的上下文中的“施用”意指(i) 应起始所述至少一种药剂的施用(并且因此应加入疗法中),或(ii)所述至少一种药剂的施用应以更高的剂量施用(并且因此应上调)。
如本文使用的,术语“剂量”优选指日剂量。
在第一种情况(i)下,对象先前应未服用所述至少一种药剂。因此,在已获得待测试的样品前,所述至少一种药剂不应已施用于所述对象。优选地,在获得待测试样品之前至少三个月,更优选至少六个月,所述至少一种药剂未施用于对象。
在后面一种情况(ii)下,对象应已用所述至少一种药剂进行治疗(在获得样品之前)。优选地,在获得待测试样品之前,对象已用所述至少一种药剂治疗至少两周,更优选至少两个月,甚至更优选至少六个月,并且最优选至少一年。优选地,所述至少一种药剂的剂量在该时期中不改变。
特别优选待测试的对象已经用所述至少一种药剂进行治疗,并且评价对象是否适合于以更高剂量的施用所述至少一种药剂,即疗法是否应以所述至少一种药物的更高剂量继续。因此,可以评价所述至少一种药剂的剂量是否应上调。
总之,适合于所述至少一种药剂的施用的对象适合于起始所述至少一种药剂的施用,或以更高剂量的施用所述至少一种药剂,而不适合所述至少一种药剂的施用的对象不适合于起始所述至少一种药剂的施用(在获得待测试样品之前,对象未用所述药剂进行治疗的情况下),或以更高剂量的施用所述至少一种药剂(在获得待测试样品之前,对象用所述药剂进行治疗的情况下)。相应地,如果对象适合于药剂的施用,则可以起始所述药剂的施用,或所述药剂的剂量可以增加。然而,如果对象不适合于药剂的施用,则不应起始所述药剂的施用或不应上调至更高剂量。相应地,如果对象在获得待测试样品之前用所述药剂进行治疗,则若对象不适合于所述药剂的施用,则疗法应继续而不改变剂量,特别是不增加剂量。还优选地,不适合于所述药剂的施用的对象可以接受更低剂量的所述药剂。
本发明的上下文中提及的药剂是本领域众所周知的,例如参见例如Heart Disease,2008,第8版,编辑Braunwald,Elsevier Sounders,第24章或ESC Guidelines for the diagnosis and treatment of acute and chronic heart failure (European Heart Journal (2008)29,2388–2442)中所述。
β阻断剂(通常也称为β肾上腺素能阻断剂)阻断内源儿茶酚胺肾上腺素(肾上腺素)和去甲肾上腺素(降肾上腺素)特别是β肾上腺素能受体的作用。优选地,β阻断剂选自cebutolol、阿普洛尔、阿替洛尔、倍他洛尔、比索洛尔、布拉洛尔、卡拉洛尔、卡替洛尔、卡维地洛、塞利洛尔、美替洛尔、美托洛尔、纳多洛尔、奈必洛尔、氧烯洛尔、喷布洛尔、吲哚洛尔、普萘洛尔、索他洛尔、他林洛尔(tanilolol)和噻吗洛尔。最优选的β阻断剂是阿替洛尔、卡维地洛、美托洛尔和比索洛尔。
醛固酮拮抗剂属于拮抗醛固酮对盐皮质激素受体的作用的一类利尿剂药物。它们通常与其他药物组合用作辅助疗法用于管理慢性心力衰竭。优选地,醛固酮拮抗剂选自依普利酮、螺内酯、坎利酮、己烯酮、丙利酮。特别优选的醛固酮拮抗剂是螺内酯(7α-乙酰硫基-3-氧代-17α-孕甾-4-烯21,17-羧内酯)或依普利酮。
利尿剂是增加钠和水经由尿的消除的利尿剂。特别优选的利尿剂是髓袢利尿剂或噻嗪类利尿剂。
优选地,髓袢利尿剂由于其功效和作用的快速发作而使用。它们作用于肾中的亨勒上升袢。优选地,髓袢利尿剂选自:呋塞米、阿佐塞米、布美他尼、吡咯他尼、托拉塞米、依地尼酸、依托唑啉。特别地,髓袢利尿剂是呋塞米。
优选地,噻嗪类利尿剂选自:氢氯噻嗪和氯噻酮(chlortaildon)。特别优选的噻嗪类利尿剂是氢氯噻嗪。
肾素-血管紧张素系统(RAS)的抑制剂包括血管紧张素转换酶(ACE)抑制剂、血管紧张素II受体阻断剂(ARB,血管紧张素II受体拮抗剂)和直接肾素抑制剂。优选地,抑制剂是ACE抑制剂。还优选地,抑制剂是血管紧张素II受体阻断剂。
优选地,ACE抑制剂选自贝那普利、卡托普利、西拉普利、依那普利、福辛普利、赖诺普利、莫昔普利、培哚普利、喹那普利、雷米普利、螺普利和群多普利。特别优选的ACE抑制剂是卡托普利、依那普利、赖诺普利、雷米普利或群多普利。
优选地,血管紧张素II受体拮抗剂选自氯沙坦、缬沙坦、厄贝沙坦、坎地沙坦、奥美沙坦、替米沙坦和依普罗沙坦。特别优选的ARB是缬沙坦、氯沙坦、坎地沙坦或替米沙坦。
优选的直接肾素抑制剂是阿利吉仑。
如本文上文所述,在已获得待测试样品时,待测试的对象可以已经用所述至少一种药剂进行治疗。因此,通过进行本发明的方法,鉴定适合于以更高剂量的施用所述至少一种药剂的对象,所述更高剂量即比在获得待测试样品之前施用的所述药剂剂量更高的剂量。优选地,日剂量应更高。在本发明的上下文中,考虑使剂量增加高达500%或更多。优选地,所述剂量应比在获得待测试样品之前施用的剂量高至少30%,更优选至少50%,甚至更优选至少100%,或最优选至少200%。
如本文在上述方法的上下文中使用的,术语“对象”指动物,优选哺乳动物,并且更优选人。在本发明的上下文中设想所述对象患有心力衰竭(HF)。
如本文使用的,术语“心力衰竭”指受损的心脏收缩功能和/或舒张功能,伴随如本领域技术人员已知的心力衰竭的明显体征。优选地,本文提及的心力衰竭也是慢性心力衰竭。根据本发明的心力衰竭包括明显和/或晚期心力衰竭。在明显心力衰竭中,对象显示如本领域技术人员已知的心力衰竭症状。
HF可以分类成不同程度的严重性。
根据NYHA (纽约心脏协会)分类,心力衰竭患者分类为属于NYHA I、II、III和IV类。患有心力衰竭的患者已经经历其心包膜、心肌、冠状动脉循环或心脏瓣膜的结构和功能变化。他不能完全恢复其健康,并且需要治疗处理。NYHA I类的患者没有心血管疾病的明显症状,但已具有功能损害的客观证据。NYHA II类的患者具有体力活动的轻微限制。NYHA III类的患者显示体力活动的显著限制。NYHA IV类的患者无法进行任何体力活动而没有不适感。他们在休息时显示心功能不全的症状。
该功能分类得到美国心脏病学会和美国心脏协会的更近期分类的增补(参见Am. Coll. Cardiol. 2001;38;2101-2113,2005年更新,参见J. Am. Coll. Cardiol. 2005;46;e1-e82)。限定了4个阶段A、B、C和D。阶段A和B不是HF,但视为帮助在发展出真正的“HF”之前,在早期鉴定患者。阶段A和B患者最佳定义为具有HF发展的危险因素的那些患者。例如,尚未证实左心室(LV)功能受损、肥大或室几何变形(geometric chamber distortion)的患有冠状动脉疾病、高血压或糖尿病的患者将视为阶段A,而无症状但证实LV肥大和/或LV功能受损的患者将指定为阶段B。阶段C则指示具有与潜在结构性心脏病相关的目前或过去HF症状的患者(大多数患有HF的患者),并且阶段D指示患有真正的难治性HF的患者。
如本文使用的,术语“心力衰竭”特别指上文提及的ACC/AHA分类的阶段B、C和D。在这些阶段中,对象显示心力衰竭的典型症状。相应地,患有心力衰竭的对象患有根据ACC/AHA分类的心力衰竭阶段B、C或D,特别是阶段C或D。另外优选地,可被分类的对象可以分类为属于NYHA II;III或IV类,特别是III或IV类。
优选地,设想在本发明的上下文中的对象不具有肾功能受损。优选地,对象不应患有肾衰竭,特别地,对象不应患有急性、慢性和/或末期肾衰竭。进一步地,对象优选不应患有肾性高血压。如何评价对象是否显示出肾功能受损是本领域众所周知的。肾病症可以通过已知且视为适当的任何手段进行诊断。特别地,肾功能可以借助于肾小球滤过率(GFR)进行评价。例如,GFR可以通过Cockgroft-Gault或MDRD公式(Levey 1999,Annals of Internal Medicine,461-470)进行计算。GFR是从肾脏肾小球毛细血管过滤到鲍曼囊(Bowman's capsule)内的流体体积/单位时间。临床上,这通常用于测定肾功能。由公式例如MDRD公式的Cockgroft Gault公式导出的所有计算均提供估计值,而不是通过将胰岛素注射到血浆内而得到的“真实”GFR)。因为胰岛素在肾小球过滤后不由肾再吸收,所以它的排泄率与水和溶质跨越肾小球过滤的滤过率成正比。然而,在临床实践中,肌酸酐清除率用于测量GFR。肌酸酐是内源分子,在体内合成,其通过肾小球自由过滤(但还由肾小管以极少量分泌)。肌酸酐清除率(CrCl)因此是GFR的紧密近似值。GFR通常以毫升/分钟(mL/分钟)进行记录。男性的正常GFR范围为97 - 137 mL/分钟,女性的正常GFR范围为88 - 128 ml/分钟。因此,特别考虑未显示出肾功能受损的对象的GFR在该范围内。此外,所述对象优选具有低于0.9 mg/dl、更优选低于1.1 mg/dl且最优选低于1.3 mg/dl的血液肌酸酐水平(特别是血清肌酸酐水平)。
优选地,对象不患有ACS(急性冠脉综合症)。如本文使用的,术语“ACS”包括STEMI (ST段抬高型心肌梗死);NSTEMI (非ST段抬高型心肌梗死)和不稳定型心绞痛。进一步设想待测试的对象不具有ACS史。特别地,对象在进行本发明的方法前一个月内(更精确地,在获得样品前一个月内)不应患有ACS。
如上所述,待测试的对象可以用如本发明方法的上下文中所示的药剂进行治疗。优选地,用利尿剂、β阻断剂、醛固酮拮抗剂和/或肾素-血管紧张素系统的抑制剂进行治疗对象。在这种情况下,本发明的方法允许鉴定适合于以更高剂量的施用药剂的对象,或用于鉴定不适合于以更高剂量的施用药剂的对象(其优选可以继续疗法而不改变剂量)。
术语“样品”指体液样品,分离的细胞的样品或者来自组织或器官的样品。体液样品可以通过众所周知的技术获得,并且优选包括血液、血浆、血清或尿样品、更优选血液、血浆或血清样品。组织或器官样品可以通过例如活组织检查得自任何组织或器官。分离的细胞可以通过分离技术例如离心或细胞分选得自体液或组织或器官。优选地,细胞、组织或器官样品得自表达或产生本文提及的肽的那些细胞、组织或器官。
如本文使用的,术语“BNP型肽”包含pre-proBNP、proBNP、NT-proBNP和BNP。前原肽(在pre-proBNP的情况下134个氨基酸)包含短信号肽,其被酶促切割掉,以释放前肽(在proBNP的情况下108个氨基酸)。前肽进一步切割成N末端前肽(NT前肽,在NT-proBNP的情况下76个氨基酸)和活性激素(在BNP的情况下32个氨基酸)。优选地,根据本发明的BNP型肽是NT-proBNP、BNP及其变体。BNP是活性激素,并且具有比各自的失活配对物NT-proBNP更短的半衰期。BNP代谢到血液中,而NT-proBNP在血液中作为完整分子循环,并且如此被肾清除。NT-proBNP的体内半衰期比BNP长120分钟,所述BNP的体内半衰期是20分钟(Smith 2000,J Endocrinol. 167:239-46.)。预分析(Preanalytics)对于NT-proBNP更稳健,允许样品至中心实验室的容易运输(Mueller 2004,Clin Chem Lab Med 42:942-4.)。血样可以在室温下贮存几天,或者可以邮寄或运送而无回收损失。相比之下,BNP在室温下或在4°摄氏度下贮存48小时导致至少20%的浓度丧失(Mueller上述引文;Wu 2004,Clin Chem 50:867-73.)。因此,取决于时间过程或目的特性,对活性或失活形式的利钠肽的任一测量可以是有利的。根据本发明最优选的利钠肽是NT-proBNP或其变体。如上文简要讨论的,如依照本发明提及的人NT-proBNP是优选包含76个氨基酸的多肽,长度对应于人NT-proBNP分子的N末端部分。人BNP和NT-proBNP的结构已在现有技术中详细描述,例如WO 02/089657、WO 02/083913或Bonow上文引文。优选地,如本文使用的,人NT-proBNP是如EP 0 648 228 B1中公开的人NT-proBNP。这些现有技术文件就本文公开的NT-proBNP及其变体的具体序列而言,通过引用随同并入本文。依照本发明提及的NT-proBNP进一步涵盖上文讨论的人NT-proBNP的所述具体序列的等位基因及其他变体。具体地,设想的是变体多肽,其在氨基酸水平上,优选在人NT-proBNP的整个长度上,优选与人NT-proBNP至少50%、60%、70%、80%、85%、90%、92%、95%、97%、98%或99%相同。两个氨基酸序列之间的同一性程度可以如上所述进行测定。还涵盖的是与人NT-proBNP的氨基酸序列相比较,具有氨基酸缺失、取代和/或添加的变体多肽,只要所述多肽具有NT-proBNP特性。如本文提及的NT-proBNP特性是免疫学和/或生物学特性。优选地,NT-proBNP变体具有可与人NT-proBNP的那些相当的免疫学特性(即,表位组成)。因此,变体应可由用于测定利钠肽的量的上述手段或配体识别。生物学和/或免疫学NT-proBNP特性可以通过Karl等人(Karl 1999,Scand J Clin Lab Invest 230:177-181),Yeo等人(Yeo 2003,Clinica Chimica Acta 338:107-115)中所述的测定进行检测。
术语“生长分化因子15”或“GDF-15”指其为转化生长因子(TGF)细胞因子超家族成员的多肽。术语多肽、肽和蛋白质在本说明书自始至终可互换使用。GDF-15最初作为巨噬细胞抑制细胞因子1进行克隆,并且以后也鉴定为胎盘转化生长因子15、胎盘骨形态发生蛋白、非甾体抗炎药活化基因1和前列腺衍生因子(Bootcov同前;Hromas,1997 Biochim Biophys Acta 1354:40-44;Lawton 1997,Gene 203:17-26;Yokoyama-Kobayashi 1997,J Biochem (Tokyo),122:622-626;Paralkar 1998,J Biol Chem 273:13760-13767)。类似于其他TGF相关细胞因子,GDF-15作为无活性的前体蛋白质合成,其经历二硫键合的同二聚化。在N末端前肽的蛋白酶解切割后,GDF-15作为~28 kDa二聚蛋白质分泌(Bauskin 2000,Embo J 19:2212-2220)。GDF-15的氨基酸序列公开于WO99/06445,WO00/70051,WO2005/113585,Bottner 1999,Gene 237:105-111,Bootcov loc. cit,Tan同前,Baek 2001,Mol Pharmacol 59:901-908,Hromas同前,Paralkar同前,Morrish 1996,Placenta 17:431-441或Yokoyama-Kobayashi同前中。如本文使用的,GDF-15还涵盖上述特异性GDF-15多肽的变体。此类变体具有至少与特异性GDF-15多肽相同的基本生物学和免疫学特性。特别地,如果它们可通过本说明书中提及的相同特异性测定检测,例如通过使用特异性识别所述GDF-15多肽的多克隆或单克隆抗体的ELISA测定检测,则它们共享相同的基本生物学和免疫学特性。优选测定在所附实施例中描述。此外,应当理解如依照本发明提及的变体应具有由于至少一个氨基酸取代、缺失和/或添加而不同的氨基酸序列,其中变体的氨基酸序列仍优选与特异性GDF-15多肽的氨基酸序列,优选与人GDF-15的氨基酸序列,更优选在特异性GDF-15例如人GDF-15的整个长度上至少约50%、至少约60%、至少约70%、至少约80%、至少约85%、至少约90%、至少约92%、至少约95%、至少约97%、至少约98%或至少约99%相同。两个氨基酸序列之间的同一性程度可以如上所述进行测定。上文提及的变体可以是等位基因变体或任何其他物种特异性同源物、旁系同源物或直向同源物。此外,本文提及的变体包括特异性GDF-15多肽的片段或上述类型的变体,只要这些片段具有如上文提及的基本免疫学和生物学特性。此类片段可以是例如GDF-15多肽的降解产物。进一步包括的是由于翻译后修饰例如磷酸化或肉豆蔻化而不同的变体。
胰岛素样生长因子结合蛋白(IGFBP)系统在细胞生长和分化中起重要作用。它包含两种配体,IGF-I和IGF-II,两种受体,1型和2型IGF受体,并且到1995年,包含六种IGF结合蛋白(IGFBP),IGFBP-1至-6 (Jones,J.I.等人,Endocr. Rev. 16 (1995)3-34)。近来,IGFBP家族已扩展为包括IGFBP相关蛋白质(IGFBP-rP),其与IGFBP具有显著的结构相似性(Hwa,V.等人,Endocr. Rev 20 (1999)761-787)。因此,IGFBP超家族包括对于IGF具有高亲和力的六种常规IGFBP,以及至少10种IGFBP-rP,其不仅共享IGFBP的保守氨基末端结构域,还显示对于IGF和胰岛素的一定程度的亲和力。IGFBP-rP是控制不同的细胞功能的一组富含半胱氨酸的蛋白质,所述细胞功能例如细胞生长、细胞粘附和迁移、以及细胞外基质的合成。另外,这些蛋白质可能涉及生物过程如组织增殖和分化、繁殖、血管生成、伤口修复、炎症、纤维化和肿瘤发生(Hwa,V.等人,Endocr. Rev 20 (1999)761-787)。
IGF结合蛋白7 (=IGFBP7)是已知由内皮细胞、血管平滑肌细胞、成纤维细胞和上皮细胞分泌的30-kDa模块糖蛋白(Ono,Y.等人,Biochem Biophys Res Comm 202 (1994)1490-1496)。在文献中,该分子已命名为FSTL2;IBP 7;IGF结合蛋白相关蛋白质I;IGFBP 7;IGFBP 7v;IGFBP rPl;IGFBP7;IGFBPRP1;胰岛素样生长因子结合蛋白7;胰岛素样生长因子结合蛋白7前体;MAC25;MAC25蛋白质;PGI2刺激因子;和PSF或前列环素刺激因子。蛋白质印迹分析揭示该基因在人组织中的广泛表达,所述人组织包括心脏、脑、胎盘、肝、骨骼肌和胰腺(Oh,Y.等人,J. Biol. Chem. 271 (1996)30322-30325)。
IGFBP7最初鉴定为与其配对肿瘤细胞相比较,在正常柔脑膜和乳房上皮细胞中差异表达的基因,并且命名为脑膜瘤相关cDNA (MAC25) (Burger,A.M.等人,Oncogene 16 (1998)2459-2467)。所表达的蛋白质独立地作为肿瘤衍生的粘附分子(以后重命名为血管调控蛋白) (Sprenger,C.C.等人,Cancer Res 59 (1999)2370-2375)和前列环素刺激因子(Akaogi,K.等人,Proc Natl Acad Sci USA 93 (1996)8384-8389)纯化。它另外已作为T1Al2 (在乳腺癌中下调的基因)报告(StCroix,B.等人,Science 289 (2000)1197-1202)。
在患有多种疾病包括心脏病、肾病、炎性疾病(给予Scios Inc.的US 6,709,855)和血管移植疾病(US 2006/0,003,338)的患者中测量到IGFBP7 mRNA的差异表达。
许多不同测定已得到描述且用于测试IGFBP7的激素结合蛋白特性。经由竞争亲和力交联测定分析低亲和力IGF结合。重组人mac25蛋白质特异性结合IGF-I和-II (Oh,Y.等人,J. Biol. Chem. 271 (1996)20322-20325;Kim,H.S.等人,Proc. Natl. Acad. Sci USA 94 (1997)12981-12986.)。IGFBP活性也可以通过在蛋白质配体印迹中测量蛋白质结合放射性标记的IGF的能力进行检测。
优选地,术语“IGFBP7”指人IGFBP7。蛋白质的序列是本领域众所周知的,并且例如可经由GenBank (NP_001240764.1)获得。如本文使用的,IGFBP7优选还涵盖特异性IGFBP7多肽的变体。关于术语“变体”的说明,请参见上文。
近来执行循环IGFBP7的免疫学测定。在随机人血清中检测到低水平的该分析物,并且增加的血清水平与胰岛素抗性相关可见(Lopez-Bermejo, A.等人, J. Clinical Endocrinology and Metabolism 88 (2003)3401-3408, Lopez-Bermejo, A.等人, Diabetes 55 (2006)2333-2339)。
术语“心肌肌钙蛋白”还涵盖上述特异性肌钙蛋白的变体,即优选肌钙蛋白I且更优选肌钙蛋白T的变体。此类变体具有至少与特异性心肌肌钙蛋白相同的基础生物学和免疫学特性。特别地,如果它们可通过本说明书中提及的相同特异性测定,例如通过使用特异性识别所述心肌肌钙蛋白的多克隆或单克隆抗体的ELISA测定检测,则它们共享相同的基础生物学和免疫学特性。此外,应当理解如依照本发明提及的变体应具有由于至少一个氨基酸取代、缺失和/或添加而不同的氨基酸序列,其中所述变体的氨基酸序列优选仍与特异性肌钙蛋白的氨基酸序列至少约50%、至少约60%、至少约70%、至少约80%、至少约85%、至少约90%、至少约92%、至少约95%、至少约97%、至少约98%或至少约99%相同。变体可以是等位基因变体或任何其他物种特异性同源物、旁系同源物或直向同源物。此外,本文提及的变体包括特异性心肌肌钙蛋白的片段或上述类型的变体,只要这些片段具有如上文提及的基础免疫学和生物学特性。优选地,心肌肌钙蛋白变体具有可与人肌钙蛋白T或肌钙蛋白I的那些比较的免疫学特性(即,表位组成)。因此,变体应可由用于测定心肌肌钙蛋白浓度的上述手段或配体识别。因此,变体应可由用于测定心肌肌钙蛋白浓度的上述手段或配体识别。此类片段可以是例如肌钙蛋白的降解产物。进一步包括的是由于翻译后修饰例如磷酸化或肉豆蔻化而不同的变体。优选地,肌钙蛋白I及其变体的生物学特性是在体内和体外抑制肌动球蛋白ATP酶或抑制血管生成的能力,所述能力可以例如基于由Moses等人1999 PNAS USA 96 (6):2645-2650)描述的测定进行检测。优选地,肌钙蛋白T及其变体的生物学特性是与肌钙蛋白C和I形成复合物,结合钙离子或结合原肌球蛋白的能力,优选地,如果作为肌钙蛋白C、I和T的复合物,或由肌钙蛋白C、肌钙蛋白I和肌钙蛋白T的变体形成的复合物存在。已知低浓度的循环心肌肌钙蛋白可以以多个浓度在对象中检测到,但需要进一步研究以理解其各自的作用和速率(Masson等人,Curr Heart Fail Rep (2010)7:15–21)。
标记物内皮抑素是本领域众所周知的。内皮抑素最初作为XVIII型胶原的20 kDA蛋白酶解片段分离自鼠血管内皮瘤(O'Reilly,M.S.等人,Cell 88 (1997)277-285)。胶原代表具有特征性三螺旋构象的细胞外基质蛋白质家族,形成在维持组织结构完整性中起主导作用的超分子聚集体。过量胶原沉积导致破坏外围组织的正常功能的纤维化。胶原XVIII是Multiplexin胶原家族的成员,具有在中心三螺旋结构域中的多重中断和主要在基膜中的C末端处的独特非三螺旋结构域。胶原XVIII的人α1型链的短同种型的序列(SwissProt:P39060)例如公开于WO2010/124821中,所述专利关于其整个公开内容随同引入作为参考。
内皮抑素通过多种蛋白水解酶的作用从胶原XVIII的α1链中释放(关于细节参见Ortega,N.和Werb,Z., Journal of Cell Science 115 (2002)4201-4214 - 该论文的完全公开内容随同引入作为参考)。如本文使用的,内皮抑素由跨越胶原XVIII的氨基酸位置1337至氨基酸位置1519的胶原XVIII片段表示,如WO2010/124821中公开的。在胶原XVIII的α链的C末端处的铰链区含有几个蛋白酶敏感位点,并且许多酶包括嗜中性粒细胞弹性蛋白酶、组织蛋白酶和基质金属蛋白酶已知通过切割该区域中的胶原链而生成内皮抑素。这些蛋白酶并非唯一地释放内皮抑素,而是可以释放含有内皮抑素序列的其他更大片段。如对于技术人员显而易见的,此类更大片段也通过内皮抑素的免疫测定进行测量。
骨桥蛋白(本文也称为“OPN”)也称为骨涎蛋白I (BSP-1或BNSP)、早期T-淋巴细胞活化(ETA-1)、分泌的磷蛋白1 (SPP1)、2ar和立克次氏体抗性(Ric),是高度带负电的细胞外基质蛋白质的多肽,其缺乏广泛的二级结构。它由约300个氨基酸(在小鼠中297个;在人中314个)组成,并且作为33-kDa新生蛋白质表达;还存在功能上重要的切割位点。OPN可以经历翻译后修饰,这使其表观分子量增加至约44 kDa。骨桥蛋白的序列是本领域众所周知的(人骨桥蛋白:UniProt P10451,GenBank NP_000573.1)。骨桥蛋白在正常胎盘、尿、乳和胆汁中发现(US 6,414,219; US 5,695,761; Denhardt, D.T.和Guo, X., FASEB J. 7 (1993)1475-1482; Oldberg, A.等人,PNAS 83 (1986)8819-8823; Oldberg, A.等人, J. Biol. Chem. 263 (1988)19433-19436; Giachelli, CM.等人, Trends Cardiovasc. Med. 5 (1995)88-95)。人OPN蛋白质和cDNA已得到分离且测序(Kiefer M. C等人,Nucl. Acids Res. 17 (1989)3306)。OPN在细胞粘附、趋化现象、巨噬细胞定向白介素-10中起作用。已知OPN与许多整联蛋白受体相互作用。增加的OPN表达已在许多人癌症中报告,并且它的同源受体(av-b3、av-b5和av-bl整联蛋白和CD44)已得到鉴定。通过Irby,R.B.等人,Clin. Exp. Metastasis 21 (2004)515-523的体外研究指示内源OPN表达(经由稳定转染)以及外源OPN (加入培养基中)两者均在体外增强人结肠癌细胞的运动性和侵入能力。
内皮抑素是血管生成和血管生长的有力抑制剂。内皮抑素和细胞因子网络之间的关系有待确定,但已知内皮抑素能够改变广泛范围的基因的表达(Abdollahi,A.等人,MoI. Cell 13 (2004)649-663)。
如本文使用的,内皮抑素优选还涵盖特异性内皮抑素多肽的变体。关于术语“变体”的说明,请参见上文。
Mimecan是具有富含亮氨酸重复和包含298个氨基酸的前体的小蛋白聚糖。mimecan的其他名称是OGN、骨甘蛋白聚糖(osteoglycin)、OG、OIF、SLRR3A。
Mimecan是具有结构相关核心蛋白质的分泌的富含亮氨酸的小蛋白聚糖(SLRP)家族成员。由所有SLRP共享的共同特点是在核心蛋白质的C末端一半中的串联富含亮氨酸的重复(LRR)单位。然而,在N末端区域中,每类SLRP具有含有半胱氨酸簇的独特结构域,所述半胱氨酸簇具有称为LRRN结构域的保守间隔。III类SLRP含有六个羧基LRR,并且包括mimecan、骺蛋白聚糖和opticin。
关于I和II类成员例如核心蛋白聚糖、双糖链蛋白多糖、lumecan 和纤维调节素,来自小鼠敲除的功能研究显示SLRP缺陷小鼠展示可归于异常胶原纤维原纤维形成的大量缺陷,表明这些SLRP在建立和维持胶原蛋白基质中起重要作用(Ameye,L.和Young,M.F., Glycobiology 12 (2002)107R-116R)。III类mimecan的缺陷也引起胶原蛋白纤维异常(Tasheva, E.S.等人,MoI. Vis. 8 (2002)407-415)。
Mimecan是细胞外基质的多功能组分。它结合多种其他蛋白(IGF2、IKBKG、IFNBl、INSR、CHUK、IKBKB、NFKBIA、ILl 5、Cd3、视黄酸、APP、TNF、脂多糖、c-abl癌基因 1、受体酪氨酸激酶、v-src肉瘤病毒癌基因)。这些不同的结合活性可以负责mimecan在多种组织中发挥不同功能的能力。
Mimecan已在角膜、骨、皮肤和更多组织中发现。它的表达模式在不同病理条件下改变。尽管对于mimecan的生物学作用的数据量增加,但是它的功能仍不明确。Mimecan已显示涉及调节胶原纤维原纤维形成,这是在发育、组织修复和转移中必需的过程(Tasheva等人,MoI. Vis. 8 (2002)407-415)。它与TGF-β-1或TGF-β-2结合在骨形成中起作用。
人mimecan多肽的序列是本领域众所周知的,并且可以例如经由GenBank登记号NP_054776.1 GI:7661704来获取。进一步地,该序列公开于WO2011/012268中。如本文使用的,mimecan优选还涵盖特异性mimecan多肽的变体。关于术语“变体”的说明,请参见上文。在本发明的上下文中,mimecan优选如WO2011/012268中所述进行测定。
如本文使用的,术语“可溶性Flt-1”或“sFlt-1”(可溶性fms样酪氨酸激酶1)指其为可溶形式的VEGF受体Flt1的多肽。它在人脐静脉内皮细胞的条件化培养基中得到鉴定。内源可溶性Flt1 (sFlt1)受体在层析和免疫学上类似于重组人sFlt1,并且以可比较的高亲和力结合[125I] VEGF。人sFlt1显示在体外与KDR/Flk-1的细胞外结构域形成VEGF稳定化复合物。优选地,sFlt1指人sFlt1。更优选地,人sFlt1可以由如Genbank登记号P17948,GI:125361中所示的Flt-1的氨基酸序列推导。关于小鼠sFlt1的氨基酸序列显示于Genbank登记号BAA24499.1,GI:2809071中。
本文使用的术语“sFlt-1”还涵盖上述特异性sFlt-1多肽的变体。此类变体具有至少与特异性sFlt-1多肽相同的基本生物学和免疫学特性。特别地,如果它们可通过本说明书中提及的相同特异性测定,例如通过使用特异性识别所述sFlt-1多肽的多克隆或单克隆抗体的ELISA测定检测,则它们共享相同的基本生物学和免疫学特性。关于术语“变体”的更详细说明,请参见上文。
如本文使用的,术语“PlGF”(胎盘生长因子)指胎盘衍生的生长因子,其为长149个氨基酸的多肽,并且与人血管内皮生长因子(VEGF)的胎盘衍生的生长因子样区域高度同源(53%同一性)。如同VEGF,PlGF在体外和体内具有血管生成活性。例如,衍生自经转染的COS-1细胞的PlGF的生物化学和功能表征揭示,它是能够在体外刺激内皮细胞生长的糖基化二聚分泌蛋白质(Maqlione1993,Oncogene 8 (4):925-31)。优选地,PlGF指人PlGF,更优选具有如Genebank登记号P49763,GI:17380553中所示的氨基酸序列的人PlGF (Genebank可在www.ncbi.nlm.nih.gov/entrez下得自NCBI,USA)。
在本发明的方法的上下文中,特别设想测定人肽或多肽的量。
尿酸是在对象生物中的嘌呤代谢的最终产物。IUPAC名称为7,9-二氢-3H-嘌呤-2,6,8-三酮。该化合物通常也称为尿酸盐、石质酸、2,6,8-三氧嘌呤、2,6,8-三羟基嘌呤、2,6,8-三氧嘌呤、1H-嘌呤-2,6,8-三醇(化合物分子式C5H4N4O3,PubChem CID 1175,CAS编号69-93-2)。
尿酸测量用于众多肾和代谢病症以及接受细胞毒性药物的患者的诊断和治疗中,所述肾和代谢病症包括肾衰竭、痛风、白血病、银屑病、饥饿或其他消瘦状况。尿酸的氧化提供了定量测定该嘌呤代谢产物的两种方法的基础。一种方法是碱性溶液中磷钨酸至钨蓝的还原,其进行光度测量。由Praetorius和Poulson描述的第二种方法利用尿酸酶来氧化尿酸;该方法消除化学氧化固有的干扰(Praetorius E,Poulsen H. Enzymatic Determination of Uric Acid with Detailed Directions. Scandinav J Clin Lab Investigation 1953;3:273-280)。尿酸酶可以用于涉及尿酸消耗的UV测量或与其他酶组合以提供比色测定的方法中。另一种方法是由Town等人开发的比色法(Town MH,Gehm S,Hammer B,Ziegenhorn J. J Clin Chem Clin Biochem 1985;23:591)。样品最初与含有抗坏血酸氧化酶的试剂混合物和清洁系统一起温育。在该测试系统中,重要的是样品中存在的任何抗坏血酸在初步反应中消除;这排除后续POD指示剂反应的任何抗坏血酸干扰。在起始试剂添加后,通过尿酸酶的尿酸氧化开始。
在本发明的上下文中,尿酸可以通过视为适当的任何方法进行测定。优选地,生物标记物通过上述方法进行测定。更优选地,尿酸通过应用上文描述的比色法的轻微修饰进行测定。在该反应中,过氧化物在过氧化物酶(POD)、N-乙基-N-(2-羟基-3-磺丙基)-3-甲基苯胺(TOOS)和4-氨基比林的存在下反应,以形成苯醌-二亚胺染料。形成的红色强度与尿酸浓度成比例且光度测定。
半乳糖凝集素-3 (Gal-3)是β半乳糖苷结合凝集素家族的结构上独特的成员。半乳糖凝集素-3的表达已与上皮和炎症细胞相关,所述炎症细胞包括巨噬细胞、嗜中性粒细胞和肥大细胞。半乳糖凝集素-3已牵涉在心力衰竭中重要的多种生物过程,包括成肌纤维细胞增生、纤维化、组织修复、心脏重塑和炎症。半乳糖凝集素-3大约30 kDa,并且如同所有半乳糖凝集素,含有约130个氨基酸的碳水化合物识别结合结构域(CRD),其允许β-半乳糖苷的特异性结合。半乳糖凝集素-3由单一基因LGALS3编码。它包含与约130个氨基酸的单个C末端CRD连接,具有短氨基酸区段的串联重复的N末端结构域(总共110–130个氨基酸)。它在核、细胞质、线粒体、细胞表面和细胞外间隙中表达。该蛋白质已显示涉及下述生物过程:细胞粘附、细胞活化和化学吸引、细胞生长和分化、细胞周期和细胞凋亡。升高水平的半乳糖凝集素-3已发现与与急性失代偿性心力衰竭和慢性心力衰竭群体中更高的死亡危险显著相关(参见例如DeFilippi C,Christenson R,Shah R,等人(2009). Clinical validation of a novel assay for galectin-3 for risk assessment in acutely destabilized heart failure.)。
半乳糖凝集素-3的蛋白质序列是本领域众所周知的,参见例如uniprot登记号P17931 (版本5,2008年11月25日),GenBank登记号NP_002297.2 NM_002306.3。
ST2是IL-1受体家族的成员,其在机械应激的条件下由心脏成纤维细胞和心肌细胞产生。ST2是白细胞介素-1受体家族成员,且以膜结合同种型和可溶性同种型(sST2)两者存在。在本发明的上下文中,应测定可溶性ST2的量(参见Dieplinger等人(Clinical Biochemistry,43,2010:1169 - 1170)。ST2也称为白细胞介素1受体样1或IL1RL1,在人中由IL1RL1基因编码。人ST2多肽的序列是本领域众所周知的,并且例如可经由GenBank获得,参见NP_003847.2 GI:27894328。可溶性ST2 (sST2)被认为充当诱饵受体,其通过经由细胞膜结合形式ST2结合IL-33且取消IL-33信号转导的以其他方式的心脏保护效应。
标记物胱抑素C是本领域众所周知的。胱抑素C由CST3基因编码,并且由所有有核细胞以恒定速率产生,并且在人中的生产率在整个寿命期间是惊人恒定的。从循环中消除几乎完全经由肾小球过滤。为此,在1 - 50岁的年龄范围内,胱抑素C的血清浓度不依赖于肌肉质量和性别。因此,血浆和血清中的胱抑素C已提议作为GFR的更灵敏标记物。人胱抑素C多肽的序列可以经由Genbank获取(参见例如登记号NP_000090.1)。生物标记物可以通过粒子增强免疫比浊测定进行测定。人胱抑素C与由抗胱抑素C抗体包被的乳胶颗粒凝集。比浊测定聚集体。
标记物前白蛋白是技术人员众所周知的。它是富含色氨酸的蛋白质,其在肝细胞中合成且具有55000道尔顿的分子量。在pH 8.6时,由于其至阳极的更大扩散率,电泳条带以< 2.5%的相对量在白蛋白前出现。它的功能是结合且转运低分子量视黄醇结合蛋白(小于21000道尔顿的分子量),阻止其肾小球过滤。30-50%的循环前白蛋白由视黄醇结合蛋白复合。此外,它结合且转运甲状腺素(T4),然而,它与该激素的亲和力小于甲状腺素结合球蛋白的那种。人前白蛋白多肽的序列可以经由Genbank来获取(参见例如登记号NP_000362.1)。多种方法可用于测定前白蛋白,例如放射免疫扩散(RID)、散射比浊法和比浊法。
转铁蛋白(通常也称为血清转铁蛋白或β-1金属结合球蛋白)是分子量约79570道尔顿的糖蛋白。它由具有两条N糖苷键合的寡糖链的多肽链组成。转铁蛋白是铁结合转运蛋白质,其可以结合两个Fe3+离子伴随阴离子的结合,通常为碳酸氢盐。多种方法可用于测定转铁蛋白,包括放射免疫扩散、散射比浊法和比浊法。转铁蛋白是序列是本领域众所周知的,参见例如Schaeffe等人Gene 56:109-116 (1987)或Uniprot登记号P02787,特别是版本178)。
P1NP (前胶原1型N末端前肽)是骨形成的标记物。它是1型胶原沉积的特异性指示剂。它作为三聚结构释放,但降解为单体。优选地,测量P1NP的总量(总前胶原1型N末端前肽)。
在本说明书中提及的测定肽或多肽,特别是GDF-15 (生长分化因子15)、内皮抑素、mimecan、IGFBP7 (IGF结合蛋白7)、心肌肌钙蛋白、BNP型肽、Gal-3 (半乳糖凝集素-3)、sST2 (可溶性ST2)、sFlt-1、PlGF、P1NP、胱抑素C或前白蛋白的量指优选半定量或定量地测量量或浓度。测量可以直接或间接完成。
如何测定尿酸的量在本文上文描述。如果生物标记物是肽或多肽例如GDF-15 (生长分化因子15)、内皮抑素、mimecan、IGFBP7 (IGF结合蛋白7)、心肌肌钙蛋白、BNP型肽、尿酸、Gal-3 (半乳糖凝集素-3)或sST2 (可溶性ST2)、sFlt-1、PlGF、P1NP、胱抑素C或前白蛋白,则应用下述:
直接测量指基于得自肽或多肽自身的信号测量肽或多肽的量或浓度,并且其强度与样品中存在的肽分子数目直接关联。此类信号 - 在本文中有时被称为强度信号 - 可以例如通过测量肽或多肽的特异性物理或化学特性的强度值来获得。间接测量包括测量得自第二组分(即并非肽或多肽本身的组分)或生物读出系统的信号,所述生物读出系统例如可测量的细胞应答、配体、标记或酶促反应产物。
依照本发明,测定肽或多肽的量可以通过测定样品中的肽量的所有已知手段来实现。所述手段包括免疫测定和方法,其可以利用以多种夹心、竞争或其他测定形式的标记分子。此类测定优选基于检测试剂例如特异性识别待测定肽或多肽的抗体。检测试剂应直接或间接地能够生成指示肽或多肽的存在或不存在的信号。此外,信号强度可以优选与样品中存在的多肽量直接或间接(例如成反比)关联。进一步的合适方法包括测量对于肽或多肽特异性的物理或化学特性,例如它的精确分子量或NMR光谱。所述方法优选包括生物传感器、与免疫测定偶联的光学装置、生物芯片、分析装置例如质谱仪、NMR-分析仪或层析设备。进一步地,方法包括基于微板ELISA的方法、完全自动化或机械手免疫测定(例如在ElecsysTM分析仪上可获得)、CBA (酶促钴结合测定,在Roche-HitachiTM分析仪上可获得)、和乳胶凝集反应测定(例如在Roche-HitachiTM分析仪上可获得)。
优选地,测定肽或多肽的量包括步骤:(a)使能够引发细胞应答的细胞与所述肽或多肽接触足够的时间段,所述细胞应答的强度指示肽或多肽的量,(b)测量细胞应答。对于测量细胞应答,样品或加工的样品优选加入细胞培养物中,并且测量内部或外部细胞应答。细胞应答可以包括可测量的报道基因表达或物质例如肽、多肽或小分子分泌。表达或物质应生成与肽或多肽的量关联的强度信号。
还优选地,测定肽或多肽的量包括测量可得自样品中的肽或多肽的特异性强度信号的步骤。如上所述,此类信号可以是在对于肽或多肽特异性的质谱或NMR光谱中观察到的对于肽或多肽特异性的m/z变量处观察到的信号强度。
测定肽或多肽的量可以优选包括步骤:(a)使肽与特异性配体接触,(b) (任选)去除未结合的配体,(c)测量结合配体的量。
根据优选实施方案,所述接触、去除和测量步骤可以通过本文公开的系统的分析仪单元执行。根据一些实施方案,所述步骤可以通过所述系统的单一分析仪单元或通过彼此可操作地通讯的超过一个分析仪单元执行。例如,根据具体实施方案,本文公开的所述系统可以包括用于执行所述接触和去除步骤的第一分析仪单元,和通过运输单元(例如机械臂)与所述第一分析仪单元可操作地连接的第二分析仪单元,所述第二分析仪单元执行所述测量步骤。
结合配体特别是配体或配体/肽复合物生成强度信号。根据本发明的结合包括共价和非共价结合。根据本发明的配体可以是与本文描述的肽或多肽结合的任何化合物,例如肽、多肽、核酸或小分子。优选配体包括抗体、核酸、肽或多肽,例如肽或多肽的受体或结合配偶体及其包含肽的结合结构域的片段,和适体例如核酸或肽适体。制备此类配体的方法是本领域众所周知的。例如,合适抗体或适体的鉴定和产生也由商业供应者提供。本领域技术人员熟悉开发具有更高亲和力或特异性的此类配体衍生物的方法。例如,随机突变可以引入核酸、肽或多肽内。这些衍生物随后可以根据本领域已知的筛选操作例如噬菌体展示,就结合进行测试。如本文提及的抗体包括多克隆和单克隆抗体两者,以及其片段,例如能够结合抗原或半抗原的Fv、Fab和F(ab)2片段。本发明还包括单链抗体和人源化杂交抗体,其中显示出所需抗原特异性的非人供体抗体的氨基酸序列与人受体抗体的序列组合。供体序列通常包括至少供体的抗原结合氨基酸残基,但同样可以包含供体抗体的其他结构和/或功能相关氨基酸残基。此类杂交物可以通过本领域众所周知的几种方法进行制备。优选地,配体或试剂与肽或多肽特异性结合。根据本发明的特异性结合意指配体或试剂不应与待分析样品中存在的另一种肽、多肽或物质大量结合(“交叉反应”)。优选地,特异性结合的肽或多肽应以比任何其他相关肽或多肽高至少3倍、更优选高至少10倍且甚至更优选高至少50倍的亲和力结合。非特异性结合可以是可耐受的,如果它仍可以明确区分且测量,例如根据其在蛋白质印迹上的大小,或通过其在样品中的相对更高丰度。配体的结合可以通过本领域已知的任何方法进行测量。优选地,所述方法是半定量或定量的。用于测定多肽或肽的进一步合适技术在下文描述。
首先,配体的结合可以例如通过NMR或表面等离振子共振直接进行测量。根据优选实施方案,配体结合的测量通过本文公开的系统的分析仪单元执行。其后,测量的结合量可以通过本文公开的系统的计算装置进行计算。其次,如果配体还充当目的肽或多肽的酶促活性的底物,则可以测量酶促反应产物(例如蛋白酶的量可以通过例如在蛋白质印迹上测量切割底物的量进行测量)。可替代地,配体可以自身显示出酶促特性,并且分别由肽或多肽结合的“配体/肽或多肽”复合物或配体可以与合适的底物接触,允许检测通过强度信号的生成。对于酶促反应产物的测量,优选地,底物的量是饱和的。底物还可以在反应前用可检测标记进行标记。优选地,样品与底物接触足够时间段。足够时间段指产生可检测、优选可测量的产物量所需的时间。代替测量产物量,可以测量给定(例如可检测)产物量出现所需的时间。第三,配体可以与标记共价或非共价偶联,允许配体的检测和测量。标记可以通过直接或间接方法来完成。直接标记涉及标记与配体的直接(共价或非共价)偶联。间接标记涉及第二配体与第一配体的结合(共价或非共价地)。第二配体应与第一配体特异性结合。所述第二配体可以与合适标记偶联和/或是与第二配体结合的第三配体的靶(受体)。第二、第三或甚至更高级别的配体的使用通常用于增加信号。合适的第二和更高级别的配体可以包括抗体、二抗和众所周知的链霉抗生物素蛋白-生物素系统(Vector Laboratories,Inc.)。配体或底物还可以如本领域已知的用一种或多种标签“加上标签”。此类标签随后可以是更高级别的配体的靶。合适的标签包括生物素、地高辛配基(digoxygenin)、His标签、谷胱甘肽S转移酶、FLAG、GFP、myc标签、流感病毒A型血凝素(HA)、麦芽糖结合蛋白等等。在肽或多肽的情况下,标签优选在N末端和/或C末端处。合适的标记是可通过适当的检测方法检测的任何标记。典型标记包括金颗粒、乳胶珠、吖啶酯(acridan ester)、鲁米诺、钌、酶促活性标记、放射性标记、磁性标记(“例如磁珠”,包括顺磁性和超顺磁性标记)和荧光标记。酶促活性标记包括例如辣根过氧化物酶、碱性磷酸酶、β-半乳糖苷酶、荧光素酶及其衍生物。合适的检测底物包括二氨基联苯胺(DAB)、3,3'-5,5'-四甲基联苯胺、NBT-BCIP (4-硝基蓝四唑氯化物和5-溴-4-氯-3-吲哚基-磷酸盐,可作为现成的原液得自Roche Diagnostics)、CDP-Star™ (Amersham Biosciences)、ECF™ (Amersham Biosciences)。合适的酶-底物组合可以导致有色的反应产物、荧光或化学发光,其可以根据本领域已知的方法进行测量(例如使用光敏膜或合适的照相机系统)。关于测量酶促反应,类似地应用上文给出的标准。典型荧光标记包括荧光蛋白质(例如GFP及其衍生物)、Cy3、Cy5、德克萨斯红、荧光素和Alexa染料(例如Alexa 568)。进一步的荧光标记例如可得自Molecular Probes (Oregon)。还考虑了量子点作为荧光标记的使用。典型的放射性标记包括35S、125I、32P、33P等等。放射性标记可以通过已知和适当的任何方法进行检测,例如光敏膜或磷成像仪。根据本发明的合适测量方法还包括沉淀(特别是免疫沉淀)、电化学发光(电生成的化学发光)、RIA (放射性免疫测定)、ELISA (酶联免疫吸附测定)、夹心酶免疫测试、电化学发光夹心免疫测定(ECLIA)、解离增强镧系荧光免疫测定(DELFIA)、闪烁迫近测定(SPA)、比浊法、浊度测定法、乳胶增强比浊法或浊度测定法、或固相免疫试验。本领域已知的进一步方法(例如凝胶电泳、2D凝胶电泳、SDS聚丙烯酰胺凝胶电泳(SDS-PAGE)、蛋白质印迹和质谱法)可以单独或与如上所述的标记或其他检测方法组合使用。
肽或多肽的量还可以优选如下测定:(a)使包含如上所述的肽或多肽的配体的固体载体与包含肽或多肽的样品接触,和(b)测量与载体结合的肽或多肽的量。优选选自核酸、肽、多肽、抗体和适体的配体优选以固定形式存在于固体载体上。用于制造固体载体的材料是本领域众所周知的,并且尤其包括商购可得的柱材料、聚苯乙烯珠、乳胶珠、磁珠、胶体金属颗粒、玻璃和/或硅芯片和表面、硝化纤维素测试条、膜、片、duracytes、反应托盘的孔和壁、塑料管等。配体或试剂可以与许多不同载体结合。众所周知的载体实例包括玻璃、聚苯乙烯、聚氯乙烯、聚丙烯、聚乙烯、聚碳酸酯、右旋糖酐、尼龙、直链淀粉、天然和改性纤维素、聚丙烯酰胺、琼脂糖和磁石。为了本发明的目的,载体的性质可以是可溶或不可溶的。固定化/固定所述配体的合适方法是众所周知的,并且包括但不限于离子、疏水、共价相互作用等等。还考虑使用“悬浮测定”作为根据本发明的测定(Nolan 2002,Trends Biotechnol. 20 (1):9-12)。在此类悬浮测定中,载体例如微珠或微球体存在于悬浮液中。阵列由携带不同配体,可能标记的不同微珠或微球体组成。例如基于固相化学和光不稳定保护基团产生此类测定的方法是一般已知的(US 5,744,305)。
优选地,如本文提及的个别生物标记物的量如实施例部分中所述进行测定。
如本文使用的,术语“量”涵盖生物标记物的绝对量,所述生物标记物的相对量或浓度,以及与之关联或可以由其衍生的任何值或参数。此类值或参数包含来自通过直接测量得自所述肽的所有特异性物理或化学特性的强度信号值,例如质谱或NMR光谱中的强度值。此外,涵盖的是通过本说明书中其他地方指定的间接测量获得的所有值或参数,例如响应得自特异性结合配体的肽或强度信号的生物读出系统测定的应答水平。应当理解与上述量或参数关联的值还可以通过所有标准数学运算获得。根据本发明的优选实施方案,“量”的测定通过所公开的系统执行,由此计算装置基于由所述系统的一个或多个分析仪单元执行的接触和测量步骤测定“量”。
如本文使用的,术语“比较”涵盖比较由待分析的样品包含的生物标记物特别是肽或多肽的量与本说明书中其他地方指定的合适参考来源的量。应当理解如本文使用的比较指相应的参数或值的比较,例如绝对量与绝对参考量相比较,而浓度与参考浓度相比较,或得自测试样品的强度信号与参考样品的相同类型的强度信号相比较。本发明方法的步骤(b)中提及的比较可以手动或计算机辅助进行。因此,本发明方法的步骤(b)中提及的比较可以通过(例如本文公开的系统的)计算装置进行。量和参考的值可以例如彼此相比较,并且所述比较可以通过执行比较算法的计算机程序自动进行。进行所述评估的计算机程序提供以合适输出形式的所需评价。对于计算机辅助的比较,测定量的值可以通过计算机程序与贮存于数据库中的对应于合适参考的值相比较。计算机程序可以进一步评估比较的结果,即自动提供以合适输出形式的所需评价。对于计算机辅助的比较,测定量的值可以通过计算机程序与贮存于数据库中的对应于合适参考的值相比较。计算机程序可以进一步评估比较的结果,即自动提供以合适输出形式的所需评价。所述结果可以优选充当用于鉴定适合于至少一种药剂的施用的对象的帮助,如本文其他地方描述的。
如本文使用的,术语“参考量”(或参考比)优选指这样的量(或比),其允许将对象分配到如本发明方法的上下文中所述的适合于所述至少一种药剂的施用的对象组,或不适合所述至少一种药剂的施用的对象组。相应地,参考量(或参考比)应允许鉴定适合于至少一种药剂的施用的对象。
此类参考量(或比)可以是使这些组彼此分开的阈值量。鉴定可以基于所计算的“量”(或比)与参考或阈值的所述比较,通过本文公开的系统的计算装置提供。例如,系统的计算装置可以提供以词、符号或数值形式的指示符,所述指示符是对象鉴定的指示。
取决于多种生理参数例如年龄、性别或亚群,以及用于测定本文提及的多肽或肽的手段,可应用于个别对象的参考量(或参考比)可以改变。合适的参考量可以由待分析的参考样品连同(即同时或随后)测试样品一起测定。
原则上,可以通过应用标准统计方法,基于给定生物标记物的平均数或平均值,由如上指定的对象队列计算参考量(或比)。特别地,测试例如旨在判断事件是否的方法的准确度通过其接受者操作特征(ROC)得到最佳描述(尤其参见Zweig 1993,Clin. Chem. 39:561-577)。ROC曲线是起因于在观察到的整个数据范围连续改变决策阈值的所有灵敏度相对于特异性对的曲线。诊断方法的临床表现取决于其准确度,即其将对象正确分配到某一预后或诊断的能力。ROC曲线通过对于适合于作出区分的完全阈值范围标绘灵敏度相对于1特异性,指示两种分布之间的重叠。在y轴上的是灵敏度,或真阳性部分,其定义为真阳性测试结果数目与真阳性数目和假阴性测试结果数目乘积的比。在疾病或状况的存在下,这也被称为阳性率。它单独由受累亚组进行计算。在x轴上的是假阳性部分或1特异性,其定义为假阳性结果数目与真阴性数目和假阳性测试结果数目乘积的比。它是特异性的指数,并且完全由未受累亚组进行计算。因为真阳性和假阳性部分完全分开计算,所以通过使用来自两个不同亚组的测试结果,ROC曲线不依赖于队列中的事件流行率。ROC曲线上的每个点代表对应于特定决策阈值的灵敏度/特异性对。具有完全区别的测试(在两个结果分布中无重叠)具有经过左上角的ROC曲线,其中真阳性部分是1.0,或100% (完全灵敏度),并且假阳性部分是0 (完全特异性)。无区别的测试(两个组的结果的相同分布)的理论曲线是从左下角到右上角的45°对角线。大多数曲线介于这两个极端之间。如果ROC曲线完全低于45°对角线,则这通过将“阳性率”标准从“大于”逆转为“小于”或反之亦然容易地补救。在定性上,曲线越接近于左上角,测试的总准确度越高。取决于所需置信区间,阈值可以衍生自允许如本文提及的鉴定适合于施用的对象的ROC曲线,伴随灵敏度和特异性各自的适当平衡。相应地,优选地,通过如上所述建立用于所述队列的ROC且由其衍生阈值量,可以生成用于本发明的上述方法的参考,即允许区别如本文提及的适合于施用的对象,或不适合于所述施用的对象的阈值。取决于诊断方法的所需灵敏度和特异性,ROC曲线允许衍生合适阈值。
诊断算法,即药剂施用是否应起始,或药剂剂量是否应增加(“上调”),公开于实施例部分中。在下文中概括了优选诊断算法:
如果至少一种药剂是β阻断剂,并且如果至少一种生物标记物是内皮抑素、mimecan、GDF-15、心肌肌钙蛋白和/或BNP型肽,则优选应用下述:
优选地,与参考量(或多个参考量)相比较增加的测试样品中的生物标记物(或多种生物标记物)的量(或多个量)指示对象适合于所述至少一种药剂的施用,和/或与参考量(或多个参考量)相比较减少的生物标记物(或多种生物标记物)的量(或多个量)指示对象不适合所述至少一种药剂的施用。
更优选地,待测试的对象已经用β阻断剂进行治疗。在这种情况下,与参考量(或多个参考量)相比较增加的生物标记物(或多种生物标记物)的量(或多个量)指示对象适合于以更高剂量的施用所述药剂,和/或与参考量(或多个参考量)相比较减少的生物标记物(或多种生物标记物)的量(或多个量)指示对象不适合于所述药剂以更高剂量的施用。
如果药剂是β阻断剂,并且如果生物标记物是IGFBP7、P1NP、sFlt-1或骨桥蛋白,则优选应用下述:
优选地,与一个或多个参考量相比较减少的测试样品中的一种或多种生物标记物的量(或多个量)指示对象适合于所述β阻断剂的施用,和/或与一个或多个参考量相比较增加的一种或多种生物标记物的量(或多个量)指示对象不适合于所述β阻断剂的施用。特别地,与一个或多个参考量相比较减少的测试样品中的一种或多种生物标记物的量(或多个量)指示对象适合于所述β阻断剂的施用。
更优选地,待测试的对象已经用β阻断剂进行治疗。在这种情况下,与一个或多个参考量相比较减少的测试样品中的一种或多种生物标记物的量(或多个量)指示对象适合于以更高剂量的施用所述药剂,和/或与一个或多个参考量相比较增加的一种或多种生物标记物的量(或多个量)指示对象不适合于以更高剂量的施用所述药剂。特别地,与一个或多个参考量相比较减少的测试样品中的一种或多种生物标记物的量(或多个量)指示对象适合于以更高剂量的施用所述β阻断剂。
如果至少一种药剂是醛固酮拮抗剂,并且如果至少一种生物标记物是IGFBP7、心肌肌钙蛋白、Gal-3、胱抑素C、PlGF、GDF-15和/或sST2,则优选应用下述:
优选地,与参考量(或多个参考量)相比较增加的测试样品中的生物标记物(或多种生物标记物)的量(或多个量)指示对象适合于所述至少一种药剂的施用,和/或与参考量(或多个参考量)相比较减少的生物标记物(或多种生物标记物)的量(或多个量)指示对象不适合所述至少一种药剂的施用。
更优选地,待测试的对象已经用醛固酮拮抗剂进行治疗。在这种情况下,与参考量(或多个参考量)相比较增加的生物标记物(或多种生物标记物)的量(或多个量)指示对象适合于以更高剂量的施用所述一种或多种药剂,和/或与参考量(或多个参考量)相比较减少的生物标记物(或多种生物标记物)的量(或多个量)指示对象不适合于以更高剂量的施用所述一种或多种药剂。
如果测定PlGF量与sFlt-1量的比,则应用下述作为诊断算法。
优选地,与参考比相比较增加的测试样品中的PlGF量与sFlt-1量的比指示对象适合于所述醛固酮拮抗剂的施用,和/或与参考比相比较减少的比指示对象不适合于所述醛固酮拮抗剂的施用。
更优选地,待测试的对象已经用醛固酮拮抗剂进行治疗。在这种情况下,与参考比相比较增加的测试样品中的PlGF量与sFlt-1量的比指示对象适合于以更高剂量的施用所述醛固酮拮抗剂,和/或与参考比相比较减少的比指示对象不适合于所述醛固酮拮抗剂以更高剂量的施用。
如果至少一种药剂是醛固酮拮抗剂,并且如果至少一种生物标记物是内皮抑素、尿酸和/或sFlt-1,则优选应用下述:
优选地,与参考量(或多个参考量)相比较减少的测试样品中的生物标记物(或多种生物标记物)的量(或多个量)指示对象适合于所述至少一种药剂的施用,和/或与参考量(或多个参考量)相比较增加的生物标记物(或多种生物标记物)的量(或多个量)指示对象不适合所述至少一种药剂的施用。
更优选地,待测试的对象已经用醛固酮拮抗剂进行治疗。在这种情况下,与参考量(或多个参考量)相比较减少的生物标记物(或多种生物标记物)的量(或多个量)指示对象适合于以更高剂量的施用所述药剂,和/或与参考量(或多个参考量)相比较增加的生物标记物(或多种生物标记物)的量(或多个量)指示对象不适合于以更高剂量的施用所述药剂。
如果至少一种药剂是肾素-血管紧张素系统的抑制剂,并且如果至少一种生物标记物是GDF-15、心肌肌钙蛋白、尿酸、BNP型肽和/或骨桥蛋白,则优选应用下述:
优选地,与参考量(或多个参考量)相比较增加的测试样品中的生物标记物(或多种生物标记物)的量(或多个量)指示对象适合于所述至少一种药剂的施用,和/或与参考量(或多个参考量)相比较减少的生物标记物(或多种生物标记物)的量(或多个量)指示对象不适合所述至少一种药剂的施用。
更优选地,待测试的对象已经用肾素-血管紧张素系统的抑制剂进行治疗。在这种情况下,与参考量(或多个参考量)相比较增加的生物标记物(或多种生物标记物)的量(或多个量)指示对象适合于以更高剂量的施用所述药剂,和/或与参考量(或多个参考量)相比较减少的生物标记物(或多种生物标记物)的量(或多个量)指示对象不适合于以更高剂量的施用所述药剂。
如果至少一种药剂是利尿剂,并且至少一种生物标记物选自IGFBP-7、内皮抑素、mimecan、GDF-15、前白蛋白、转铁蛋白、BNP型肽和尿酸,则优选应用下述:
优选地,与参考量(或多个参考量)相比较增加的测试样品中的生物标记物(或多种生物标记物)的量(或多个量)指示对象不适合于所述药剂的施用,和/或与参考量(或多个参考量)相比较减少的生物标记物(或多种生物标记物)的量(或多个量)指示对象适合于所述药剂的施用。
更优选地,待测试的对象已经用利尿剂进行治疗。在这种情况下,与参考量(或多个参考量)相比较增加的生物标记物(或多种生物标记物)的量(或多个量)指示对象不适合于所述药剂以更高剂量的施用,和/或与参考量(或多个参考量)相比较减少的生物标记物(或多种生物标记物)的量(或多个量)指示对象不适合于所述药剂以更高剂量的施用,和/或与参考量(或多个参考量)相比较减少的生物标记物(或多种生物标记物)的量(或多个量)指示对象适合于以更低剂量的施用所述药剂。
如果至少一种药剂是肾素-血管紧张素系统的抑制剂,并且如果至少一种生物标记物是sFlt-1和/或IGFBP7,则应用下述。
优选地,与参考量相比较增加的测试样品中的生物标记物的量指示对象不适合于所述药剂的施用,和/或与参考量相比较减少的生物标记物的量指示对象适合于所述药剂的施用。
更优选地,待测试的对象已经用肾素血管紧张素系统抑制剂进行治疗。在这种情况下,与参考量相比较增加的生物标记物的量指示对象不适合于以更高剂量的施用所述药剂,和/或与参考量相比较减少的生物标记物的量指示对象适合于以更高剂量的施用所述药剂。
还优选参考量衍生自已知适合于所述至少一种药剂的施用的对象或对象组,和/或衍生自已知不适合所述至少一种药剂的施用的对象或对象组。
在这种情况下,优选诊断算法如下:
如果至少一种药剂是β阻断剂,并且如果至少一种生物标记物是内皮抑素、mimecan、GDF-15、心肌肌钙蛋白和/或BNP型肽,则优选应用下述:
优选地,参考量衍生自已知适合于所述至少一种药剂的施用的对象或对象组,其中与参考量(或多个参考量)相比较基本上相同或增加的测试样品中的生物标记物(或多种生物标记物)的量(或多个量)指示对象适合于所述至少一种药剂的施用,和/或参考量衍生自已知不适合所述至少一种药剂的施用的对象或对象组,其中与参考量(或多个参考量)相比较基本上相同或减少的测试样品中的生物标记物(或多种生物标记物)的量(或多个量)指示对象不适合所述至少一种药剂的施用。
如果药剂是β阻断剂,并且如果生物标记物是IGFBP7、P1NP、sFlt-1和/或骨桥蛋白,则优选应用下述:
优选地,关于IGFBP7、P1NP、sFlt-1和/或骨桥蛋白的参考量衍生自已知适合于所述β阻断剂的施用的对象或对象组,其中与参考量相比较基本上相同或减少的测试样品中的IGFBP7、P1NP、sFlt-1和/或骨桥蛋白的量指示对象适合于所述β阻断剂的施用,和/或参考量衍生自已知不适合于所述β阻断剂的施用的对象或对象组,其中与参考量相比较基本上相同或增加的测试样品中的IGFBP7、P1NP、sFlt-1和/或骨桥蛋白的量指示对象不适合于所述β阻断剂的施用。
如果至少一种药剂是醛固酮拮抗剂,并且如果至少一种生物标记物是IGFBP7、胱抑素C、心肌肌钙蛋白、Gal-3、PlGF、GDF-15和/或sST2,则优选应用下述:
优选地,参考量衍生自已知适合于所述至少一种药剂的施用的对象或对象组,其中与参考量(或多个参考量)相比较基本上相同或增加的测试样品中的生物标记物(或多种生物标记物)的量(或多个量)指示对象适合于所述至少一种药剂的施用,和/或参考量衍生自已知不适合所述至少一种药剂的施用的对象或对象组,其中与参考量(或多个参考量)相比较基本上相同或减少的测试样品中的生物标记物(或多种生物标记物)的量(或多个量)指示对象不适合所述至少一种药剂的施用。
如果至少一种药剂是醛固酮拮抗剂,并且如果至少一种生物标记物是内皮抑素、尿酸和/或sFlt-1,则优选应用下述:
优选地,参考量衍生自已知适合于所述至少一种药剂(即醛固酮拮抗剂)的施用的对象或对象组,其中与参考量(或多个参考量)相比较基本上相同或减少的测试样品中的生物标记物(或多种生物标记物)的量(或多个量)指示对象适合于所述至少一种药剂的施用,和/或参考量衍生自已知不适合所述至少一种药剂的施用的对象或对象组,其中与参考量(或多个参考量)相比较基本上相同或增加的测试样品中的生物标记物(或多种生物标记物)的量(或多个量)指示对象不适合所述至少一种药剂的施用。
更优选地,待测试的对象已经用醛固酮拮抗剂进行治疗。在这种情况下,与参考量(或多个参考量)相比较增加的生物标记物(或多种生物标记物)的量(或多个量)指示对象不适合于所述药剂以更高剂量的施用,和/或与参考量(或多个参考量)相比较减少的生物标记物(或多种生物标记物)的量(或多个量)指示对象不适合于所述药剂以更高剂量的施用。
如果至少一种药剂是肾素-血管紧张素系统的抑制剂,并且如果至少一种生物标记物是GDF-15、心肌肌钙蛋白、尿酸、BNP型肽和/或骨桥蛋白,则优选应用下述:
优选地,关于一种或多种生物标记物的一个或多个参考量衍生自已知适合于所述肾素-血管紧张素系统抑制剂的施用的对象或对象组,其中与参考量相比较基本上相同和/或增加的测试样品中的两种生物标记物的量指示对象适合于所述肾素-血管紧张素系统抑制剂的施用,和/或参考量衍生自已知不适合于所述肾素-血管紧张素系统抑制剂的施用的对象或对象组,其中i)与心肌肌钙蛋白的参考量相比较基本上相同或减少的测试样品中的生物标记物心肌肌钙蛋白的量,或ii)其中与参考量相比较基本上相同和/或减少的测试样品中的两种生物标记物的量,指示对象不适合于所述肾素-血管紧张素系统抑制剂的施用。
如果至少一种药剂是利尿剂,并且至少一种生物标记物选自内皮抑素、mimecan、GDF-15、前白蛋白、转铁蛋白、BNP型肽和尿酸,则优选应用下述:
优选地,参考量衍生自已知适合于所述至少一种药剂(即利尿剂)的施用的对象或对象组,其中与参考量(或多个参考量)相比较基本上相同或减少的测试样品中的生物标记物(或多种生物标记物)的量(或多个量)指示对象适合于所述至少一种药剂的施用,和/或参考量衍生自已知不适合所述至少一种药剂的施用的对象或对象组,其中与参考量(或多个参考量)相比较基本上相同或增加的测试样品中的生物标记物(或多种生物标记物)的量(或多个量)指示对象不适合所述至少一种药剂的施用。
还优选地,参考量衍生自已知不适合所述至少一种药剂的施用的对象或对象组,其中与参考量(或多个参考量)相比较基本上相同或增加的测试样品中的生物标记物(或多种生物标记物)的量(或多个量)指示对象适合于以更低剂量的施用所述药剂。
更优选地,待测试的对象已经用利尿剂进行治疗。在这种情况下,与参考量(或多个参考量)相比较增加的生物标记物(或多种生物标记物)的量(或多个量)指示对象不适合于所述药剂以更高剂量的施用,和/或与参考量(或多个参考量)相比较减少的生物标记物(或多种生物标记物)的量(或多个量)指示对象不适合于所述药剂以更高剂量的施用。
如果至少一种药剂是肾素-血管紧张素系统的抑制剂,并且如果至少一种生物标记物是sFlt-1和/或IGFBP7,则应用下述:
优选地,参考量衍生自已知适合于所述肾素-血管紧张素系统抑制剂的施用的对象或对象组,其中与参考量相比较基本上相同或减少的测试样品中的sFlt-1和/或IGFBP7的量指示对象适合于所述肾素-血管紧张素系统抑制剂的施用,和/或参考量衍生自已知不适合于所述肾素-血管紧张素系统抑制剂的施用的对象或对象组,其中与参考量相比较基本上相同或增加的测试样品中的sFlt-1和/或IGFBP7的量指示对象不适合于所述肾素-血管紧张素系统抑制剂的施用。
在本发明的上下文中待应用的优选参考量是实施例中公开的那些。进一步的优选参考量如下:
• GDF-15:在约3000至约5000 ng/ml的范围内,特别是约4000 ng/ml
•内皮抑素:在约230至约270 ng/ml的范围内,特别是约250 ng/ml
• mimecan:在约30至约70 ng/ml的范围内,特别是约50 ng/ml
• IGFBP7:在约70至约130 ng/ml的范围内,特别是约100 ng/ml
• NT-proBNP:在约2500至约3500 pg/ml的范围内,特别是约3000 pg/ml
• Troponin:在约22至约30 ng/ml的范围内,特别是约26 ng/ml
•尿酸:在约5至约10 ng/ml的范围内,特别是约7.3 ng/ml
• Gal3 (Galectin-3):在约26至约38 ng/ml的范围内,特别是约31.6 ng/ml
•骨桥蛋白:在约80至约120 ng/ml的范围内,特别是约100 ng/ml
• sST2 (可溶性ST2):在约30至约38 ng/ml的范围内,特别是约34.0 ng/ml
• sFLT-1:在约85至约111 ng/ml的范围内,特别是约98 ng/ml
• PlGF:在约15至约31 ng/ml的范围内,特别是约20.7 ng/ml
• P1NP:在约29.0 ng/ml至约43.5 ng/ml的范围内,特别是约36.72 ng/ml
•胱抑素C:在约1.20 mg/l至约2.3mg/l的范围内,特别是约1.76 mg/l
•前白蛋白:在约0.11 g/l至约0.27 g/l的范围内,特别是约0.19 g/l
•转铁蛋白:在约2.15 g/l至约2.80 g/l的范围内,特别是约2.48 g/l。
如果计算PlGF与sFlt-1的比,则参考比特别在约0.17至约0.29的范围内。在一个实施方案中,参考比是0.23。
优选地,上述参考量(比)是使本文提及的这些组彼此分开的阈值量(比)。
如果在本发明的上下文中,测定超过一种生物标记物用于评价对象是否对于药剂施用敏感,则特别设想比较个别生物标记物的测定量与个别生物标记物的参考量。例如,生物标记物IGFBP7的量应与IGFBP7的参考量相比较,生物标记物mimecan的量应与mimecan的参考量相比较,生物标记物内皮抑素的量应与内皮抑素的参考量相比较,生物标记物sFlt-1的量应与sFlt-1的参考量相比较,等等。在这种情况下,诊断。此外,如果测定超过一种生物标记物,则优选组合如本文所述的个别生物标记物的诊断算法。
此外,本发明涉及用心力衰竭疗法的至少一种药剂治疗对象的方法,其包括:
a)如上文与本发明的方法结合所述,测定来自患有心力衰竭的对象的样品中的至少一种生物标记物的量,和
b)比较如步骤a)中测定的至少一种生物标记物的一个或多个量与一个或多个参考量,由此鉴定适合于所述至少一种药剂的施用的对象,
c)将对象鉴定为适合于至少一种药剂的施用,
d)给所述对象施用所述至少一种药剂。
药剂在上文公开。施用可以是所述至少一种药剂的施用起始,或所述至少一种药剂以更高剂量的施用。
步骤c)基于比较步骤b)的结果。诊断算法在本文其他地方公开。
在本发明基础的研究的背景下显示,通过使用单一生物标记物,能够作出关于几个药剂类别施用的决定。因此,通过本发明的方法设想特别是通过使用单一标记物,评价对象是否适合于超过一种药剂的施用。
因此,在本发明的方法的一个优选实施方案中,鉴定适合于超过一种药剂的施用,特别是两种或三种药剂的施用的对象。优选组合如下:
如果生物标记物是GDF-5,则药剂优选为:
i. β阻断剂和肾素-血管紧张素系统的抑制剂,
ii. β阻断剂和利尿剂,
iii. 肾素-血管紧张素系统的抑制剂和利尿剂,或
iv. β阻断剂、肾素-血管紧张素系统的抑制剂和利尿剂。
如果生物标记物是IGFBP7,则药剂优选为:β阻断剂和醛固酮拮抗剂。此外,药剂优选为:β阻断剂、醛固酮拮抗剂和利尿剂。进一步地,设想药剂是β阻断剂、醛固酮拮抗剂、利尿剂和肾素-血管紧张素系统的抑制剂。
如果生物标记物是mimecan,则药剂优选为:β阻断剂和利尿剂。
如果生物标记物是内皮抑素,则药剂优选为:
i. β阻断剂和醛固酮拮抗剂,
ii. β阻断剂和利尿剂,
iii. 醛固酮拮抗剂和利尿剂,或
iv. β阻断剂、醛固酮拮抗剂和利尿剂。
如果生物标记物是心肌肌钙蛋白,则药剂优选为:
i. β阻断剂和醛固酮拮抗剂,
ii. β阻断剂和肾素-血管紧张素系统的抑制剂,
iii. 醛固酮拮抗剂和肾素-血管紧张素系统的抑制剂,或
iv. β阻断剂、醛固酮拮抗剂和肾素-血管紧张素系统的抑制剂。
如果生物标记物是尿酸,则药剂优选为:
i. 利尿剂和醛固酮拮抗剂,
ii. 利尿剂和肾素-血管紧张素系统的抑制剂,
iii. 醛固酮拮抗剂和肾素-血管紧张素系统的抑制剂,或
iv. 利尿剂、醛固酮拮抗剂和肾素-血管紧张素系统的抑制剂。
相应地,本发明涉及用于鉴定适合于两种或三种药剂的施用的对象的方法,其包括:
a)测定来自患有心力衰竭的对象的样品中的GDF-15 (生长分化因子15)的量,和
b)比较如步骤a)中测定的量与参考量,由此鉴定适合于所述药剂的施用的对象,
其中所述两种或三种药剂是:
i. β阻断剂和肾素-血管紧张素系统的抑制剂,
ii. β阻断剂和利尿剂,
iii. 肾素-血管紧张素系统的抑制剂和利尿剂,或
iv. β阻断剂、肾素-血管紧张素系统的抑制剂和利尿剂。
进一步地,本发明涉及用于鉴定适合于两种药剂的施用的对象的方法,其包括:
a)测定来自患有心力衰竭的对象的样品中的IGFBP7的量,和
b)比较如步骤a)中测定的量与参考量(或多个参考量),由此鉴定适合于所述药剂的施用的对象,
其中所述两种药剂是β阻断剂和醛固酮拮抗剂。
另外,本发明涉及用于鉴定适合于两种药剂的施用的对象的方法,其包括:
a)测定来自患有心力衰竭的对象的样品中的mimecan的量,和
b)比较如步骤a)中测定的量与参考量(或多个参考量),由此鉴定适合于所述药剂的施用的对象,
其中所述两种药剂是β阻断剂和利尿剂。
相应地,本发明涉及用于鉴定适合于两种或三种药剂的施用的对象的方法,其包括:
a)测定来自患有心力衰竭的对象的样品中的心肌肌钙蛋白的量,和
b)比较如步骤a)中测定的量与参考量(或多个参考量),由此鉴定适合于所述药剂的施用的对象,
其中所述两种或三种药剂是:
i. β阻断剂和醛固酮拮抗剂,
ii. β阻断剂和肾素-血管紧张素系统的抑制剂,
iii. 醛固酮拮抗剂和肾素-血管紧张素系统的抑制剂,或
iv. β阻断剂、醛固酮拮抗剂和肾素-血管紧张素系统的抑制剂。
相应地,本发明涉及用于鉴定适合于两种或三种药剂的施用的对象的方法,其包括:
a)测定来自患有心力衰竭的对象的样品中的内皮抑素的量,和
b)比较如步骤a)中测定的量与参考量(或多个参考量),由此鉴定适合于所述药剂的施用的对象,
其中所述两种或三种药剂是:
i. β阻断剂和醛固酮拮抗剂,
ii. β阻断剂和利尿剂,
iii. 醛固酮拮抗剂和利尿剂,或
iv. β阻断剂、醛固酮拮抗剂和利尿剂。
如果应基于单一生物标记物的量的测定,鉴定对于两种或三种药剂的施用敏感的对象,则下述应就参考量而言应用:
优选地,步骤b)中所述的关于多种药剂的参考量可以对于各自标记物相同。相应地,如本发明的方法的步骤a)中测定的生物标记物的量优选与单一参考量相比较,并且因此关于个别标记物的参考量允许评价对象适合于所述两种或三种药剂的施用(即参考量应用于所有药剂。还优选地,就多种药剂而言的关于个别生物标记物的参考量可以不同,即它可以是药剂特异性的。相应地,如本发明的方法的步骤a)中测定的生物标记物的量优选与两个或三个参考量相比较。因此,如果应鉴定适合于两种药剂的施用的对象,则生物标记物的量应与两个参考量相比较。另外,如果鉴定适合于三种药剂的施用的对象,则生物标记物的量应与三个参考量相比较。个别参考量应是药剂特异性的。相应地,可以应用关于多种药剂(就单一标记物而言)的个别参考量。例如,如果应鉴定对于β阻断剂和醛固酮拮抗剂施用敏感的对象,则步骤a)中测定的生物标记物的量应与i)所述生物标记物的参考量相比较,用于鉴定适合于β阻断剂的施用的对象,和ii)所述生物标记物的参考量相比较,用于鉴定适合于醛固酮拮抗剂的施用的对象(如果生物标记物是IGFBP7,则应用这点)。例如,如果应鉴定对于β阻断剂和利尿剂施用敏感的对象,则步骤a)中测定的生物标记物的量应与i)所述生物标记物的参考量相比较,用于鉴定适合于β阻断剂的施用的对象,和ii)所述生物标记物的参考量相比较,用于鉴定适合于利尿剂的施用的对象(如果生物标记物是mimecan,则应用这点)。
与个别药剂组合的个别生物标记物的诊断算法已在本文其他地方阐述。此外,上文描述了优选参考量。如果应基于单一生物标记物的量的测定,鉴定对于两种或更多种药剂的施用敏感的对象,则优选还应用诊断算法以及优选参考量。如果应鉴定适合于两种或更多种药剂的施用的对象,则组合本文上文关于与药剂组合的各自生物标记物阐述的诊断算法。
例如,就生物标记物IGFBP7而言,应用下述:
优选地,与参考量(特别是用于鉴定适合于β阻断剂的施用的对象的参考量)相比较减少的测试样品中的生物标记物的量指示对象适合于所述β阻断剂的施用,和/或与所述参考量相比较增加的生物标记物的量指示对象不适合于所述β阻断剂的施用,而与参考量(特别是用于鉴定适合于醛固酮拮抗剂的施用的对象的参考量)相比较增加的测试样品中的生物标记物的量指示对象适合于所述醛固酮拮抗剂的施用,和/或与所述参考量相比较减少的生物标记物的量指示对象不适合于所述醛固酮拮抗剂的施用。
可替代地,就生物标记物IGPBP7而言用于鉴定适合于β阻断剂的施用的对象的参考量衍生自已知适合于所述β阻断剂的施用的对象或对象组,其中与参考量相比较基本上相同或减少的测试样品中的IGFBP7的量指示对象适合于所述β阻断剂的施用,和/或用于鉴定适合于β阻断剂的施用的对象的参考量衍生自已知不适合于所述β阻断剂的施用的对象或对象组,其中与参考量相比较基本上相同或增加的测试样品中的IGFBP7的量指示对象不适合于所述β阻断剂的施用,而用于鉴定适合于醛固酮拮抗剂的施用的对象的IGPBP7的参考量衍生自已知适合于所述醛固酮拮抗剂的施用的对象或对象组,其中与参考量相比较基本上相同或增加的测试样品中的IGFBP7的量指示对象适合于所述醛固酮拮抗剂的施用,和/或用于鉴定适合于醛固酮拮抗剂的施用的对象的IGFBP7的参考量衍生自已知不适合于所述醛固酮拮抗剂施用的对象或对象组,其中与参考量相比较基本上相同或减少的测试样品中的IGFBP7的量指示对象不适合于所述醛固酮拮抗剂的施用。
在本发明的一个方面,考虑了用于建立用于鉴定适合于选自下述的至少一种药剂的施用的对象的帮助的方法:β阻断剂、醛固酮拮抗剂、利尿剂和肾素-血管紧张素系统的抑制剂,所述方法包括:
a)通过(i) 使样品与特异性结合所述至少一种标记物的检测试剂(多种检测试剂)接触一定时间,所述时间足以允许形成所述检测试剂和来自样品的至少一种标记物的复合物,(ii)测量所形成复合物的量,其中所形成复合物的所述量与样品中存在的至少一种标记物的量成比例,和(iii)将所形成复合物的量转化成反映样品中存在的至少一种标记物的量的至少一种标记物的量,来测定选自下述的至少一种标记物的量:GDF-15 (生长分化因子15)、内皮抑素、mimecan、IGFBP7 (IGF结合蛋白7)、心肌肌钙蛋白、BNP型肽、尿酸、Gal-3 (半乳糖凝集素-3)、骨桥蛋白、sST2 (可溶性ST2)、sFlt-1、PlGF、P1NP、胱抑素C、前白蛋白和转铁蛋白;
b)比较所述量与参考;和
c)基于步骤b)中作出的比较结果,建立用于鉴定适合于所述至少一种药剂的施用的对象的帮助。
在本发明的另一个方面,考虑了用于建立用于鉴定适合于选自下述的至少一种药剂的施用的对象的帮助的系统:β阻断剂、醛固酮拮抗剂、利尿剂和肾素-血管紧张素系统的抑制剂,所述系统包括:
a)分析仪单元,其配置为使样品与特异性结合选自下述的所述至少一种标记物的检测试剂(多种检测试剂)接触一定时间:GDF-15 (生长分化因子15)、内皮抑素、mimecan、IGFBP7 (IGF结合蛋白7)、心肌肌钙蛋白、BNP型肽、尿酸、Gal-3 (半乳糖凝集素-3)、骨桥蛋白、sST2 (可溶性ST2)、sFlt-1、PlGF、P1NP、胱抑素C、前白蛋白和转铁蛋白,所述时间足以允许形成所述检测试剂和来自样品的至少一种标记物的复合物,
b)分析仪单元,其配置为测量所形成复合物的量,其中所形成复合物的所述量与样品中存在的至少一种标记物的量成比例,
c)具有处理器且与所述分析单元可操作地通讯的计算装置,和
d)包括可由处理器执行的多个指令的非瞬态计算机可读介质,当执行时,所述指令将所形成复合物的量转化成反映样品中存在的至少一种标记物的量的至少一种标记物的量,比较所述量与参考量,并且基于与所述参考的所述比较结果,建立用于鉴定适合于所述至少一种药剂的施用的对象的帮助。
在一个方面,合适的检测试剂可以是特异性结合在待通过本发明方法研究的对象的样品中的至少一种标记物的抗体,即结合GDF-15 (生长分化因子15)、内皮抑素、mimecan、IGFBP7 (IGF结合蛋白7)、心肌肌钙蛋白、BNP型肽、尿酸、Gal-3 (半乳糖凝集素-3)、骨桥蛋白、sST2 (可溶性ST2)、sFlt-1、PlGF、P1NP、胱抑素C、前白蛋白和转铁蛋白的检测试剂。在一个方面,可以应用的另一种检测试剂可以是特异性结合样品中的至少一种标记物的适体。在再一个方面,在测量所形成复合物的量之前,从检测试剂和至少一种标记物之间形成的复合物中去除样品。相应地,在一个方面,检测试剂可以固定到固体载体上。在再一个方面,通过应用洗涤溶液,可以从固体载体上所形成的复合物中去除样品。所形成的复合物应与样品中存在的至少一种标记物的量成比例。应当理解待应用的检测试剂的特异性和/或灵敏度限定样品中包含的能够特异性结合的至少一种标记物的比例程度。关于测定可以如何进行的进一步细节也在本文其他地方发现。所形成复合物的量应转化成反映样品中实际存在的量的至少一种标记物的量。在一个方面,此类量可以基本上是样品中存在的量,或在另一个方面,可以是由于所形成复合物和原始样品中存在的量之间的关系,其一定比例的量。
在上述方法的再一个方面,步骤a)可以通过分析仪单元进行,在一个方面,分析仪单元如本文其他地方限定。
在本发明方法的一个方面,步骤a)中测定的一个或多个量与参考量相比较。在一个方面,参考是如本文其他地方限定的参考。在另外一个方面,参考考虑测量的复合物量和原始样品中存在的量之间的比例关系。因此,在本发明方法的一个方面,应用的参考是用于反映已使用的检测试剂的限制的人工参考。在另一个方面,在实际上比较测定量和参考的值之前,例如通过包括测定量的标准化和/或校正计算步骤,在进行比较时还可以考虑所述关系。再次,测定量的标准化和/或校正计算步骤采用比较步骤,从而使得适当反映已使用的检测试剂的限制。在一个方面,比较例如通过计算机系统等等的帮助自动进行。
如本文其他地方描述的,通过将对象分配到适合于施用或不适合于所述施用的对象组内,基于步骤b)中进行的比较来建立用于鉴定适合于所述至少一种药剂的施用的对象的帮助。如本文其他地方已讨论的,研究对象的分配无需在100%的研究病例中是正确的。此外,研究对象分配到其内的对象组是人工组,因为它们基于统计考虑即本发明的方法应基于其操作的一定预选择可能性程度而建立。在本发明的一个方面,用于鉴定适合于所述至少一种药剂的施用的对象的帮助通过计算装置等等的帮助自动建立,如本文描述且公开的。
在本发明方法的一个方面,所述方法进一步包括根据如本文其他地方详细阐述的步骤c)中建立的结果,推荐和/或管理对象,和/或适应疾病监控的强度的步骤。
在上述方法的一个方面,步骤b)和/或c)通过如本文其他地方阐述的一个或多个分析仪单元进行。
本发明还涉及在患有心力衰竭的对象的样品中,i)选自GDF-15 (生长分化因子15)、内皮抑素、mimecan、IGFBP7 (IGF结合蛋白7)、心肌肌钙蛋白、BNP型肽、尿酸、Gal-3 (半乳糖凝集素-3)、骨桥蛋白、sST2 (可溶性ST2)、sFlt-1、PlGF、P1NP、胱抑素C、前白蛋白和转铁蛋白的至少一种生物标记物,或ii)和/或特异性结合选自GDF-15 (生长分化因子15)、内皮抑素、mimecan、IGFBP7 (IGF结合蛋白7)、心肌肌钙蛋白、BNP型肽、尿酸、Gal-3 (半乳糖凝集素-3)、骨桥蛋白、sST2 (可溶性ST2)、sFlt-1、PlGF、P1NP、胱抑素C、前白蛋白和转铁蛋白的生物标记物的检测试剂,用于鉴定适合于选自下述的至少一种药剂的施用的对象的用途:β阻断剂、醛固酮拮抗剂、利尿剂和肾素-血管紧张素系统的抑制剂。
本发明还涉及i)选自GDF-15 (生长分化因子15)、内皮抑素、mimecan、IGFBP7 (IGF结合蛋白7)、心肌肌钙蛋白、BNP型肽、尿酸、Gal-3 (半乳糖凝集素-3)、骨桥蛋白、sST2 (可溶性ST2)、sFlt-1、PlGF、P1NP、胱抑素C、前白蛋白和转铁蛋白的至少一种生物标记物,或ii)和/或特异性结合选自GDF-15 (生长分化因子15)、内皮抑素、mimecan、IGFBP7 (IGF结合蛋白7)、心肌肌钙蛋白、BNP型肽、尿酸、Gal-3 (半乳糖凝集素-3)、骨桥蛋白、sST2 (可溶性ST2)、sFlt-1、PlGF、P1NP、胱抑素C、前白蛋白和转铁蛋白的生物标记物的检测试剂,用于制造用于鉴定适合于选自下述的至少一种药剂的施用的对象的药物或诊断组合物的用途:β阻断剂、醛固酮拮抗剂、利尿剂和肾素-血管紧张素系统的抑制剂。
进一步地,本发明涉及选自GDF-15 (生长分化因子15)、内皮抑素、mimecan、IGFBP7 (IGF结合蛋白7)、心肌肌钙蛋白、BNP型肽、尿酸、Gal-3 (半乳糖凝集素-3)、骨桥蛋白、sST2 (可溶性ST2)、sFlt-1、PlGF、P1NP、胱抑素C、前白蛋白和转铁蛋白的至少一种生物标记物,或ii)和/或特异性结合选自GDF-15 (生长分化因子15)、内皮抑素、mimecan、IGFBP7 (IGF结合蛋白7)、心肌肌钙蛋白、BNP型肽、尿酸、Gal-3 (半乳糖凝集素-3)、骨桥蛋白、sST2 (可溶性ST2)、sFlt-1、PlGF、P1NP、胱抑素C、前白蛋白和转铁蛋白的生物标记物的检测试剂,用于鉴定适合于选自下述的至少一种药剂的施用的对象:β阻断剂、醛固酮拮抗剂、利尿剂和肾素-血管紧张素系统的抑制剂。所述至少一种生物标记物或所述至少一种检测试剂可以由试剂盒包含。
如本文使用的,术语“检测试剂”指能够特异性识别且结合样品中存在的一种或多种生物标记物多肽的试剂。此外,所述试剂应允许直接或间接检测由所述试剂和生物标记物形成的复合物。直接检测可以通过将可检测标记包括到试剂内来实现。间接标记可以通过进一步试剂来实现,所述进一步试剂特异性结合包含生物标记物和检测试剂的复合物,其中所述进一步试剂随后能够生成可检测信号。可以用作检测试剂的合适化合物是本领域众所周知的。优选地,检测试剂是特异性结合生物标记物的抗体或适体。术语“抗体”已在本文其他地方描述。
根据本发明的优选实施方案,提供了适合进行本发明方法的装置,其包括:
a)包含特异性结合选自下述的检测试剂(或多种试剂)的分析仪单元:GDF-15 (生长分化因子15)、内皮抑素、mimecan、IGFBP7 (IGF结合蛋白7)、心肌肌钙蛋白、BNP型肽、尿酸、Gal-3 (半乳糖凝集素-3)、骨桥蛋白、sST2 (可溶性ST2)、sFlt-1、PlGF、P1NP、胱抑素C、前白蛋白和转铁蛋白,所述单元适合测定来自患有心力衰竭的对象的样品中的一种或多种标记物的一个或多个量;和
b)用于比较一个或多个测定量与一个或多个参考量的分析仪单元,由此鉴定适合于选自下述的至少一种药剂的施用的对象:β阻断剂、醛固酮拮抗剂、利尿剂和肾素-血管紧张素系统的抑制剂,所述单元包括具有参考量(或多个量)的数据库和进行比较的计算机实现的算法。
优选参考量和算法在本文其他地方公开。
本公开内容的优选实施方案包括用于鉴定适合于选自下述的至少一种药剂的施用的对象的系统:β阻断剂、醛固酮拮抗剂、利尿剂和肾素-血管紧张素系统的抑制剂。系统的实例包括用于检测化学或生物反应结果或者监控化学或生物反应进展的临床化学分析仪、凝血化学分析仪、免疫化学分析仪、尿分析仪、核酸分析仪。更具体而言,本公开内容的示例性系统可以包括Roche ElecsysTM系统和Cobas® e免疫测定分析仪、Abbott ArchitectTM和AxsymTM分析仪、Siemens CentaurTM和ImmuliteTM分析仪、以及Beckman Coulter UniCelTM和AcessTM分析仪等等。
系统的实施方案可以包括用于实践本公开内容的一个或多个分析仪单元。本文公开的系统的分析仪单元通过如已知的有线连接、蓝牙、LANS或无线信号中的任一种,与本文公开的计算装置可操作地通讯。另外,根据本公开内容,分析仪单元可以包括独立仪器,或在更大仪器内的模块,其执行检测,例如用于诊断目的的样品定性和/或定量评价之一或两者。例如,分析仪单元可以执行或帮助样品和/或试剂的吸取、给药、混合。分析仪单元可以包括用于容纳执行测定的试剂的试剂容纳单元。试剂可以例如以含有个别试剂或试剂组的容器或药液筒的形式排列,置于适当容器或者贮存区室或传送带内的位置中。检测试剂还可以采用在固体载体上的固定形式,所述固体载体与样品接触。进一步地,分析仪单元可以包括对于特异性分析优化的过程和/或检测部件。
根据一些实施方案,分析仪单元可以配置用于样品内的分析物例如标记物的光学检测。配置用于光学检测的示例性分析仪单元包括配置用于将电磁能转换成电信号的装置,所述装置包括单和多元件或阵列光检测器两者。根据本公开内容,光检测器能够监控光学电磁信号,且相对于指示位于光程中的样品中的分析物存在和/或浓度的基线信号,提供电源插座信号或应答信号。此类装置还可以包括例如光电二极管,包括雪崩光电二极管、光电晶体管、光电导检测器、线性传感器阵列、CCD检测器、检测器CMOS包括CMOS阵列检测器、光电倍增管和光电倍增阵列。根据某些实施方案,光检测器例如光电二极管或光电倍增管可以含有另外的信号条件化或加工电子器件。例如,光检测器可以包括至少一个前置放大器、电子滤波器或集成电路。合适的前置放大器包括例如集成、跨阻抗和电流增益(电流镜)前置放大器。
另外,根据本公开内容的一个或多个分析仪单元可以包括用于发光的光源。例如,分析仪单元的光源可以由至少一个发光元件(例如发光二极管,电动辐射源例如白炽灯、电致发光灯、气体放电灯、高强度放电灯、激光)组成,用于测量待测试样品的分析物浓度或允许能量转移(例如,通过荧光共振能量转移或催化酶)。
进一步地,系统的分析仪单元可以包括一个或多个温育单元(例如用于使样品或试剂维持在指定温度或温度范围下)。在一些实施方案中,分析仪单元可以包括热循环仪,包括实时热循环仪,用于对样品实施重复温度循环且监控样品内的扩增产物量中的变化。
另外,本文公开的系统的分析仪单元可以包括或可操作地连接至反应器皿或小杯进料单元。示例性进料单元包括液体加工单元,例如吸取单元,以将样品和/或试剂递送至反应器皿。吸取单元可以包括可重复使用的可洗涤的针例如钢针,或一次性使用的吸管尖端。分析仪单元可以进一步包括一个或多个混合单元,例如振荡器以振荡包含液体的小杯,或混合浆以混合小杯或试剂容器中的液体。
遵循上文,根据本公开内容的一些实施方案、本文公开且描述的方法的一些步骤的部分,可以通过计算装置执行。计算装置可以是例如通用计算机或便携式计算装置。还应理解多重计算装置可以例如经过网络或其他转移数据的方法一起使用,用于执行本文公开的方法的一个或多个步骤。示例性计算装置包括台式计算机、膝上型计算机、个人数据助理(“PDA”)例如BLACKBERRY品牌装置、蜂窝装置、平板电脑、服务器等等。一般而言,计算装置包括能够执行多个指令(例如软件程序)的处理器。
计算装置有权访问存储器。存储器是计算机可读介质,并且可以包括例如局部位于计算装置内或跨越网络对计算装置可访问的单一贮存装置或多个贮存装置。计算机可读介质可以是可以通过计算装置访问的任何可用介质,并且包括易失性和非易失性介质两者。进一步地,计算机可读介质可以是可移动和不可移动介质之一或两者。例如且非限制性地,计算机可读介质可以包含计算机贮存介质。示例性计算机贮存介质包括但不限于RAM、ROM、EEPROM、闪速存储器或任何其他存储技术、CD-ROM、数字通用盘(DVD)或其他光盘贮存、磁带盒、磁带、磁盘贮存或其他磁贮存装置、或可以用于贮存能够由计算装置访问且由计算装置的处理器执行的多个指令的任何其他介质。
根据本公开内容的实施方案,软件可以包括指令,当通过计算装置的处理器执行时,所述指令可以执行本文公开的方法的一个或多个步骤。一些指令可以适合产生控制其他机器的操作的信号,并且因此可以通过这些控制信号操作以转化远离计算机自身去除的材料。这些描述和表示是由数据加工领域技术人员使用的手段,例如以最有效地将其工作物质输送给本领域技术人员。
多个指令还可以包含一般设想为导致所需结果的自相容步骤顺序的算法。这些步骤是需要物理数量的物理操作的那些。通常,尽管不一定,但这些数量采取能够贮存、转移、转化、组合、比较且以其他方式操作的电或磁脉冲或信号的形式。原则上出于常见用法的原因,将这些信号称为值、字符、展示数据、数目等等作为其中此类信号体现或表达的物理项目或表现的提及,有时证明是方便的。然而,应记住所有这些和相似术语与适当的物理数量关联,并且此处仅用作应用于这些数量的方便标记。根据本公开内容的一些实施方案,进行本文公开的一种或多种标记物的测定量和合适参考之间的比较的算法通过执行指令得到体现且执行。结果可以作为参数诊断原始数据的输出或者作为绝对量或相对量给出。根据本文公开的系统的多个实施方案,“诊断”可以基于所计算“量”与参考或阈值的所述比较,通过本文公开的系统的计算装置提供。例如,系统的计算装置可以提供以词、符号或数值形式的指示符,所述指示符是特定诊断的指示。
计算装置还可以访问输出装置。示例性输出装置包括例如传真机、显示器、打印机和文件。根据本公开内容的一些实施方案,计算装置可以执行本文公开的方法的一个或多个步骤,并且其后经由输出装置提供关于方法的结果、指示、比例或其他因素的输出。
最后,本发明涉及适合进行本发明的方法的试剂盒,其包含特异性结合选自GDF-15 (生长分化因子15)、内皮抑素、mimecan、IGFBP7 (IGF结合蛋白7)、心肌肌钙蛋白、BNP型肽、尿酸、Gal-3 (半乳糖凝集素-3)、骨桥蛋白、sST2 (可溶性ST2)、sFlt-1、PlGF、P1NP、胱抑素C、前白蛋白和转铁蛋白的标记物的至少一种检测试剂,参考标准以及进行所述方法的说明书。
如本文使用的,术语“试剂盒”指优选分开地或在单一容器内提供的上述组分的集合。容器还包含进行本发明的方法的说明书。这些说明书可以采取手册的形式或可以通过计算机程序代码提供,当在计算机或数据加工装置上实现时,所述计算机程序代码能够进行本发明方法中提及的比较且相应地建立诊断。计算机程序代码可以在数据贮存介质或装置例如光贮存介质(例如光盘)上,或者直接在计算机或数据加工装置上提供。进一步地,试剂盒应包含用于如本文上文定义的参考的至少一种标准,即具有代表参考量的如本文提及生物标记物的预定量的溶液。
在一些实施方案中,本文公开的试剂盒包括用于实践所公开方法的至少一种组分或组分的包装组合。“包装组合”意指试剂盒提供含有一种或多种组分的组合的单一包装,所述一种或多种组分例如探针(例如抗体)、对照、缓冲剂、试剂(例如缀合物和/或底物)、说明书等等,如本文公开的。含有单一容器的试剂盒也包括在“包装组合”的定义内。在一些实施方案中,试剂盒包括至少一种探针,例如抗体(对于如本文公开的生物标记物的表位具有特异性亲和力。例如,试剂盒可以包括用荧光团标记的抗体或其为融合蛋白的成员的抗体。在试剂盒中,探针可以是固定的,并且可以以特异性构象固定。例如,固定的探针可以在试剂盒中提供,以特异性结合靶蛋白,以检测样品中的靶蛋白,和/或从样品中去除靶蛋白。
根据一些实施方案,试剂盒包括在至少一个容器中的至少一种探针,其可以是固定的。试剂盒还可以包括任选固定在一个或多个容器中的多重探针。例如,多重探针可以存在于单一容器或分开容器中,例如其中每个容器含有单一探针。
在一些实施方案中,试剂盒可以包括一种或多种非固定的探针,以及包括或不包括固定探针的一种或多种固体载体。一些此类实施方案可以包含将一种或多种探针固定至固体载体所需的一些或全部试剂和供应品,或者固定探针与样品内的特异性蛋白质结合所需的一些或全部试剂和供应品。
在某些实施方案中,单一探针(包括相同探针的多个拷贝)可以固定到单一固体载体上,并且在单一容器中提供。在其他实施方案中,各自对于不同靶蛋白或单一靶蛋白的不同形式(例如特异性表位)特异性的两种或更多种探针,在单一容器中提供。在一些此类实施方案中,固定探针可以在多个不同容器中提供(例如以单次使用的形式),或多重固定探针可以在多个不同容器中提供。在进一步实施方案中,探针可以固定到多重不同类型的固体载体上。对于本文公开的试剂盒考虑了一种或多种固定探针和一个或多个容器的任何组合,并且可以选择其任何组合以实现用于所需用途的合适试剂盒。
试剂盒的容器可以是适合于包装和/或含有本文公开的一种或多种组分的任何容器,所述一种或多种组分包括例如探针(例如抗体)、对照、缓冲剂和试剂(例如缀合物和/或底物)。合适材料包括但不限于玻璃、塑料、纸板或其他纸制品、木材、金属及其任何合金。在一些实施方案中,容器可以完全包围一种或多种固定探针,或可以简单地覆盖探针,以使通过灰尘、油等的污染和对光的暴露降到最低。在一些进一步实施方案中,试剂盒可以包括单一容器或多个容器,并且当存在多个容器时,每个容器可以与所有其他容器相同,彼此不同,或与一些而不是所有其他容器不同。
本发明的优选实施方案
在下文中公开了本发明的优选实施方案。本文其他地方给出的定义和说明作必要的修改应用。
1. 一种用于鉴定适合于至少一种药剂的施用的对象的方法,其包括:
a) 测定来自患有心力衰竭的对象的样品中的至少一种生物标记物的量,和
b) 比较如步骤a)中测定的量与参考量,由此鉴定适合于所述至少一种药剂的施用的对象,
其中所述药剂是β阻断剂,并且其中所述生物标记物是IGFBP7 (IGF结合蛋白7)或mimecan。
2. 一种用于鉴定适合于选自β阻断剂、醛固酮拮抗剂、利尿剂和肾素-血管紧张素系统抑制剂的至少一种药剂的施用的对象的方法,其包括:
a)测定来自患有心力衰竭的对象的样品中选自下述的至少一种生物标记物的量:GDF-15 (生长分化因子15)、内皮抑素、mimecan、IGFBP7 (IGF结合蛋白7)、心肌肌钙蛋白、BNP型肽、尿酸、Gal-3 (半乳糖凝集素-3)、骨桥蛋白、PlGF、sFlt-1、sST2 (可溶性ST2)、P1NP、胱抑素C、前白蛋白和转铁蛋白,和
b)比较如步骤a)中测定的量与参考量(多个参考量),由此鉴定适合于所述至少一种药剂的施用的对象,
特别地,其中
i)所述生物标记物是骨桥蛋白,并且所述药剂是肾素-血管紧张素系统的抑制剂,
ii)所述生物标记物是内皮抑素,并且所述药剂是醛固酮拮抗剂,
iii)所述生物标记物是s-Flt-1,并且所述药剂是醛固酮拮抗剂和/或肾素-血管紧张素系统的抑制剂,
iv)所述生物标记物是PlGF,并且所述药剂是醛固酮拮抗剂,
v)所述生物标记物是心肌肌钙蛋白,并且所述药剂是肾素-血管紧张素系统的抑制剂,
vi)所述生物标记物是BNP型肽,并且所述药剂是肾素-血管紧张素系统的抑制剂和/或β阻断剂,
vii)所述生物标记物是尿酸,并且所述药剂是利尿剂和/或肾素-血管紧张素系统的抑制剂,
viii)所述生物标记物是GDF-15,并且所述药剂是利尿剂和/或肾素-血管紧张素系统的抑制剂,
ix)所述生物标记物是sST2,并且所述药剂是醛固酮拮抗剂和/或β阻断剂,
x)所述生物标记物是IGFBP7,并且所述药剂是肾素-血管紧张素系统的抑制剂,
xi)所述生物标记物是P1NP,并且所述药剂是β阻断剂,
xii)所述生物标记物是胱抑素C,并且所述药剂是醛固酮拮抗剂,
xiii)所述生物标记物是前白蛋白,并且所述药剂是利尿剂,
xiv)所述生物标记物是转铁蛋白,并且所述药剂是利尿剂,和/或
xv)所述生物标记物是PlGF和sFlt-1,并且所述药剂是醛固酮拮抗剂,其中计算PlGF量与sFlt-1量的比(或反之亦然),并且其中所述比用参考比进行计算。
3. 实施方案1或2的方法,其中所述施用是起始所述至少一种药剂的施用,或以更高剂量的施用所述至少一种药剂。
4. 实施方案1-3中任一项的方法,其中所述对象是人。
5. 实施方案1-4中任一项的方法,其中所述样品是血液、血清或血浆。
6. 实施方案1-5中任一项的方法,其中
•所述生物标记物是IGFBP7、P1NP、sFlt-1和/或骨桥蛋白,并且所述药剂是β阻断剂,
•所述生物标记物是内皮抑素和/或sFlt-1,并且所述药剂是醛固酮拮抗剂,
•所述生物标记物是尿酸和/或GDF-15,并且所述药剂是利尿剂,
•其中所述生物标记物是sFlt-1和/或IGFBP7,并且所述药剂是肾素-血管紧张素系统的抑制剂,
其中与所述参考量相比较减少的至少一种生物标记物的量指示对象适合于所述至少一种药剂的施用,和/或其中与所述参考量相比较增加的至少一种生物标记物的量指示对象不适合所述至少一种药剂的施用。
7. 实施方案1-6中任一项的方法,其中
•所述生物标记物是mimecan、BNP型肽和/或sST2,并且所述药剂是β阻断剂、
•所述生物标记物是骨桥蛋白、心肌肌钙蛋白、BNP型肽、尿酸和/或GDF-15,并且所述药剂是肾素-血管紧张素系统的抑制剂,和/或
•所述生物标记物是sST2、胱抑素C和/或PlGF,并且所述药剂是醛固酮拮抗剂,
其中与所述参考量相比较增加的至少一种生物标记物的量指示对象适合于所述至少一种药剂的施用,和/或其中与所述参考量相比较减少的至少一种生物标记物的量指示对象不适合所述至少一种药剂的施用。
8. 实施方案1-7中任一项的方法,其中所述生物标记物是IGFBP-7,并且该方法用于鉴定适合于β阻断剂和醛固酮拮抗剂的施用的对象。
9. 实施方案8的方法,其中如步骤a)中测定的所述IGFPB7量在步骤中与i)单一参考量,或ii) IGFBP7的参考量相比较,用于鉴定适合于β阻断剂的施用的对象,和IGFBP7的参考量相比较,用于鉴定适合于醛固酮拮抗剂的施用的对象。
10. 实施方案8和9的方法,其中
与所述参考量相比较减少的所述测试样品中的所述生物标记物的量指示对象适合于所述β阻断剂的施用,和/或与所述参考量相比较增加的所述生物标记物的量指示对象不适合于所述β阻断剂的施用,
和
与所述参考量相比较增加的所述测试样品中的所述生物标记物的量指示对象适合于所述醛固酮拮抗剂的施用,和/或与所述参考量相比较减少的所述生物标记物的量指示对象不适合于所述醛固酮拮抗剂的施用。
11. 实施方案1-10中任一项的方法,其中所述对象患有根据ACC/AHA分类的心力衰竭阶段B、C或D。
12. 实施方案2的方法,其中(i)所述至少一种药剂是醛固酮拮抗剂,并且其中所述至少一种生物标记物选自GDF-15、IGFBP7、心肌肌钙蛋白、尿酸、PlGF、sST2和Gal-3,或(ii)其中所述至少一种药剂是β阻断剂,并且其中所述至少一种生物标记物是选自内皮抑素、mimecan、心肌肌钙蛋白、BNP型肽和sST2的至少一种生物标记物,或(iii)其中所述至少一种药剂是肾素-血管紧张素系统的抑制剂,并且其中所述至少一种生物标记物选自心肌肌钙蛋白、BNP型肽、骨桥蛋白和/或尿酸。
13. 实施方案12的方法,其中与所述参考量相比较增加的至少一种生物标记物的量指示适合于所述至少一种药剂的施用的对象,和/或其中与所述参考量相比较减少的至少一种生物标记物的量指示不适合所述至少一种药剂的施用的对象。
14. 实施方案2的方法,其中所述至少一种药剂是利尿剂,并且其中所述生物标记物是内皮抑素、mimecan、GDF-15、尿酸和/或BNP型肽。
15. 实施方案14的方法,其中与所述参考量相比较减少的至少一种生物标记物的量指示适合于所述至少一种药剂的施用的对象,和/或其中与所述参考量相比较增加的至少一种生物标记物的量指示不适合所述至少一种药剂的施用的对象。
16. 在患有心力衰竭的对象的样品中,i)选自GDF-15 (生长分化因子15)、内皮抑素、mimecan、IGFBP7 (IGF结合蛋白7)、心肌肌钙蛋白、BNP型肽、尿酸、Gal-3 (半乳糖凝集素-3)、骨桥蛋白和sST2 (可溶性ST2)、sFlt-1、PlGF、P1NP、胱抑素C、前白蛋白和转铁蛋白的至少一种生物标记物,或ii)特异性结合利钠肽的至少一种检测试剂,和/或特异性结合选自GDF-15 (生长分化因子15)、内皮抑素、mimecan、IGFBP7 (IGF结合蛋白7)、心肌肌钙蛋白、BNP型肽、尿酸、Gal-3 (半乳糖凝集素-3)、骨桥蛋白、sFlt-1、PlGF、sST2 (可溶性ST2)、P1NP、胱抑素C、前白蛋白和转铁蛋白的生物标记物的检测试剂,用于鉴定适合于选自下述的至少一种药剂的施用的对象的用途:β阻断剂、醛固酮拮抗剂、利尿剂和肾素-血管紧张素系统的抑制剂。
17. 一种适合进行实施方案1-12中任一项的方法的装置,其包括:
a)包含特异性结合选自下述的标记物的检测试剂(或多种试剂)的分析仪单元:GDF-15 (生长分化因子15)、内皮抑素、mimecan、IGFBP7 (IGF结合蛋白7)、心肌肌钙蛋白、BNP型肽、尿酸、Gal-3 (半乳糖凝集素-3)、骨桥蛋白、sFlt-1、PlGF、sST2 (可溶性ST2)、P1NP、胱抑素C、前白蛋白和转铁蛋白,所述单元适合用于测定患有心力衰竭的对象的样品中的一种或多种标记物的一个或多个量;和
b)用于比较一个或多个测定量与一个或多个参考量的分析仪单元,由此鉴定适合于选自下述的至少一种药剂的施用的对象:β阻断剂、醛固酮拮抗剂、利尿剂和肾素-血管紧张素系统的抑制剂,所述单元包括具有参考量(或多个量)的数据库和进行比较的计算机实现的算法。
附图显示:
图1:基于标记物水平的醛固酮拮抗剂的添加/上调效应。
图2:基于标记物水平的添加/上调β阻断剂的效应。
图3:基于标记物水平的添加/上调利尿剂的效应。
图4:基于标记物水平的添加/上调肾素-血管紧张素系统的抑制剂(RAS)的效应。
上文提及的所有参考文献就其整个公开内容以及其在上文说明书中明确提及的具体公开内容而言,通过引用随同并入。
实施例
本发明现在将通过下述实施例举例说明,所述实施例不预期限定或限制本发明的范围。
实施例1:测定
测定血浆中的下述标记物。
使用Roche的电化学发光ELISA夹心测试Elecsys Troponin T hs (高灵敏度)STAT (短回转时间(Short Turn Around Time))测定来测定肌钙蛋白T。该测试采用特异性针对人心肌肌钙蛋白T的两种单克隆抗体。该抗体识别位于心肌肌钙蛋白T蛋白质的中心部分中的两个表位(氨基酸位置125-131和136-147),所述蛋白质由288个氨基酸组成。hs-TnT测定允许测量在3 - 10000 pg/mL范围内的肌钙蛋白T水平。
使用Roche的电化学发光ELISA夹心测试Elecsys proBNP II STAT (短回转时间)测定来测定NT-proBNP。该测试采用识别位于proBNP (1-108)的N末端部分(1-76)中的表位的两种单克隆抗体。
为了测定血清和血浆样品中的GDF-15浓度,采用Elecsys原型测试,使用来自R&D Systems (AF957)的多克隆GDF-15亲和层析纯化的山羊抗人GDF-15 IgG抗体。在每次实验中,用来自R&D Systems的重组人GDF-15 (957-GD/CF)生成标准曲线。在标准血浆样品中测试关于新批次或重组GDF-15蛋白质的结果,并且通过引入关于该测定的调整因素校正超过10%的任何偏差。在校正最后稀释因子后,来自相同患者的血清和血浆样品中的GDF-15测量获得实际上相同的结果。测定的检测极限是200 pg/ml。
为了检测人血清或血浆中的IGFBP7,使用了夹心ELISA。对于抗原捕获和检测,使来自R&D Systems的抗IGFBP7多克隆抗体(目录号:AF 1334)的等分试样分别与生物素和地高辛缀合。
链霉抗生物素蛋白包被的96孔微量滴定板与1 pg/m1的100 pi生物素化的抗IGFBP7多克隆抗体一起在lx PBS溶液中温育60分钟。在温育后,板用lx PBS + 0.02% Tween-20洗涤三次,用PBS + 1% BSA (牛血清白蛋白)封闭,并且随后再次用lx PBS + 0.02% Tween-20洗涤三次。孔随后与作为标准抗原的重组IGFBP7的系列稀释物或者分别来自患者或对照个体的稀释血清或血浆样品(1:50)一起温育1.5小时。在IGFBP7结合后,板用lx PBS + 0.02% Tween-20洗涤三次。对于结合的IGFBP7的特异性检测,孔与以1 µg/ml的100 µl地高辛化抗IGFBP7多克隆抗体一起在lx PBS + 1% BSA中温育60分钟。其后,将板洗涤三次以去除未结合的抗体。在下一个步骤中,使孔与75 mU/ml抗地高辛-POD缀合物(Roche Diagnostics GmbH,Mannheim,德国,目录号1633716)一起在lx PBS + 1% BSA中温育60分钟。板随后用相同缓冲液洗涤六次。对于抗原-抗体复合物的检测,使孔与100 µl ABTS溶液(Roche Diagnostics GmbH,Mannheim,德国,目录号11685767)一起温育,并且在15分钟后用ELISA阅读器在405和492 nm处测量光密度(OD)。
通过使用BGM半乳糖凝集素-3测定(BG medicine,Waltham,MA,USA)测定Gal-3。它通过在微量滴定板平台上利用针对半乳糖凝集素-3的两种单克隆抗体的酶联免疫吸附测定法(ELISA),定量测量血清或EDTA-血浆中的半乳糖凝集素-3。将一种大鼠单克隆抗小鼠半乳糖凝集素-3抗体包被到微量滴定板中的孔表面上,并且充当捕获抗体以结合样品中的半乳糖凝集素-3分子,而另一种小鼠单克隆抗人半乳糖凝集素-3抗体在溶液中提供,且充当示踪剂抗体用于检测与捕获抗体结合的半乳糖凝集素-3分子。
为了检测人血清或血浆中的mimecan,使用夹心ELISA。对于抗原捕获和检测,使来自R&D Systems的抗mimecan多克隆抗体(目录号:AF 2660)的等分试样分别与生物素和地高辛缀合。链霉抗生物素蛋白包被的96孔微量滴定板与0.2 [mu]g/ml的100 µl生物素化的抗mimecan多克隆抗体一起在Ix PBS溶液中温育60分钟。在温育后,板用1x PBS + 0.02% Tween-20洗涤三次,用PBS + 2% BSA (牛血清白蛋白)封闭45分钟,并且随后再次用Ix PBS + 0.02% Tween-20洗涤三次。孔随后与作为标准抗原的100 µl重组mimecan的系列稀释物或者分别来自患者或对照个体的稀释血清或血浆样品(在1x PBS + 1%BSA中1:5)一起温育1小时。在mimecan结合后,板用Ix PBS + 0.02% Tween-20洗涤三次。对于结合的mimecan的特异性检测,孔与0.2 µg/ml的100 µl地高辛化抗mimecan多克隆抗体一起在Ix PBS + 1% BSA中温育45分钟。其后,将板洗涤三次以去除未结合的抗体。在下一个步骤中,使孔与100 µl 75 mU/ml抗地高辛-POD缀合物(Roche Diagnostics GmbH,Mannheim,德国,目录号1633716)一起在1x PBS + 1% BSA中温育30分钟。板随后用如上的相同缓冲液洗涤六次。对于抗原-抗体复合物的检测,使孔与100 µl ABTS溶液(Roche Diagnostics GmbH,Mannheim,德国,目录号11685767)一起温育,并且在15分钟后用ELISA阅读器在405和492 nm处测量光密度(OD)。
为了测量人血清或血浆中的内皮抑素,使用商购可得的夹心ELISA (Quantikine Human Endostatin Immunoassay,目录号DNSTO,R&D Systems)。根据由制造商给予的说明书执行测量。
通过使用来自Critical Diagnostics (San Diego,CA,USA)的Presage™ ST2测定来测定sST2。测定是在96孔板形式中的定量夹心单克隆ELISA,用于测量血清或血浆中的ST2。将稀释的血浆装载到抗ST2抗体包被的板中的适当孔内,并且温育指定的时间。在将试剂从板中洗去,并且加入另外试剂且随后洗出的一系列步骤后,通过添加比色试剂最终检测分析物,并且在450 nm处分光光度测量所得到的信号。
生物标记物mimecan如WO2011/012268中所述进行测定。
使用ELECSYS免疫测定来测试PlGF和sFlt1,所述ELECSYS免疫测定采用分别对于PlGF和sFlt1特异性的两种抗体。测试可以使用不同Roche分析仪包括ELECSYS 2010以及cobra e411和cobra e601自动进行。对于PlGF,测试具有3 pg/ml的灵敏度。sFlt-1量在10 - 85,000 pg/ml之间。
在Roche/Hitachi cobas c systems (ACN 710用于c 311/501分析仪; ACN 8710用于c 520分析仪;目录号20764655 322)上,使用人血清中的前白蛋白的定量测定的体外测试来测试前白蛋白。测定是免疫比浊测定。人前白蛋白与特异性抗血清形成沉淀物,通过比浊方式测定所述沉淀物。
通过在Roche自动化临床化学分析仪(对于Roche/Hitachi 917,MODULAR P分析仪:ACN 431,目录号04975774 190)上,使用用于人血清和血浆中的胱抑素C的定量体外测定的免疫比浊测定使用胱抑素C。人胱抑素C与由抗胱抑素C抗体包被的乳胶颗粒凝集。在546 nm处通过比浊方式测定聚集体。
实施例2:患者队列/结果
来自TIME-CHF研究的例子:GDF-15、TnT-hs、尿酸、内皮抑素、IGFBP-7、 Mimecan、sST2、半乳糖凝集素-3和骨桥蛋白水平已在来自TIME-CHF随机化试验(年龄60岁或更大,患有心脏收缩性HF (射血分数</= 45%),在1年内在HF住院治疗前NYHA II类或更大,并且NTproBNP水平是正常上限的2倍或更多倍)的n= 450个患者的样品中进行测定。TIME-CHF研究在BNP-Guided vs Symptom-Guided Heart Failure Therapy JAMA,2009;301 (4):383-392中描述。
在基线时,大多数患者接受推荐的HF疗法ACE抑制剂或血管紧张素II受体阻断剂、β阻断剂、利尿剂。
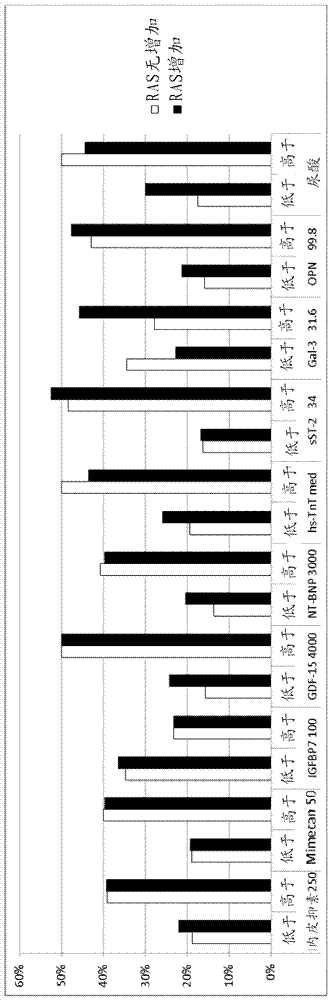
在基线时和6个月后测量生物标记物。下表中给出的数目是具有“不良预后”(死亡、反复住院治疗)的患者%。分析测量的生物标记物是否将允许鉴定患者,所述患者将获益于增加下述的剂量或降低下述的给药间隔:β阻断剂、醛固酮拮抗剂、利尿剂和/或肾素-血管紧张素系统的抑制剂,和/或向疗法中添加某些药剂。对于该分析,将患者分成i)接受增加剂量的药剂和/或接受另外药剂的对象组,和ii) 治疗方案没有修改的对象组。在进一步的步骤中,基于各自的生物标记物水平(低于中值/高于阈值),将两组各自分成组。结果显示于表1中:
使用功能主成分分析(fPCA)进一步分析数据。fPCA降低药物的复杂给药数据的维数,以允许在多个时间点(超出基线)的标记物水平和结果的相互作用分析。在这种情况下,使用三个主成分,代表1)在研究期间药物的总体剂量水平(最重要成分),2)在研究期间药物剂量增加或减少的趋势,和3)药物剂量首先增加且随后减少或首先减少且随后增加的趋势。fPCA超过在基线时的分层分析(先前分析)的优点和补充信息是它揭示了在超出基线的时间点时标记物和药物的相互作用。因此,可以评价另外的相互作用和疗法应答预测。随后就相互作用和疗法应答预测对fPCA的成分进行测试,其中使用中值标记物水平和结果,使用如上所述的相同终点。相互作用的结果和强度在下表中表示。这些结果证实了许多先前发现的相互作用,并且提出了另外的标记物药物组合。
结果显示于下表中。
IGFBP7的结果:数据评估显示在基线时IGFBP-7水平(不依赖于其他生物标记物)低于参考值的患者(在研究中< 100 ng/mL)不获益于螺内酯的添加或上调。如果IGFBP-7水平高于参考值(在研究中> 100 ng/mL,值截断待限定;年龄依赖性,在更年轻的群体中通常发现更低水平),则应添加或上调醛固酮拮抗剂(例如螺内酯)和/或β阻断剂。在第二组中的18个月的存活得到改善,而存活率在第一组中不变。
GDF-15的结果:数据评估显示在基线时GDF-15水平(不依赖于其他生物标记物)低于参考值的患者(在研究中< 4000 pg/mL)不获益于β阻断剂或醛固酮拮抗剂(例如螺内酯)的另外施用或上调,而GDF-15水平高于参考值(在研究中> 4000 pg/mL)的患者可能获益于β阻断剂或醛固酮拮抗剂的添加或上调。在第二组中的18个月的存活得到改善,而存活率在第一组中不变。
内皮抑素的结果:数据评估显示在基线时内皮抑素水平(不依赖于其他生物标记物)低于参考值的患者(在研究中< 250 ng/mL)不获益于β阻断剂的另外施用或上调。已经服用β阻断剂化合物的患者应保持,但剂量无需增加。内皮抑素水平高于参考值(在研究中> 250 ng/mL)的患者可能获益于β阻断剂的另外施用。另外,应避免利尿剂的上调。在第二组中的18个月的存活得到改善,而存活率在第一组中不变。
mimecan的结果:数据评估显示在基线时mimecan水平(不依赖于其他生物标记物)低于参考值的患者(在研究中< 50 ng/mL)不获益于β阻断剂的另外施用或上调。如果mimecan水平高于参考值(在研究中> 50 ng/mL),则β阻断剂应添加或β阻断剂的剂量应上调。另外,应避免利尿剂的上调。
NTproBNP的结果:数据评估显示NTproBNP水平高于参考值的患者(在研究中> 3000 pg/mL)不获益于利尿剂的添加或上调。
sST2的结果:数据评估显示sST2水平高于参考值的患者(在研究中> 34.0 g/mL)获益于β阻断剂的添加或上调。
Gal-3的结果:数据评估显示Gal-3水平低于参考值的患者(在研究中<31.6 g/mL)获益于肾素-血管紧张素系统抑制剂的添加或上调。
sFlt-1的结果:数据评估显示sFlt-1水平低于参考值的患者(在研究中<98 g/mL)获益于RAS抑制剂和/或醛固酮拮抗剂的添加或上调。
PlGF的结果:数据评估显示sFlt-1水平高于参考值的患者(在研究中>20.7 g/mL)获益于醛固酮拮抗剂的添加或上调。
骨桥蛋白的结果:数据评估显示骨桥蛋白水平高于参考值的患者(在研究中>100g/mL)不获益于利尿剂疗法的添加或上调。
可以得出下述结论:
•如果内皮抑素高于参考值,则BB应添加和/或其剂量应上调。另外,应避免醛固酮拮抗剂和/或利尿剂的上调。
•如果Mimecan高于参考值,则BB应添加和/或BB的剂量应上调。另外,应避免利尿剂的上调。
•如果IGFBP7低于参考值,则BB应添加或上调。如果IGFBP7高于参考值,则醛固酮拮抗剂应添加或上调。
•如果IGFBP7低于参考值,则醛固酮拮抗剂和RAS抑制剂不应添加或上调。
•如果GDF-15高于参考值,则BB、RAS抑制剂和醛固酮拮抗剂应添加或上调。相比之下,利尿剂不应添加或利尿剂剂量不应增加。
•如果cTnT-hs高于中值,则RAS抑制剂、BB化合物或醛固酮拮抗剂可以上调,而当cTnT-hs低于中值时,则不应这样做。
•如果尿酸高于中值,则RAS抑制剂化合物可以上调。另外,应避免利尿剂和/或醛固酮拮抗剂的上调。
• NTproBNP水平高于参考量的患者(在研究中> 3000 pg/mL)不获益于利尿剂的上调,但RAS抑制剂和BB应上调。NTproBNP水平低于参考量的患者(在研究中< 3000 pg/mL)不获益于RAS抑制剂的上调。
•如果Gal-3高于中值,则醛固酮拮抗剂应添加和/或上调。
•如果骨桥蛋白高于中值,则RAS抑制剂应添加和/或上调。如果骨桥蛋白低于中值,则BB化合物应添加和/或上调。
•如果sFlt-1低于参考量(在该研究中使用中值),则RAS抑制剂、BB化合物和/或醛固酮拮抗剂应添加和/或上调。
•如果PLGF高于参考量(例如中值),则醛固酮拮抗剂应添加和/或上调。
•如果sST2高于参考量(例如中值),则醛固酮拮抗剂和/或β阻断剂应添加和/或上调。
•如果P1NP低于参考量(例如中值),则β阻断剂应添加和/或上调。
•如果前白蛋白高于参考量(例如中值),则利尿剂不应添加,剂量减少或不上调。
•如果转铁蛋白高于参考量(例如中值),则利尿剂不应添加,剂量减少或不上调。
•如果胱抑素C低于参考量(例如中值),则醛固酮拮抗剂不应添加或上调,高剂量应减少。
•如果比PlGF/sFlt-1 C高于参考比(例如中值),则醛固酮拮抗剂应添加或剂量上调。
因此,通过应用上文概括的诊断算法,可以鉴定适合于上文提及的药剂施用(即初始施用或以更高剂量的施用,“上调”)的对象。合适的参考量可以如说明书中所述进行测定。
实施例3:个体病例研究
89岁患有C类心力衰竭的男性患者接受低剂量的氯噻酮(25 mg/d)、依那普利(5 mg/d)和美托洛尔(25 mg/d)。该患者显示心力衰竭进展的体征,伴随升高的NT-proBNP水平。该患者还患有哮喘,并且治疗医生不确定BB是否应上调。在得自患者的血浆样品中测定Mimecan。Mimecan值高于80 pg/mL。通过依那普利(至20 mg/d)和美托洛尔(100 mg/d)的序贯上调的方式加强疗法。相比之下,氯噻酮剂量不增加。该患者保持稳定,具有良好结果直到研究结束时(无死亡或住院治疗)。
90岁患有C类心力衰竭的女性患者接受组合的固定剂量组合的氢氯噻嗪(12.5 mg/d)和缬沙坦(80 mg/d),以及阿替洛尔(100 mg/d)。该患者过去具有失代偿发作和住院治疗。在末次就诊中,该患者的运动不耐性恶化,并且与3个月前的最近就诊相比较,6分钟步行测试获得降低的步行距离。在得自患者的血浆样品中测定NT-ProBNP和IGFBP-7。NT-proBNP值高于1000 pg/mL,并且IGFBP-7值高于100 pg/ml。治疗医生不确定是否安全添加螺内酯,因为该患者偶然呈现升高的钾水平。疗法得到加强,并且螺内酯以25 mg/d起始添加,并且以后上调至100 mg/d,同时密切监控血清钾水平。结果,NT-proBNP值下降低于1000 pg/mL。该患者保持稳定,具有良好结果直到研究结束时(无死亡,无住院治疗)。
93岁患有D类心力衰竭的男性患者接受氢氯噻嗪(25 mg/d)和缬沙坦(160 mg/d),以及比索洛尔(2.5 mg/d)。该患者过去具有失代偿发作和延长的住院治疗。在过去就诊中,在得自患者的血浆样品中测定NT-ProBNP和IGFBP-7。NT-proBNP值高于1000 pg/mL,并且IGFBP-7值低于100 pg/ml。治疗医生未添加螺内酯。代之以通过比索洛尔上调至10 mg/d的方式加强疗法。该患者保持稳定,具有良好结果直到研究结束时(无死亡,无住院治疗)。
70岁患有B类心力衰竭的女性患者接受卡托普利(2 x 6.25 mg/d)。该患者已稳定10个月,但在看电视,食用一袋马铃薯片后因急性心力衰竭而住院治疗。在预先安排的就诊时得自患者的血浆样品中测定GDF-15和cTnThs。GDF-15值高于4000 pg/mL,并且cTnT-hs高于中值。选择β阻断剂美托洛尔和醛固酮拮抗剂螺内酯的添加,以加强疗法。由于眩晕和低血压,该患者刚经历再一次的住院治疗事件。
77岁患有C类心力衰竭的男性素食患者接受缬沙坦(160 mg/d)以及卡维地洛(12.5 mg/d)。该患者在过去5个月期间已稳定,但在伴随急性呼吸困难、啰音和心动过速的失代偿状态中到达急诊室。在得自患者的血浆样品中测定尿酸和Gal-3。尿酸和Gal-3值低于中值。治疗医生通过卡维地洛上调至50 mg/d来加强疗法。此外,螺内酯以25 mg/d起始添加,并且以后上调至50 mg/d。该患者保持稳定1个月,但随后发展水肿、心房颤动、呼吸困难和咳嗽。在去医院的途中,该患者由于猝死而死亡。
结论:
本发明提供了用于选择药物疗法的方法,所述药物疗法在患有心力衰竭的患者中将是有利的。该方法预测对疗法的应答和/或帮助选择适当疗法或疗法加强。与现有技术和先前生物标记物指导的心力衰竭方法相比较,本发明提供了多种标记物的具体目标水平以及用于疗法选择和给药的具体指示。本发明还改善了对患者有利的药物疗法的鉴定和利用,并且相反避免对患者潜在有害的疗法。因此,本发明旨在降低心力衰竭患者的死亡率和发病率。
- 还没有人留言评论。精彩留言会获得点赞!