锂组合物的制造方法及硫化物固体电解质材料的制造方法与流程
本发明涉及可抑制多硫化物产生的锂组合物的制造方法。
背景技术:
硫化物固体电解质材料由于Li离子传导性高,因此在实现电池的高输出化方面是有用的。作为硫化物固体电解质材料的原料,已知的有含有Li2S及LiI的锂组合物。
在专利文献1中,公开了一种锂组合物的合成方法,其中从单一的Li源制备含有LiHS及LiX(X为F、Cl、Br或I)的原料混合物,使硫化氢从原料混合物中的LiHS脱离以形成Li2S。另外,在专利文献1中,作为得到原料混合物的方法,公开了进行:使金属(Me)的氢氧化物(例如氢氧化钙)、卤素(例如碘)和甲酸反应从而制作含有Me的氢氧化物及Me的卤化物的水溶液的还原处理,将Me置换成Li从而形成氢氧化锂及卤化锂的置换处理,和将氢氧化锂硫化以形成氢硫化锂的硫化处理。
现有技术文献
专利文献
专利文献1:特开2014-179265号公报
技术实现要素:
发明所要解决的课题
锂组合物例如由于成为硫化物固体电解质材料的原料,因此期望杂质少。但是,在以往的锂组合物的制造方法中,在硫化处理时有时产生多硫化物。
多硫化物(例如为HSn-、Sn2-)为不定量的硫以链状或环状形式连 接的物质,可认为作为由多硫化物引起的微粒生成物而生成硫胶体。
本发明是鉴于上述实际情况而完成的,主要目的在于提供一种可抑制多硫化物产生的锂组合物的制造方法以及使用该锂组合物的硫化物固体电解质材料的制造方法。
用于解决课题的手段
为了解决上述课题,在本发明中,提供一种锂组合物的制造方法,该锂组合物至少含有硫化锂(Li2S)和碘化锂(LiI),该方法的特征在于,具有:使碘与含有氧化钙、甲酸及水的还原性水溶液在pH 5.5以上、pH 10.21以下的条件下通过加热反应,形成含有碘化钙(CaI2)的第一水溶液的第一水溶液形成工序;在上述第一水溶液中添加氧化钙,形成含有氢氧化钙(Ca(OH)2)和上述碘化钙(CaI2)的第二水溶液的第二水溶液形成工序;在上述第二水溶液中添加碳酸锂,形成含有氢氧化锂(LiOH)和碘化锂(LiI)的第三水溶液的第三水溶液形成工序;和将上述氢氧化锂(LiOH)硫化以形成氢硫化锂(LiHS),其后使硫化氢从上述氢硫化锂(LiHS)脱离,形成上述硫化锂(Li2S)的Li2S形成工序。
根据本发明,在第一水溶液形成工序中,使碘与含有氧化钙、甲酸及水的还原性水溶液在中性附近的pH下反应,由此可得到抑制了多硫化物产生的锂组合物。
在上述发明中,优选在上述第一水溶液形成工序中,加热含有上述碘和水的含碘水溶液,向上述加热了的含碘水溶液添加上述还原性水溶液。
在上述发明中,优选在上述第一水溶液形成工序中,向加热了的水分别添加上述碘和上述还原性水溶液。
在上述发明中,优选分多次向上述加热了的水添加上述碘。
在上述发明中,优选在上述第三水溶液形成工序和上述Li2S形成工序之间,具有在上述第三水溶液中添加LiX(X为F、Cl或Br)的LiX添加工序。
另外,在本发明中,提供一种硫化物固体电解质材料的制造方法,其特征在于,具有:通过上述的锂组合物的制造方法准备锂组合物的 准备工序,和使上述锂组合物与Li2S以外的硫化物反应,合成硫化物固体电解质材料的合成工序。
根据本发明,通过使用特定的锂组合物,可合成杂质少的硫化物固体电解质材料。
发明效果
本发明的锂组合物的制造方法取得了可抑制多硫化物产生的效果。
附图说明
图1是说明本发明的锂组合物的制造方法的流程图。
图2是说明以往的锂组合物的制造方法的一例的流程图。
图3是说明从本发明中的第一水溶液形成工序到第三水溶液形成工序的一例的流程图。
图4是说明从本发明中的第一水溶液形成工序到第三水溶液形成工序的一例的流程图。
图5是说明本发明的硫化物固体电解质材料的制造方法的流程图。
图6是示出实施例1~3和比较例2的初始pH与碘减少量(重量%)的关系的图。
具体实施方式
以下,对本发明的锂组合物的制造方法和硫化物固体电解质材料的制造方法的详细内容进行说明。
A.锂组合物的制造方法
图1是示出本发明的锂组合物的制造方法的一例的流程图。本发明为至少含有硫化锂(Li2S)和碘化锂(LiI)的锂组合物的制造方法。在图1中,使碘(I2)与含有氧化钙(CaO)、甲酸(HCOOH)及水(H2O)的还原性水溶液在pH 5.5以上、pH 10.21以下的条件下通过加热反应,形成含有碘化钙(CaI2)的第一水溶液(第一水溶液形成工序)。接着,在第一 水溶液中添加氧化钙(CaO),形成含有氢氧化钙(Ca(OH)2)及碘化钙(CaI2)的第二水溶液(第二水溶液形成工序)。接着,在第二水溶液中添加碳酸锂,形成含有氢氧化锂(LiOH)及碘化锂(LiI)的第三水溶液(第三水溶液形成工序)。接着,在第三水溶液中添加LiX(例如LiBr)(LiX添加工序)。接着,将氢氧化锂(LiOH)硫化以形成氢硫化锂(LiHS),其后使硫化氢从氢硫化锂(LiHS)脱离,形成硫化锂(Li2S)(Li2S形成工序)。
根据本发明,在第一水溶液形成工序中,使碘与含有氧化钙、甲酸及水的还原性水溶液在中性附近的pH下反应,由此可得到抑制了多硫化物产生的锂组合物。
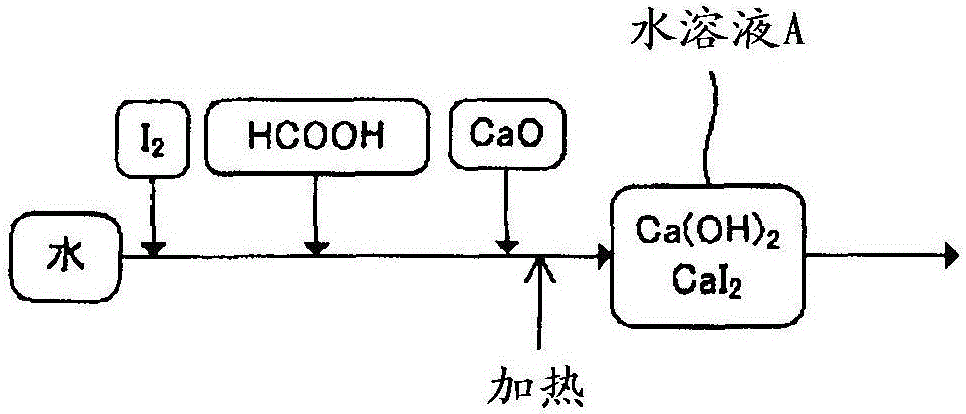
在以往的方法中,例如如图2所示,通过在水中添加碘、甲酸、氧化钙并在随后进行加热,形成含有氢氧化钙(Ca(OH)2)和碘化钙(CaI2)的水溶液A(相当于本发明中的第二水溶液)。但是,在该方法的情形下,即使其后的工序(第三水溶液形成工序和Li2S形成工序)与本发明相同,在得到的锂组合物中也产生多硫化物。关于其原因,可推定如下。即,在图2中,在向水中添加碘、甲酸、氧化钙的阶段,pH成为12以上。当在这样的碱过剩条件下进行还原反应时,在反应时产生作为氧化性物质的碘酸。推测碘酸与硫化处理时使用的硫化氢反应,生成作为杂质的多硫化物。另外,来自多硫化物的硫胶体产生时,也成为组成偏差的原因。
与此相对,在本发明中,在第一水溶液形成工序中,使碘与含有氧化钙、甲酸及水的还原性水溶液在中性附近的pH下反应。基本上,分开添加用于形成CaI2(LiI的原料)的氧化钙和用于形成Ca(OH)2(Li2S的原料)的氧化钙。由此,可抑制使碘与还原性水溶液反应时的pH增加,可抑制碘酸的产生。进而,在本发明中,还原性水溶液含有氧化钙和甲酸。通过组合甲酸,可缓和由氧化钙引起的pH增加,可抑制碘酸的产生。在本发明中,由于还原性水溶液含有作为碱的氧化钙,因此使还原性水溶液与碘一点一点地反应,使得pH不过度增加。
以下,对本发明的锂组合物的制造方法中的各工序进行说明。
1.第一水溶液形成工序
本发明中的第一水溶液形成工序是使碘与含有氧化钙、甲酸及水的还原性水溶液在pH 5.5以上、pH 10.21以下的条件下通过加热反应,形成含有碘化钙(CaI2)的第一水溶液的工序。具体而言,发生下述反应式1的反应。
Ca(OH)2+I2+HCOOH→CaI2+2H2O+CO2 (反应式1)
予以说明,本发明中的“水溶液”是指至少含有水作为溶剂的溶液,可以仅含有水作为溶剂,也可以进一步含有水以外的溶剂。特别地,上述水溶液优选全部溶剂中的水的比例为50重量%以上。这些方面不限于第一水溶液,关于后述的其它水溶液也同样。
在第一水溶液形成工序中,使碘与还原性水溶液在pH 5.5以上、pH 10.21以下的条件下反应。“pH 5.5以上、pH 10.21以下的条件”是指碘与还原性水溶液即将反应之前的溶液的pH。具体而言,是指在即将首次添加还原性水溶液之前的溶液的pH。第一水溶液形成工序中的pH通常为pH 10.21以下,也可以为8以下。另一方面,第一水溶液形成工序中的pH例如为5.5以上,也可以为7以上。
在第一水溶液形成工序中,使碘与还原性水溶液通过加热反应。加热温度可以是碘与还原性水溶液进行反应的温度,但也可以是碘与氢氧化钙及甲酸反应的温度,例如优选为60℃以上,更优选为75℃以上。另一方面,作为加热温度,例如优选为90℃以下,更优选为85℃以下。予以说明,由于碘的挥发性强,因此即使在单纯加热的情况下有时也会蒸发而损失。因此,期望将溶液温度控制在还原反应开始的温度附近。
(1)碘
在本发明中,使碘与还原性水溶液反应。在使碘与还原性水溶液反应时,可以单独使用碘,也可以使用含有碘及水的含碘水溶液。予以说明,作为前者的实施方式,例如可举出向被加热的水中分别添加碘和还原性水溶液的实施方式。另一方面,在含碘水溶液中,碘的至少一部分溶解在水中即可。另外,含碘水溶液至少含有水及碘,但在 可维持pH 5.5以上、pH 10.21以下的范围内,也可以含有其它化合物。作为其它化合物,例如可举出氧化钙。由于添加氧化钙时pH通常大幅增加,因此可添加的氧化钙通常为少量。
(2)还原性溶液
本发明中的还原性水溶液含有氧化钙、甲酸及水。氧化钙(CaO)通常在还原性水溶液中作为氢氧化钙(Ca(OH)2)存在。
还原性水溶液中的氧化钙的含量优选根据待反应的碘的量来调整。相对于1mol的碘,氧化钙例如在1.00mol~1.10mol的范围内,优选在1.00mol~1.05mol的范围内。另一方面,还原性水溶液中的甲酸含量优选为碘的还原反应充分地发生的量。相对于1mol的碘,甲酸例如在1.0mol~1.1mol的范围内,优选在1.0mol~1.05mol的范围内。
还原性水溶液中的氧化钙和甲酸的浓度分别例如在0.3mol/L~0.6mol/L的范围内。另外,还原性水溶液的pH例如为11以上。
(3)碘与还原性水溶液的反应
第一水溶液形成工序使碘与含氧化钙、甲酸及水的还原性水溶液在pH 5.5以上、pH 10.21以下的条件下通过加热反应。
使碘与还原性水溶液反应的方法优选为可使还原性水溶液一点一点地与碘反应的方法。作为使碘与还原性水溶液反应的方法的一例,如图3所示,可举出加热含有碘及水的含碘水溶液,向加热了的含碘水溶液添加还原性水溶液的方法。作为添加还原性水溶液的方法,可举出一点一点地添加还原性水溶液的方法。例如,每单位时间(分钟)的还原性水溶液的添加量例如可以设在1mL~10mL的范围内。另外,作为还原性水溶液的添加时间,例如在1小时~10小时的范围内。
作为使碘与还原性水溶液反应的方法的其它例子,如图4所示,可举出向加热了的水分别添加碘和还原性水溶液的方法。其中,优选向加热了的水分多次添加碘。这是由于可通过抑制碘的蒸发来抑制锂组合物的组成偏离的产生。
碘的蒸发可推测因以下原因而产生。即,可推测当在pH低的条 件下(pH小于5.5)进行反应时,产生大量游离碘,被通过同时发生的还原反应而产生的二氧化碳运送,由此具有升华性的碘也蒸发。pH 5.5为普通水中的最低pH,为饱和了碳酸的水的pH。
可推测在溶液的pH高(碱性强)的情况下,通过碘与氢氧离子的反应而产生碘酸。
I2+6OH-→5I-+IO3-
碘酸在碱性下氧化力弱,但在酸性~中性范围则成为强氧化剂,将碘离子氧化而产生碘(I2)。如果将溶液pH维持在碱性条件下,则会使碘酸残留在合成物中,并成为后续工序中产生多硫化物的原因。另外,可认为一旦添加还原性溶液,则pH局部地成为碱性,并产生碘酸。其后,可推定随着溶液pH因搅拌而向中性附近变化,将碘离子氧化而产生碘,损失量因蒸发而增多。因此,需要在将溶液pH维持在中性附近的同时进行还原反应。
在分多次添加碘的情况下,例如优选在开始添加还原性水溶液的同时或在开始添加还原性水溶液之前添加第一次部分的碘。这是因为可将溶液的pH维持为较低。例如,优选分2次~10次添加碘。另外,在分多次添加碘的情况下,可以单独添加碘,也可以添加含有碘及水的含碘水溶液。
2.第二水溶液形成工序
本发明中的第二水溶液形成工序是在上述第一水溶液中添加氧化钙,形成含有氢氧化钙(Ca(OH)2)及上述碘化钙(CaI2)的第二水溶液的工序。添加的氧化钙通常在第二水溶液中作为氢氧化钙存在。
第二水溶液形成工序中添加的氧化钙主要用作用于形成Li2S的原料。氧化钙的添加量可根据锂组合物中的Li2S的比例适当地选择。
3.第三水溶液形成工序
本发明中的第三水溶液形成工序是在上述第二水溶液中添加碳酸锂,形成含有氢氧化锂(LiOH)及碘化锂(LiI)的第三水溶液的工序。具体而言,发生下述反应式2、3的反应。
CaI2+Li2CO3→2LiI+CaCO3 (反应式2)
Ca(OH)2+Li2CO3→2LiOH+CaCO3 (反应式3)
作为碳酸锂的添加量,根据第二水溶液中含有的氢氧化钙和碘化钙的量适当地调整。
在第三水溶液中,LiOH相对于LiI的摩尔比(MLiOH/MLiI)可根据作为目标的锂组合物所包含的LiI的比例适当地选择,例如优选为1以上,优选为4以上。考虑LiI-LiOH系的相图时,暗示在LiI:LiOH=1:1的情况下及在LiI:LiOH=1:4的情况下形成稳定相。推测特别是LiI:LiOH=1:4的稳定相可维持固体直至340℃。
在本发明中,也可以在第三水溶液形成工序和后述的Li2S形成工序之间具有在第三水溶液中添加LiX(X为F、Cl或Br)的LiX添加工序。关于LiX的添加量,可根据成为目标的锂组合物适当地选择。
4.Li2S形成工序
本发明中的Li2S形成工序是将上述氢氧化锂(LiOH)硫化以形成氢硫化锂(LiHS),其后使硫化氢从上述氢硫化锂(LiHS)脱离,形成上述硫化锂(Li2S)的工序。
Li2S形成工序至少进行将LiOH硫化以形成LiHS的硫化处理,和使H2S从LiHS脱离以形成Li2S的硫化处理。另外,优选在硫化处理前进行将第三水溶液干燥的干燥处理。
(1)干燥处理
在干燥处理中,通过将第三水溶液干燥以除去水分,得到至少含有LiOH和LiI的前体混合物。
干燥方法不特别限定,但可举出加热干燥、减压干燥(真空干燥)、冷冻干燥、喷雾干燥及它们的任意组合等。予以说明,冷冻干燥通常是使对象物冷冻,利用真空泵减压以使溶剂升华从而进行干燥的方法。在加热干燥的情况下,加热温度例如在50℃~200℃的范围内,优选在120℃~190℃的范围内。
(2)硫化处理
在硫化处理中,将LiOH硫化以形成LiHS,得到至少含有LiHS和LiI的原料混合物。
作为LiOH的硫化方法,例如可举出使硫化气体与前体混合物反应的方法。作为硫化气体,例如可举出H2S、CS2、单质硫蒸气等,其中优选H2S或CS2。这是由于单质硫蒸气根据条件而有可能聚集或者有可能生成高分子硫。予以说明,硫化气体也可以用氩气等非活性气体来稀释。使硫化气体反应时的温度例如在0℃~200℃的范围内,优选在100℃~150℃的范围内。另外,使硫化气体反应的时间例如在10分钟~180分钟的范围内。
LiOH的硫化优选在使前体混合物溶解或分散于溶剂中的状态下进行或者在非活性气体气氛下进行,其中优选前者。予以说明,本发明中的溶剂指的是不仅包括溶解有溶质的严格意义上的溶剂,也包括分散介质。特别地,在本发明中,优选在极性溶剂中进行LiOH的硫化。这是由于可高效地进行LiOH的硫化。作为极性溶剂,具体可举出质子性极性溶剂。作为质子性极性溶剂的一例,可举出碳原子数为1-8的醇。作为上述醇,具体可举出甲醇、乙醇、丙醇、丁醇、叔丁醇、2-戊醇、2-甲基-1-丁醇、2,2-二甲基-1-丙醇等。作为质子性极性溶剂的其它例子,可举出苯酚、甲酚等酚类等。
(3)脱硫化氢处理
在脱硫化氢处理中,使硫化氢从LiHS脱离以形成Li2S。具体而言,发生2LiHS→Li2S+H2S的反应。
脱硫化氢处理不特别限定,但例如可举出加热处理。加热处理的温度例如在150℃~220℃的范围内,优选在170℃~190℃的范围内。加热处理的时间例如在15分钟~6小时的范围内,优选在30分钟~5小时的范围内。另外,加热处理优选在使原料混合物溶解或分散于溶剂中的状态下进行或者在非活性气体气氛下进行。在前者的情况下,特别优选使用非质子性溶剂作为溶剂,更优选使用非极性的非质子性溶剂作为溶剂。其中,用于脱硫化氢处理的溶剂优选在25℃下为液体的烷烃。
另外,在本发明中,也可以将硫化处理和脱硫化氢处理作为一个反应进行。具体而言,通过将含有LiOH及LiI的前体混合物中的LiOH 硫化时的温度设定为较高,可连续地进行硫化和脱硫化氢。另外,也可以在溶解或分散于溶剂中的状态下连续地进行硫化处理和脱硫化氢处理。
B.硫化物固体电解质材料的制造方法
图5是示出本发明的硫化物固体电解质材料的制造方法的一例的流程图。如图5所示,在本发明中,首先,通过上述的制造方法准备至少含有Li2S及LiI的锂组合物(准备工序)。接着,使锂组合物与P2S5(Li2S以外的硫化物)反应,合成硫化物固体电解质材料(合成工序)。具体而言,使锂组合物分散在非极性溶剂中,添加P2S5,进行非晶化。其后,通过干燥除去非极性溶剂,由此得到硫化物玻璃形式的硫化物固体电解质材料。另外,通过在制作硫化物玻璃之后进行热处理,得到玻璃陶瓷形式的硫化物固体电解质材料。
根据本发明,通过使用特定的锂组合物,可合成杂质少的硫化物固体电解质材料。
1.准备工序
本发明中的准备工序是通过上述的锂组合物的制造方法准备锂组合物的工序。关于详细内容,与上述“A.锂组合物的制造方法”中记载的内容同样。
2.合成工序
本发明中的合成工序是使锂组合物与Li2S以外的硫化物反应,合成硫化物固体电解质材料的工序。
作为Li2S以外的硫化物,只要可得到所期望的硫化物固体电解质材料就不特别限定,但例如优选为含有A元素(A为P、Si、Ge、Al或B)及S元素的组合物。具体而言,可举出P2S3、P2S5、SiS2、GeS2、Al2S3、B2S3等。
硫化物固体电解质材料的组成不特别限定。例如,在使用含有Li2S、P2S5及LiI的原料合成硫化物固体电解质材料的情况下,Li2S相对于Li2S和P2S5的合计的比例优选在70mol%~80mol%的范围内。这是由于可得到化学稳定性高的硫化物固体电解质材料。在使用 Al2S3、B2S3替代P2S5的情况下,Li2S的上述比例也同样。
另一方面,在使用含有Li2S、SiS2及LiI的原料合成硫化物固体电解质材料的情况下,Li2S相对于Li2S和SiS2的合计的比例优选在62.5mol%~70.9mol%的范围内。这是由于可得到化学稳定性高的硫化物固体电解质材料。在使用GeS2替代SiS2的情况下,Li2S的上述比例也同样。
LiI的比例例如优选在1mol%~60mol%的范围内,更优选在5mol%~50mol%的范围内,进一步优选在10mol%~40mol%的范围内,特别优选在10mol%~30mol%的范围内。予以说明,LiI的比例是指LiI相对于全部硫化物固体电解质材料的比例。例如,是指xLiI·(100-x)(Li3PS4)中的x。
合成硫化物固体电解质材料的合成处理只要是可得到所期望的硫化物固体电解质材料的处理就不特别限定。作为合成处理的一例,可举出非晶化处理。通过非晶化处理,得到硫化物玻璃形式的硫化物固体电解质材料。作为非晶化处理,例如可举出机械研磨和熔融急冷法,其中优选机械研磨。另外,机械研磨可以是干式机械研磨,也可以是湿式机械研磨。
根据需要,也可以在非晶化处理之后进行热处理工序。通过热处理工序,可得玻璃陶瓷形式的硫化物固体电解质材料。热处理温度例如优选在160℃~200℃的范围内。热处理时间例如优选在1分钟~24小时的范围内。另外,热处理优选在非活性气体气氛(例如Ar气气氛)中进行。热处理的方法例如可举出使用烧成炉的方法。另外,也可以对含有锂组合物及Li2S以外的硫化物的混合物进行固相反应处理。通过固相反应处理,可得到结晶材料形式的硫化物固体电解质材料。
3.硫化物固体电解质材料
通过本发明得到的硫化物固体电解质材料至少具有LiI,通常具有LiI以外的离子传导体(例如Li3PS4)。另外,LiI的至少一部分优选在作为LiI成分并入离子传导体的结构中的状态下存在。另外,硫化物固体电解质材料也可以具有LiX(X为F、Cl或Br)。LiX的至少一 部分优选在作为LiX成分并入离子传导体的结构中的状态下存在。
上述离子传导体例如优选具有Li、A(A为P、Si、Ge、Al及B中的至少一种)及S,其中更优选具有原组成或其附近组成。这是由于可制成化学稳定性高的硫化物固体电解质材料。具体而言,上述离子传导体优选含有原组成的阴离子结构(PS43-结构、SiS44-结构、GeS44-结构、AlS33-结构、BS33-结构)作为主体。原组成的阴离子结构的比例相对于离子传导体中的全部阴离子结构优选为60mol%以上。予以说明,原组成的阴离子结构的比例例如可通过拉曼光谱法、NMR、XPS等来确定。
硫化物固体电解质材料优选基本上不含有Li2S和交联硫。这是由于可制成硫化氢产生量少的硫化物固体电解质材料。“基本上不含有Li2S”可通过X射线衍射来确认。具体而言,在不具有Li2S的峰(2θ=27.0°、31.2°、44.8°、53.1°)的情况下,可判断基本上不含有Li2S。另一方面,交联硫是指Li2S与上述A的硫化物反应而成的化合物中的交联硫。例如,相当于Li2S和P2S5反应而成的S3P-S-PS3结构的交联硫。“基本上不含有交联硫”可通过拉曼光谱的测定来确认。例如,在Li2S-P2S5系的硫化物固体电解质材料的情况下,S3P-S-PS3结构的峰通常出现在402cm-1处。因此,优选检测不出该峰。
作为硫化物固体电解质材料的形状,例如可举出粒子状。硫化物固体电解质材料的平均粒径(D50)例如优选在0.1μm~50μm的范围内。另外,硫化物固体电解质材料优选Li离子传导性高,25℃下的Li离子传导率例如为1×10-4S/cm以上,优选为1×10-3S/cm以上。另外,硫化物固体电解质材料可用于利用Li离子传导的任意用途,其中优选用于电池。
予以说明,本发明不限于上述实施方式。上述实施方式为例示,具有与本发明的权利要求书所记载的技术思想实质上相同的构成、取得同样的作用效果的实施方式,不论哪一种实施方式都包含在本发明的技术范围内。
实施例
以下示出实施例以更具体地说明本发明。
[比较例1]
在比较例1中,通过以往的方法制作锂组合物。在四口烧瓶中加入纯水600ml和氧化钙1.523g。接着,添加碘0.530g、甲酸0.114g(浓度88%),加热至80℃。pH为至少12以上。在确认碘的溶解后,添加碳酸锂2.006g。加热停止后,搅拌3小时以上然后过滤。向滤液添加溴化锂0.363g。接着,使用蒸发器将滤液浓缩干燥。得到的粉末为白色。
将得到的粉末添加到十三烷-戊醇的混合溶液中。一边搅拌得到的溶液,一边在120℃下使H2S气体流通2小时(硫化处理)。吹入H2S气体之后,溶液马上显色为绿色,显色随着时间的经过而变强。在使H2S气体流通的状态下在190℃下维持4小时以除去醇。其后,在使Ar气流通的状态下,在190℃下进行5小时左右的搅拌,使硫化氢从LiHS脱离(脱硫化氢处理)。其结果,得到浓绿色的浆液,将该浆液过滤后得到黑色粉末。
另一方面,将碘化锂(购入试剂)和氢氧化锂(购入试剂)混合以制作碘化锂和氢氧化锂的混合材料。具体而言,使购入试剂溶解在纯水中,在使用蒸发器浓缩之后在氩气流中在150℃下干燥,将得到的物质作为混合材料。在对该混合材料进行硫化处理时,得到白色粉末。即,在对未经过水系合成的混合材料进行硫化处理时,得到白色粉末。使购入的试剂分别溶解在纯水中。在使用蒸发器将该溶液浓缩之后,在氩气流中于150℃下干燥。
从与未经过水系合成的混合材料的对比可推定,比较例1中的浓绿色浆料混入硫胶体。因此,在对浓绿色浆料的滤液进行元素分析时确认了硫。从这些结果等可推定:由于在合成体系内产生碘酸,碘酸与硫化氢反应从而产生硫胶体。因此,以下确认将添加碘时的溶液pH设为中性范围对于抑制碘酸的产生是否有效。
[实施例1]
在实施例1中,为了抑制碘化锂合成时溶液的pH升高,向含碘水溶液缓慢添加还原性溶液,制作锂组合物。在四口烧瓶中添加纯水400ml和碘0.530g,其后加热至80℃。pH为7。准备事先在纯水200ml中混合有氧化钙0.117g、甲酸0.114g(浓度88%)的还原性溶液,花费1小时以上添加到四口烧瓶中。在确认碘的溶解后,添加氧化钙1.406g、碳酸锂2.006g。加热停止后,搅拌3小时以上然后过滤。向滤液添加溴化锂0.363g。接着,使用蒸发器将滤液浓缩干燥。得到的粉末为白色。
对于得到的粉末,进行与比较例1同样的硫化处理和脱硫化氢处理。其结果,硫化处理后的显色为非常小或几乎没有的状态。另外,脱硫化氢处理后的粉末为淡灰色。予以说明,在添加还原性溶液时,确认了碘的强烈蒸发。
[实施例2]
在实施例2中,为了研究碘化锂合成中的溶液pH的上限,在含碘水溶液中添加使用的氧化钙的一部分,制作锂组合物。在四口烧瓶中添加纯水400ml、碘0.530g、氧化钙1mg,其后加热至80℃。pH为10.21。准备事先在纯水200ml中混合有氧化钙0.117g、甲酸0.114g(浓度88%)的还原性溶液,花费1小时以上添加到四口烧瓶中。在确认碘的溶解后,添加氧化钙1.405g、碳酸锂2.006g。加热停止后,搅拌3小时以上然后过滤。向滤液添加溴化锂0.363g。接着,使用蒸发器将滤液浓缩干燥。得到的粉末为白色。
对于得到的粉末,进行与比较例1同样的硫化处理和脱硫化氢处理。其结果,硫化处理后的显色为非常小或几乎没有的状态。另外,脱硫化氢处理后的粉末为淡灰色。予以说明,在添加还原性溶液时,确认了碘的蒸发。
[比较例2]
在比较例2中,为了研究碘化锂合成中的溶液pH的上限,在含碘水溶液中添加使用的氧化钙的一部分,制作锂组合物。在四口烧瓶中添加纯水400ml、碘0.530g,进一步添加事先在纯水200ml中混合 有氧化钙0.117g、甲酸0.114g(浓度88%)的还原性溶液,其后加热至80℃。pH为11.50。在确认碘的溶解后,添加氧化钙1.406g、碳酸锂2.006g。加热停止后,搅拌3小时以上然后过滤。向滤液添加溴化锂0.363g。接着,使用蒸发器将滤液浓缩干燥。得到的粉末为白色。
对于得到的粉末,进行与比较例1同样的硫化处理和脱硫化氢处理。其结果,吹入硫化氢之后,溶液马上显色为绿色,显色随着时间的经过而变强。通过脱硫化氢处理得到浓绿色的浆液,将该浆液过滤后的粉末为灰黑色。予以说明,在添加还原性溶液时,未确认到碘的强烈蒸发。
[实施例3]
在实施例3中,将碘化锂合成中的溶液pH维持在中性附近,再分批投入碘,制作锂组合物。在四口烧瓶中添加纯水400ml,其后加热至80℃。pH为7。将碘0.530g分为6份,以约20分钟的间隔添加到四口烧瓶中。另外,准备事先在纯水200ml中混合有氧化钙0.117g、甲酸0.114g(浓度88%)的还原性溶液,在首次投入碘的同时开始注入,花费约2小时将全部量添加。在确认碘的溶解后,添加氧化钙1.406g、碳酸锂2.006g。加热停止后,搅拌3小时以上然后过滤。向滤液添加溴化锂0.363g。接着,使用蒸发器将滤液浓缩干燥。得到的粉末为白色。
对于得到的粉末,进行与比较例1同样的硫化处理和脱硫化氢处理。其结果,硫化处理后的显色为非常小或几乎没有的状态。另外,脱硫化氢处理后的粉末为淡灰色。予以说明,在添加还原性溶液时,确认了碘的蒸发。予以说明,在添加还原性溶液时,未确认到碘的强烈蒸发。在表1中示出实施例1~3、比较例1、2的实验条件。
【表1】
[评价]
(有无抑制多硫化物)
在实施例1~3中,由于抑制了由硫化处理引起的显色并得到了淡灰色粉末,因此可确认能够抑制多硫化物的产生。
(有无碘的组成偏离)
对实施例1~实施例3、比较例2中得到的粉末进行元素分析,计算出碘减少量(与装入量的偏离量,重量%)。使经称量的样品溶解在碱性溶液中。予以说明,也可以使样品溶解在纯水中。在定容后利用ICP发光分析法实施测定。通过溴化锂的重量将Li和I的比例归一化。
图6中示出碘减少量与初始pH(第一水溶液形成工序的pH)。如图6所示,关注于实施例1、2、比较例2的结果时,暗示了pH越高,越能够抑制碘的蒸发(予以说明,pH越高,多硫化物越多地生成)。另一方面,关注于实施例1、3的结果时,在实施例3中,在中性范围下也可抑制碘的蒸发。换句话说,在实施例3中,可兼顾抑制多硫化物的产生和抑制碘的蒸发。另外,表2中示出实施例1、3的组成变化。予以说明,表2中的括号内的数值表示与理论值的数值的偏离量(重 量%)。
【表2】
如表2所示,在实施例1中,相对于理论值(装入量),I偏离了5重量%左右。与此相对,在实施例3中,I为与理论值(装入量)几乎相同的值。因此,在实施例3中,确认了可抑制碘的蒸发。因此,碘减少量优选为小于5重量%,更优选为3重量%以下,进一步优选为1重量%以下。
- 还没有人留言评论。精彩留言会获得点赞!