三苯基新木质素类化合物在制备抗菌药物的应用的制作方法
本发明涉及三苯基新木质素类化合物的应用,尤其涉及含有红花八角醇、大花八角醇及其衍生物为有效成分在制备抗菌药物中的应用,属于医药技术领域。
背景技术:
耐甲氧西林的金黄色葡萄球菌(Methicillin-resistant Staphylococcus aureus,MRSA)是引起医院和社区获得性感染的重要病原菌之一,可引起肺炎、脓毒性关节炎、骨髓炎、脑膜炎和心内膜炎等多种致死性感染。尤其是医院获得性MRSA(hospital-acquired MRSA,HA-MRSA),基于其多重耐药和易传播的特点给治疗带来极大困难。目前仅糖肽类万古霉素及恶唑烷酮类利奈唑胺等少数几类药物对其有效。因此一些学者也将MRSA与乙型肝炎、艾滋病并列为世界三大感染性疾病。有资料表明,美国每年因MRSA感染导致死亡的患者数相当于AIDS、结核病和病毒性肝炎的总和。虽然万古霉素、利奈唑胺、达托霉素和替加环素等少数药物经美国FDA批准用于临床治疗MRSA感染,但近年来临床上已发现上述药物的耐药菌株,并且分得的几率逐渐增加,故新型抗MRSA感染药物的研发显得尤为迫切。
红花八角醇,大花八角醇是自八角属(Illicium)植物茎叶中分离得到的一种三苯基新木质素类化合物。其提取分离操作简便,因此由其生产的抗菌药物或其衍生物具有成本低,安全性高的特点。目前未见将其应用于制备抗菌药物中的相关报道。
技术实现要素:
本发明目的在于提供含有化合物红花八角醇(Dunnianol)或大花八角醇(Macranthol)为有效成分的药物在制备治疗耐甲氧西林金黄色葡萄球菌和多药抗药性金黄色葡萄球菌药物中的应用。
为实现本发明目的,本发明人在长期从事抗菌天然药物研究与开发的基础上,对初筛的几种抗菌活性较好的药用植物进行活性追踪,从中分离得到2个具有显著抗菌活性的天然产物红花八角醇,大花八角醇。发现红花八角醇,大花八角醇及其衍生物作为有效成分在治疗耐甲氧西林金黄色葡萄球菌和多药抗药性金黄色葡萄球菌有较好的效果。
本发明所说的三苯基新木质素类化合物为红花八角醇,大花八角醇及其衍生物,其化学通式如下:
其中R1为H或OH,R2为H或OH。
优选如下式(1)、(2)化合物:
红花八角醇,大花八角醇提取方法:在典型的分离方法中,将包含该化合物的植物与一种或多种有机试剂一起粉碎以形成一种或多种植物提取物,然后纯化该提取物以得到化合物。本发明化合物得自八角属植物,特别是得自八角属植物种野八角(Illicium simonsii),红花八角(Illicium dunnianum)或文山八角(Illicium tsaii)中提取分离得到。其它八角属植物种例如华中八角(Illicium fargesii)也可用于提取本发明化合物。
本发明从天然来源分离红花八角醇,大花八角醇。本发明化合物所采用的制备方法均为公认技术,在各种文献中均可查阅到。
在针对革兰氏阳性菌株,特别是MRSA和耐青霉素变异菌株方面,本发明所述化合物具有比现有技术有更好的活性,例如对细菌的多药抗药性菌株的活性。在发明人进行的实验中,发现所述化合物具有对β-内酰胺类、大环内脂类、氟喹诺酮类和四环素类耐药的菌株在内的所有多药抗药性菌株的显著活性。可以将本化合物直接使用,或者以药物组合物的形式使用。该药物组合物含有质量百分比0.1-99%本发明化合物,优选为0.5-90%,其余为药物学上可接受的、对人和动物无毒和惰性的可药用载体和/或赋形剂。
所述的药用载体或赋形剂是一种或多种固体、半固体和液体稀释剂、填料以及药物制品辅剂。将本发明药物组合物以单位体重服用量或涂膜剂的形式使用。红花八角醇,大花八角醇及其衍生物的组合物采用制药领域公认的方法制备成各种剂型。如液体制剂(注射液、混悬剂、乳剂、溶液剂、糖浆剂等)、固体制剂(片剂、胶囊剂、颗粒剂、冲剂等)、喷剂、气雾剂、软膏剂等。本发明的药物可经注射(静脉注射,静脉滴注、肌肉注射、腹腔注射、皮下注射)和口服、舌下给药、粘膜透析等给药途径进行细菌感染的治疗。
本发明优点:所得红花八角醇,大花八角醇及其衍生物分离自植物天然产物,显示出对革兰氏阳性球菌的抗菌活性,尤其针对临床治疗困难的耐甲氧西林金黄色葡萄球菌(Methicillin-resistant Staphylococcus aureus,MRSA)和多药耐药的葡萄球菌属。作为有效成分将其应用在制备治疗耐甲氧西林金黄色葡萄球菌和多药抗药性金黄色葡萄球菌药物中具有较好的效果。有利于新型抗MRSA感染药物的研发。
附图说明
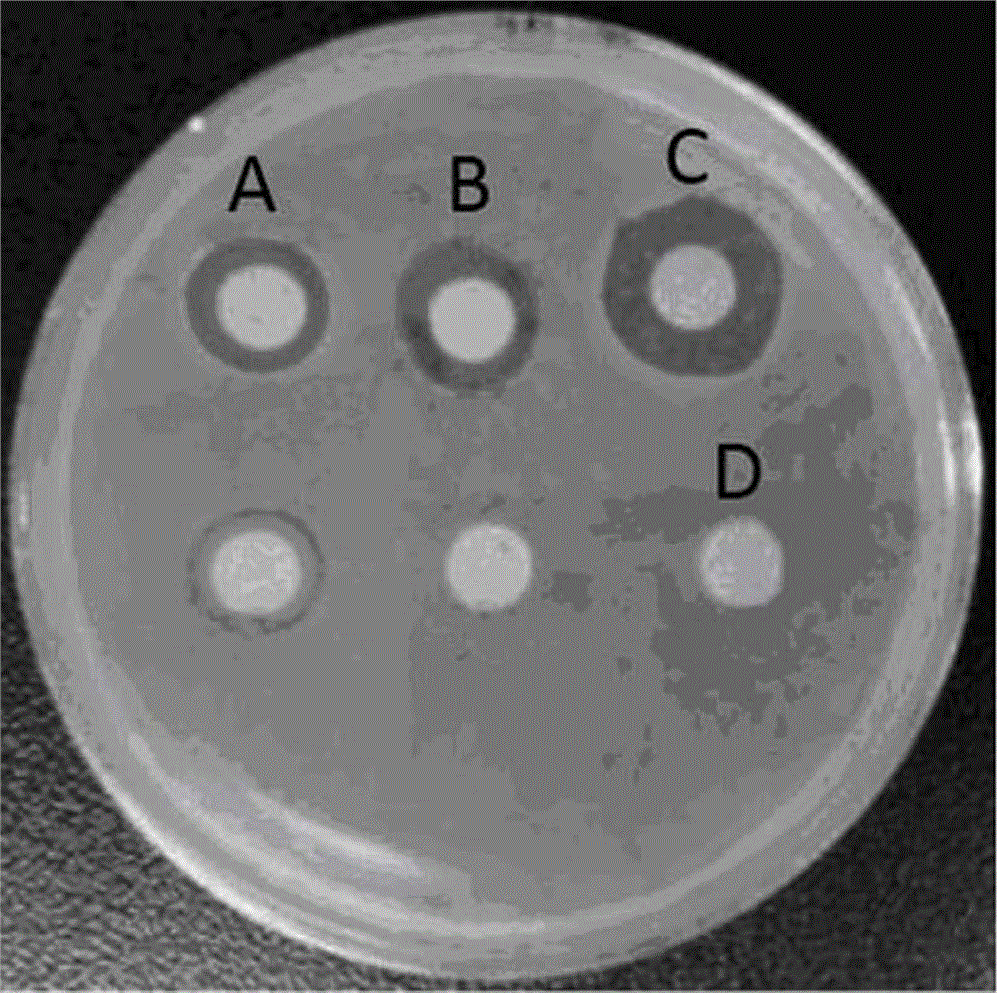
图1为本发明药物对金葡菌敏感株的抑菌活性实验,图中:A-红花八角醇,B-大花八角醇,C-万古霉素,D-DMSO;
图2为本发明药物对MRSA临床株的抑菌活性实验,图中:A-红花八角醇,B-大花八角醇,C-万古霉素,D–DMSO。
具体实施方式
为对本发明进行更好地说明,举实施例如下:
实施例1:红花八角醇(1),大花八角醇(2)的提取分离纯化:
采集野八角茎叶,阴干,其学名经鉴定为Illicium simonsii Maxim.,粉碎。取7.0kg阴干、粉碎的野八角茎叶,用质量百分比95%乙醇回流提取3次,每次40L,每次3小时,过滤液浓缩至小体积,加水3L使悬浮,分别用氯仿(3L×3)和正丁醇(3L×4)萃取,减压蒸馏得到氯仿部分(300g)和正丁醇部分(300g)。
氯仿部分(134g)用氯仿/甲醇溶解后吸附于300g硅胶,室温挥干后经硅胶柱层析(1kg,9.5×40cm,柱体积1500mL),氯仿/甲醇(100∶0,95∶5,90∶10,80∶20,70∶30,60∶40,0∶100)梯度洗脱,每1500mL为一个流分。经硅胶TLC检查,合并相同流份,得9个流分(A-I)。对各流分进行进一步的活性筛选发现,流分E活性最强。
对流分E进行进一步的化学成分分离。流分E(16.0g)用氯仿/甲醇溶解后吸附于20g硅胶,称取200g硅胶装柱(4×40cm),以氯仿/丙酮(95:5,85:15,70:30)为洗脱剂梯度洗脱得到五个流分(E-1—E-5)。E-4(10g)以石油醚/丙酮(95:5)为洗脱剂经硅胶柱(4×55cm,270g)得到流分E-3-2,再经硅胶柱反复纯化(石油醚:丙酮=90:10)得到化合物1(2g),化合物2(0.2g)。
结构测定:旋光由JASCODIP-370旋光仪测定;红外光谱(IR)采用KBr压片法,由Bio-Rad FTS-135型红外光谱仪;核磁共振谱(1H-、13C-NMR、DEPT)用Brucker AM-400型和DRX-500型超导核磁共振仪测定、TMS(四甲基硅烷)作内标;质谱(MS)用VGAutospec-3000型质谱仪测定;薄层色谱硅胶、柱层析硅胶(200-300目)购自青岛海洋集团有限公司。
UV(甲醇):λmax(1ogε)=320(2.39),295(2.69),216(3.41)。
IR(溴化钾):IR vmax(KBr)cm-1:3250,3070,2975,2870,1640,1498,1405。
EI-MS m/z(%):398([M]+,100),369(15),316(20),298(18)。
1H-NMR(500MHz,CDCl3):δ:7.13(2H,s,H-3,H-5),7.11(2H,d,J=10.0Hz,H-5',H-5”),7.09(2H,s,H-3',H-3”),6.85(2H,d,J=10.0Hz,H-6',H-6”),6.00(3H,m,H-8,H-8',H-8”),5.95(4H,m,H-9,H-9”),5.13(2H,m,H-9),3.37(6H,d,J=8.5Hz,H-7,H-7',H-7”)。
13C-NMR(125MHz,CDCl3)δ:147.6(s,C-1),125.8(s,C-2,C-6),131.4(d,C-3,C-5),133.8(s,C-4),39.4(t,C-7),137.3(d,C-8),116.1(t,C-9),150.9(s,C-1',C-1”),124.8(s,C-2',C-2”),131.6(d,C-3',C-3”),133.2(s,C-4',C-4”),129.7(d,C-5',C-5”),117.0(d,C-6',C-6”),39.4(t,C-7',C-7”),137.5(d,C-8',C-8”),115.8(t,C-9',C-9”)。
UV(甲醇):λmax(1og ε)=295(2.73),214(3.28),204(3.29)。
IR(溴化钾):IR vmax(KBr)cm-1:3434,3217,1637,1498,1468,1174,913cm-1。
EI-MS m/z(%):398([M]+,100),369(15),316(20),298(18)。
1H-NMR(400MHz,CDCl3)δ:7.29(1H,d,J=2.2Hz,H-2),7.25(1H,d,J=2.2Hz,H-6),7.14(1H,dd,J=8.1,2.2Hz,H-4”),7.10(1H,d,J=2.2Hz,H-6”),7.04(1H,d,J=2.2Hz,H-6'),7.03(1H,overlaped,H-4'),6.94(1H,d,J=8.1Hz,H-3”),6.88(1H,dd,J=7.2,1.8Hz,H-3'),6.05(1H,m,H-8),5.98(1H,m,H-8”),5.93(1H,m,H-8'),5.17(2H,m,H-9),5.03-5.10(2H,overlaped,H-9'),5.03-5.10(2H,overlaped,H-9”)。
13C-NMR(125MHz,CDCl3)δ:130.1(s,C-1),130.9(d,C-2),128.3(s,C-3),150.9(s,C-4),124.8(s,C-5),130.0(d,C-6),35.0(t,C-7),136.2(d,C-8),116.7(t,C-9),127.5(s,C-1'),150.8(s,C-2'),115.8(d,C-3'),128.9(d,C-4'),132.4(s,C-5'),130.3(d,C-6'),39.3(t,C-7'),137.4(d,C-8'),115.9(t,C-9'),123.3(s,C-1”),151.2(s,C-2”),116.8(d,C-3”),130.2(d,C-4”),133.4(s,C-5”),131.3(d,C-6”),39.4(t,C-7”),137.7(d,C-8”),115.6(t,C-9”)。
实施例2.红花八角醇,大花八角醇的体外抗菌活性实验
(1)K-B纸片法:
实验方法:参照美国临床和实验室标准协会(Clinical and Laboratory Standards Institute,CLSI)M02-A11文件关于药敏纸片制备的方法,同时制备本发明药物和阳性对照药物万古霉素的药敏纸片,使纸片载药量为10μg/mL。此外,设溶剂DMSO阴性对照纸片。将制备好的药敏纸片分别贴于涂布好金黄色葡萄球菌标准株ATCC 29213和MRSA临床株JP-5的MHA琼脂板上,在放置好纸片后15min内倒置琼脂板并将其放置在37℃孵箱中培养16-18小时后读取结果,即抑菌圈大小。
实验结果:从图1抑菌圈内径大小可见(红花八角醇0.49cm;大花八角醇0.46cm;万古霉素:0.53cm),本发明药物红花八角醇和大花八角醇对金葡菌敏感株表现出与万古霉素(临床治疗包括MRSA在内的金葡菌感染的一线药物)相当的抑菌活性。对MRSA临床株(图2)的抑菌活性(红花八角醇0.41cm;大花八角醇0.41cm)虽然稍弱于万古霉素(0.58cm),但仍表现出显著抑菌活性。
(2)微量肉汤稀释法测定最低抑菌浓度(Minimum Inhibitory Concentration,MIC):
实验方法:参照CLSI M07-A9文件关于稀释法抗菌药物敏感性试验方法标准,测定本发明药物对MRSA临床株的最低抑菌浓度。该实验中,本发明药物的溶解剂为DMSO,稀释剂为纯水,DMSO终浓度≤1%;受试药物稀释检测范围为8-0.015μg/mL;金黄色葡萄球菌标准株ATCC 29213为质控菌株。具体方法如下:按照倍比稀释法,将抗菌药物原液用MH肉汤稀释成10个梯度,依次加入96孔细胞培养板前10个孔中,每孔100μL。用MH肉汤将测试菌株稀释成105CFU/mL,在每排前10孔各加入稀释菌液100μL。第11孔加100μL MH肉汤作阴性对照,第12孔加100μL稀释菌液作阳性对照。37℃培养16~20h,观察各孔培养液中细菌的生长情况,以抑制细菌生长的药物最高稀释度作为测试药物的最小抑菌浓度(MIC)。每种药物做2个平行。
实验结果:由表1可见,本发明药物对MRSA临床株表现出与万古霉素相当的良好的抗菌活性。
表1本发明药物对10株无重复临床分离MRSA的MIC(μg/mL)
实施例3.红花八角醇,大花八角醇对小鼠表皮感染模型的在体抗菌活性试验
实验方法:
将小鼠适应性饲养1周,期间给予充足的鼠粮和水。1周后随机挑取30只小鼠剪去背毛,用质量百分比10%水合氯醛0.1ml/20g将其麻醉,麻醉后的小鼠用恒温烫伤仪100℃烫伤10秒,烫伤压力1000g烫伤面积为2.5cm2;挑取过夜培养的MRSA临床株,200rmp 37℃过夜培养,取100μL菌液于每只小鼠烫伤伤口处涂匀进行感染,反复感染11次,经检测30只小鼠全部感染成功。将30只感染小鼠随机分为2组,每组15只,再将每组的15只小鼠随机分为5组每组3只,分别为大花八角醇组、红花八角醇组、万古霉素组、生理盐水组、1%DMSO组,小鼠感染感染24和48h后给药,每3h给药1次,连续给药5次,每次给药量4μg(100μL,浓度40μg/mL)。给药后第15个小时将小鼠脱臼处死,用酒精棉球简单消毒感染部位周围,用蘸有生理盐水的棉签刮擦感染部位,取脓液于1mL生理盐水中,3000转离心5分钟,弃上清,再加1mL生理盐水重悬菌体,混匀,稀释适当倍数后涂布于金黄色葡萄球菌显色培养基(金葡菌在此板上显红色,杂菌无色或蓝色),37℃培养16-18h后读取菌落数(每组每只小鼠平行涂板3块,菌落数取平均数),观察持续给药后感染部位菌落减少数。
实验结果:由表2可见,本发明药物大花八角醇和红花八角醇,对小鼠MRSA表皮感染模型的治疗效果显著,能够显著降低小鼠感染部位的菌落数,对MRSA具有一定的抑杀活性。
表2本发明药物对小鼠MRSA表皮感染模型的治疗效果
实施例4:注射液
本发明化合物1或化合物2用少量的DMSO溶解后,按常规加注射用水,精滤,灌封灭菌制成注射液。
实施例5:片剂
本发明化合物1或化合物2与赋形剂按照重量比为1:5的比例加入赋形剂,制粒压片,得片剂。
实施例6:胶囊
本发明化合物1或化合物2与赋形剂按照重量比为1:5的比例加入赋形剂,制成胶囊。
实施例7:软膏剂
本发明化合物1或化合物2与赋形剂按照重量比为1:5的比例加入赋形剂,制成软膏剂。
本发明的用途和方法已经通过具体的实施例进行了描述。本领域技术人员可以借鉴本发明的内容适当改变原料、工艺条件等环节来实现相应的其它目的,其相关改变都没有脱离本发明的内容,所有类似的替换和改动对于本领域技术人员来说是显而易见的,都被视为包括在本发明的范围之内。
- 还没有人留言评论。精彩留言会获得点赞!