阿洛酮糖的制备方法与流程
本发明涉及能够以高纯度分离阿洛酮糖的阿洛酮糖的制备方法。
背景技术:
阿洛酮糖(d-psicose)为果糖(d-fructose)的3号碳的差向异构体(epimer),虽然像普通糖类一样具有甜味,但由于无法在人体内代谢,因而属于因卡路里几乎为零而对糖尿病及肥胖患者而言可作为代替白糖的功能性甜味剂来使用的功能性糖。并且,具有通过抑制在肝脏参与脂质合成的酶的活性来减少腹部肥胖的功能,是当前作为糖尿病和动脉硬化治疗剂来进行研究的糖。
像这样,随着阿洛酮糖作为甜味剂备受瞩目,在食品产业领域,开发可有效生产阿洛酮糖的方法的必要性逐渐增加。由于在天然物质内的糖蜜处理过程或葡萄糖异构化反应过程中存在非常少量的阿洛酮糖,因而现有的阿洛酮糖生产主要通过化学过程来实现。比利克(bilik)等人曾开发利用钼酸(molybdicacid)离子的催化作用来从果糖生产阿洛酮糖的技术。麦克唐纳(mcdonald)通过对1,2:4,5-二-o-丙酮缩甘油-β-d-果糖(1,2:4,5-di-o-ispropylidene-bata-d-fructopyranose)进行三步骤化学处理过程来生产了阿洛酮糖。并且,多纳(doner)通过对乙醇、三乙胺及果糖一同进行加热的方法生产了阿洛酮糖。但是,这些通过化学方法生产阿洛酮糖的方法花费很多费用,相反,存在生产效率低、产生大量副产物的问题。
作为基于生物学方法实现的阿洛酮糖生产方法,肯·伊兹莫里(kenizumori)等人证实了可利用微生物细胞反应来从半乳糖醇(galacitol)、d-塔格糖(d-tagatose)或d-塔罗糖醇(d-talitol)等生产阿洛酮糖。但是,这些底物属于自然界中非常稀缺的糖或糖醇,具有成本高的缺点。
酶转换方法有在重组大肠杆菌中生产并纯化分离微生物菊苣假单胞菌st-24(pseudomonascichoriist-24)的d-塔格糖-3-差向异构酶(d-tagatose-3-epimerase)来使果糖酶转换为阿洛酮糖的方法,肯·伊兹莫里等人曾利用固定d-塔格糖-3-差向异构酶的反应系统来以25%的转换率生产了阿洛酮糖。
根据这种现有技术,为了从果糖生产阿洛酮糖,以往以通过纯化酶,固定所纯化的酶来提高阿洛酮糖生产率的方向进行了研究。但这种酶纯化过程实际需要很多时间和费用。
另一方面,果糖具有与阿洛酮糖类似的物性,从而即使生产阿洛酮糖,也存在难以从果糖中分离其的问题。
因此,需要能够以高效率生产阿洛酮糖且容易分离其的阿洛酮糖的生产方法。
现有技术文献
专利文献
韩国公开专利第2013-0029754号
技术实现要素:
技术问题
本发明的目的在于,提供能够以高纯度分离阿洛酮糖的阿洛酮糖的制备方法。
本发明的目的在于,提供阿洛酮糖的生产能力得到改善的阿洛酮糖的制备方法。
解决问题的方案
本发明的一实施方式提供阿洛酮糖的制备方法,其包括:在果糖及阿洛酮糖的混合物中添加甘露醇脱氢酶来使上述果糖转换为甘露醇的步骤;以及从上述混合物中分离上述甘露醇的步骤。
作为阿洛酮糖的代表性的制备方法,可例举利用催化剂来将果糖转换为阿洛酮糖的化学方法、将对催化从果糖到阿洛酮糖的转换的酶进行编码的基因导入于微生物,来从中将果糖转换为阿洛酮糖的生物学方法等。
这些方法具有均将果糖用作底物的共同点,果糖和阿洛酮糖的物性类似,从而存在难以从反应混合物中分离阿洛酮糖的问题。
但是,本发明人着眼于可使果糖和阿洛酮糖的混合物与甘露醇脱氢酶发生反应来将果糖转换为甘露醇,并从甘露醇中分离阿洛酮糖,来更容易且高效率地分离阿洛酮糖的情况,从而完成了本发明。
以下,详细说明本发明。
根据本发明的一实例,首先,在果糖及阿洛酮糖的混合物中添加甘露醇脱氢酶来使上述果糖转换为甘露醇。
上述果糖及阿洛酮糖的混合物是通过化学或生物学方法来将果糖转换为阿洛酮糖之后的经转换的阿洛酮糖和未转换的果糖的混合物。
对此,本发明还可包括如下步骤:使作为底物的果糖与其差向异构酶发生反应,来制备上述果糖及阿洛酮糖的混合物。
上述差向异构酶可以为阿洛酮糖-3-差向异构酶,具体地,可以为来源于根癌土壤杆菌(agrobacteriumtumefaciens)的阿洛酮糖-3-差向异构酶或来源于粪厌氧棒状菌(anaerostipescaccae)的阿洛酮糖-3-差向异构酶。
对上述差向异构酶进行编码的基因可以为对来源于序列1的根癌土壤杆菌的阿洛酮糖-3-差向异构酶进行编码的基因或对来源于序列2的粪厌氧棒状菌的阿洛酮糖-3-差向异构酶进行编码的基因。
来源于根癌土壤杆菌的阿洛酮糖-3-差向异构酶可具有序列3的氨基酸序列,来源于粪厌氧棒状菌的阿洛酮糖-3-差向异构酶可具有序列4的氨基酸序列。
差向异构酶具有更优秀的高温稳定性,从这个方面来看,优选地,对差向异构酶进行编码的基因可以为对序列5的阿洛酮糖-3-差向异构酶的氨基酸序列进行编码的基因。
上述序列5的氨基酸序列为来源于根癌土壤杆菌的阿洛酮糖-3-差向异构酶的氨基酸序列中的第33个氨基酸被亮氨酸取代且第213个氨基酸被半胱氨酸取代的序列,其热稳定性优秀。
本发明的发明人确认了来源于梭菌属的阿洛酮糖-3-差向异构酶具有优秀的热稳定性,参照图7,在热稳定性高的来源于梭菌属的阿洛酮糖-3-差向异构酶的情况下,一个氨基酸具有与其相对应的序列,或具有如上所述的两个序列。
对此,不仅是来源于根癌土壤杆菌的阿洛酮糖-3-差向异构酶,来源于其他菌株的阿洛酮糖-3-差向异构酶也被确认到与来源于上述根癌土壤杆菌的阿洛酮糖-3-差向异构酶的氨基酸序列的第33个氨基酸、第213个氨基酸相对应的氨基酸序列为对提高热稳定性重要的序列。
这种氨基酸序列的具体的例可例举在序列6的氨基酸序列中第32个氨基酸被亮氨酸取代或第196个氨基酸被半胱氨酸取代的序列。序列6为对图7中的用方框所标注的序列进行排列的序列,是在本发明中所使用的根癌土壤杆菌、粪厌氧棒状菌、鲍氏梭菌(clostridiumbolteae)、来源于门冬虫梭菌(clostridiumhylemonae)的阿洛酮糖-3-差向异构酶氨基酸序列(序列3、序列4、序列9、序列10)的共同碱基序列。因此,上述微生物可以为被对上述氨基酸序列进行编码的基因取代的,但并不限定于此。
并且,同样,从优秀的高温稳定性、阿洛酮糖的生产能力方面来看,差向异构酶可以为来源于梭菌属的阿洛酮糖-3-差向异构酶,对其进行编码的基因可以为对来源于序列7的鲍氏梭菌的阿洛酮糖-3-差向异构酶进行编码的基因或对来源于序列8的门冬虫梭菌的阿洛酮糖-3-差向异构酶进行编码的基因。从将高温稳定性极大化的方面来看,优选地,可以为对来源于序列8的门冬虫梭菌的阿洛酮糖-3-差向异构酶进行编码的基因。
来源于鲍氏梭菌的阿洛酮糖-3-差向异构酶可具有序列9的氨基酸序列,来源于门冬虫梭菌的阿洛酮糖-3-差向异构酶可具有序列10的氨基酸序列。
在所例示的上述阿洛酮糖-3-差向异构酶中,来源于粪厌氧棒状菌的阿洛酮糖-3-差向异构酶、具有在序列6的氨基酸序列中的第32个氨基酸被亮氨酸取代或第196个氨基酸被半胱氨酸取代的序列的阿洛酮糖-3-差向异构酶、来源于鲍氏梭菌的阿洛酮糖-3-差向异构酶及来源于门冬虫梭菌的阿洛酮糖-3-差向异构酶的表示最佳活性的ph为7以下。
果糖和差向异构酶的反应可在20℃至90℃的温度下执行,从阿洛酮糖的生产能力极大化方面来看,优选地,可在40℃至90℃的温度下执行。具体地,例如,可以为40℃至50℃、40℃至60℃、40℃至70℃、40℃至80℃、40℃至90℃、45℃至60℃、45℃至70℃、45℃至80℃、45℃至90℃、50℃至70℃、50℃至80℃、50℃至90℃、55℃至60℃、55℃至70℃、55℃至80℃、55℃至90℃、60℃至70℃、60℃至80℃、60℃至90℃、70℃至80℃、70℃至90℃、75℃至80℃、75℃至90℃、80℃至90℃等。若反应温度大于90℃,则差向异构酶或后述的微生物有可能被热损伤或变性。
若上述反应在40℃以上的温度下执行,则差向异构酶有可能被热损伤或变性,因而优选地,上述反应在微生物内执行。随着反应温度增加,阿洛酮糖生产能力更增加,但差向异构酶热变性而有可能难以将其实现,但是,在微生物内执行上述反应的情况下,差向异构酶由微生物保护,因而可在高温条件下执行反应。
在本说明书中,术语“微生物”可以为可在液体培养基中进行培养的细胞。
上述微生物可内在性表达上述差向异构酶或通过转化来表达上述差向异构酶。在此情况下,可在微生物内生成差向异构酶来通过上述果糖与差向异构酶的微生物内反应连续执行阿洛酮糖的生产。
在上述微生物转化为对差向异构酶进行编码的基因来表达差向异构酶的情况下,对上述差向异构酶进行编码的基因可以为对来源于序列1的根癌土壤杆菌的阿洛酮糖-3-差向异构酶进行编码的基因或对来源于序列2的粪厌氧棒状菌的阿洛酮糖-3-差向异构酶进行编码的基因。
差向异构酶具有更优秀的高温稳定性,从这个方面来看,优选地,对差向异构酶进行编码的基因可以为对序列5的阿洛酮糖-3-差向异构酶的氨基酸序列进行编码的基因。
并且,同样,从优秀的高温稳定性、阿洛酮糖的生产能力方面来看,对差向异构酶进行编码的基因可以为对来源于序列7的鲍氏梭菌的阿洛酮糖-3-差向异构酶进行编码的基因或对来源于序列8的门冬虫梭菌的阿洛酮糖-3-差向异构酶进行编码的基因。
上述微生物为原核细胞或真核细胞,可在液体培养基中进行培养,并可在上述的高温条件下进行培养。上述微生物例如可以为细菌、霉或它们的组合。细菌可以为革兰氏阳性细菌、革兰氏阴性细菌或它们的组合,从提高阿洛酮糖生产率方面来看,优选地,可以为革兰氏阳性细菌。革兰氏阴性细菌可以为埃希氏菌属(escherichia)。革兰氏阳性细菌可以为芽孢杆菌属、棒状杆菌属、放线菌属、乳酸菌或它们的组合。霉可以为酵母、克鲁维酵母属或它们的组合。
在本发明的阿洛酮糖的生产方法中,若果糖与差向异构酶的反应在40℃以上的温度下执行,则微生物优选为热稳定性高的高温型微生物(thermophiles)。例如,可以为棒状杆菌属、放线菌属,更优选为谷氨酸棒状杆菌,最优选为向谷氨酸棒状杆菌atcc13032导入对上述差向异构酶进行编码的基因的微生物。
埃希氏菌属微生物可以为大肠杆菌,具体地,可以为向dh5α、mg1655、bl21(de)、s17-1、xl1-blue、bw25113或它们的组合导入对差向异构酶进行编码的基因的微生物。
并且,上述大肠杆菌可以为对内在性6-磷酸果糖激酶进行编码的基因及由阿洛糖代谢操纵子(allosemetabolicoperon)形成的一个区域实现非活性化的菌。
对上述6-磷酸果糖激酶进行编码的基因例如可以为具有序列11的核苷酸序列的基因,6-磷酸果糖激酶可以为具有序列12的氨基酸序列的酶。
构成上述阿洛糖代谢操纵子的基因为rpib、alsr、alsb、alsa、alsc、alse及alsk,可以为其中的一个以上的基因实现非活性化的基因。
上述rpib、alsr、alsb、alsa、alsc、alse及alsk基因例如可以为分别具有序列13、序列14、序列15、序列16、序列17、序列18及序列19的核苷酸序列的基因。
上述rpib、alsr、alsb、alsa、alsc、alse及alsk基因可以为分别对序列20、序列21、序列22、序列23、序列24、序列25及序列26的氨基酸序列进行编码的基因。
术语“非活性化”意味着上述基因的表达减少或未形成表达的情况。上述“非活性化”可通过本领域公知的方法来实现。例如,可通过同源重组(homologuousrecombination)来实现非活性化。上述同源重组例如可由转位子突变(transposonmutagenesis)或p1转导(p1transduction)介导。
棒状杆菌属微生物可以为谷氨酸棒状杆菌,具体地,可以为向谷氨酸棒状杆菌atcc13032导入对差向异构酶进行编码的基因的微生物。
棒状杆菌属微生物可以为将内在性d-果糖转换为d-果糖1-磷酸盐并使作为向菌体内进行转运的pts转运系统的ptsf(eiifru、frua、ncgl1861、gi:19553141、ec2.7.1.69)基因缺损或实现非活性化的微生物。
ptsf基因可以为具有序列27的核苷酸序列的基因,也可以为对序列28的氨基酸序列进行编码的基因。
由于阿洛酮糖从d-果糖生成,因而若使上述基因缺损或实现非活性化,则可抑制果糖的磷酸化,因而可明显改善阿洛酮糖的生成效率。
并且,棒状杆菌属微生物可以为使对甘露醇2-脱氢酶(mannitol2-dehydrogenase)进行编码的mtld(ncgl0108、gi:19551360、ec1.1.1.67)基因缺损或实现非活性化的微生物。
mtld基因可以为具有序列29的核苷酸序列的基因,也可以为对序列30的氨基酸序列进行编码的基因。
若上述果糖与其差向异构酶的反应在微生物内执行,则可在包含果糖的培养基中培养微生物。
上述培养基可以为2yt培养基、lb培养基、tb培养基等的包含酵母提取物和氮源的营养培养基。
培养基所包含的果糖的浓度不受特别限制,例如,能够以1%(w/v)至80%(w/v)的浓度包含,在上述范围内,例如,可以为1%(w/v)至35%(w/v)、10%(w/v)至80%(w/v)、20%(w/v)至80%(w/v)、30%(w/v)至80%(w/v)、40%(w/v)至80%(w/v)等。优选地,可以为1%(w/v)至50%(w/v)。
并且,培养基可以为包含葡萄糖、甘油等的碳源、包含氨、尿素(urea)等的氮源、钠、钾、钙、镁、锰、钴等的必要金属离子、包含维生素等的在本领域通常使用的规定(defined)培养基。
上述培养可以为连续、半连续或批量(batch)形式的培养。
上述微生物可在包含果糖的培养基中以使菌体的浊度(在600nm的吸光度下测定的测定值,以下称为od600)达到0.01至300的浓度接种,例如,菌体的浊度可达到1至300、10至300、20至300、5至300或40至300。通过使用包含这种高浓度的上述酶的菌体,可在包含高浓度果糖的培养基中使果糖有效地转换为阿洛酮糖。
上述培养可通过还添加用于诱导对差向异构酶进行编码的基因的表达的物质来执行。
用于诱导基因的表达的物质不受特别限制,可以为在本领域通常使用的物质。
在本发明的阿洛酮糖的生产方法中,可在仅包含作为底物的果糖和用于供给辅助因子的无机盐的培养基中生产阿洛酮糖。可在仅包含作为底物的果糖和用于供给辅助因子的无机盐的培养基中执行上述反应。上述无机盐例如可以为锰盐或钴盐。从呈现更加得到改善的阿洛酮糖的生产速度的方面来看,优选为钴盐,从可将所生产的阿洛酮糖安全地用作食品等的方面来看,优选为锰盐。
仅包含果糖和无机盐的培养基可以为果糖和无机盐溶解于溶剂的液体培养基。溶剂例如可以为水。
当利用微生物来生产阿洛酮糖时,除了阿洛酮糖之外,培养基中还会生成微生物的有机酸等的代谢物等,因而培养基有可能逐渐被酸性化。由于本发明的仅包含果糖和无机盐的培养基并不包含缓冲溶液,因而更优选地,使用最佳活性ph低的(例如,ph为7以下)阿洛酮糖-3-差向异构酶。
在上述果糖与差向异构酶发生反应之前,本发明的阿洛酮糖的生产方法还可包括如下的步骤:在未包含上述果糖的培养基中培养上述微生物,来以使上述微生物具有休眠细胞的方式进行诱导。
以具有上述休眠细胞的方式进行的诱导可通过在未包含果糖的培养基中将上述微生物培养至静止期(stationaryphase)来执行。
在本说明书中,休眠细胞(restingcell)意味着处于不再进行增殖的状态的培养细胞。在本说明书中,静止期意味着在培养细胞的过程中经过对数生长期(exponentialphase)后使细胞的分裂及增殖停止来不再呈现出细胞个体数量的增加并使细胞成分的合成和分解达到均衡的状态。
因此,本发明的休眠细胞意味着处于结束生长并使细胞内的差向异构酶的表达达到充分的状态的细胞,在以使微生物具有休眠细胞的方式进行诱导的情况下,差向异构酶的表达量呈现最大值,从而可将阿洛酮糖的生产极大化。
除了不包含果糖之外,未包含果糖的培养基可以为与上述的包含果糖的培养基相同的培养基。
并且,在上述果糖与其差向异构酶发生反应之后,本发明还可包括如下的步骤:回收上述微生物来再用于使其他底物转换为阿洛酮糖。
在本发明中,在微生物内执行果糖与其差向异构酶的反应,即使露出在高温下,也可使差向异构酶得到微生物的保护,因此仍然呈现出酶的活性,因而可以再使用。
即,可在上述反应之后,通过回收上述微生物来再用于使其他底物转换为阿洛酮糖。
若在可使所分离的微生物的生育得到维持的环境中执行反应,则再使用次数不受限制,可达到数百次以上、数千次以上。
若本发明还包括再使用微生物的步骤,则微生物多次露在高温下,因而优选地,使用热稳定性高的高温型微生物,以使再使用时的酶的活性达到高的水平。
在上述的例示内容中,优选地,可以为棒状杆菌属、放线菌属,更优选为谷氨酸棒状杆菌,最优选为向谷氨酸棒状杆菌atcc13032导入对上述差向异构酶进行编码的基因。
在本发明中,使上述果糖及阿洛酮糖的混合物与甘露醇脱氢酶发生反应,来将未与差向异构酶发生反应的果糖转换为甘露醇。
若在微生物内执行上述的果糖与阿洛酮糖的转换反应,则上述反应混合物可以为从微生物中分离果糖和阿洛酮糖的混合物的上清液。
上述甘露醇脱氢酶可以为甘露醇-2-脱氢酶。具体地,可以为来源于假肠膜明串珠菌atcc12291(leuconostocpseudomesenteroidesatcc12291)的甘露醇-2-脱氢酶(genbank:cad31644.1,gi:28865823)、来源于肠膜明串珠菌(leuconostocmesenteroides)的甘露醇-2-脱氢酶(genbank:act22631.1,gi:253317413)、来源于类球红细菌(rhodobactersphaeroides)的甘露醇-2-脱氢酶(genbank:aac45771.1,gi:2338764)或来源于荧光假单胞菌dsm50106(pseudomonasfluorescensdsm50106)的甘露醇-2-脱氢酶(genbank:aac04472.1,gi:2293418),从果糖向甘露醇的转换率方面来看,优选地,可以为来源于假肠膜明串珠菌atcc12291的甘露醇-2-脱氢酶。
来源于假肠膜明串珠菌atcc12291的甘露醇-2-脱氢酶可具有序列43的氨基酸序列,来源于肠膜明串珠菌的甘露醇-2-脱氢酶可具有序列44的氨基酸序列,来源于类球红细菌的甘露醇-2-脱氢酶可具有序列45的氨基酸序列,来源于荧光假单胞菌dsm50106的甘露醇-2-脱氢酶可具有序列46的氨基酸序列。
根据需要,果糖及阿洛酮糖的混合物与甘露醇脱氢酶的反应可在还原型烟酰胺腺嘌呤二核苷酸(nadh,(nad,nicotinamideadeninedinucleotide)的还原形态)供给源存在下执行。
还原型烟酰胺腺嘌呤二核苷酸为甘露醇脱水酶的辅酶,在向甘露醇脱水酶供给还原型烟酰胺腺嘌呤二核苷酸的情况下,可明显增加果糖向甘露醇的转换率。由此,反应液中的果糖减少,从而可更容易分离阿洛酮糖。
还原型烟酰胺腺嘌呤二核苷酸供给源可不受限制地使用在本领域公知的物质,例如,可以为甲酸及甲酸脱氢酶。
甲酸脱氢酶可不受限制地使用在本领域公知的甲酸脱氢酶,例如,可以为来源于母牛分枝杆菌菌苗n10(mycobacteriumvaccaen10)的甲酸脱氢酶(formatedehydrogenase,fdh,genbank:ab072394.1,gi:15982576)。
来源于母牛分枝杆菌菌苗n10(mycobacteriumvaccaen10)的甲酸脱氢酶可具有序列49的氨基酸序列。
同样,上述反应混合物与甘露醇脱氢酶的反应可在微生物内执行。
上述微生物为原核细胞或真核细胞,可在液体培养基中进行培养,并可在上述的高温条件下进行培养。上述微生物例如可以为细菌、霉或它们的组合。细菌可以为革兰氏阳性细菌、革兰氏阴性细菌或它们的组合,从提高阿洛酮糖生产率方面来看,优选地,可以为革兰氏阳性细菌。革兰氏阴性细菌可以为埃希氏菌属。革兰氏阳性细菌可以为芽孢杆菌属、棒状杆菌属、放线菌属、乳酸菌或它们的组合。霉可以为酵母、克鲁维酵母属或它们的组合。
阿洛酮糖作为代替白糖的功能性甜味剂,用于食品中,上述微生物优选为一般认为安全的(gras,generallyrecognizedassafe)菌株。例如,可以为棒状杆菌属,更具体地,可以为谷氨酸棒状杆菌,最优选地,可以为谷氨酸棒状杆菌atcc13032。
上述微生物可内在性表达上述甘露醇脱氢酶或通过转化来表达上述甘露醇脱氢酶。在此情况下,可在微生物内生成甘露醇脱氢酶来通过上述反应混合物与甘露醇脱氢酶的微生物内反应连续执行甘露醇的生产。
在上述微生物转化为对甘露醇脱氢酶进行编码的基因来使甘露醇脱氢酶表达的情况下,可使来源于上述假肠膜明串珠菌kctc3652(leuconostocpseudomesenteroideskctc3652)的甘露醇-2-脱氢酶(genbank:cad31644.1,gi:28865823)、来源于肠膜明串珠菌(leuconostocmesenteroides)的甘露醇-2-脱氢酶(genbank:act22631.1,gi:253317413)、来源于类球红细菌的甘露醇-2-脱氢酶(genbank:aac45771.1,gi:2338764)或来源于荧光假单胞菌dsm50106(pseudomonasfluorescensdsm50106)的甘露醇-2-脱氢酶(genbank:aac04472.1,gi:2293418)表达。
并且,上述微生物可内在性表达甲酸脱氢酶或通过转化来表达甲酸脱氢酶。在此情况下,可在微生物内生成甲酸脱氢酶来从甲酸生成还原型烟酰胺腺嘌呤二核苷酸。由此,所生成的还原型烟酰胺腺嘌呤二核苷酸起到甘露醇脱氢酶的辅酶的作用,从而可明显增加果糖向甘露醇的转换率。
甲酸脱氢酶例如可以为来源于母牛分枝杆菌菌苗n10(mycobacteriumvaccaen10)的甲酸脱氢酶(formatedehydrogenase,fdh,genbank:ab072394.1,gi:15982576)。
并且,上述微生物可内在性表达葡萄糖转运蛋白质(glucosetransportprotein,glf)或通过转化来表达葡萄糖转运蛋白质。在此情况下,向微生物内的作为底物的果糖的流入量增加,从而可增加甘露醇生成量。由此,反应液中的果糖减少,从而可更容易分离阿洛酮糖。
葡萄糖转运蛋白质可不受限制地使用在本领域公知的葡萄糖转运蛋白质,例如,可以为来源于运动发酵单胞菌(zymomonasmobilissubsp.mobiliszm4、atcc31821或kctc1534)的葡萄糖转运蛋白质(genbank:aag29864.1;gi:11095424)。
来源于运动发酵单胞菌(zymomonasmobilissubsp.mobiliszm4、atcc31821或kctc1534)的葡萄糖转运蛋白质可具有序列50的氨基酸序列。
在上述果糖与其差向异构酶的反应在微生物内执行的情况下,可在上述的培养基中培养微生物。
在上述微生物内在性表达甲酸脱氢酶或通过转化来表达甲酸脱氢酶的情况下,培养基还包含甲酸。
此时,培养基的ph可以为6至7.5,更优选地,ph可以为6.5至7.0。若ph在上述范围内,则甘露醇生产率优秀,从而可更容易分离阿洛酮糖。上述范围的ph是通过将乙酸钠、哌嗪-1,4-二乙磺酸(pipes)、磷酸钠缓冲溶液等用作液体培养基的溶剂或使用水来取得的。
并且,若上述微生物可内在性表达甲酸脱氢酶或通过转化来表达甲酸脱氢酶,则使上述果糖转换为甘露醇的步骤可在开放的反应系统中执行。在此情况下,释放通过甲酸与甲酸脱氢酶的反应来生成的co2,从而可活跃地维持甲酸脱氢酶的作用。只是,甲酸的消耗有可能使培养基的ph变高,优选地,培养基包含缓冲溶液作为液体溶剂,更优选地,可使用哌嗪-1,4-二乙磺酸缓冲溶液。
在上述反应混合物与甘露醇脱氢酶发生反应之前,本发明的阿洛酮糖的生产方法还可包括如下的步骤:在未包含上述果糖的培养基中培养上述微生物,来以使上述微生物具有休眠细胞的方式进行诱导。
并且,在上述反应混合物与甘露醇脱氢酶发生反应之后,本发明还可包括如下的步骤:回收上述微生物来再用于使其他底物转换为甘露醇。
之后,从上述混合物中分离上述甘露醇。
果糖和阿洛酮糖具有类似的物性,从而难以分离,但甘露醇的物性与阿洛酮糖的物性不同,从而可从甘露醇容易分离阿洛酮糖。
其分离方法不受特别限制,例如,可例举离心分离、过滤、结晶化、离子交换色谱法等的方法,甘露醇和阿洛酮糖对于溶剂的溶解度差异大,因而优选地,可通过根据甘露醇和阿洛酮糖对于溶剂的溶解度差异的结晶化来进行分离。例如,可使用在包含第一溶剂的反应液内添加第一溶剂和另一第二溶剂来使甘露醇结晶化,或使反应液内的溶剂加热及浓缩来使甘露醇结晶化等的方法。
上述溶剂不受特别限制,例如,可例举水、盐类水溶液、乙醇、己烷、丙酮等。这些可单独使用或混合两种以上来使用。
并且,甘露醇和阿洛酮糖还可通过液体色谱法来进行分离。阿洛酮糖和果糖的物性类似,从而停留在液体色谱法中的柱的时间类似,导致峰上面积相重叠,但阿洛酮糖和甘露醇的物性不同,从而在峰上分离,因而可容易进行分离。
并且,本发明的一实施方式提供阿洛酮糖的制备方法,其包括如下的步骤:在果糖及阿洛酮糖的混合物中添加甘露醇脱氢酶来使上述果糖转换为甘露醇。
在果糖及阿洛酮糖的混合物中添加甘露醇脱氢酶来使上述果糖转换为甘露醇的步骤如上所述可通过化学或生物学方法来将果糖转换为阿洛酮糖之后,在经转换的阿洛酮糖和未转换的果糖的混合物中添加甘露醇脱氢酶,来使果糖转换为甘露醇。
如上所述,上述反应混合物与甘露醇脱氢酶的反应可在微生物内执行。具体的方法如上所述。
阿洛酮糖为果糖的3号碳的差向异构体,虽然像普通糖类一样具有甜味,但由于无法在人体内代谢,因而属于因卡路里几乎为零而对糖尿病及肥胖患者而言可作为代替白糖的功能性甜味剂来使用的糖,但果糖的卡路里高,且当过度摄取时,有可能成为使胰岛素敏感性降低来诱发糖尿病的主要原因。
但是,甘露醇与果糖不同,是卡路里低,不易被体内吸收,且需要长时间的代谢的多糖类,也是利用为糖尿病患者的甜味剂的成分。
由此,若在果糖及阿洛酮糖的混合物中添加甘露醇脱氢酶来使上述果糖转换为甘露醇,则即使不将阿洛酮糖单独分离为甘露醇,以阿洛酮糖和甘露醇的混合物状态用作甜味剂,也可利用为减少了糖尿病、肥胖等代谢综合征诱发可能性的代替白糖的功能性甜味剂。
并且,本发明还可包括如下的步骤:使作为底物的果糖与其差向异构酶发生反应,来制备上述果糖及阿洛酮糖的混合物。
使作为底物的果糖与其差向异构酶发生反应,来制备上述果糖及阿洛酮糖的混合物的步骤可通过上述的方法来执行。
并且,在上述果糖与其差向异构酶发生反应之后,本发明还可包括如下的步骤:回收上述微生物来再用于其他底物向阿洛酮糖的转换,同样,这可通过上述的方法来执行。
发明的效果
根据本发明的方法,能够以高纯度分离阿洛酮糖,从而明显改善阿洛酮糖的生产收率。
根据本发明的方法,改善阿洛酮糖的生产量及生产速度。
附图说明
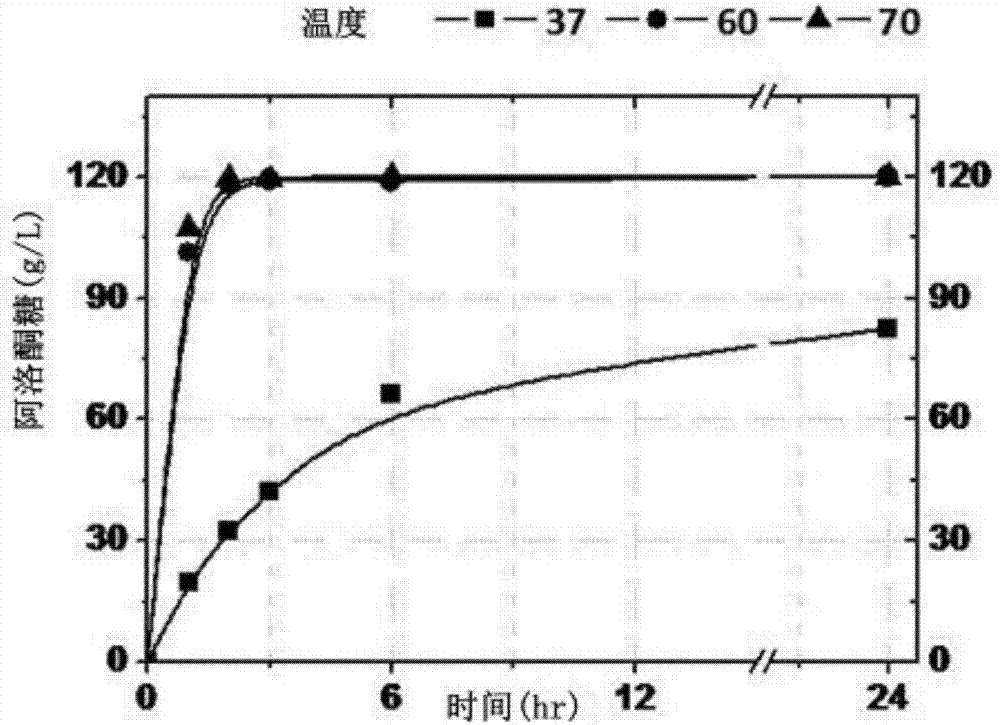
图1为从导入了阿洛酮糖-3-差向异构酶的谷氨酸棒状杆菌转化体对来自作为根据休眠细胞转换反应的反应温度的底物的果糖的阿洛酮糖生产量进行测定来表示的。
图2为从导入了阿洛酮糖-3-差向异构酶的大肠杆菌mg1655转化体对来自作为根据休眠细胞转换反应的反应温度的底物的果糖的阿洛酮糖生产量进行测定来表示的。
图3为对利用导入了阿洛酮糖-3-差向异构酶的谷氨酸棒状杆菌和大肠杆菌mg1655转化体来在60℃温度下将阿洛酮糖生产休眠细胞转换反应进行3小时之后,再回收菌体来在相同反应条件下进行反应而得的阿洛酮糖生产量进行测定来表示的。
图4为从根据用于导入了阿洛酮糖-3-差向异构酶的谷氨酸棒状杆菌转化体的休眠细胞转换反应的阿洛酮糖生产反应培养基的组成变化的果糖表示阿洛酮糖的生产量的。
图5为表示导入了阿洛酮糖-3-差向异构酶的谷氨酸棒状杆菌转化体的休眠细胞转换反应时的来源于阿洛酮糖-3-差向异构酶的菌株及根据阿洛酮糖生产反应培养基组成的阿洛酮糖的生产量的。
图6为表示导入了阿洛酮糖-3-差向异构酶的谷氨酸棒状杆菌转化体的休眠细胞转换反应时的来源于阿洛酮糖-3-差向异构酶的菌株及根据加热时间的阿洛酮糖的生产量的。
图7为比较来源于多种菌株的阿洛酮糖-3-差向异构酶的氨基酸序列的。
图8为根据导入了来源于梭菌属的阿洛酮糖-3-差向异构酶的谷氨酸棒状杆菌的再使用次数的阿洛酮糖的生产量的。
图9为表示利用导入了来源于多种菌株的甘露醇脱氢酶和甲酸脱氢酶的棒状杆菌重组菌株来生产的甘露醇生产量的图表。lpmdh表示来源于假肠膜明串珠菌的甘露醇脱氢酶,lmmdh表示来源于肠膜明串珠菌的甘露醇脱氢酶,rsmdh表示来源于类球红细菌的甘露醇脱氢酶,且pfmdh表示来源于荧光假单胞菌的甘露醇脱氢酶。
图10为表示当提供由阿洛酮糖和果糖形成的混合糖作为底物时,未利用甘露醇脱氢酶来发生反应而残留的阿洛酮糖的量(图10的(a)部分)和从果糖转换的甘露醇生产量(图10的(b)部分)的图表。
图11为表示使用包括具有分别不同的ph的缓冲溶液的转换培养基时以及不使用缓冲溶液而使用含水的转换培养基时的甘露醇生产量(图11的(a)部分)和ph变化(图11的(b)部分)的图表。w表示将无缓冲溶液的水用作转换培养基,sa表示将ph为5的乙酸钠(sodiumaceteate)缓冲溶液用作转换培养基,p表示将ph为6的哌嗪-1,4-二乙磺酸缓冲溶液用作转换培养基,sp表示将ph为6.5的磷酸钠(sodiumphosphate)缓冲溶液用作转换培养基。
图12为比较使用作为密闭反应容器的锥形管(conicaltube)和作为开放反应容器的试管(testtube)之后的甘露醇生产量(图12的(a)部分)和ph变化(图12的(b)部分)的图表。
图13为表示在作为开放反应容器的试管中将水或ph为6的哌嗪-1,4-二乙磺酸缓冲溶液用作转换培养基时的甘露醇生产量的图表。
图14为比较根据葡萄糖转运蛋白质的导入与否的甘露醇生产量的图表。
图15为表示根据乙醇添加量来分离在甘露醇转换反应混合糖溶液中进行结晶化的甘露醇之后的果糖、甘露醇、阿洛酮糖的浓度的曲线图。
图16为表示分离随着通过蒸发减少甘露醇转换反应混合糖溶液的体积而结晶化的甘露醇之后的果糖、甘露醇、阿洛酮糖的浓度的曲线图。
图17为比较在根据阿洛酮糖生产工序之后添加的甘露醇转换反应有无的反应液内的多种混合糖的高性能液体色谱法中分离能力状态的曲线图。
具体实施方式
以下,为了具体说明本发明,例举实施例来进行详细说明。
实施例
1.在利用谷氨酸棒状杆菌菌株来从果糖生产阿洛酮糖的过程中根据温度的阿洛酮糖生产速度及生产量变化
(1)重组菌株的制备
使作为大肠杆菌-棒状杆菌穿梭载体的pces208(j.microbiol.biotechnol.,18:639-647,2008)发生变形来制作插入有终止子(terminator)和lac启动子的psgt208穿梭载体,从而进行使用。
为了从谷氨酸棒状杆菌生产阿洛酮糖,阿洛酮糖-3-差向异构酶将根癌土壤杆菌(agrobacteriumtumefaciensstr.c58;taxid:176299;genbanknid:nc_003062,atcc33970)的dpe基因(agr_l_260,gi:15890243,序列1)导入于已制作的上述psgt208穿梭载体来进行使用。
详细地,利用序列31的引物1和序列32的引物2来从根癌土壤杆菌基因组扩增dpe基因,使用限制酶kpni和bamhi来进行切割,并向psgt208穿梭载体的相同部位进行插入,从而制作了包含阿洛酮糖-3-差向异构酶的ps208-dpe重组穿梭载体。
之后,为了在谷氨酸棒状杆菌中增加阿洛酮糖-3-差向异构酶的表达量,在ps208-dpe中将lac启动子取代为来源于ptrc99a的trc启动子,并将其命名为ps208ct-dpe。
将所制作的包含上述阿洛酮糖-3-差向异构酶的重组载体ps208-dpe、ps208ct-dpe和作为其阴性对照组的psgt208载体导入于野生型谷氨酸棒状杆菌atcc13032来进行转化,并将其利用于从果糖生产阿洛酮糖的生产当中。转化法采用了handbookofcorynebacteriumglutamicum(lothareggeling等,isbn0-8493-1821-1,2005bycrcpress)中的方法。
(2)重组菌株的培养及利用其的阿洛酮糖的生产
为了确保高浓度的菌体,将在上述中制备的谷氨酸棒状杆菌转化体接种到包含20μg/ml的卡那霉素的5ml的lb培养基(difco)来在30℃温度且250rpm的条件下进行种培养,之后,接种到包含10g/l的葡萄糖及20μg/ml的卡那霉素的最小培养基(每1l包含1g的k2hpo4、10g的(nh4)2so4、0.4g的mgso47h2o、20mg的feso47h2o、20mg的mnso45h2o、50mg的nacl、2g的尿素、0.1mg的生物素(biotin)、0.1mg的硫胺素(thiamine))来进行了本培养。本培养在具有槽的500ml的三角烧瓶中以100ml的体积在30℃温度且180rpm的条件下进行12个小时,从而诱导了充分的菌体量和蛋白质的充分表达。
对所得到的上述培养液进行离心分离来去除上清液,并回收菌体,从而在包含作为底物的40%(w/v)果糖的与上述相同的最小培养基中以使菌体浓度达到40od600的方式进行再悬浮之后,在25℃、30℃、37℃、50℃、60℃或70℃温度且180rpm的条件下进行了休眠细胞转换反应。
利用高性能液体色谱法(hplc)来测定了果糖及阿洛酮糖的浓度。高性能液体色谱法使用了设置有kromasil5nh2柱(4.6mm×250mm)的scl-10a(日本岛津公司,shimadzu),移动相利用75%乙腈来在以1.5ml/分钟流下并在40℃温度下分离后,利用反射指数(ri,reflectiveindex)检测器来进行了分析。在上述条件下,果糖的停留时间(retentiontime)为5.5分钟,阿洛酮糖的停留时间为4.6分钟。
图1示出了测定结果。参照图1,使导入了psgt208ct-dpe穿梭载体的谷氨酸棒状杆菌atcc13032菌株在包含40%果糖的培养基中进行转换反应,其结果表明反应温度越高,阿洛酮糖的生产速度越快,生产量越增加。尤其,在50℃、60℃、70℃温度下发生反应的实验组大致在3个小时的时间内使阿洛酮糖-3-差向异构酶达到酶的反应平衡,从而生产了约120g/l的阿洛酮糖,这可被视为阿洛酮糖-3-差向异构酶的从果糖转换为阿洛酮糖的转换速度及生产量依赖于温度。
生产量以50℃温度为起点来急剧增加,这属于比正常酶反应所需的温度明显高的温度,判断为在该温度下,酶与底物之间的反应的状态发生变化。
2.在利用大肠杆菌来从果糖生产阿洛酮糖的过程中根据温度的阿洛酮糖生产速度及生产量变化
根据在韩国专利授权号第10-1106253号中的实施例1中所记载的方法,制备了使用向ptrc99a载体导入来源于根癌土壤杆菌的阿洛酮糖-3-差向异构酶的ptpe质体进行转化的e.colimg1655(δpfka,als2)菌株。
为了阻断阿洛酮糖分解路径,利用了pfka(序列11)和als2(序列14、序列15、序列16、序列17、序列18及序列19)基因缺损的大肠杆菌mg1655。
为了确保高浓度的菌体,将在上述中所制备的大肠杆菌mg1655转化体接种到包含100μg/ml的氨比西林的5ml的lb培养基(difco),并在37℃温度且250rpm的条件下进行种培养,之后,接种到包含10g/l的葡萄糖及100μg/ml的氨比西林的2yt培养基进行了本培养。本培养在具有槽的500ml的三角烧瓶中以100ml的体积在37℃温度且180rpm的条件下进行12个小时,从而诱导了充分的菌体量和蛋白质的充分表达。
对所得到的上述培养液进行离心分离来去除上清液,并回收菌体,从而在包含作为底物的40%(w/v)果糖的大肠杆菌最小培养基m9培养基中(每1l包含11.3g的m9最小盐(minimalsalts)(difco)、0.1ml的1mcacl2、2ml的1mmgso4、1ml的100mmmnso45h2o)中以使菌体浓度达到40od600的方式进行再悬浮之后,分别在37℃、60℃或70℃温度且180rpm的条件下进行了休眠细胞转换反应。果糖及阿洛酮糖的浓度根据在上述实施例1中所记载的方法来进行了分析。图2示出测定结果。
参照图2,也使导入了ptpe载体的大肠杆菌mg1655(δpfka、als2)菌株在包含40%果糖的培养基中进行转换反应,其结果也表明反应温度越高,阿洛酮糖的生产速度越快,生产量越增加。尤其,在60℃、70℃温度下发生反应的实验组也与棒状杆菌中的实验一样,大致在2个小时的时间内使阿洛酮糖-3-差向异构酶达到酶的反应平衡,从而生产了约120g/l的阿洛酮糖。
这重新证明了阿洛酮糖-3-差向异构酶的从果糖转换为阿洛酮糖的转换速度及生产量依赖于温度。
以作为代表性的革兰氏阳性菌的棒状杆菌和作为代表性的革兰氏阴性菌的大肠杆菌作为对象来在高温条件下进行休眠细胞转换反应实验,其结果可知,作为糖转换酶的阿洛酮糖-3-差向异构酶在细胞内在极寒外部环境中受到保护,因而与单纯的酶的状态相比,可在高温条件下,不发生热变性,并以更快的速度生产阿洛酮糖。这种细胞转换反应的优点也可适用于大部分微生物。
3.谷氨酸棒状杆菌转化菌体通过在休眠细胞转换反应中的菌体回收及再使用来实现的从果糖生产的阿洛酮糖的连续生产
从上述实施例1及实施例2的结果中可知,当将阿洛酮糖-3-差向异构酶导入于棒状杆菌和大肠杆菌转化体内,并在50℃以上的高温条件下进行转换反应时,在3小时以内使阿洛酮糖的生产量达到最大值之后,并不再增加。
即,为了确认阿洛酮糖-3-差向异构酶在达到使阿洛酮糖的生产量达到最大值的反应平衡的3个小时之后还残留多少使果糖转换为阿洛酮糖的活性,回收在存在果糖的条件下通过3个小时的休眠细胞转换反应来用于阿洛酮糖生产的菌体,来再用于阿洛酮糖生产休眠细胞转换反应中。
上述菌体的再使用休眠细胞转换反应在60℃温度下反复进行了3次。最初的休眠细胞转换反应表示为r0,从之前的反应液中回收菌体来进行第一次再使用的休眠细胞转换反应表示为r1,进行第二次再使用的休眠细胞转换反应表示为r2,进行第三次再使用的休眠细胞转换反应表示为r3。培养条件及分析方法与实施例1相同。图3示出其结果。
参照图3,即使在60℃的高温糖转换反应中也可再使用菌体。但是,越是再使用菌体,酶的活性的规定部分越减少。并且,当在高温条件下再使用菌体时,作为革兰氏阳性菌的谷氨酸棒状杆菌菌株的残留酶活性高于作为革兰氏阴性菌的大肠杆菌mg1655菌株的残留酶活性。
实施例4.在多种休眠细胞转换反应培养基中从果糖生产阿洛酮糖
在上述实施例1中,在谷氨酸棒状杆菌中从果糖生产阿洛酮糖的转换反应中,利用了包含40%果糖的最小培养基(每1l包含1g的k2hpo4、10g的(nh4)2so4、0.4g的mgso47h2o、20mg的feso47h2o、20mg的mnso45h2o、50mg的nacl、2g的尿素、0.1mg的生物素、0.1mg的硫胺素)。将用于该转换反应的培养基的结构成分最小化来制备更经济、简便的培养基,执行了与在实施例1中使用的培养基之间的阿洛酮糖生产率比较。
参照图4,即使使用包含40%果糖和0.1mm的mnso4的磷酸盐缓冲液(phosphatebuffer)(ph为7)培养基,更简便地,仅使用仅包含40%果糖和0.1mm的mnso4的培养基,也在最终生产的阿洛酮糖的生产量方面没有太大差异。上述状态在30℃和60℃的反应温度下均同样被观察到。在未将0.1mm的mnso4作为阿洛酮糖-3-差向异构酶的辅助因子来进行添加的情况下,得到了生产量减少的结果。
在上述实施例中,可知用于阿洛酮糖生产休眠细胞转换反应的培养基的成分仅有作为底物的果糖和作为阿洛酮糖-3-差向异构酶的辅助因子的mnso4即可。
5.包含对来源于多种菌株的阿洛酮糖-3-差向异构酶氨基酸序列进行编码的多核苷酸的重组谷氨酸棒状杆菌的制备
从德国微生物菌种保藏中心(dsmz)公司购买了粪厌氧棒状菌(anaerostipescaccaedsm14662;taxid:411490)的整体基因。将所购买的整体基因作为模板以包含阿洛酮糖-3-差向异构酶推定基因(apendonuclease;sequenceid:gb|edr98778.1|;gi:167654649;序列4)的方式将序列33及序列34的引物对作为引物来执行了第一次聚合酶链式反应(pcr)。以扩增的聚合酶链式反应产物作为模板将与阿洛酮糖-3-差向异构酶基因特异性结合的序列35及序列36的引物对用作引物,来执行了第二次聚合酶链式反应。
使用限制酶bamhi和xbai来将所得到的聚合酶链式反应的产物插入于ps208ct-dpe(在韩国专利申请号10-2013-0060703的实施例1中所记载的载体)的相同酶部位,来制备了重组载体ps208ct-acdpe。
将所制备的ps208ct-acdpe载体导入于野生型谷氨酸棒状杆菌atcc13032来进行转化,并将其用于从果糖生产阿洛酮糖的生产中。转化法采用在handbookofcorynebacteriumglutamicum(lothareggeling等,isbn0-8493-1821-1,2005bycrcpress)中记载的方法。
所得到的重组谷氨酸棒状杆菌菌株在-80℃温度下得到保管后用于培养。
包含鲍氏梭菌(clostridiumbolteaeatccbaa-613;taxid:411902)的阿洛酮糖-3-差向异构酶推定基因(hypotheticalproteinclobol_00069;sequenceid:gb|edp19602.1|;gi:15844190;序列9)的质体从韩国益力多乳品有限公司购得。将与阿洛酮糖-3-差向异构酶基因特异性结合的序列37及序列38的引物对用作引物来执行了聚合酶链式反应。
使用限制酶kpnⅰ和xbaⅰ来将所得到的聚合酶链式反应的产物插入于ps208ct-dpe(在韩国专利申请号10-2013-0060703的实施例1中所记载的载体)的相同酶部位,来制备了重组载体ps208ct-cbdpe。
通过如上所述的方法将所制备的重组载体ps208ct-cbdpe载体导入于野生型谷氨酸棒状杆菌atcc13032来进行转化,并将其用于从果糖生产阿洛酮糖的生产中。所得到的重组谷氨酸棒状杆菌菌株在-80℃温度下得到保管后用于培养。
从德国微生物菌种保藏中心购买了门冬虫梭菌(clostridiumhylemonaedsm15053;taxid:553973)的整体基因。将所购买的整体基因作为模板以包含阿洛酮糖-3-差向异构酶推定基因(dolicholmonophosphatemannosesynthase;sequenceid:ref|wp_006442985.1|;gi:225161759;序列10)的方式将序列39及序列40的引物对作为引物来执行了第一次聚合酶链式反应。以扩增的聚合酶链式反应产物作为模板将与阿洛酮糖-3-差向异构酶基因特异性结合的序列41及序列42的引物对用作引物,来执行了第二次聚合酶链式反应。
使用限制酶bamhi和xbai来将所得到的聚合酶链式反应的产物插入于ps208ct-dpe(在韩国专利申请号10-2013-0060703的实施例1中所记载的载体)的相同酶部位,来制备了重组载体ps208ct-chdpe。
通过如上所述的方法将所制备的ps208ct-chdpe载体导入于野生型谷氨酸棒状杆菌atcc13032来进行转化,并将其用于从果糖生产阿洛酮糖的生产中。所得到的重组谷氨酸棒状杆菌菌株在-80℃温度下得到保管后用于培养。
6.利用导入了来源于多种菌株的阿洛酮糖-3-差向异构酶的重组谷氨酸棒状杆菌菌株来从果糖生产阿洛酮糖
利用在上述实施例5中所制备的谷氨酸棒状杆菌转化体来确认了从高浓度的果糖生产阿洛酮糖。
将上述的转化体接种到包含20μg/ml的卡那霉素的2yt培养基来在30℃温度且250rpm条件下进行种培养,之后,再次将转化体接种到包含20μg/ml的卡那霉素的2yt培养基来进行了本培养。本培养在具有槽的300ml的三角烧瓶中以60ml的体积在30℃温度且180rpm条件下培养7个小时,从而诱导了充分的菌体量和蛋白质的充分表达。
对所得到的上述培养液进行离心分离来去除上清液,并回收菌体,从而在包含20μg/ml的卡那霉素、作为底物的40%(w/v)果糖和浓度为0.1mm的作为阿洛酮糖-3-差向异构酶的主要辅助因子的锰或钴的简单的转换反应培养基中,在55℃温度下进行了休眠细胞转换反应。果糖和阿洛酮糖的浓度采用在上述实施例1中所记述的方法相同的方法来进行了测定。图5示出其结果。atdpe是指以往使用的根癌土壤杆菌的阿洛酮糖-3-差向异构酶。
参照图5,在所有导入了多种阿洛酮糖-3-差向异构酶的重组菌株中,与锰相比,将钴作为辅助因子时,阿洛酮糖的生产速度更快。
导入了来源于粪厌氧棒状菌和根癌土壤杆菌的阿洛酮糖-3-差向异构酶的重组谷氨酸棒状杆菌的阿洛酮糖生产量在6个小时时达到平衡,但导入了来源于梭菌属的阿洛酮糖-3-差向异构酶的重组谷氨酸棒状杆菌的阿洛酮糖生产量在将锰作为辅助因子的情况下,也在3个小时时达到平衡。
因此,不仅可确认到来源于梭菌属的阿洛酮糖-3-差向异构酶可实现从果糖生产阿洛酮糖,阿洛酮糖的生产速度比来源于根癌土壤杆菌的阿洛酮糖-3-差向异构酶更快。
7.导入了来源于多种菌株的阿洛酮糖-3-差向异构酶的重组谷氨酸棒状杆菌菌株的高温条件下的阿洛酮糖生产活性的持续维持
从上述实施例1、实施例2的结果中,确认到当以50℃以上的高温条件进行转换反应时,所有阿洛酮糖生产在3个小时以内完成。像这样,在高温条件下,从果糖生产阿洛酮糖的生产速度快,因而需要即使再使用菌体的情况下也可在长时间的高温条件下维持稳定的阿洛酮糖-3-差向异构酶。因此,确认了来源于多种菌株的阿洛酮糖-3-差向异构酶在高温条件下的活性维持程度。
使通过上述实施例1中所记载的方法得到的菌体在2yt中进行浮游,从而利用振荡培养器来在0小时、3小时、6小时、9小时、12小时、24小时的时间内持续施加60℃的热量。在按各个时间施加热量之后,回收菌体,并在仅包含20μg/ml的卡那霉素、0.1mm的锰及40%(w/v)的果糖的简单转换反应培养基中进行浮游,从而再次在60℃温度下进行3个小时的休眠细胞转换反应。果糖和阿洛酮糖的浓度通过与上述实施例1中所记载的方法相同的方法进行了测定。图6示出其结果。
参照图6,导入了以往使用的来源于根癌土壤杆菌的阿洛酮糖-3-差向异构酶和来源于粪厌氧棒状菌的阿洛酮糖-3-差向异构酶的重组谷氨酸棒状杆菌在受到3个小时的60℃热量之后,几乎无法进行阿洛酮糖的生产。相反,导入了来源于梭菌属的阿洛酮糖-3-差向异构酶的重组谷氨酸棒状杆菌在受到24个小时的热量后,也维持阿洛酮糖的生产,从而与来源于根癌土壤杆菌的阿洛酮糖-3-差向异构酶相比,更加有利于高温工序下的阿洛酮糖的生产。
众所周知,当对于来源于根癌土壤杆菌的阿洛酮糖-3-差向异构酶的热稳定性起到重要作用的序列(参考文献1)中的第33个氨基酸或第213个氨基酸分别被亮氨酸、半胱氨酸取代时,50℃温度下的酶的半寿命分别达到3.3倍、7.2倍,或者,在两个均被取代时,达到29.9倍。
图7示出来源于根癌土壤杆菌的阿洛酮糖-3-差向异构酶的氨基酸序列与来源于梭菌属的阿洛酮糖-3-差向异构酶的氨基酸序列之间的比较,参照图7,热稳定性高的来源于梭菌属的阿洛酮糖-3-差向异构酶使一个氨基酸具有与其相对应的序列或具有两个序列。
8.导入了来源于梭菌属的阿洛酮糖-3-差向异构酶的重组谷氨酸棒状杆菌菌体通过在休眠细胞转换反应中的菌体回收及再使用来实现从果糖生产阿洛酮糖
由于在上述实施例7中确认到来源于梭菌属的阿洛酮糖-3-差向异构酶在高温条件下具有稳定性,因而在导入了来源于梭菌属的阿洛酮糖-3-差向异构酶的两个重组菌株中,代表性地,使导入了门冬虫梭菌的阿洛酮糖-3-差向异构酶的重组谷氨酸棒状杆菌菌体在高温条件下进行休眠细胞转换反应之后,确认了菌体再使用效果。
在使通过与在上述实施例3中所记述的方法相同的方法得到的菌体在60℃温度下进行3个小时的休眠细胞转换反应之后,再回收菌体来实施相同的休眠细胞转换反应,菌体共被再使用3次(与上述实施例3中的条件相同的条件进行实验)。最初的休眠细胞转换反应表示为r0,从之前的反应液中回收菌体来进行第一次再使用的休眠细胞转换反应表示为r1,进行第二次再使用的休眠细胞转换反应表示为r2,进行第三次再使用的休眠细胞转换反应表示为r3。图8示出其结果。
参照图8,可知在高温条件下多次再使用菌体的过程中,导入了梭菌属的阿洛酮糖-3-差向异构酶的重组菌体以阿洛酮糖生产量没有任何减少的方式维持规定量。可结合上述实施例7的结果来确认到酶本身的热稳定性在高温条件下持续进行糖转换反应,并且,在菌体的再使用过程中也非常有利。
9.从果糖生产甘露醇的谷氨酸棒状杆菌重组菌株的开发
(1)重组棒状杆菌菌株的开发
将以容易克隆的方式变形的psgt208载体用作作为大肠杆菌-棒状杆菌穿梭载体的pces208载体(在韩国专利申请号10-2013-0060703的实施例1中所记载的载体)。启动子使用了去除lac操纵子来持续表达的trc启动子。
作为甘露醇生产酶,使用了来源于假肠膜明串珠菌atcc12291(或kctc3652,leuconostocpseudomesenteroidesatcc12291)、肠膜明串珠菌、类球红细菌及荧光假单胞菌dsm50106(pseudomonasfluorescensdsm50106)的酶。
从kctc购买假肠膜明串珠菌菌株,并对整体基因组进行纯化之后,将其作为模板来以包含甘露醇脱氢酶(mannitol2-dehydrogenase;mdh;genbank:aj486977.1,gi:28865822,序列43,lpmdh)的方式将序列47及序列48的引物对作为引物执行了聚合酶链式反应。
从genscript合成了来源于肠膜明串珠菌的甘露醇脱氢酶(genbank:act22631.1,gi:253317413,序列44,lmmdh)、来源于类球红细菌的甘露醇脱氢酶(genbank:aac45771.1,gi:2338764,序列45,rsmdh)及来源于荧光假单胞菌的甘露醇脱氢酶(genbank:aac04472.1,gi:2293418,序列46,pfmdh)。
使用限制酶kpni和bamhi来向导入了去除lac操纵子的trc启动子的psgt208载体的相同的限制酶部位插入所得到的聚合酶链式反应产物及合成基因,从而制备了重组载体ps208ct-lpmdh、ps208ct-lmmdh、ps208ct-rsmdh及ps208ct-pfmdh。
并且,一同导入了有助于用作甘露醇脱氢酶的辅酶的还原型烟酰胺腺嘌呤二核苷酸的持续再生的酶。作为有助于还原型烟酰胺腺嘌呤二核苷酸的再生的酶,利用了通过从甲酸到二氧化碳的氧化来再生还原型烟酰胺腺嘌呤二核苷酸的甲酸脱氢酶。利用了来源于母牛分枝杆菌菌苗n10(mycobacteriumvaccaen10)的甲酸脱氢酶(formatedehydrogenase,fdh,genbank:ab072394.1,gi:15982576,序列49),并从genscript合成了基因。使用限制酶bamhi和xbai来向之前构筑的ps208ct-lpmdh、ps208ct-lmmdh、ps208ct-rsmdh及ps208ct-pfmdh载体的相同的限制酶部位插入所合成的基因,从而制备了重组载体ps208ct-lpmdh-fdh、ps208ct-lmmdh-fdh、ps208ct-rsmdh-fdh及ps208ct-pfmdh-fdh。
将所制备的ps208ct-lpmdh-fdh、ps208ct-lmmdh-fdh、ps208ct-rsmdh-fdh及ps208ct-pfmdh-fdh载体导入于野生型谷氨酸棒状杆菌atcc13032(corynebacteriumglutamicumatcc13032),转化法采用handbookofcorynebacteriumglutamicum(lothareggeling等,isbn0-8493-1821-1,2005bycrcpress)中的方法。所转化的重组棒状杆菌菌株在-80℃温度下进行保管来使用。
(2)利用重组菌株的甘露醇生产实验
甘露醇生产使用了利用高浓度的菌体的休眠细胞转换反应。为了确保高浓度的菌体,将所制备的上述谷氨酸棒状杆菌重组菌株接种到包含20μg/ml的卡那霉素的2yt培养基,并以30℃温度且250rpm的条件进行种培养之后,在包含20μg/ml的卡那霉素、0.5%(v/v)葡萄糖的2yt培养基中接种5%(v/v)至10%(v/v)的种培养液,从而以30℃温度且180rpm的条件进行了诱导充分的菌体量及蛋白质表达的本培养。
针对通过本培养得到的大量的菌体去除培养基之后,利用于转换反应中。休眠细胞转换反应通过在包含10%(v/v)果糖和555mm的甲酸的100mm的磷酸钠(ph为6.5)缓冲溶液中以使浓度成为od60040的方式将菌体进行悬浮,来以30℃温度且250rpm的条件进行了48个小时。果糖及甘露醇的浓度利用高性能液体色谱法来进行了测定。高性能液体色谱法使用了设置有kromasil5nh2柱(4.6mm×250mm)的scl-10a(日本岛津公司),移动相利用80%乙腈来以1.5ml/分钟流下并在40℃温度下分离之后,利用反射指数检测器来进行了分析。图9示出其测定结果。
参照图9,根据甘露醇脱氢酶的甘露醇生产量无大的差异,但当利用来源于假肠膜明串珠菌的甘露醇脱氢酶时,在48个小时的转换反应之后,从100g/l的果糖生产约26g/l的甘露醇,从而呈现最多的甘露醇生产量。由此,之后,在甘露醇转换反应中继续使用了来源于假肠膜明串珠菌的甘露醇脱氢酶。虽然未在实施例中表示,但与导入甲酸脱氢酶之前相比,甘露醇生产量增加约86倍,从而可以确认到利用了甲酸脱氢酶的还原型烟酰胺腺嘌呤二核苷酸的再生起到有效作用。
10.利用了阿洛酮糖和果糖的混合糖的甘露醇生产
如上所述,阿洛酮糖和果糖的物性很类似。由此,若甘露醇脱氢酶为对于底物的特异性不高的酶,则不仅是果糖,阿洛酮糖也被认定为底物,从而还可以被还原。因此,在阿洛酮糖和果糖的混合糖中,仅将果糖转换为甘露醇,从而确认了容易与阿洛酮糖分离的战略是否适用。
利用所构筑的上述重组棒状杆菌菌株来仅将底物换为阿洛酮糖和果糖的混合糖,从而以与实施例9中的实验条件相同的条件进行了实验。混合糖以可在从果糖到阿洛酮糖的转换反应之后得到的果糖7和阿洛酮糖3(v/v)的比率制备而成,混合糖的浓度如同实施例9利用了10%(v/v)。图10的(a)部分和图10的(b)部分示出其结果。
图10的(a)部分表示未用作底物而残留的阿洛酮糖浓度,在48个小时的转换反应期间,一直维持作为初始浓度的约30g/l,可确认到几乎未使用。图10的(b)部分表示从构成100g/l的混合糖的70g/l的果糖生产的甘露醇量,在30℃的转换温度下,在48个小时的转换反应期间,生产了约20g/l。由此,可以确认到甘露醇脱氢酶在阿洛酮糖和果糖一同存在的混合糖底物溶液中选择性地仅将果糖用作底物。因此,确认了可成功适用将在从果糖到阿洛酮糖的转换反应之后残留的果糖转换为甘露醇,从而容易分离阿洛酮糖的本专利的概念。
11.利用多种转换培养基的甘露醇生产比较
需要寻找用于提高甘露醇生产率的最佳ph条件,从而比较了根据ph的甘露醇生产量。众所周知,甘露醇转换反应在弱酸性条件下发生,因而筛选了以弱酸性的ph维持的缓冲溶液。并且,一同确认了即使利用无缓冲溶液而仅由水构成的转换培养基,甘露醇生产是否也有效进行。
使用无缓冲溶液的水(w)、ph为5的乙酸钠缓冲溶液(sa)、ph为6的哌嗪-1,4-二乙磺酸缓冲溶液(p)来与以往使用的ph为6.5的磷酸钠缓冲溶液(sp)比较了甘露醇生产率。未用实施例表示转换温度,但利用了比30℃呈现更快的转换反应的45℃,作为转换培养基,在之前说明的水或缓冲溶液中包含作为底物的10%(v/v)果糖和555mm的甲酸,若使用缓冲溶液,则使缓冲溶液浓度成为100mm。此外,以与上述实施例9中的实验条件相同的条件进行了实验,随着转换速度变快,转换反应进行至24个小时为止。图11的(a)部分及图11的(b)部分示出其结果。
参照图11的(a)部分,当使用ph为6的哌嗪-1,4-二乙磺酸时,生产约29g/l的甘露醇,从而呈现了最多的甘露醇生产量。并且,当使用由水构成的转换培养基时,与将以往使用的ph为6.5的磷酸钠缓冲溶液作为转换培养基来生产的甘露醇生产量无差异,从而可以确认到即使将水用作转换培养基来代替缓冲溶液,也可有效地生产甘露醇。
根据使用图11的(a)部分的分别不同的转换培养基时的甘露醇生产量和图11的(b)部分的转换反应时的ph变化的对照结果可知,若转换培养基的ph维持在6.5至7之间,则活跃地进行甘露醇的生产。由此,当前条件下的最佳甘露醇生产ph视为6.5至7之间,这视为将弱酸性ph5为最佳的甘露醇生产环境和将弱碱性ph7.5为最佳的甲酸脱氢酶的折中ph。
12.根据有无反应容器密闭的甘露醇生产量比较
在之前的实施例中,在转换反应中使用锥形管来在密闭的环境中实施了甘露醇转换反应。但是,为了确认在甲酸的脱氢反应过程中生产的co2不被排出而再次溶解于转换反应培养基,从而影响反应的情况,使用气体进出自由的试管来执行了实验。以与将之前实施例11的水用作转换培养基的实验条件相同的条件进行了实验。图12的(a)部分和图12的(b)部分示出实验结果。
图12的(a)部分表示在作为密闭容器反应条件的锥形管和作为开放容器反应条件的试管中得到的甘露醇生产量。有关甘露醇生产,可以确认到在利用试管的开放环境下,反而更少生产约9倍左右。但是,参照图12的(b)部分的ph测定结果,在开放环境下,甘露醇转换反应进行24个小时之后的ph为9.2,可见与密闭环境下的ph为7.2相比,非常高。其原因推定为在密闭的环境下,未排出co2而以碳酸形态溶解于培养基,从而还妨碍ph的上升和甲酸脱氢酶的作用。
甲酸脱氢酶的作用具有通过甲酸消耗使培养基的ph上升的效果。但是,这应该是在开放的环境下,容易排出co2,且甲酸脱氢酶的作用也活跃,从而使ph大大上升,在这种高的ph条件下,甘露醇脱氢酶的作用受到阻碍,从而减少甘露醇生产量的原因。
因此,若甲酸脱氢酶的作用考虑是供给甘露醇脱氢酶的作用所需的还原型烟酰胺腺嘌呤二核苷酸的反应,则推定为只要防止在甲酸脱氢酶的反应活跃的开放的环境下,ph上升至阻碍甘露醇脱氢酶的反应的水平以上,则可得到高的甘露醇生产率。
13.在开放的环境下,利用弱酸性转换培养基的甘露醇生产
如从之前实施例12中所确认,在利用试管的情况下,由于甲酸脱氢酶的活跃作用,还原型烟酰胺腺嘌呤二核苷酸的供给变得丰富。因此,在开放的环境下,以适合生产甘露醇的方式将ph校正为弱酸性来生产了甘露醇。以使最终浓度成为300mm的方式向转换培养基添加哌嗪-1,4-二乙磺酸(ph6)缓冲溶液来校正了ph,转换温度利用了45℃。图13示出其结果。
参照图13,当未校正ph且使用仅由底物和水构成的培养基时,在12个小时期间,甘露醇生产量低,是3.6g/l,但若利用哌嗪-1,4-二乙磺酸缓冲溶液来校正ph,则可以确认在24个小时的转换反应之后,是51g/l,可知100g/l的果糖中的一半转换为甘露醇。这应该是在开放的环境下,由于甲酸脱氢酶的还原型烟酰胺腺嘌呤二核苷酸的再生速度得到提高,且因使用哌嗪-1,4-二乙磺酸缓冲溶液来校正ph而提高甘露醇脱氢酶的甘露醇生产速度的原因。
14.通过导入果糖转运蛋白质来提高底物流入量
(1)重组棒状杆菌菌株的开发
利用众所周知的流入了果糖的葡萄糖转运蛋白质来增加细胞内作为底物的果糖的流入量,从而提高甘露醇的生产量。葡萄糖转运蛋白质使用了来源于运动发酵单胞菌(zymomonasmobilissubsp.mobiliszm4或atcc31821)的酶,并从kctc购买(kctc1534)。将所纯化的基因组作为模板,并对于运动发酵单胞菌的葡萄糖转运蛋白质(genbank:aag29864.1;gi:11095424;序列50)将序列51及序列52的引物对作为引物来执行了聚合酶链式反应。使用限制酶bamhi及xbai来向pjc1-1-ct-cmp载体的相同的限制酶部位插入所得到的聚合酶链式反应产物,从而构筑了重组载体pjc1-1-ct-glf-cmp。
用于构筑的表达载体(pjc1-1-ct-cmp)是将作为大肠杆菌-棒状杆菌穿梭载体的pjc1变形而得的,导入了psgt208载体的启动子可变区域和mcs区域,追加地,导入棒状杆菌的终止子区域来构筑了pjc1-1载体。由trc启动子取代包含pjc1-1载体的lac操纵子的lac启动子区域来构筑了pjc1-1-ct载体,为了与在之前实施例中使用的psgt208载体一同用于表达,由氯霉素抗生素抗性基因取代卡那霉素抗生素抗性基因来最终构筑了pjc1-1-ct-cmp载体。
将之前制备的pjc1-1-ct-glf-cmp重组载体导入于由ps208ct-lpmdh-fdh转化的谷氨酸棒状杆菌atcc13032(corynebacteriumglutamicumatcc13032),重组棒状杆菌菌株在-80℃温度下进行保管来使用。
(2)利用重组菌株的甘露醇生产实验
利用之前构筑的重组棒状杆菌菌株来以与实施例13中的条件相同的条件使用哌嗪-1,4-二乙磺酸缓冲溶液转换培养基进行了甘露醇生产实验,氯霉素浓度使用了5μg/ml。图14示出其结果。
参照图14,在未导入葡萄糖转运蛋白质的情况下,在24个小时的转换反应之后,生产51g/l的甘露醇,相反,在导入葡萄糖转运蛋白质来提高果糖的流入量的情况下,通过24个小时的转换反应来生产95g/l的甘露醇,从而呈现了从果糖接近100%的转换率。
由此,将难以与阿洛酮糖分离的果糖转换为甘露醇,从而可从甘露醇容易分离阿洛酮糖,且将阿洛酮糖和甘露醇混合糖其本身也能够以高价的功能性糖所利用。
15.通过甘露醇转换反应液中的甘露醇结晶化的阿洛酮糖含量增加
(1)通过添加乙醇的甘露醇的结晶化
以往的果糖和阿洛酮糖的物理特性类似,从而当前难以分离及纯化。但是,甘露醇与果糖和阿洛酮糖的溶解度差异大,因而可容易分离及纯化。在阿洛酮糖生产工序中,作为底物的果糖以约30%的转换率转换为阿洛酮糖。因此,在使用400g/l的果糖的情况下,反应结束之后的反应液混合有约280/l的果糖和约120g/l的阿洛酮糖。
在上述反应液中,利用实施例13的重组棒状杆菌菌株(ps208ct-mdh-fdh)来执行残留果糖的甘露醇转换反应,从而得到了混合有果糖(140g/l)、甘露醇(140g/l)及阿洛酮糖(120g/l)的最终反应液。在微量离心管(eppendorf-tube)中以500μl的方式分注果糖(140g/l)、甘露醇(140g/l)及阿洛酮糖(120g/l)混合糖溶液,并将乙醇从100μl添加至900μl的体积,从而对溶解度低的甘露醇进行结晶化来分离。
在添加乙醇之后,在常温(25℃)条件下定置1个小时,并通过离心分离(13000rpm,10分钟)来分离了经结晶化的甘露醇和溶液。以与实施例9中的条件相同的条件利用高性能液体色谱法来分析了通过离心分离所得到的溶液中的糖浓度。图15示出其结果。
参照图15,可以确认通过甘露醇结晶化维持甘露醇转换反应液中的果糖和阿洛酮糖的浓度,相反,只有甘露醇的浓度明显下降。因此,通过添加乙醇仅分离甘露醇,从而可容易得到阿洛酮糖含量增加的溶液。
(2)通过蒸发的甘露醇的结晶化
将100ml的甘露醇转换反应混合糖溶液(果糖140g/l、甘露醇140g/l、阿洛酮糖120g/l)放入烧杯进行搅拌,并通过水浴来煮。随着混合糖溶液蒸发,整体溶液浓度变高,体积减小。此时,当通过蒸发的溶液的体积分别减小为100ml、75ml、50ml时,提取1ml的溶液来在常温(25℃)条件下进行冷却,并使甘露醇进行结晶化。在对冷却的溶液进行离心分离(13000rpm,10分钟)之后,提取上清液来以与实施例9中的条件相同的条件利用高性能液体色谱法来测定了糖浓度。图16示出其结果。
参照图16,可以确认在初始混合糖溶液中,果糖和阿洛酮糖的浓度被浓缩而增加,相反,甘露醇的浓度下降。因此,若果糖转换为甘露醇,则仅通过提高温度的方法也可提高混合糖内阿洛酮糖比率。
16.从使用高性能液体色谱法的混合糖中分离阿洛酮糖
利用实施例1的高性能液体色谱法分析条件来观察了甘露醇转换反应前后的反应液内的多种混合糖的分离能力状态。使用阿洛酮糖生产反应液(阿洛酮糖120g/l、果糖280g/l;图17的(a)部分)、50%甘露醇转换反应液(阿洛酮糖120g/l、果糖140g/l、甘露醇140g/l;图17的(b)部分)、100%甘露醇转换反应液(阿洛酮糖120g/l、甘露醇280g/l;图17的(c)部分)来进行了分析。
参照图17的(a)部分,可以确认阿洛酮糖和果糖的停留时间相似,从而在峰上相重叠的面积宽。参照图17的(b)部分,果糖50%转换为停留时间更长的甘露醇,从而呈现阿洛酮糖与果糖相重叠的区间减小的状态。参照图17的(c)部分,若果糖均转换为甘露醇,则可以确认阿洛酮糖和甘露醇在高性能液体色谱法峰上完全分离。
用于上述实验的高性能液体色谱法柱为实验室水平的柱。产业用高性能液体色谱法柱的容积大于实验室水平柱的容积,可在不稀释的情况下直接分离高浓度的溶液,但分离能力是不及于此的水平。因此,当使用产业用高性能液体色谱法柱时,阿洛酮糖与果糖的重叠面积更明显突出。因而,当使用产业用高性能液体色谱法柱时,为了从果糖有效地分离阿洛酮糖,有利的是,必须将残留果糖转换为甘露醇。
- 还没有人留言评论。精彩留言会获得点赞!
- 一种高效扁柏双黄酮的制备方法与流程
- (1R,4S)‑(-)‑2‑氮杂双环[2.2.1]庚‑5‑烯‑3‑酮的制备方法与制造工艺
- 制备环状和非环状酮的方法与制造工艺
- 7‑溴‑5‑(2‑氯苯基)‑1,3‑二氢噻吩并[2,3e]‑1,4‑二氮杂卓‑2‑硫酮的制备方法与制造工艺
- 一种2‑苯基‑1,4‑苯并哌喃酮的制备方法与制造工艺
- 一种2′4′‑二氟‑2‑[1‑(1H‑1,2,4‑三唑基)]苯乙酮的制备方法与制造工艺
- 一种5‑氨基苯并咪唑酮的制备方法与制造工艺
- 一种制备GLYT-1抑制剂的方法与制造工艺
- 一种1‑[5‑(苯基甲氧基)‑2‑吡啶]‑乙酮的制备方法与制造工艺
- 一种2‑氯乙酰氨基‑5硝基二苯甲酮的制备方法与制造工艺