化合物dichotocejpinA及其制备方法和在制备治疗糖尿病药物中的应用与流程
本发明属于生物和医药领域,具体涉及一个新化合物dichotocejpin A及其制备方法和在制备治疗糖尿病药物中的应用。
背景技术:
α-葡萄糖苷酶(α-glucosidase)是一类能够从含有α-糖苷键底物的非还原端催化水解α-葡萄糖基酶的总称。它存在于人体小肠刷状缘上,能够催化碳水化合物非还原末端的α-1,4糖苷键水解并释放出葡萄糖的酶,包括麦芽糖酶、异麦芽糖酶、蔗糖酶和海藻糖酶等。人体对淀粉、糊精、蔗糖等碳水化合物的利用吸收依赖于小肠刷状缘上该酶的活性(Asano N.et al.1997),因此,α-葡萄糖苷酶抑制剂如阿卡波糖具有明确的降低餐后血糖的作用,寻找具有α-葡萄糖苷酶抑制活性的化合物,也是寻找具有治疗糖尿病药物的重要研究热点之一(Xiao S.Z.et al.1999)。
海洋拥有特殊的环境,像高盐、弱碱性、低营养、缺氧等,栖息于海洋环境的海洋微生物为了适应这些特殊环境,产生了独特的代谢途径,由此能够产生结构特异、生物活性特殊的次级代谢产物。近年来从海洋微生物中发现了大量结构新颖、活性显著的化合物,如生物碱类、萜类、聚酮类等(Blunt J.W.et al.2015;Yang J.G.et al.2013)。目前,海洋微生物已经成为天然产物研究的重要资源。与其它海洋微生物相比,海洋真菌来源的次生代谢产物不仅数量占到整个海洋微生物的一半左右,还具有产量大、结构和活性多样丰富等优势,已经成为目前海洋微生物的研究热点(Bugni T.S.et al.2013;Saleem M.et al.2013;Rateb M.E.2011;Blunt J.W.et al.2013)。
深海真菌Dichotomomyces cejpii FS110于2011年9月从南海(18°44.606′N,119°44.263′E)水深3739米处海底表层沉积物中分离得到。本发明的前期研究表明(杨小岚.et al.2014),深海真菌Dichotomomyces cejpii FS110的发酵液乙酸乙酯粗提物具有很好的生物活性,因此我们对该深海真菌次级代谢产物进行了深入的研究。
技术实现要素:
本发明的第一个目的是提供一个对α-葡萄糖苷酶具有抑制活性的化合物dichotocejpin A。
本发明中化合物dichotocejpin A,其特征在于,结构如式(I)所示:
本发明的第二个目的是提供一种化合物dichotocejpin A制备方法,其特征在于,所述的化合物dichotocejpin A是从Dichotomomyces cejpii FS110的发酵培养物中制备得到。
优选,具体步骤如下:
制备Dichotomomyces cejpii FS110的发酵培养物,将发酵培养物的发酵液和菌丝体分离,发酵液经乙酸乙酯萃取,乙酸乙酯层经浓缩后得到浸膏;
将浸膏用石油醚-乙酸乙酯从30:1,20:1,10:1,7:1,9:2,3:1,2:1v/v梯度洗脱,收集石油醚:乙酸乙酯=2:1v/v洗脱下来的馏分F6,将此馏分经纯化后得到的化合物dichotocejpin A。
所述的纯化是通过HPLC纯化。
所述的制备Dichotomomyces cejpii FS110的发酵培养物优选是将活化的Dichotomomyces cejpii FS110接入马铃薯葡萄糖液体培养基中,28℃,120rpm,培养5d制得种子液,将种子液以体积比10%的接种量接入到马铃薯葡萄糖液体培养基中,28℃,120rpm,振荡培养7d,而制得发酵培养物。
本发明的第三个目的是提供Dichotomomyces cejpii FS110在制备化合物dichotocejpin A中的应用。
本发明通过酶抑制活性测试发现,化合物dichotocejpin A对α-葡萄糖苷酶的IC50值为138μM,阳性对照药物阿卡波糖对α-葡萄糖苷酶的IC50值为463μM。结果表明:本发明的化合物dichotocejpin A具有显著的α-葡萄糖苷酶抑制活性,能用于制备治疗糖尿病的药物。
本发明的第四个目的是提供化合物dichotocejpin A在制备治疗糖尿病药物中的应用
所述的治疗糖尿病的药物优选为对α-葡萄糖苷酶具有抑制活性的药物。
本发明的第五个目的是提供一种治疗糖尿病的药物,其特征在于,含有化合物dichotocejpin A作为有效成分。
所述的治疗糖尿病的药物优选为对α-葡萄糖苷酶具有抑制活性的药物。
本发明从Dichotomomyces cejpii FS110的发酵培养物中制备分离得到一个新的化合物dichotocejpin A,该化合物对α-葡萄糖苷酶具有明显的抑制活性,可为治疗糖尿病的新药研发提供化学实体。
本发明所涉及的Dichotomomyces cejpii FS110公开于文献:杨小岚,陈玉婵,李浩华,章卫民.23株海洋真菌的分子鉴定及其抗植物病原真菌和细胞毒活性研究,2014,8:132-137。该菌株保藏于微生物研究所,并保证自申请日起20年内向公众提供。
附图说明:
图1是化合物1的1H-NMR谱;
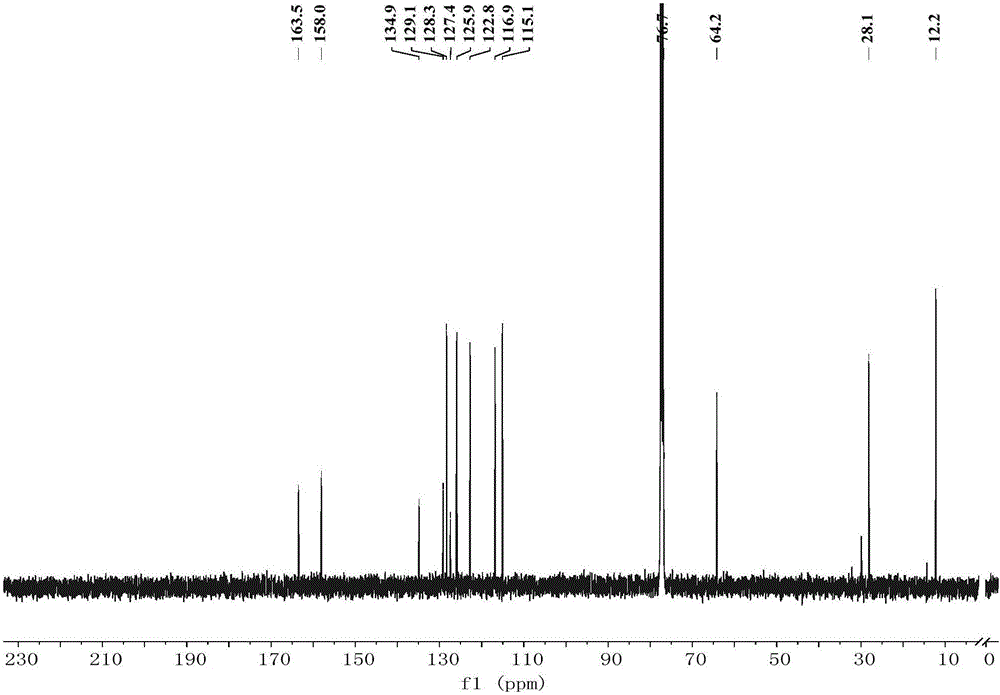
图2是化合物1的13C-NMR谱;
图3是化合物1的DEPT 135谱;
图4是化合物1的HSQC谱;
图5是化合物1的HMBC谱;
图6是化合物1的1H-1H COSY谱;
图7是化合物1的HRESIMS谱;
图8是化合物1的实验与计算的CD图谱。
具体实施方式:
以下实施例是对本发明的进一步说明,而不是对本发明的限制。
实施例1:
将活化的Dichotomomyces cejpii FS110接入马铃薯葡萄糖液体培养基中,28℃,120rpm,培养5d制得种子液,将种子液以体积比10%的接种量接入到马铃薯葡萄糖液体培养基中,28℃,120rpm,振荡培养7d,而制得发酵培养物。将发酵培养物的发酵液和菌丝体分离,发酵液经乙酸乙酯萃取,乙酸乙酯层经浓缩后得到浸膏;浸膏先用石油醚-乙酸乙酯从30:1,20:1,10:1,7:1,9:2,3:1,2:1,1:1,1:2v/v梯度洗脱,再用乙酸乙酯洗脱,最后用二氯甲烷:甲醇=5:1v/v洗脱,收集石油醚:乙酸乙酯=2:1v/v洗脱下来的馏分F6,将此馏分进行经反相制备HPLC(YMC-pack ODS-A柱,250×20mm,5μm,12nm,MeOH/H2O,20:80→50:50v/v,10mL/min)得F6.2(tR=34min),F6.2经正相制备HPLC(YMC-pack SIL柱,250×20mm,5μm,12nm,n-hexane/EtOAc,50:50v/v,10mL/min)得化合物1(1.4mg,tR=17min)。
马铃薯葡萄糖液体培养基,每升是这样配置的:将200g马铃薯切成小块,加水加热煮烂,用纱布过滤,滤液中加入20g葡萄糖,搅拌均匀,稍冷后再补足水至1L,灭菌备用。
化合物1经质谱和核磁共振波谱分析(如图1-7所示),其结构鉴定如下:
化合物1具有以下理化和波谱特性:淡黄色固体;UV(MeOH)λmax(logε)207(4.37),244(4.34),296(4.15)nm;IRνmax 3372,2955,2922,2853,1709,1636,1587,1429,1391,1358,1259,1026cm–1。HRESIMS m/z 291.0798[M+H]+(C14H15N2O3S,calcd for 291.0803)。1H-NMR(500MHz,CDCl3)δ:8.44(1H,dt,J=8.3,1.0Hz,H-6),7.47(1H,ddd,J=8.3,7.2,1.0Hz,H-7),7.42(1H,dt,J=8.0,1.0Hz,H-9),7.26(1H,ddd,J=8.0,7.2,1.0Hz,H-8),7.30(1H,d,J=0.8Hz,H-10),4.46(1H,dd,J=12.0,7.8Hz,H-3a),4.08(1H,dd,J=12.0,4.8Hz,H-3a),3.32(3H,s,H3C-N),1.90(3H,s,H3C-S),3.39(1H,t,HO-3a)。13C NMR(125MHz,CDCl3)δ:163.5(C-4),158.0(C-1),134.9(C-9a),129.1(C-5a),128.3(C-7),127.4(C-10a),125.9(C-8),122.8(C-9),116.9(C-6),115.1(C-10),76.7(C-3),64.2(C-3a),28.2(C-N),12.2(C-S)。实验的CD谱数据显示该化合物1在300和237nm显示正的Cotton效应,在254nm显示负的Cotton效应,与计算的3R构型的CD数据一致(如图8),因此,确定该化合物1的绝对构型为3R。经文献检索,该化合物1为新化合物,命名为dichotocejpin A,具体结构如式(I)中所示。
实施例2:
采用pNPG法测试化合物dichotocejpin A的α-葡萄糖苷酶抑制活性。
1、实验方法:酶液的制备:将α-葡萄糖苷酶冻干粉用PH7.0的0.1mol/L含0.2%BSA的磷酸盐缓冲液(PBS)配制成0.2U/mL的工作液,分装,-20℃冻存备用。
底物(PNPG)的配制:PNPG用PH7.0的0.1mol/L PBS配制成10mmol/L的工作液。
待测样品的制备:化合物dichotocejpin A均用DMSO溶解,配制成浓度为100mmol/L的储存液,用PBS稀释成所需浓度的工作液。
取20μL稀释好的化合物dichotocejpin A溶液与20μL 0.2U/mLα-葡萄糖苷酶溶液、140μL PH 7.0的0.1mol/L PBS混合,37℃孵育10min,加入20μL 10mM PNPG,37℃反应15min,再加入30μL 3%SDS终止反应,405nm处测定吸光度值(A)。以上反应在96孔板上完成,每个样品设3个重复,以阿卡波糖为阳性对照,同时设:
阴性对照组=160μL PBS+20μL酶液+20μL底物;
样品背景组=20μL样品+20μL酶液+160μL PBS;
空白对照组=160μL PBS+20μL酶液。
用以下公式计算样品对α-葡萄糖苷酶的抑制率:
抑制率(%)=(1-(A样品-A样品背景)/(A阴性对照-A空白对照))×100%
2、实验结果:化合物dichotocejpin A对α-葡萄糖苷酶抑制活性的IC50值为138μM,而阳性对照药物阿卡波糖的IC50值为463μM。结果表明:本发明的化合物dichotocejpin A具有显著的α-萄糖苷酶抑制活性,因此,本发明的实现为研究与开发新的治疗糖尿病的药物提供了候选化合物,为开发利用海洋真菌资源提供了科学依据。
- 还没有人留言评论。精彩留言会获得点赞!