A型和O型口蹄疫病毒特异性引物和试剂盒的制作方法
本发明涉及一种对牛和猪以及相关牛和猪的产品是否感染特定的传染病进行检测的试剂盒,确切讲本发明是一种检测牛和猪以及相关牛和猪的产品是否感染A型和O口蹄疫病毒的试剂盒。
背景技术:
口蹄疫(Foot and mouth disease,FMD)是一种由口蹄疫病毒(Foot and mouth disease virus,FMDV)引起的危害牛、羊等偶蹄动物的严重的急性热性高度接触性传染病。由于其传播速度快,不易控制和消灭,严重危害世界动物贸易,被世界卫生组织列为必须上报传染病之一。
口蹄疫病毒属于微核糖核酸病毒科(picornaviridas)中的口蹄疫病毒属(aphthavirus)。共包括A、C、O、Asia I、SAT I、SAT II及SAT III型7个血清型,各血清型之间无交叉保护力。FMDV的病毒粒子直径20-25nm,为正二十面体结构,近似圆形;基因组为全长8500(nt)的正链RNA,包括一个开放阅读框(open reading frame,ORF),5’-非编码区(5’-Untraslated Region,5’-UTR)和3’-非编码区(3’-Untraslated Region,3’-UTR);ORF编码病毒多聚蛋白,依赖于自身编码的蛋白酶(L、2A、3C)及少数的宿主因子,在经过3级裂解后,形成4种病毒结构蛋白(VP4、 VP2、VP3和VP1)和9 种非结构蛋白(Lab、Lb、2A、2B、2C、3A、3B、3C和3D);四种结构蛋白各60分子构成病毒颗粒, VP1靠近由五个原粒组成病毒表面的小洞,VP2和VP3位于远端,VP4则完全位于衣壳里面。
尽管目前国内外对口蹄疫的病原学、血清分型、诊断做了大量的研究,但口蹄疫病毒几乎遍及世界各地,口蹄疫对偶蹄类经济动物的威胁众所周知,它的发病率和造成的经济损失至今仍为各类传染病之首。2004年,台湾爆发的口蹄疫导致了600万头猪被屠宰,直接和间接经济损失到120亿美元。在畜牧兽医方面,它也威胁着多种家畜和很多野生动物的繁衍和生存。O型和A型口蹄疫基本呈世界性分布,Asia 1在我国到目前已经60年没有发生,已经不对其进行检测,SAT I-III和C型口蹄疫在国内不存在。由于口蹄疫与猪水泡病、水泡性口炎等类似症状的病毒,在临床上很难区分,而且临床症状和病理变化因感染动物的种类、年龄、病程长短及感染毒株毒力等不同而有所差别,可能缺乏特征病症,这给口蹄疫的诊断和防治带来极大困难。因此,建立分子生物学技术疫诊断技术具有很大优势。
为了确定口蹄疫是否在某一地区存在,检测动物血清抗体的方法并非完全可靠,还必须通过病原学检测以确诊病原的存在,但生物学实验、血清型诊断技术和分子生物学技术等诊断技术有的敏感性不高、有的特异性不强、有的检出率较低,而被认为是检测口蹄疫的金标准病毒分离技术,其确认结果至少需要7天,检测周期太长,并且这些技术普遍存在二次散毒的隐患,基层很难开展此项工作。鉴于O型和A型口蹄疫近年在我国流行比较普遍,因此建立一种快速定性的O型和A型口蹄疫的诊断技术具有重要意义。
技术实现要素:
本发明提供一种快速、简便、灵敏和经济的检测试剂盒及使用方法,且这种方法用于检测临床样品时,可以区分动物所感染的是A和O型口蹄疫病毒。
本发明的方法从待检动物的器官拭子或OP液或血液或病死动物的组织中提取其全基因组RNA,以RNA为模板,以试剂盒中的特异性A和O型口蹄疫的引物进行多重RT-PCR,对得到的产物进行电泳,根据电泳图谱分析被检动物是否感染有A和O型口蹄疫病毒。
本发明提供A型和O型口蹄疫病毒特异性引物,所述特异性引物为3对引物,具体为:
第一对引物和第二对引物用于对A型和O型口蹄疫病毒进行分型,其中:
第一对引物为:
上游引物:5,- CCCATCGAAAGAGGGGATCG-3,
下游引物:5,-CCCGTCGTCAAAACAGAGGA-3,
第二对引物为:
上游引物:5,-ATTTTGTGAGCGGGCCAAAC-3,
下游引物:5,-CTCTCCGCTCGATGGAACAA-3,
第三对引物是用于扩增定型的口蹄疫3D目的基因的引物,其中:
上游引物:5,-CGAGGCTATCCTCTCCTTTGC-3,
下游引物:5,-TACTCGTCAGGTCCAGAGTGG-3,。
本发明还提供一种A型和O型口蹄疫病毒检测试剂盒,所述试剂盒包括权利要求1所述的特异性引物。
作为优选,在50μl反应体系中,所述引物对混合物为3μl。
作为优选,所述试剂盒包括RNA模板,所述RNA模板为使用提取试剂对器官拭子、OP液、血液或动物组织进行提取得到的。
作为优选,RT-PCR反应程序如下:50℃反转录30 min,94℃,2 min,然后是循环程序94℃ 30s,55℃ 1min,72℃ 50s,36个循环;最后72℃延伸10min。RT-PCR反应在BIOMRTRA扩增仪中进行。
本发明还提供上述特异性引物在制备A型和O型口蹄疫病毒检测试剂盒中的应用。
本发明较经典的病毒分离、单RT-PCR和血清型分型方法快捷。本发明可以相当方便地一次性利用3D基因序列鉴定出是否存在口蹄疫感染,而特异性的A型和O型引物可以特异性的鉴定是否是A型或O型口蹄疫病毒感染,可以及时快捷的对疫病情况及区域、环境做出及时快捷的反应,这对及时扑灭或阻断传染病的传播具有积极的意义。另外,本发明具有快速、简单、成本低和所需试剂少的特点,特别适于小样品的提取。因此,本发明具有广泛的市场应用前景。
附图说明
附图用来提供对本发明的进一步理解,并且构成说明书的一部分,与本发明的实施例一起用于解释本发明,并不构成对本发明的限制。在附图中:
图1为应用本发明的试剂盒对A型和O型口蹄疫标准样品RT-PCR检测结果;
图2为本发明的试剂盒的特异性试验结果。
具体实施方式
以下的实施例便于更好地理解本发明,但并不限定本发明。下述实施例中的实验方法,如无特殊说明,均为常规方法。下述实施例中所用的试验材料,如无特殊说明,均为市售。
实施例1 本发明的试剂盒的制备和使用方法
一、本发明的试剂盒包括:
阳性对照:A型和O型口蹄疫标准样品提取的病毒RNA的混合物;
阴性对照:健康猪的血液提取的RNA。
特异性引物三对,其为引物的混合物。
特异性引物是参照Genbank登录的A和O型口蹄疫编码区基因的序列,设计并合成三对引物,一对引物用于定型,其余两对引物进行分型。引物序列见如下表1。
表1 本试剂盒涉及多重RT-PCR扩增的引物及扩增片段的大小
二、本发明试剂盒的使用方法为:
1、A和O型口蹄疫的核酸提取
无菌采集待检动物的器官拭子或OP液或血液或病死动物的组织,用生理盐水稀释或研磨制成1:5的乳悬液,采用TAKARA试剂盒提取其全基因组RNA。
2、多重RT-PCR反应
以步骤1提取的FMDV的RNA及A型和O型口蹄疫标准样品为模板,应用takara反转录一步法试剂盒说明进行多重RT-PCR反应,在50μL反应体系中加入FMDV的RNA 各1.5 μL,10μmol/L的六条引物混合物3μL(每条引物各0.5μL),1 step MIX 2 μL,2×缓冲液25 μL,加无菌的双蒸水至50μL。RT-PCR反应程序如下:50℃反转录30 min,94℃,2 min,然后是循环程序94℃ 30s,55℃ 1min,72℃ 50s,36个循环;最后72℃延伸10min。RT-PCR反应在BIOMRTRA扩增仪中进行。
3、结果检测
RT-PCR反应产物进行琼脂糖凝胶电泳。然后用溴化乙锭染色,BIO-RAD凝胶成像仪中照相并分析,电泳结果见图1。
图1为O型和A型FMDV 多重RT-PCR的方法建立。
图1为应用本发明的试剂盒对A型和O型口蹄疫标准样品RT-PCR检测结果;其中,从左至右依次为:M,DNA分子量标准DL-2000(marker条带的大小依次为2000bp、1000bp、750bp、500bp、250bp、100bp);泳道1为三套混合引物检测A型和O型口蹄疫混合标准样品多重RT-PCR检测结果;泳道2为三套混合引物检测O型口蹄疫标准样品多重RT-PCR检测结果;泳道3为三套引物检测A型口蹄疫标准样品多重RT-PCR检测结果;泳道4为阴性对照。
从图中可以看出,本发明的试剂盒可以特异的检出病毒目的基因和定型的3D基因,大小分别为193bp和93bp,泳道1-3电泳结果完全一致。结果说明了本发明的混合引物检测这两个型混合可以检测到同样的条带,混合引物单检测每型可以检出同样条带。
实施例2 本发明的试剂盒的敏感性和特异性试验
1 FMDV 多重RT-PCR的敏感性试验
1.1 A型和O型FMDV的定量
A型和O型FMDV提取的病毒RNA1:2、1:4、1:8、1:16和1:32分别进行稀释,按照实施例1中的引物和RT-PCR扩增条件和方法进行扩增。
1.2 结果检测
RT-PCR产物反应产物进行琼脂糖凝胶电泳。然后用溴化乙锭染色,BIO-RAD凝胶成像仪中照相并分析。结果表明本发明的方法可以检测到1:16倍稀释的病毒,即约为100拷贝/mL。
2. FMDV 多重RT-PCR的特异性试验
2.1 病毒RNA的提取和多重RT-PCRT反应
分别用经过病毒分离技术鉴定过的O型、A型FMDV、水泡性口炎病毒、猪水泡病病毒和猪繁殖与呼吸综合征病毒的RNA作为A和O型口蹄疫的多重RT-PCR的反应模板,同时为了确定三套引物的必要性,分别用第一对引物和3D引物检测O型口蹄疫病毒,用第二对引物和3D引物检测A型口蹄疫病毒,以健康猪的血液提取的RNA作为阴性对照模板。然后按照实施例1中的A和O型口蹄疫的多重RT-PCR体系和条件进行反应,反应产物用琼脂凝胶电泳检测。
2.2 特异性结果分析
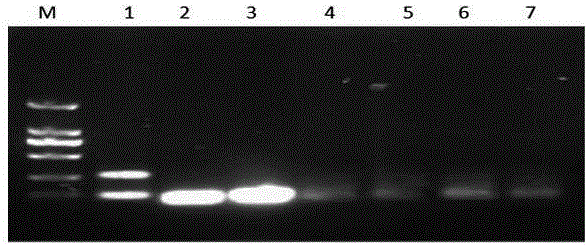
本发明的试剂盒与水泡性口炎病毒、猪水泡病病毒和猪繁殖与呼吸综合征病毒等病毒的RT-PCR方法交叉反应结果见图2。
图2为本发明的试剂盒的特异性试验结果。其中,1泳道为本发明的引物混合物检测A和O型口蹄疫病毒的多重RT-PCR结果;2泳道为使用本发明的第一对引物和3D引物检测O型口蹄疫病毒的多重RT-PCR结果;3泳道为使用本发明的第二对引物和3D引物检测A型口蹄疫病毒的多重RT-PCR结果;4泳道为检测水泡性口炎病毒结果;5泳道为检测猪水泡病病毒结果;6泳道为检测猪繁殖与呼吸综合征病毒的结果;7泳道为检测健康猪血清的RNA的结果。
检测结果表明本发明的引物混合物检测A和O型口蹄疫的多重RT-PCR结果出现两条特异的电泳条带,而在检测水泡性口炎病毒、猪水泡病病毒、猪繁殖与呼吸综合征病毒以及健康猪血清的RNA的结果全部没有特异条带;而第一对引物和3D引物检测O型口蹄疫病毒只能检测到一条100bp左右的特异条带(2泳道),使用第二对引物和3D引物检测A型口蹄疫病毒也只能检测到一条100bp左右的特异条带(3泳道)。上述结果表明本实验所建立的A和O型口蹄疫的多重RT-PCR方法特异性很好,与水泡性口炎病毒、猪水泡病病毒和猪繁殖与呼吸综合征病毒无交叉反应。
3 本发明的A和O型口蹄疫的多重RT-PCR临床样品检测
3.1 临床样品的准备
共包括41份临床样品,为单个RT-PCR和ELISA共同诊断为A和O型口蹄疫阳性的血清和组织样品。
3.2 多重RT-OCR检测结果
对上述41个A和O型口蹄疫阳性的临床样品用本发明的多重RT-PCR试剂盒检测,检测结果见表2,从表中可以看出,本发明的多重RT-RCR方法对41个A和O型口蹄疫为阳性的临床样品的检出率与单个RT-PCR的检出率基本相同,检出率为100%,同时比ELISA检出率要接近9个百分点。
表2 多重RT-PCR检测方法的敏感性比较
4 结论
上述试验证明本发明所建立的A和O型口蹄疫的多重RT-PCR方法定性和分型的作用,具有敏感性高、特异性强、快速、实验设备简单和操作容易等特点,适合于实验室和临床对A和O型口蹄疫的定性和分型。
最后应说明的是:以上所述仅为本发明的优选实施例而已,并不用于限制本发明,尽管参照前述实施例对本发明进行了详细的说明,对于本领域的技术人员来说,其依然可以对前述各实施例所记载的技术方案进行修改,或者对其中部分技术特征进行等同替换。凡在本发明的精神和原则之内,所作的任何修改、等同替换、改进等,均应包含在本发明的保护范围之内。
序列表
<110> 中国农业科学院兰州兽医研究所
<120> A型和O型口蹄疫病毒特异性引物和试剂盒
<170> PatentIn version 3.5
<210> 1
<211> 20
<212> DNA
<213> 人工序列
<400> 1
cccatcgaaa gaggggatcg 20
<210> 2
<211> 20
<212> DNA
<213> 人工序列
<400> 2
cccgtcgtca aaacagagga 20
<210> 3
<211> 20
<212> DNA
<213> 人工序列
<400> 3
attttgtgag cgggccaaac 20
<210> 4
<211> 20
<212> DNA
<213> 人工序列
<400> 4
ctctccgctc gatggaacaa 20
<210> 5
<211> 21
<212> DNA
<213> 人工序列
<400> 5
cgaggctatc ctctcctttg c 21
<210> 6
<211> 21
<212> DNA
<213> 人工序列
<400> 6
tactcgtcag gtccagagtg g 21
- 还没有人留言评论。精彩留言会获得点赞!
- 用于检测AEDs引起的SJS/TEN的引物、试剂盒及方法与制造工艺
- 检测植原体的LAMP引物组及其试剂盒和应用的制造方法与工艺
- 用于多重PCR检测致腹泻寄生虫的引物组及试剂盒的制造方法与工艺
- 使用重叠非等位基因特异性引物和等位基因特异性阻断剂寡核苷酸的组合物进行等位基因特异性扩增的制造方法与工艺
- 一种基于特异性SS-COI引物的丽草蛉PCR快速检测方法与制造工艺
- 一种利用线粒体D-loop区特异区域鉴定鼋的标记引物及方法
- 一种用于检测大豆拟茎点种腐病菌的特异性lamp引物组合物及其应用
- 一种针对膨胀污泥中Eikelboom Type 0092型丝状菌群特异性引物和方法
- 紫苑石斛的分子特异性标记引物及检测方法
- 一种检测牛hcd携带者的特异性pcr引物、试剂盒及检测方法
- 检测植原体的LAMP引物组及其试剂盒和应用的制造方法与工艺
- 用于多重PCR检测致腹泻寄生虫的引物组及试剂盒的制造方法与工艺
- 使用重叠非等位基因特异性引物和等位基因特异性阻断剂寡核苷酸的组合物进行等位基因特异性扩增的制造方法与工艺
- 一种利用线粒体D-loop区特异区域鉴定鼋的标记引物及方法
- 一种用于检测大豆拟茎点种腐病菌的特异性lamp引物组合物及其应用
- 一种针对膨胀污泥中Eikelboom Type 0092型丝状菌群特异性引物和方法
- 紫苑石斛的分子特异性标记引物及检测方法
- 一种检测牛hcd携带者的特异性pcr引物、试剂盒及检测方法
- 用于检测牛源性成分的lamp引物及其设计方法
- 七种不同种属来源细胞的pcr检测引物和检测方法与应用
- 玉米低镁条件下特异性转运镁离子基因ZmMGT10及其应用的制造方法与工艺
- CRISPR‑Cas9特异性敲除猪SLA‑3基因的方法及用于特异性靶向SLA‑3基因的sgRNA与制造工艺
- 毛酸浆的分子特异性标记引物及鉴别方法与制造工艺
- 一种检测CYP2C9基因多态性的ARMS引物的制造方法与工艺
- 构建在海马体区域特异性敲除IKKα基因的小鼠模型的方法及打靶载体和试剂盒与制造工艺
- 使用重叠非等位基因特异性引物和等位基因特异性阻断剂寡核苷酸的组合物进行等位基因特异性扩增的制造方法与工艺
- 一种利用线粒体D-loop区特异区域鉴定鼋的标记引物及方法
- 一种用于检测大豆拟茎点种腐病菌的特异性lamp引物组合物及其应用
- 一种针对膨胀污泥中Eikelboom Type 0092型丝状菌群特异性引物和方法
- 脯氨酸特异性蛋白酶基因及其应用
- 一种特异性引物检测鼠源性成分的方法与制造工艺
- 一组用于驴源性的实时荧光PCR检测的特异性引物和探针的制造方法与工艺
- 一组用于鸡源性实时荧光PCR检测的特异性引物和探针的制造方法与工艺
- 实时荧光PCR特异性检测肉苁蓉的引物及检测方法与制造工艺
- 小酸浆的分子特异性标记引物和检测方法与制造工艺
- 玉米低镁条件下特异性转运镁离子基因ZmMGT10及其应用的制造方法与工艺
- CRISPR‑Cas9特异性敲除猪SLA‑3基因的方法及用于特异性靶向SLA‑3基因的sgRNA与制造工艺
- 毛酸浆的分子特异性标记引物及鉴别方法与制造工艺
- 一种检测CYP2C9基因多态性的ARMS引物的制造方法与工艺
- 基于环介导等温扩增消光技术的玉米检测方法与制造工艺