CD19‑CAR基因序列在恶性B细胞肿瘤中的应用的制作方法
本发明属于恶性肿瘤的生物治疗技术领域,具体涉及一种CD19-CAR基因序列及利用该序列在恶性B细胞肿瘤治疗中的应用。
背景技术:
肿瘤生物免疫治疗是继外科手术、化疗和放疗以后肿瘤治疗的第四种手段。嵌合抗原受体(chimeric antigen receptor,CAR)T细胞技术(CAR-T细胞技术)是近年来获得重大突破的肿瘤生物免疫治疗新手段。CAR-T细胞技术是将可特异性识别肿瘤抗原的基因工程载体导入人体免疫细胞(如杀伤性CD8+T细胞)中,使该群T细胞编码出肿瘤特异性抗原,进而识别肿瘤细胞表面的受体靶向杀伤肿瘤细胞。同以往的细胞免疫治疗手段相比,CAR-T细胞技术具有如下的优势:首先,CAR-T细胞对抗原的识别不依赖抗原加工和HLA分子的抗原呈递,免疫逃逸的肿瘤细胞往往具有低表达HLA的和蛋白酶体抗原加工的特点,也能被CAR-T细胞识别,因此CAR-T细胞对肿瘤细胞具有更好的靶向性和杀伤性;第二,CAR-T细胞不仅能识别细胞表面的蛋白,也能识别细胞表面的碳链和糖链等空间结构,具有更广泛地识别肿瘤细胞的特点;第三,在CAR-T细胞表面除了特异性抗体的表达还有共刺激分子的表达,共刺激分子的表达以及细胞因子的加入都能有效地促进T细胞的存活和活力,在临床上更大限度地提高了免疫治疗的持久性。目前一系列动物试验和临床试验都证明了CAR-T细胞对血液肿瘤和实体瘤治疗的有效性和安全性,CAR-T细胞在肿瘤的临床治疗中具有巨大的应用潜力和发展前景,是未来治愈肿瘤的利器。
B细胞恶性肿瘤主要包括多种类型的白血病和淋巴瘤,目前除了少数接受异体造血干细胞移植的病人,大多数成年慢性淋巴细胞白血病和套淋巴细胞瘤患者无法被目前临床上常用的治疗手段治愈,因此新的治疗方法尤其是生物免疫治疗的开发对于B 细胞恶性肿瘤极其重要。
技术实现要素:
本发明目的一是提供一种翻译后可特异性识别B细胞表面CD19分子的CD19-CAR基因序列;二是利用嵌合抗原受体T细胞技术(CAR-T细胞技术)可将CD19-CAR基因序列嵌合进入抗原受体T细胞用于B细胞恶性肿瘤的治疗。
本发明所采取的技术方案如下。
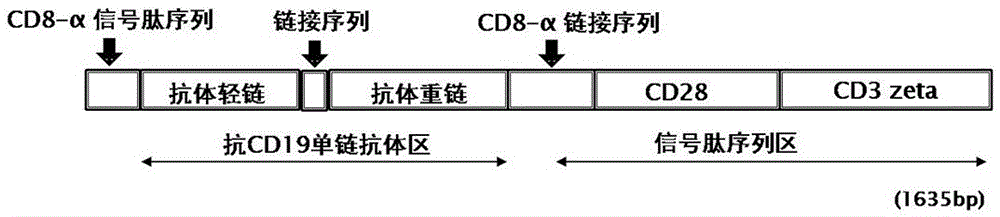
一种可特异性识别B细胞表面CD19分子的CD19-CAR基因序列,由CD19基因的scFv片段和由CD28和CD3 zeta片段组成的信号结构域构成,共1635个碱基,其碱基序列如SEQ ID NO.1所示。
利用所述可特异性识别B细胞表面CD19分子的CD19-CAR基因序列,可构建CD19-CAR-BTC载体。
所述CD19-CAR-BTC载体的制备方法,包括以下步骤:
(1)PCR扩增CD19-CAR基因序列;
PCR扩增时,引物序列设计如下:
正向引物序列为:5’-GGACTAGTGCCACC ATGGCCTTACCAGTGACCGCCTTGC-3’;
反向引物序列为:5’-CGGAATTCGCGAGGGGGCAGGGCCTGCATGTG-3’;
以携带有CD19-CAR基因序列的pUC-CD19质粒为模板进行PCR扩增;
(2)将步骤(1)中扩增后的CD19-CAR基因序列与载体质粒pSin-EF2-Pur双酶切;
(3)将步骤(2)中双酶切产物进行连接构建CD19-CAR-BTC载体。
所述CD19-CAR-BTC载体在B细胞恶性肿瘤中的应用,应用时,其具体应用步骤如下所述:
(1)T细胞培养和改造,采集B细胞恶性肿瘤病人外周血,分离其T细胞,利用T高效培养技术,在体外快速增值T细胞;
(2)利用慢病毒载体转染技术,将CD19-CAR-BTC载体转染构建嵌合抗原受体T细胞;
(3)将步骤(2)构建的抗原受体T细胞输入B细胞恶性肿瘤病人血液,达到治愈B细胞恶性肿瘤病人的目的。
由于CD19分子只在B细胞表面表达,在B细胞系以外的正常细胞中不表达,因而在治疗B淋巴细胞淋巴瘤、小淋巴细胞淋巴瘤、套细胞淋巴瘤、滤泡淋巴瘤、Burkitt淋巴瘤等恶性肿瘤中是较好的特异性识别抗原分子。
本发明设计构建了表达后可特异性识别B细胞恶性肿瘤表面CD19分子的CD19-CAR基因序列,利用CD19-CAR基因序列所构建CD19-CAR-BTC载体,在转染T细胞后,可特异性的识别B细胞恶性肿瘤相关细胞并使其凋亡,从而达到治愈目的。
为验证本发明所提供的CD19-CAR基因序列的技术效果,发明人利用CAR-T细胞技术特异性的改造T细胞,与传统CIK细胞的免疫过继治疗的技术效果进行进一步的对比,结果显示在所有的效靶比条件下,与CD19-CAR T细胞共培养的Raji细胞的死亡比率高,证明CD19-CAR T细胞对Raji细胞的杀伤作用比CIK强,具有有效力强、特异度高的特点,因而具有较好的推广应用价值。
附图说明
图1为特异性识别B细胞表面CD19分子的CD19-CAR基因序列结构示意图;
图2为流式细胞仪检测对转染效率的检测结果;其中左上图为进入细胞仪中细胞总数,右上图为检测结果,下图为检测判定数据;
图3为CD19-CAR T细胞对于Raji细胞的细胞毒性与传统CIK细胞杀伤效果比较(共培养4小时)。
具体实施方式
下面结合实施例对本发明做进一步的解释说明。
实施例1
如图1所示,本发明所提供的可特异性识别B细胞表面CD19分子的CD19-CAR基因序列,由靶向CD19的抗体基因的scFv片段和由CD28和CD3 zeta片段组成的信号结构域构成,共1635个碱基,其序列如序列表(SEQ ID NO.1)所示。
该序列由生工生物工程(上海)股份有限公司合成提供;具体使用前,该序列已由序列合成提供商将该序列与质粒构建pUC-CD19连接提供。
实施例2
根据实施例1所提供的CD19-CAR基因序列,构建CD19-CAR-BTC载体,具体包括以下步骤。
(1)PCR扩增CD19-CAR基因序列
首先,设计PCR扩增用引物序列如下:
正向引物序列为:5’-GGACTAGTGCCACC ATGGCCTTACCAGTGACCGCCTTGC-3’;
反向引物序列为:5’-CGGAATTCGCGAGGGGGCAGGGCCTGCATGTG-3’;
以携带有CD19-CAR基因序列的pUC-CD19质粒为模板,50μL的PCR反应体系设计如下:
正向引物,0.75µL(浓度:10µmol/mL);
反向引物,0.75µL(浓度:10µmol/mL);
PrimeSTAR Max Premix(宝生物工程(大连)有限公司),25µL;
携带CD19-CAR基因序列的pUC-CD19质粒模板,1.5µL(500ng/µL);
ddH2O,22µL;
反应程序:94℃ 预变性 3min;98℃、10s,55℃、5s,72℃、10s,35个循环;4℃延伸 10min。
对PCR扩增产物进行电泳,并回收扩增产物,备用。
(2)将步骤(1)中扩增后的CD19-CAR基因序列与载体质粒pSin-EF2-Pur分别进行双酶切;
20μL双酶切体系设计如下:
10X M Buffer(宝生物工程(大连)有限公司),2µL;
Spe I酶(宝生物工程(大连)有限公司),1µL;
EcoR I酶(宝生物工程(大连)有限公司),1µL;
步骤(1)中扩增的CD-19 CAR序列(或pSin-EF2-Pur质粒(Addgene)),1µg;
ddH2O,补充至20µL;
37℃酶切2h。
酶切结束后,琼脂糖凝胶电泳分离条带,凝胶回收试剂盒(MiniBEST Agarose Gel DNA Extraction Kit,宝生物工程(大连)有限公司)分别回收酶切后的CD19-CAR序列和线性pSin-EF2-Pur质粒。
(3)酶切产物的连接
将步骤(2)中所回收酶切产物进行连接,10μL连接体系设计如下:
DNA 混合物(步骤(2)中回收产物,摩尔比,pSin-EF2-Pur︰CD19-CAR=1︰5),5µL;
Solution I(宝生物工程(大连)有限公司),5µL;
4℃连接过夜。
(4)阳性克隆的筛选
在步骤(3)中连接产物中加入1微升Solution II(宝生物工程(大连)有限公司),然后转化大肠杆菌DH5α感受态细胞;
将转化后菌株在含氨苄青霉素(1mg/100mL)的琼脂糖培养基中37℃培养16h,以进行抗性筛选;
挑选阳性克隆菌株进行PCR鉴定和双酶切鉴定(酶切体系及PCR鉴定参考前述内容即可),对鉴定正确的菌株进一步进行测序鉴定,对测序鉴定正确的菌株进一步培养后,即可提取质粒备用,所提取质粒即为携带有CD19-CAR序列的重组的CD19-CAR-BTC载体。
实施例3
为检验实施例2中所制得的CD19-CAR-BTC载体在B细胞恶性肿瘤治疗中的具体应用效果,发明人进一步的做了体外试验,简要介绍如下。
(1)T细胞的采集
采集某身体健康志愿者(郑大一附院提供)10mL外周血,1500转/min、离心10 min(亦可根据情况:1500~2000 转/min,离心7~10 min),弃上清;
PBS缓冲液冲洗一次,弃上清;
将沉淀细胞用30 mL PBS缓冲液重悬细胞后置于15mL淋巴细胞分离液上,进行密度梯度离心,收集单个核细胞并用PBS缓冲液冲洗三次备用。
(2)T细胞的转染
首先,将用于包装生产病毒的辅助细胞293T细胞(ATCC细胞库)按照85%融合度(亦可根据情况选择80~90%融合度)接种在6孔板中,无抗生素DMEM+10%FBS培养基,37℃过夜培养;
其次,用Lipofectamin 2000转染试剂(Invitrogen公司)将2μg实施例2中所制备的 CD19-CAR-BTC载体+1.5μg psPAX2(Intrivogen公司)+1.5μg pMD2.G(Intrivogen公司)转入293T细胞中,转染48小时;
第三,转染结束后,用0.45μm滤膜(Millopore公司)过滤细胞悬液,在细胞培养上清中按照每4mL细胞上清加入1mL PEG6000的比例加入PEG6000,重复混匀,4℃放置2天, 8000转/分钟离心30分钟,收集病毒沉淀;
第四,将步骤(1)所采集的浓度为2×105/mL悬浮T细胞接种到6孔板中,加入聚凝胺(polybrene,Sigma公司)至浓度为6 μg/mL,同时加入上述第三步骤中所制备的病毒沉淀,病毒沉淀用量为100µL滴度为106的病毒溶液,充分混匀,37℃孵育培养感染。
感染48小时后,通过流式细胞仪(BD公司FASCanto流式细胞仪)检测GFP荧光以确定转染效率。其原理主要是用带荧光标记的CD19分子作为诱饵筛选细胞表面已经表达抗CD19抗体分子的T细胞(成功转染了CD19-CAR载体的T细胞才会在细胞表面表达抗CD19的抗体),计算公式为:
转染效率=有荧光标记的细胞数目/进入流式细胞仪的细胞总数。
检测结果如图2所示。对图2进行分析可知:图2左上图中P1相所示的细胞为进入流式细胞仪的活细胞总数,对P1中的细胞按照结合的CD19分子荧光进行进一步筛选,Q4相中所示细胞为被CD19分子标记的成功转染了CD19-CAR载体的T细胞,流式细胞仪数据分析显示Q4细胞所占活细胞总数的比率为51.2%,即转染效率为51.2%。
第五,将转染了CD19-CAR-BTC载体的T细胞与肿瘤细胞中淋巴瘤细胞的Raji细胞系、Ramos细胞系和K562细胞系(细胞系均来自于ATCC细胞库)分别按照0.5:1、2:1和10:1的体积比例(体积比设计原则为,以效靶比相同为设计原则)混合培养48小时(37℃、10%二氧化碳条件下细胞培养箱中培养);同时设置GFP对照(GFP对照是指在构建CD19-CAR-BTC载体时,以GFP替代CD19-CAR序列插入质粒pSin-EF2-Pur中所构建GFP-BTC载体)。
以流式细胞仪,对不同细胞系中肿瘤细胞的凋亡比率进行检测,具体检测结果见下表:
。
从上表数据可以看出,CD19-CAR-BTC转染后T细胞对CD19阳性的B细胞具有较好的选择性。具体而言,转染了CAR-CD19-BTC载体的T细胞相比只转染了GFP对照的T细胞对CD19阳性细胞Raji和Ramos的杀伤能力明显增高(凋亡比率升高);而在CD19阴性的K562细胞中,CAR-CD19-BTC细胞对K562的杀伤能力和对照细胞没有明显区别。因而从上述数据可以说明,本发明所提供的CD19-CAR基因序列、CD19-CAR-BTC载体在B细胞恶性肿瘤治疗方面是有较好的应用前景的。
现有技术中,利用嵌合抗原受体T细胞技术(CAR-T细胞技术)治疗B细胞恶性肿瘤所遵循的一般步骤为:
(1)T细胞培养和改造,采集B细胞恶性肿瘤病人外周血,分离其T细胞,利用T高效培养技术,在体外快速增值T细胞;
(2)利用慢病毒载体转染技术,将相应的病毒载体转染构建嵌合抗原受体T细胞;
(3)将步骤(2)构建的抗原受体T细胞输入B细胞恶性肿瘤病人血液,达到治愈B细胞恶性肿瘤病人的目的。
参考现有技术方法检测CD19-CAR T细胞对淋巴瘤的杀伤作用,以传统的CIK细胞做为对照,将CD19-CAR T细胞和传统的CIK细胞分别按照相同的比例(100:1, 50:1, 10:1, 5:1)与淋巴瘤细胞系Raji细胞共同培养48小时(37℃、10%二氧化碳条件下细胞培养箱中培养),应用LDH细胞毒性检测试剂盒检测Raji细胞被杀伤过程中产生的标志物乳酸脱氢酶的活性,比较CD-19 CAR T细胞和CIK细胞对Raji细胞系的杀伤效果,实验结果如图3所示。
图3中,横坐标为转染了CD19-CAR-BTC载体的T细胞或者传统的CIK细胞与淋巴瘤Raji细胞的比例(效靶比),纵坐标表示被杀伤的Raji细胞的比例(毒性率)。当效靶比为100:1时,约38%的Raji细胞被传统CIK杀死,约62%的Raji细胞被CD19-CAR T细胞杀死,被CD19-CAR T细胞杀死的Raji细胞的比率明显高于被传统CIK杀死的Raji细胞的比率。同样在效靶比为50:1, 10:1和5:1时,被CD19-CAR T细胞杀死的Raji细胞的比率都高于被传统CIK杀死的Raji细胞的比率。该结果证明CD19-CAR T细胞对肿瘤细胞的杀伤作用优于传统的CIK细胞。本发明所提供的CD19-CAR基因序列具有效力强、特异度高的特点,具有更好的应用价值。
SEQUENCE LISTING
<110> 郑州大学第一附属医院
<120> CD19-CAR基因序列在恶性B细胞肿瘤中的应用
<130> none
<160> 1
<170> PatentIn version 3.5
<210> 1
<211> 1635
<212> DNA
<213> CD19-CAR
<400> 1
atggccttac cagtgaccgc cttgctcctg ccgctggcct tgctgctcca cgccgccagg 60
ccggaggtga aactgcagga gtcaggacct ggcctggtgg cgccctcaca gagcctgtcc 120
gtcacatgca ctgtctcagg ggtctcatta cccgactatg gtgtaagctg gattcgccag 180
cctccacgaa agggtctgga gtggctggga gtaatatggg gtagtgaaac cacatactat 240
aattcagctc tcaaatccag actgaccatc atcaaggaca actccaagag ccaagttttc 300
ttaaaaatga acagtctgca aactgatgac acagccattt actactgtgc caaacattat 360
tactacggtg gtagctatgc tatggactac tggggtcaag gaacctcagt caccgtctcc 420
tcaggtggag gcggttcagg cggaggtggc tctggcggtg gcggatcgga catccagatg 480
acacagacta catcctccct gtctgcctct ctgggagaca gagtcaccat cagttgcagg 540
gcaagtcagg acattagtaa atatttaaat tggtatcagc agaaaccaga tggaactgtt 600
aaactcctga tctaccatac atcaagatta cactcaggag tcccatcaag gttcagtggc 660
agtgggtctg gaacagatta ttctctcacc attagcaacc tggagcaaga agatattgcc 720
acttactttt gccaacaggg taatacgctt ccgtacacgt tcggaggggg gactaagttg 780
gaaataacac gggctgatgc tgcaccaact gtatccatct tcccaccatc cagtaataag 840
cccaccacga cgccagcgcc gcgaccacca acaccggcgc ccaccatcgc gtcgcagccc 900
ctgtccctgc gcccagaggc gtgccggcca gcggcggggg gcgcagtgca cacgaggggg 960
ctggacttcg cctgcaaaat tgaagttatg tatcctcctc cttacctaga caatgagaag 1020
agcaatggaa ccattatcca tgtgaaaggg aaacaccttt gtccaagtcc cctatttccc 1080
ggaccttcta agcccttttg ggtgctggtg gtggttggtg gagtcctggc ttgctatagc 1140
ttgctagtaa cagtggcctt tattattttc tgggtgagga gtaagaggag caggctcctg 1200
cacagtgact acatgaacat gactccccgc cgccccgggc ccacccgcaa gcattaccag 1260
ccctatgccc caccacgcga cttcgcagcc tatcgctcca gagtgaagtt cagcaggagc 1320
gcagacgccc ccgcgtacca gcagggccag aaccagctct ataacgagct caatctagga 1380
cgaagagagg agtacgatgt tttggacaag agacgtggcc gggaccctga gatgggggga 1440
aagccgagaa ggaagaaccc tcaggaaggc ctgtacaatg aactgcagaa agataagatg 1500
gcggaggcct acagtgagat tgggatgaaa ggcgagcgcc ggaggggcaa ggggcacgat 1560
ggcctttacc agggtctcag tacagccacc aaggacacct acgacgccct tcacatgcag 1620
gccctgcccc ctcgc 1635
- 还没有人留言评论。精彩留言会获得点赞!