用于川崎病检测的引物组、探针及试剂盒的制作方法
本发明属于生物技术领域,涉及一种用于川崎病检测的引物组、探针及试剂盒。
背景技术:
川崎病( Kawasaki disease KD) 是一种病因不明的急性发热性全身性血管炎综合征,该病最早于1961年由日本学者Tomisaku Kawasaki在日本首次发现,并于1967年首先报道。自1970年以来,KD在世界绝大多数国家或地区被陆续报道,以亚裔人发病率为最高。近年来KD己成为小儿常见病之一,KD主要影响5岁以下婴幼儿,临床特征为发热、黏膜炎、皮疹、颈淋巴结肿大和肢端改变,病理变化主要为全身性中小动脉血管炎,尤其易造成冠状动脉炎性损伤及其所引起的血栓性梗塞、狭窄、扩张和动脉瘤的形成。其中有些患儿形成巨大冠状动脉瘤,巨大冠状动脉瘤长期存在,后期发展为冠状动脉狭窄与闭塞,导致缺血性心脏病,甚至引起死亡。此外,该病还可以导致心肌细胞肥大、局灶性心肌缺血,心肌纤维化及成人期的心肌梗死,重者可导致猝死。即使对形成冠状动脉瘤的KD患者进行了及时有效的针对性治疗,但仍有患者因形成巨大冠状动脉瘤造成死亡。有文献表明,冠状动脉扩张的发生率为18.6%~26.0%,冠状动脉瘤发生率为3.1%~5.2%,而且,冠状动脉瘤的发生率呈逐年上升趋势。冠状动脉瘤是KD最严重的并发症,冠状动脉瘤发生时血管内膜易形成血栓、血管内皮增生,造成临近冠状动脉管腔的狭窄。瘤内血液滞留,易形成血栓,从而导致邻近冠状动脉血流量减少,发生心肌梗死及猝死。若瘤的直径≥8 mm,则成为巨大瘤,消退就更加困难,且发生狭窄的几率随时间延长而明显增加。给患儿带来很大的风险并严重的影响了患儿的生活质量。而目前针对KD致冠状动脉瘤的主要治疗手段包括:长期抗凝治疗、溶栓治疗、外科冠状动脉搭桥术、心脏移植以及介入治疗,但都属于事后补救性的治疗措施,效果均不理想,除治疗费用昂贵外,治疗后患儿的生存质量亦无法保证。
报道显示,在日本和美国等发达国家或地区,KD所致的冠状动脉并发症已取代风湿热成为儿童获得性心脏病的第一位病因,并且成为成人后缺血性心脏病的主导因素之一。在我国,KD的发病率也很高,成为仅次于日本、韩国之后的第三大高发国,并且也已经取代风湿热成为我国小儿后天性心脏病最主要的病因,近年来亦呈现逐年上升的趋势,给我国儿童的心脏及血管健康带来很大的风险,造成巨大的经济和社会负担。
目前对KD的诊断包括临床指征、超声影像和实验室检查。临床上诊断KD,主要依照患儿的临床表现,待一系列典型体征出现后,并排除其他可能的疾病,方能诊断,时效性不佳。超声影像学检查方面,主要借助于超声心动图确诊冠状动脉病变,而对于KD患儿早期轻微冠状动脉病变,超声诊断则存在局限性。实验室检查主要采用全身炎性指标来辅助诊断小儿KD:急性期外周血白细胞及中性粒细胞增高、轻度贫血、血小板进行性增高、C反应蛋白明显增加及红细胞沉降率明显增快等。由于这些实验室指标是通过炎性指标来间接辅助诊断KD,故特异性和指向性均不理想。许多其他疾病尤其是感染性疾病也会产生全身炎症,故此传统诊断方案常与其他感染性疾病相混淆,贻误治疗时机。
近年来不典型KD临床诊断较为困难,不典型KD发生率约为10%~36%,且发病率逐年攀升,不典型KD临床表现也常呈多样性及复杂性,易误诊为呼吸道感染、败血症、药物疹、猩红热、麻疹、淋巴结炎、幼年型类风湿等疾病,易由于误诊或漏诊而错过最佳的治疗时间。因此,许多儿童在确诊KD时,冠状动脉损伤就已经形成了。
近年来,学者们一直在努力寻找KD早期诊断的标志物,因受KD病因和致病机制不清楚的限制,学者们大多数是从基因,细胞因子,炎性因子等入手,找到的生物标记物无法用来作为特异性的指标诊断KD,虽然,有些研究报道心肌型脂肪酸结合蛋白(h-FABP)、基质金属蛋白酶9(MMP-9)、N端脑利钠肽原(NT-pro BNP)等一些蛋白和基因有可能作为诊断川崎病的分子标记物,但其灵敏度和特异性难以同时满足,且与检验者的取材手法、操作水平等相关,易造成误差,因此都未能得到较大临床队列的证实。到目前为止,仍未有一个公认指标和方法。因此,找到一种能快速准确诊断川崎病的分子标记物是非常重要的,能为临床治疗指明方向,可以避免冠状动脉病变的发生,改善预后,提高川崎病患儿的生存质量。
Exosome 是活细胞分泌的来源于晚期核内体( 也称为多囊泡体) 的囊泡,当多囊泡体与质膜融合就会把内含的囊泡释放到胞外。研究表明, 来源于不同细胞的exosome 含有源细胞最关键的功能分子。Exosome 是一种直径为30~100 nm 的小囊泡,可由多种细胞分泌,内含蛋白质、脂质以及微RNA 等成分。不同细胞来源的exosome 所含的蛋白质及微RNA不同,其生物学功能也有所差异,血液中的exosome 是一种密度很低的固相成分,被认为携带有丰富的生物标志物信息,因此,近年来受到普遍关注,在人体体液如血清、尿液、组织液等中被exosome的膜所包裹的RNA不会被核酸酶降解,而且不受白蛋白,IgG等高丰度蛋白的影响。由于来源于细胞,exosome所含的物质表征着细胞中的部分物质,也就给检测细胞内的某些蛋白质与核酸的变化带来了可能性。近年来,体液中的exosome在临床诊断中的意义日益被人们所重视,如癌症患者的血清中存在的能作为早期诊断数种癌症的microRNA分子标志物。 此外,组学手段对病因未知的疾病寻找特异性分子标记提供了最佳的平台和技术。目前常用的组学范畴有基因组、转录组、蛋白组等,可以用一定的实验手段和数据分析方法研究样品中DNA、RNA或蛋白质的全体,通过对比来自正常个体和病人的样品数据,可望找到疾病特异性的分子标记物,为疾病早期诊断、病因分析、后续深入研究和治疗等提供重要基础。目前,这些方法已经在研究细胞的增殖、分化、异常转化、肿瘤形成等方面进行了有力的探索,涉及到肝癌、乳腺癌、结肠癌、膀胱癌、前列腺癌、肺癌、肾癌和神经母细胞瘤等,鉴定了一批肿瘤相关蛋白,为肿瘤的早期诊断、药靶的发现、疗效判断和预后提供了重要依据。某些核酸分子亦可作为疾病诊断的分子标志物,临床诊断实践中,检测核酸标记物具有灵敏度高、特异性好、可精确定量的特点,很适合作为早期诊断的标志物。
成熟microRNA(miRNA)是一类长约17~25 个核苷酸的小分子非编码RNA,主要通过与靶mRNA的3’-非翻译区(UTR)、5’-UTR 和编码区域的碱基互补配对抑制靶mRNA 翻译,在转录后水平调控靶基因表达。生物信息学研究表明,每一个miRNA 可以调控多个靶基因, 反之, 1 个靶基因也可以同时被多个miRNAs 调节。因此, 据保守估计, 约60%~70%的人类蛋白编码基因受到miRNAs 的调控,单个miRNA 分子能够与数百个功能各异的靶mRNA 相结合而发挥调节作用,参与了哺乳动物几乎所有的病理和生理活动,如个体发育、组织分化、细胞凋亡以及能量代谢等,与许多疾病的发生、发展存在着紧密的联系。
既往对miRNAs的研究主要集中于它们在细胞内的活动。2008年,Mitchell等通过分离健康人血浆中的18~24个核苷酸的RNA,构建了小RNA文库,对得到的125个DNA克隆进行测序分析,在所采用的血浆样本中克隆到包括let-7a、miR-16和miR-15b等在内的37种miRNA分子,并发现miRNAs能以一种非常稳定的形式存在于人体血浆中,以保护其免受内源性RNase的降解。同一时间,Chen 等通过高通量测序技术对血清中miRNA进行了分析,在男、女性健康人血清中分别发现了超过100和91种血清miRNA,且在恶劣的条件下(如高温、极低或极高的pH环境、多次冻融)仍能保持稳定,而此时大多数RNA 都会降解。此外,对正常人和不同疾病患者血清/血浆中miRNA检测结果发现miRNA广泛存在于正常人和患者的血清/血浆中,并且随着生理状况、疾病种类和病程的不同,miRNA的表达谱将发生特异性变化。最近有研究表明,不同的肿瘤显示出特异性的microRNA表达谱,肿瘤来源的microRNA能被释放到循环系统中,进入血液组织。而在血液组织中,microRNA能避免被RNase降解,具有良好的稳定性。因此,血清血浆中的microRNA有成为肿瘤生物标志物的潜力。例如,最近的研究发现在弥漫性大B细胞淋巴瘤患者的血清中miR-21的含量比正常人群高。由于研究发现在人类血清血浆中存在大量稳定的microRNA。血液中的Exosome被认为携带有丰富的生物标记物信息,来源于不同细胞的exosome 含有源细胞最关键的功能分子。因此,近年来,体液中的exosome在临床诊断中的意义日益被人们所重视。如癌症患者的血清中存在的能作为早期诊断数种癌症的microRNA分子标志物,这些现象表明,我们可以寻找川崎病患者血清exosome中表达量发生明显改变的microRNA,以此作为生物标记物进行川崎病的早期诊断。
发明人在先的申请CN104450901A公开了hsa-miR-197、hsa-miR-671、hsa-miR1246和hsa-miR4436可以作为川崎病的分子标志,并具体公开了miR-1246、miR-4436b-5p、miR-197-3p和miR-671-5p的染料法荧光定量PCR引物序列,共计4组8条核酸序列,其检测精度仍存在改进的需要。
普通染料法荧光定量PCR的原理利用核酸双链DNA分子可与多分子染料结合并在特定条件下激发荧光的特点,其检测灵敏度极高,但引物二聚体、单链二级结构及非特异扩增产物可能影响到检测结果特异性。
技术实现要素:
为了解决上述存在的问题,本发明所采用的探针法荧光定量PCR在原方案基础上进一步改进,其同时检测多个靶标的特异性更强、灵敏性更高。
本发明的目的在于提供一种用于川崎病检测的引物组、探针及试剂盒。
本发明所采取的技术方案是:
一种用于川崎病检测的核酸序列组合,包括反转录引物、扩增引物和探针序列,其特征在于:所述核酸序列组合能够有效定性/定量检测人血清中的hsa-miR-197、hsa-miR-671、hsa-miR1246和hsa-miR4436。
作为上述核酸序列组合的进一步改进,反转录引物序列如下:
RT-miR197:GTCGTATCCAGTGCAGGGT-探针序列-ACGACGCTGGG
RT-miR671:GTCGTATCCAGTGCAGGGT-探针序列-ACGACTTTTTTTTTTTCTCCAGCC
RT-miR1246:GTCGTATCCAGTGCAGGGT-探针序列-ACGACCCTGCT
RT-miR4436:GTCGTATCCAGTGCAGGGT-探针序列-ACGACGGCAGGGC。
作为上述核酸序列组合的进一步改进,扩增引物序列如下:
正向引物:
F-miR4436:TCCTGTCCACTTCTGCCT
F-miR197:TTCACCACCTTCTCCACC
F-miR671:GAGAGGAAGCCCTGGAG
F-miR1246:GCCGAATGGATTTTTGGAG
通用反向引物R-KD:TCGTATCCAGTGCAGGG。
作为上述核酸序列组合的进一步改进,探针序列为:CCGAGGTATTCGCACTGGAT。
一种用于川崎病检测的试剂盒,包括反转录试剂、扩增试剂和探针,探针序列两端分别连接有报告基团和对应的淬灭基团,反转录引物序列为上述的RT-miR197、RT-miR671、RT-miR1246和RT-miR4436;扩增引物为上述的R-KD、F-miR197、F-miR671、F-miR1246和F-miR4436。
一种检测川崎病的芯片或装置,其使用上述的反转录引物、扩增引物和探针序列。
上述反转录引物、扩增引物和探针序列在制备川崎病的预测、辅助诊断、鉴别和/或评价川崎病的试剂或工具中的应用。
一种同时定性/定量检测hsa-miR-197、hsa-miR-671、hsa-miR1246和hsa-miR4436的方法,包括如下步骤:
1)从样品中提取血清外泌体miRNA,加入反转录引物RT-miR197、RT-miR671、RT-miR1246和RT-miR4436进行反转录,得到cDNA;
2)以cDNA为模板,使用引物R-KD、F-miR197、F-miR671、F-miR1246和F-miR4436进行扩增,扩增的同时加入探针,对扩增产物进行分析,判断各miRNA的荧光定量反应Ct值,即可;
其中,反转录引物、扩增引物和探针序列如上所述。
作为上述方法的进一步改进,扩增反应体系和条件如下:
PCR 2X mix: 10μl
引物mix:F/R各0.4μl
探针:0.4μl
CXR:0.2μl
cDNA: 2μl
ddH2O:补足至20μl
反应条件:95℃ 5min;95℃ 15S,54℃ 25s,72℃ 15s,40 cycles。
本发明的有益效果是:
本发明的核酸序列,试剂盒等可以有效的反转录目标miRNA,更好地区分阳性样本和阴性样本,更容易判断出检测结果,得到的结果更为准确。
附图说明
图1为特异性检测结果,图中A~H曲线分别为miR-4739、miR-16、miR-483、miR-21、miR-19、miR-22、miR-1260、miR-134的反应结果;
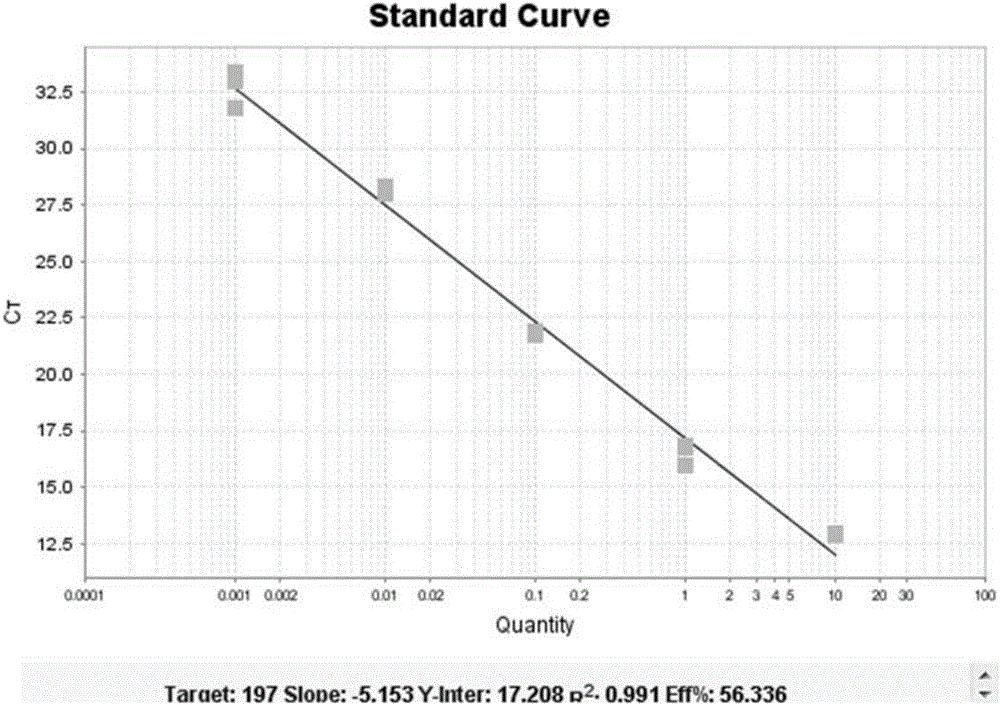
图2为本发明引物和探针检测miR-197的线性范围评价结果(R2=0.991);
图3为本发明引物和探针检测miR-671的线性范围评价结果(R2=0.988);
图4为本发明引物和探针检测miR-1246的线性范围评价结果(R2=0.986);
图5为本发明引物和探针检测miR-4436的线性范围评价结果(R2=0.993);
图6为本发明引物、探针检测miR197、miR671、miR1246、miR4436阳性标准品的结果图;
图7为原miR-197-F引物扩增miR-197的结果;
图8为本发明新miR-197-F引物扩增miR-197的结果;
图9为原miRNA-671-F引物扩增miR-671的结果;
图10为原miRNA-671-F2引物扩增miR-671的结果;
图11为本发明新miRNA-671-F引物和新miRNA-671-RT引物扩增miR-671的结果;
图12为原miRNA-4436-RT和原miRNA-4436-F引物扩增miR-4436的结果;
图13为本发明新miRNA-4436-RT和新miRNA-4436-F引物扩增miR-4436的结果;
图14为Sybrgreen法检测miR197的结果,A~H分别表示模板miR197的浓度为1μM,100nM,10nM,1nM,100pM,10pM,100fM,10fM;
图15为Sybrgreen法检测miR671的结果,A~H分别表示模板miR671的浓度为1μM,100nM,10nM,1nM,100pM,10pM,100fM,10fM;
图16为Sybrgreen法检测miR1246的结果,A~H分别表示模板miR1246的浓度为1μM,100nM,10nM,1nM,100pM,10pM,100fM,10fM;
图17为Sybrgreen法检测miR4436的结果,A~H分别表示模板miR4436的浓度为1μM,100nM,10nM,1nM,100pM,10pM,100fM,10fM。
具体实施方式
下面结合实施例,进一步说明本发明的技术方案。
实施例1 检测川崎病的反转录引物、扩增引物和探针序列
川崎病的检测标记物为:hsa-miR-197、hsa-miR-671、hsa-miR1246和hsa-miR4436。
反转录引物序列为:
RT-miR197:
GTCGTATCCAGTGCAGGGTCCGAGGTATTCGCACTGGATACGACGCTGGG;
RT-miR671:
GTCGTATCCAGTGCAGGGTCCGAGGTATTCGCACTGGATACGACTTTTTTTTTTTCTCCAGCC;
RT-miR1246:
GTCGTATCCAGTGCAGGGTCCGAGGTATTCGCACTGGATACGACCCTGCT;
RT-miR4436:
GTCGTATCCAGTGCAGGGTCCGAGGTATTCGCACTGGATACGACGGCAGGGC;
扩增引物序列为:
通用反向引物R-KD:TCGTATCCAGTGCAGGG;
F-miR197:TTCACCACCTTCTCCACC;
F-miR671:GAGAGGAAGCCCTGGAG;
F-miR1246:GCCGAATGGATTTTTGGAG;
F-miR4436:TCCTGTCCACTTCTGCCT;
探针序列为:CCGAGGTATTCGCACTGGAT。
上述引物序列中,下划线标记的为反向引物序列;斜体标记的为探针序列;加粗标记的为miRNA互补序列。探针序列两端分别连接有报告基团和对应的淬灭基团,所述报告基团和淬灭基团选择自本领域常规选用的报告基团和淬灭基团,报告基团优选的为FAM,TET,JOE,HEX,VIC,更优选的为FAM,TET,其中最优选的为FAM;淬灭基团优选的为TAMRA、DABCYL,BHQ,更优选的为TAMRA,BHQ;最优选为TAMRA。
实施例2 川崎病的检测方法
(1)血清外泌体miRNA的提取
提取血清外泌体miRNA的操作包括如下步骤:
1)将250μl血清放置冰上自然溶解,再加入60μl的exosome提取试剂,用移液器轻轻吹打混匀后,静置冰上,30min;4℃ 1500g离心10min;用移液器尽量移除所有上清,沉淀部分即为exosome;
2)将上述提取到的exosome加入1mlTrizol,使充分裂解 (超声振荡混匀),静置5min;
3)加入200μl氯仿,充分振荡混匀约30s,使水相和有机相充分接触,室温静置约10min;
4)4℃ 14000g 离心15min,RNA在上层水相,移入另一新的Rnase-free EP 管中;
5)加入等体积的异丙醇,轻柔充分混匀,-20℃静置过夜,沉淀RNA;
6)4℃ 14000g 离心15min,弃上清,用移液器去除多余上清;
7)用75%乙醇洗涤两次,4℃ 13000g 离心5min,弃上清,超净工作台开盖风干;
8)10μl DEPC处理过的水溶解,得到血清外泌体miRNA。
(2)反转录
加入反转录引物(RT-miR197、RT-miR671、RT-miR1246和RT-miR4436)进行反转录
反转录体系和反应条件如下:
反转录体系:
miRNA标准品:1μl
反转录引物:各0.5μl
DEPC水:补至 5μl
70℃,5min后立即冰浴3-5min。
上述产物:5μl
5×反转录buffer:2.25μl
dNTP mix:1μl
MgCl2(25mM):1μl
反转录酶:0.5μl
RNA酶抑制剂:0.25μl
反转录条件:42℃,60min;80℃,10min;得反转录产物,即cDNA。
(3)扩增反应
加入引物mix (R-KD、F-miR197、F-miR671、F-miR1246和F-miR4436)进行PCR反应,反应体系和条件如下:
PCR 2X mix: 10μl
引物mix:各0.4μl
探针:0.4μl
CXR:0.2μl
cDNA: 2μl
ddH2O:补足至20μl
反应条件:95℃ 5min;95℃ 15S,54℃ 25s,72℃ 15s,40 cycles;对扩增产物进行分析,判断各miRNA的荧光定量反应Ct值,即可。
(4)结果分析
对上述扩增产物进行分析,判断标准为:
设定x = Ct(miR-1246)-Ct(miR-4436), y = Ct(miR-197)- Ct(miR-671);
①若y ≤ -4.9 且 y ≤ -x+5.6 时,则患有KD 疾病;
②若y > -4.9 且x ≤ 10.2 时,则为病毒性感染;
③若x > 10.2 且y > -x+5.6 时,则为正常。
实施例3 特异性评价实验
现有8个川崎病特异的miRNA:miR-4739、miR-16、miR-483、miR-21、miR-19、miR-22、miR-1260、miR-134在川崎病患者与健康人血清exosome中均差异显著,有可能影响本发明引物和探针检测的特异性。
分别以miR-4739、miR-16、miR-483、miR-21、miR-19、miR-22、miR-1260、miR-134 10nM标准品反转录后的cDNA为模版,用上述实施例1和2所述的引物、探针及方法进检测,验证8个川崎病特异的miRNA:miR-4739、miR-16、miR-483、miR-21、miR-19、miR-22、miR-1260、miR-134是否能被扩增。
实验结果如图1所示。图1中,曲线A~H分别为miR-4739、miR-16、miR-483、miR-21、miR-19、miR-22、miR-1260、miR-134 10nM标准品反转录后的cDNA Q-PCR反应结果;由扩增曲线可知miR-4739、miR-16、miR-483、miR-21、miR-19、miR-22、miR-1260、miR-134均为阴性。说明本发明引物、探针及检测方法具有很好的特异性。
实施例4 线性范围评价实验
取用miRNA标准品(hsa-miR-197、hsa-miR-671、hsa-miR1246和hsa-miR4436),1/10浓度梯度稀释,以10nM,1nM,100pM,10pM,100fM为模版,用反转录引物(RT-miR197、RT-miR671、RT-miR1246和RT-miR4436)进行反转录,用扩增引物(R-KD、F-miR197、F-miR671、F-miR1246和F-miR4436)进行扩增反应(具体方法同实施例2)。
检测结果如图2~5所示,从扩增曲线和CT值可以看到标准品相关系数R2分别为:0.991、0.988、0.986、0.993都满足标准品相关系数R2≥0.980的要求。说明本发明引物、探针及检测方法在模版浓度为100fM~10nM内都有效地进行检测。
实施例5 准确度评价实验
分别取标准品hsa-miR-197、hsa-miR-671、hsa-miR1246和hsa-miR4436,其浓度分别为100pM、1nM、100pM、100pM,反转录后作为模版,每组3个重复,检测结果如图6所示,为阳性。说明本发明引物、探针及检测方法具有很好的可重复性。
实施例6 不同序列对检测结果的影响
参照上述的方法,使用不同的引物,确定其对检测结果的影响。
miR-197引物优化
原miR-197-F:CGTTCACCACCTTCTCCA(失败);
本发明新miR-197-F:TTCACCACCTTCTCCACC;
原miR-197扩增灵敏度不高,最低限要到Ct 值32个循环后才出现扩增(图7)。改进后,本发明新miR-197-F最低限可提高至Ct值30个循环,且荧光峰度更高(图8)。
miR-671引物优化
原miRNA-671-F: AACTATGAGGAAGCCCTG(失败);
原miRNA-671-F2:CATTAGGAAGCCCTGGAG(失败);
本发明新miRNA-671-F:GAGAGGAAGCCCTGGAG;
原miRNA-671-RT:
GTCGTATCCAGTGCTGGGTCCGAGTGATTCGCACTGGATACGACCTCCAG(失败);
本发明新miRNA-671-RT:
GTCGTATCCAGTGCAGGGTCCGAGGTATTCGCACTGGATACGACTTTTTTTTTTTCTCCAGCC;
原设计的miR-671引物,阴性对照也出现扩增,特异性不高(图9和图10)。本发明新设计引物miRNA-671-F和miRNA-671-RT可实现特异性扩增,且最低限Ct值30个循环内即可实现扩增(图11)。
miR-4436引物优化
原miRNA-4436-RT:
GTCGTATCCAGTGCTGGGTCCGAGTGATTCGCACTGGATACGACGGCAG(失败);
原miRNA-4436-F:AGCCCGTCCACTTCTGCC(失败);
本发明新miRNA-4436-RT:
GTCGTATCCAGTGCAGGGTCCGAGGTATTCGCACTGGATACGACGGCAGGGC;
本发明新miRNA-4436-F:TCCTGTCCACTTCTGCCT;
原设计miR-4436引物没有扩增曲线(图12),改进后,本发明新设计引物miRNA-4436-RT和miRNA-4436-F可实现特异性扩增(图13)。且最低限Ct值30个循环内即可实现扩增。
上述结果说明本发明设计的引物及探针具有更好的灵敏性。
实施例7 比对实验
常规荧光(Sybrgreen)PCR定量:实验操作及所使用的引物如CN104450901A所公开的,实验结果如图14~17所示,由结果可知,染料法能检测出样本中各个靶标,CT值也比较理想,但是在miRNA模板浓度较低情况下阳性样本和阴性样本CT值没有明显差异。由此说明,染料法较探针法检测特异性更低,更容易造成假阳性误判。
通过对比可知,本发明的方法所使用的探针引物,可以更好地区分阳性样本和阴性样本,更容易判断出检测结果,具有意料之外的效果。
SEQUENCE LISTING
<110> 广州赛哲生物科技股份有限公司
<120> 用于川崎病检测的引物组、探针及试剂盒
<130>
<160> 16
<170> PatentIn version 3.5
<210> 1
<211> 50
<212> DNA
<213> 人工序列
<400> 1
gtcgtatcca gtgcagggtc cgaggtattc gcactggata cgacgctggg 50
<210> 2
<211> 63
<212> DNA
<213> 人工序列
<400> 2
gtcgtatcca gtgcagggtc cgaggtattc gcactggata cgactttttt tttttctcca 60
gcc 63
<210> 3
<211> 50
<212> DNA
<213> 人工序列
<400> 3
gtcgtatcca gtgcagggtc cgaggtattc gcactggata cgaccctgct 50
<210> 4
<211> 52
<212> DNA
<213> 人工序列
<400> 4
gtcgtatcca gtgcagggtc cgaggtattc gcactggata cgacggcagg gc 52
<210> 5
<211> 17
<212> DNA
<213> 人工序列
<400> 5
tcgtatccag tgcaggg 17
<210> 6
<211> 18
<212> DNA
<213> 人工序列
<400> 6
ttcaccacct tctccacc 18
<210> 7
<211> 17
<212> DNA
<213> 人工序列
<400> 7
gagaggaagc cctggag 17
<210> 8
<211> 19
<212> DNA
<213> 人工序列
<400> 8
gccgaatgga tttttggag 19
<210> 9
<211> 18
<212> DNA
<213> 人工序列
<400> 9
tcctgtccac ttctgcct 18
<210> 10
<211> 20
<212> DNA
<213> 人工序列
<400> 10
ccgaggtatt cgcactggat 20
<210> 11
<211> 18
<212> DNA
<213> 人工序列
<400> 11
cgttcaccac cttctcca 18
<210> 12
<211> 18
<212> DNA
<213> 人工序列
<400> 12
aactatgagg aagccctg 18
<210> 13
<211> 18
<212> DNA
<213> 人工序列
<400> 13
cattaggaag ccctggag 18
<210> 14
<211> 50
<212> DNA
<213> 人工序列
<400> 14
gtcgtatcca gtgctgggtc cgagtgattc gcactggata cgacctccag 50
<210> 15
<211> 49
<212> DNA
<213> 人工序列
<400> 15
gtcgtatcca gtgctgggtc cgagtgattc gcactggata cgacggcag 49
<210> 16
<211> 18
<212> DNA
<213> 人工序列
<400> 16
agcccgtcca cttctgcc 18
- 还没有人留言评论。精彩留言会获得点赞!
- 一种快速区分prv中国型、欧美型及疫苗株的双色荧光检测方法、引物及探针的制作方法
- 实时荧光pcr技术定量检测myd88基因l265p突变的方法、引物和探针的制作方法
- 用于定性检测白血病融合基因的引物、探针、试剂盒及方法
- 在体外检测或/及定量乙型肝炎病毒的方法及其所使用的引物、探针的制作方法
- 用于检测多种呼吸道病毒的pcr引物组、探针组及试剂盒的制作方法
- 一种检测人类met基因14外显子剪接突变的引物、探针及试剂盒的制作方法
- 使用重叠引物和熔解探针检测单核苷酸多态性的制作方法
- 用于检测多种呼吸道病毒的pcr引物组、探针组及试剂盒的制作方法
- 一种检测人类met基因14外显子剪接突变的引物、探针及试剂盒的制作方法
- 使用重叠引物和熔解探针检测单核苷酸多态性的制作方法
- 一种木瑚菌属食用菌鉴别用分子标记及引物和探针的制造方法与工艺
- 一组用于驴源性的实时荧光PCR检测的特异性引物和探针的制造方法与工艺
- 一组用于鸡源性实时荧光PCR检测的特异性引物和探针的制造方法与工艺
- 一种快速检测异鳞蛇鲭和棘鳞蛇鲭源性成分的方法与制造工艺
- 一种检测食管癌相关标志物的探针组合及其试剂盒的制造方法与工艺
- 一种检测皮肤癌相关标志物的探针组合及其试剂盒的制造方法与工艺
- 一种检测骨髓瘤相关标志物的探针组合及其试剂盒的制造方法与工艺
- 一种用于检测样品中牛凸隆病毒的荧光RT-PCR引物、探针和试剂盒及检测方法与制造工艺
- CYP2C19基因多态性检测引物、探针及试剂盒的制造方法与工艺
- 检测CYP2C9和VKORC1基因多态性的引物、探针和试剂盒的制造方法与工艺