鸭肠炎病毒和鸭肝炎病毒快速检测的探针引物组及其方法与流程
本发明属于生物检测技术领域,具体涉及一种鸭肠炎病毒和鸭肝炎病毒快速检测的探针引物组及其方法。
背景技术:
鸭肠炎病毒(duckenteritisvirus,dev)属于疱疹病毒科疱疹病毒属,病毒粒子呈球形,直径为120~180nm,有囊膜,病毒核酸型为dna。dev可引起鸭、鹅等水禽的一种急性败血性传染病,发病率和死亡率都甚高,是危害养鸭业的最为严重的传染病之一。鸭病毒性肝炎(duckviralhepatitis,dhv)是由鸭肝炎病毒引起雏鸭的一种高度致死性传染病。该病主要感染4周龄以内的雏鸭。引起鸭肝炎的病原主要有3个血清型,ⅰ型、ⅱ型、ⅲ型,这三个血清型相互独立,无交叉免疫性。
荧光定量pcr技术是通过荧光染料或荧光标记的特异性探针,对pcr产物进行标记跟踪,实时监控反应过程。随着pcr反应的进行,反应产物不断累积,荧光信号强度也等比例增加。每经过一个循环,收集一次荧光强度信号,这样就可以通过荧光强度变化监测产物量的变化,结合相应的软件分析,可以得到荧光扩增曲线,计算待测样品初始模板的量。当在荧光定量pcr检测系统中引入内参基因同时与目的基因检测,计算出一个待测样本中目标核酸序列与校正样本中同一序列表达的相对变化。研发一种能够同时检测鸭肠炎病毒和鸭肝炎病毒且简单的方法具有重要意义。
技术实现要素:
本发明提供了一种鸭肠炎病毒和鸭肝炎病毒快速检测的探针引物组。
本发明还提供了一种利用上述探针引物组进行鸭肠炎病毒和鸭肝炎病毒快速检测的方法。
本发明为了实现上述目的所采用的技术方案为:
本发明提供了一种鸭肠炎病毒和鸭肝炎病毒快速检测的探针引物组,所述探针引物组包括检测鸭肠炎病毒的特异性引物及探针、检测
所述检测鸭肠炎病毒的特异性引物及探针序列为:
dev-pf,如seqidno:1所示,具体序列为:5,-acggtttgttctatcgctaa-3,;
dev-pr,如seqidno:2所示,具体序列为:5,-taggttgtggttgaattggt-3,;
dev-probe,如seqidno:3所示,具体序列为:5,-fam-catggtaagcgtattgttca-mgb-3,;
所述检测
dhv-pf,如seqidno:4所示,具体序列为:5,-tgctgtcctttctatcaatg-3,;
dhv-pr,如seqidno:5所示,具体序列为:5,-ttgtcagatgctttcttagc-3,;
dhv-probe,如seqidno:6所示,具体序列为:5,-fam-ccagcgacttggagtgaaga-mgb-3,。
本发明还提供了一种利用上述鸭肠炎病毒和鸭肝炎病毒快速检测探针引物组进行检测的方法,其特征在于,包括以下步骤:
(1)设计引物及探针;
(2)分别提取待测样品rna和dna,将rna进行rt反应得cdna;
(3)以cdna和dna为模板进行实时定量荧光pcr反应。
进一步的,所述rt反应体系为:10mmdntp1μl、5×rt缓冲液4.0μl、10μmoligodt1μl、rnaseinhibitor(40u/μl)0.5μl、rna模板100pg~1μg、rtase(200u/μl)1μl。
进一步的,所述rt反应的过程为:42℃25min,95℃2min,得到的cdna置于-20℃保存。
本发明所使用的实时定量荧光pcr反应:当使用dev引物时,反应体系包括dhvcdna和devdna各自1μl、2×pcrmix(qiagen)8μl、primer(dev-pf50pm/μl)0.2μl、primer(dev-pr50pm/μl)0.2μl、dev-probe(50pm/μl)0.1ul、h2o5.5μl,总体系16μl;
当使用dhv引物时,反应体系包括dhvcdna和devdna各自1μl、2×pcrmix(qiagen)8μl、primer(dhv-pf50pm/μl)0.2μl、primer(dhv-pr50pm/μl)0.2μl、dhv-probe(50pm/μl)0.1ul、h2o5.5μl,总体系16μl。
进一步的,所述实时定量荧光pcr反应的过程为:95℃2min,随后94℃10s、59℃10s、72℃40s共进行40cycles。
本方法旨在建立一种快速、特异、准确的鉴别诊断鸭肠炎病毒dev和
本发明的有益效果为:
(1)本发明通过提供的检测方法快速准确,特异性强,能够大大减少检测时间,节省人力成本;
(2)本发明根据病毒的保守序列设计的特异性引物及探针,能够扩增出高度特异性片段,重复稳定性好;
(3)本发明建立的方法,可以及时对临床样品进行诊断,从而减少疫病带来的损失。
附图说明
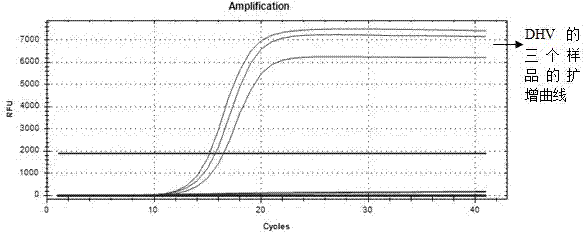
图1为实施例1中采用反应一体系时的扩增曲线图。
图2为实施例1中采用反应二体系时的扩增曲线。
图3为实施例1中采用反应一体系,反应1结束后,dev的扩增结果电泳图。
图4为实施例1中采用反应二体系,反应2结束后,dhv的扩增结果电泳图。
具体实施方式
为了更好的理解本发明,下面结合具体实施例来进一步说明。
本发明所使用的试剂及提取试剂盒等均为市售。
实施例1
1.1探针和引物的设计合成:
从genbank下载国内主要dev、ⅰ型dhv流行毒株序列,根据保守区域序列,利用primerexpress2.0软件设计实时荧光定量pcr引物以及taqman探针,荧光标记物为fam和mgb;所有引物由华大基因合成,pageplus级别纯化;具体设计的扩增所用引物及探针序列如表1所示。
表1
1.2模板的制备
(1)dhv模板的制备
选取dhv代表性毒株qd16,将待检的病毒接种12日龄的鸭胚尿囊腔,收集接种后48-72h内死亡鸭胚的尿囊液和胚体,破碎后冻融三次,作为病毒液。提取时,取上述病毒液,12000rpm离心2min,取0.2ml上清提取病毒rna。rna提取按照博日生物simplernakit操作进行,最后用30μldepc水来溶解rna。
:rt反应体系(20μl):10mmdntp1μl、5×rt缓冲液4.0μl、10μmoligodt1μl、rnaseinhibitor(40u/μl)0.5μl、rna模板100pg~1μg、rtase(200u/μl)1μl置于pcr扩增仪上进行反应,反应过程为42℃25min,95℃2min,得到的cdna置于-20℃保存。
(2)dev模板的制备
选取dev分离毒株ly16进行检测。病毒dna的提取按照takaradnaiso试剂操作进行,最后用30μl超纯水来溶解dna;将待检的病毒接种10日龄的鸭胚的尿囊腔,收集接种后48-72h内鸭胚的尿囊液和胚体,冻融三次,混合后作为病毒液;取上述病毒液,12000rpm离心2min,取0.2ml上清提取病毒dna;dna置于-20℃保存
1.3real-timepcr检测
针对2种病原同时进行2组反应;在扩增反应体系中,对探针浓度、引物浓度和退火温度进行优化,建立了最佳的荧光定量pcr反应体系和扩增程序。最终确定如下的反应体系和反应条件。
反应一:使用dev引物的反应体系包括dhvcdna和devdna各自1μl、2×pcrmix(qiagen)8μl、primer(dev-pf50pm/μl)0.2μl、primer(dev-pr50pm/μl)0.2μl、dev-probe(50pm/μl)0.1ul、h2o5.5μl,总体系16μl;
反应过程为:95℃2min,随后94℃10s、59℃10s、72℃40s共进行40cycles;
当使用该反应体系时,扩增曲线图及扩增结果电泳图如图1和图3所示,从图1中可以看出,只有dev得到明显的扩增曲线,dhv未得到扩增。
反应二、使用dhv引物的反应体系包括dhvcdna和devdna各自1μl、2×pcrmix(qiagen)8μl、primer(dhv-pf50pm/μl)0.2μl、primer(dhv-pr50pm/μl)0.2μl、dhv-probe(50pm/μl)0.1ul、h2o5.5μl,总体系16μl;反应过程同上。
当使用该反应体系时,扩增曲线图及扩增结果电泳图如图2和图4所示,从图2中可以看出,只有dhv得到明显的扩增曲线,dev未得到扩增
本发明中实时荧光定量pcr反应体系由16ul的反应体系组成,反应在bio-radcfx96pcr仪上孔板中进行,每个样品做三次平行实验,均得到相同的扩增结果。
1.4实时荧光定量pcr检测的特异性试验
利用本发明所提供的引物及探针组进行检测,通过对病毒样品进行检测,具体检测的病毒种类如表2所示。
表2
通过实验发现,利用本发明所提供的引物及探针,仅有ⅰ型鸭肝炎病毒和鸭肠炎病毒具有扩增曲线,而其他病毒检测结果均无扩增曲线。
对比例1
采用中国专利cn106755572a提供的引物及探针,杂交稳定性低于本发明所提供的方法,且本发明重复性有了很大的提高,并且本发明提高配对与非配对模板间的tm值差异,实验结果更精确,分辨率更高。
利用对比例1中提供的引物及探针结合本发明的方法,扩增效果差。
临床试验:
发明人选取了2015.09-2017.05年间44份疑似dhv和dev组织样品进行上述方法的检测,检测出了11份dhv阳性样品、9份dev阳性样品,另外检测出1份dhv和dev混合感染的情况。以上检测结果与后期序列分析的结果完全一致,准确率高达100%;证明此方法的准确性高、特异性强。所以本研究建立的方法准确快速,可以及时对临床样品进行诊断,从而减少疫病带来的损失。
核苷酸序列表
<110>山东省农业科学院家禽研究所
<120>鸭肠炎病毒和鸭肝炎病毒快速检测的探针引物组及其方法
<160>6
<210>1
<211>20
<212>dna
<213>人工合成
<220>
<223>
<400>1
acggtttgttctatcgctaa20
<210>2
<211>20
<212>dna
<213>人工合成
<220>
<223>
<400>2
taggttgtggttgaattggt20
<210>3
<211>20
<212>dna
<213>人工合成
<220>
<223>
<400>3
catggtaagcgtattgttca20
<210>4
<211>20
<212>dna
<213>人工合成
<220>
<223>
<400>4
tgctgtcctttctatcaatg20
<210>5
<211>20
<212>dna
<213>人工合成
<220>
<223>
<400>5
ttgtcagatgctttcttagc20
<210>6
<211>20
<212>dna
<213>人工合成
<220>
<223>
<400>6
ccagcgacttggagtgaaga20
核苷酸序列表
<110>山东省农业科学院家禽研究所
<120>鸭肠炎病毒和鸭肝炎病毒快速检测的探针引物组及其方法
<160>6
<210>1
<211>20
<212>dna
<213>人工合成
<220>
<223>
<400>1
acggtttgttctatcgctaa20
<210>2
<211>20
<212>dna
<213>人工合成
<220>
<223>
<400>2
taggttgtggttgaattggt20
<210>3
<211>20
<212>dna
<213>人工合成
<220>
<223>
<400>3
catggtaagcgtattgttca20
<210>4
<211>20
<212>dna
<213>人工合成
<220>
<223>
<400>4
tgctgtcctttctatcaatg20
<210>5
<211>20
<212>dna
<213>人工合成
<220>
<223>
<400>5
ttgtcagatgctttcttagc20
<210>6
<211>20
<212>dna
<213>人工合成
<220>
<223>
<400>6
ccagcgacttggagtgaaga20
- 还没有人留言评论。精彩留言会获得点赞!
- 一种快速区分prv中国型、欧美型及疫苗株的双色荧光检测方法、引物及探针的制作方法
- 实时荧光pcr技术定量检测myd88基因l265p突变的方法、引物和探针的制作方法
- 用于定性检测白血病融合基因的引物、探针、试剂盒及方法
- 在体外检测或/及定量乙型肝炎病毒的方法及其所使用的引物、探针的制作方法
- 用于检测多种呼吸道病毒的pcr引物组、探针组及试剂盒的制作方法
- 一种检测人类met基因14外显子剪接突变的引物、探针及试剂盒的制作方法
- 使用重叠引物和熔解探针检测单核苷酸多态性的制作方法
- 用于检测多种呼吸道病毒的pcr引物组、探针组及试剂盒的制作方法
- 一种检测人类met基因14外显子剪接突变的引物、探针及试剂盒的制作方法
- 使用重叠引物和熔解探针检测单核苷酸多态性的制作方法
- 一种木瑚菌属食用菌鉴别用分子标记及引物和探针的制造方法与工艺
- 一组用于驴源性的实时荧光PCR检测的特异性引物和探针的制造方法与工艺
- 一组用于鸡源性实时荧光PCR检测的特异性引物和探针的制造方法与工艺
- 一种快速检测异鳞蛇鲭和棘鳞蛇鲭源性成分的方法与制造工艺
- 一种检测食管癌相关标志物的探针组合及其试剂盒的制造方法与工艺
- 一种检测皮肤癌相关标志物的探针组合及其试剂盒的制造方法与工艺
- 一种检测骨髓瘤相关标志物的探针组合及其试剂盒的制造方法与工艺
- 一种用于检测样品中牛凸隆病毒的荧光RT-PCR引物、探针和试剂盒及检测方法与制造工艺
- CYP2C19基因多态性检测引物、探针及试剂盒的制造方法与工艺
- 检测CYP2C9和VKORC1基因多态性的引物、探针和试剂盒的制造方法与工艺