用于木薯源性成分检测的引物探针及方法和试剂盒与流程
本发明属于生物技术领域,具体而言,本发明涉及用于木薯源性成分检测的寡核苷酸引物和探针,用于测定木薯源性成分的实时荧光PCR检测方法,用于快速检测木薯源性成分的实时荧光PCR检测试剂盒以及木薯源性成分的特异性寡核苷酸引物和探针在检测木薯源性成分中的应用。
背景技术:
木薯是一种适应各种贫瘠土地、易种植、投资少的热带作物,其淀粉含量高,素有“淀粉之王”的美称。木薯淀粉是生产木薯的第二大用途。我国主要食用的薯类淀粉包括红薯淀粉、马铃薯淀粉、木薯淀粉等,其中,红薯淀粉的价格最高,木薯淀粉的价格最低。由于不同种类淀粉颗粒的感官性状、物化指标等相近,消费者很难辨识,因此,不法商贩常用低价的木薯淀粉冒充红薯淀粉出售,牟取非法利润,给消费者的利益造成损害。
近年来,国内外学者采用红外光谱、扫描电镜、肽指纹图谱等技术手段开展了淀粉种类鉴别方面的研究。如,采用红外光谱技术可将藕粉中掺杂的马铃薯、红薯、木薯以及玉米淀粉等有效鉴别;运用扫描电镜与稳定碳同位素比法分析马铃薯淀粉与玉米淀粉在颗粒超微形貌上的差异性,可准确鉴别马铃薯淀粉中掺假的玉米淀粉。通过分析不同淀粉间肽指纹图谱区的差异,可区分红薯淀粉、木薯淀粉及马铃薯淀粉。
但是,上述方法容易受到品种、产地、收获季节等因素的影响,另外,也容易受取样均匀性和代表性等问题的限制,而且依赖的仪器设备价格比较昂贵,很难在普通实验室推广。实时荧光PCR技术通过分析物种DNA水平上的差异来鉴定物种真实属性,结果准确、可靠,且不受环境因素等影响,仪器普及率高,目前在食品真实属性鉴别方面有着越来越广泛的应用。
目前,国内外尚未见报道可快速、简便、特异且灵敏地检测淀粉、粉条、粉丝、糕点等样品中木薯源性成分的方法和试剂盒。
因此,本领域需要一种快速、特异性好、灵敏度高的木薯源性成分的检测方法,进行淀粉、粉条、粉丝、糕点等样品中木薯源性成分的检测。。
技术实现要素:
本发明的一个目的在于,提供准确检测木薯源性成分的特异性寡核苷酸引物和探针。
本发明的另一个目的在于,提供准确测定木薯源性成分的实时荧光PCR检测方法。
本发明的另一个目的在于,提供准确测定木薯源性成分的实时荧光PCR检测试剂盒。
本发明的还一个目的在于,提供木薯源性成分的特异性寡核苷酸引物和探针在准确检测样品中木薯源性成分中的应用。
针对上述发明目的,本发明提供以下技术方案:
本发明的发明人根据木薯g3pdh基因(glyceraldehyde-3-phosphate dehydrogenase,甘油醛-3-磷酸脱氢酶基因)设计了能特异性鉴别木薯源性成分的寡核苷酸引物对和探针,能从样品DNA中高效特异扩增出一段较短的木薯特异性基因片段。根据本发明的一个实施方案,本发明提供用于实时荧光PCR方法检测木薯源性成分的特异性寡核苷酸引物对和荧光标记探针,所述引物对和探针是根据g3pdh基因序列在不同物种中具有差异性的特点而设计的。所述引物对由上游引物和下游引物组成,所述上游引物为Cassava-F:TGGTTCTTGATCTGCGTGAG(SEQ ID No.1),所述下游引物为Cassava-R:TGGGAGAACCTTTCCAACAG(SEQ ID No.2);所述探针为Cassava-P:TGCTGTTGCAACTGCTTAGG(SEQ ID No.3),在探针的3’端连接有一个荧光淬灭基团TAMAR,5’端连接有一个荧光报告基团FAM。在一个实施方案中,本发明提供的木薯特异性检测组合物,所述组合物包含特异性寡核苷酸引物对和探针。在一个优选的实施方案中,本发明提供了用于实时荧光PCR方法定性检测木薯源性成分的组合物,所述组合物包含木薯特异性寡核苷酸引物对和探针,其中所述木薯特异性引物对由上游引物和下游引物组成,所述上游引物的碱基序列为SEQ ID No.1,所述下游引物的碱基序列为SEQ ID No.2;所述探针的碱基序列为SEQ ID No.3,在探针的3’端连接有一个荧光淬灭基团TAMAR,5’端连接有一个荧光报告基团FAM。
根据本发明的另一个实施方案,本发明提供木薯源性成分的实时荧光PCR检测方法,所述方法包括使用针对木薯源性成分的特异性寡核苷酸引物对和探针,所述引物对和探针是根据g3pdh基因序列在不同物种中具有差异性的特点而设计的。在一个实施方案中,本发明的木薯源性成分的实时荧光PCR定性检测方法中,所使用的木薯特异性寡核苷酸引物对由上游引物和下游引物组成,所述上游引物的碱基序列为SEQ ID No.1,所述下游引物的碱基序列为SEQ ID No.2;所述探针的碱基序列为SEQ ID No.3,在探针的3’端连接有一个荧光淬灭基团TAMAR,5’端连接有一个荧光报告基团FAM。在一个实施方案中,所述的PCR扩增条件为95℃,10 min;95℃15 s,60℃1 min,共40个循环。
根据本发明的另一个实施方案,本发明提供用于准确检测样品中木薯源性成分的试剂盒,所述试剂盒包括本发明用于实时荧光PCR方法检测木薯源性成分的特异性寡核苷酸引物对以及探针和使用说明书。在本发明的试剂盒优选实施方案中,本发明的木薯源性成分定性检测特异性寡核苷酸引物对是根据g3pdh基因序列在不同物种中具有差异性的特点而设计的。在一个实施方案中,所述试剂盒的木薯特异性寡核苷酸引物对由上游引物和下游引物组成,所述上游引物的碱基序列为SEQ ID No.1,所述下游引物的碱基序列为SEQ ID No.2;所述试剂盒中探针的碱基序列为SEQ ID No.3,在探针的3’端连接有一个荧光淬灭基团TAMAR,5’端连接有一个荧光报告基团FAM。根据本发明的另一个实施方案,本发明提供用于准确定性检测木薯源性成分的试剂盒,所述试剂盒包括本发明的用于实时荧光PCR方法鉴别木薯源性成分的特异性寡核苷酸引物对和探针以及使用说明书。在试剂盒的一个优选实施方案中,所述试剂盒中包含木薯特异性寡核苷酸引物对SEQ ID No.1、SEQ ID No.2和木薯特异性探针SEQ ID No.3,在木薯g3pdh基因探针的3’端连接有一个荧光淬灭基团TAMAR,5’端连接有一个荧光报告基团FAM。在优选的实施方案中,所述试剂盒的使用说明书中包括对用于快速检测木薯源性成分的实时荧光PCR扩增条件的描述。在一个优选的实施方案中,所述试剂盒的说明书中给出的PCR扩增条件是95℃,10 min;95℃15 s,60℃1 min,共40个循环。在一个具体的实施方案中,本发明用于木薯源性成分定性检测的试剂盒还包括对照品。优选地,对照品包括阴性对照品和阳性对照品。在一个实施方案中,阴性对照为红薯DNA。
根据本发明的再一个实施方案,本发明提供本发明的用于实时荧光PCR方法检测木薯源性成分的特异性寡核苷酸引物和探针在检测食品中木薯源性成分中的应用。在一个优选的实施方案中,本发明提供食用淀粉中木薯源性成分的特异性寡核苷酸引物对SEQ ID No.1、SEQ ID No.2 和特异性探针SEQ ID No.3,在木薯g3pdh基因探针的3’端连接有一个荧光淬灭基团TAMAR,5’端连接有一个荧光报告基团FAM。在另一个实施方案中,本发明还提供本发明的试剂盒在定性检测木薯源性成分的应用。优选地,在本发明的上述应用中,所述试剂盒包括本发明的木薯特异性寡核苷酸引物对和探针。更优选的,在本发明的上述应用中,所述试剂盒包括本发明的木薯特异性寡核苷酸引物对和探针在检测样品中木薯源性成分中的应用。
本发明以木薯DNA为检测基础,根据g3pdh基因序列在不同物种中具有差异性的特点,比对分析了木薯g3pdh基因序列。根据这些序列设计引物,利用实时荧光PCR法定性检测样品中的木薯源性成分。
实时荧光定量PCR即在常规PCR方法的基础上,加入荧光标记的探针或者荧光染料,随着PCR产物的积累,探针或染料发出的荧光信号增强,而荧光监测系统可接收到荧光信号,即每产生一条 DNA 链,就有一个荧光分子形成,实现了荧光信号的累积与 PCR产物形成完全同步。因此可以实时监控整个PCR反应过程,并最终检测出待测样品的初始拷贝数,从而可检测待测食用淀粉中所含木薯源性成分。
本发明的实时荧光PCR检测方法采用完全闭管检测,无需PCR后处理,避免了交叉污染和假阳性。本发明的方法巧妙地运用了PCR技术的DNA高效扩增、核酸杂交的特异性和荧光检测技术的快速和敏感性,具有操作简单、省时省力、结果可靠和准确灵敏等优点。本发明的按照引物序列制成的试剂盒,用于此类产品的定性检测,具有灵敏度高、特异性强、结果稳定可靠且避免交叉污染造成假阳性的优点。使用本发明的PCR检测方法和PCR检测试剂盒,可用于定性检测,其简单、快速、特异且灵敏的特点适合用于国内外市场上淀粉、粉条、粉丝、糕点等样品中木薯源性成分的检测等。
附图说明
图1显示的是实时荧光PCR特异性检测木薯的结果,其中使用特异性寡核苷酸引物对SEQ ID No.1和SEQ ID No.2及SEQ ID No.3检测,其中基线上方为木薯样品的扩增曲线,基线下方为红薯、芋头、山药、马铃薯、莲藕、玉米、小麦、大麦、黑麦、大米、荞麦、高粱、薏米、小米、绿豆、赤小豆、豇豆、扁豆、菜豆、蚕豆、黄豆及空白对照(无菌双蒸水)。
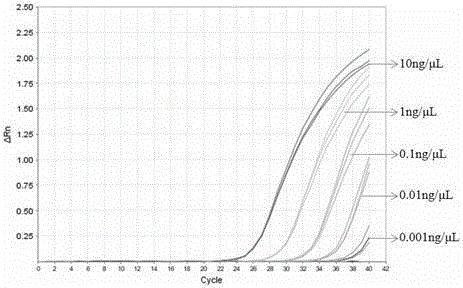
图2是对实时荧光PCR特异性检测木薯成分的绝对灵敏度进行评价,将木薯DNA溶液10倍梯度稀释,依次为10 ng/μL、1ng/μL、0.1ng/μL、0.01ng/μL、0.001ng/μL、0.0001ng/μL以及空白对照(无菌双蒸水)。
图3是对实时荧光PCR特异性检测木薯成分的相对灵敏度进行评价,将木薯淀粉和红薯淀粉混合,使木薯淀粉和红薯淀粉的质量比分别为100%、50%、10%、5%、1%、0.1%、0.01%。
图4是利用本发明建立的实时荧光PCR方法对市售样品进行检测的结果。基线以上为阳性对照(木薯DNA)、木薯淀粉1#、木薯淀粉2#以及红薯淀粉3#,基线位置为其它淀粉样品及空白对照(无菌双蒸水)。
具体实施方式
通过实施例的方式对本发明作进一步的说明,但是本发明并不仅仅局限于以下实施例。
实施例1
本实施例为通过如下试验对木薯的引物对和探针进行特异性和灵敏度评价。
通过检测g3pdh基因序列,可以确定木薯引物探针组合的特异性和检测灵敏度。反应体系为:Fast Start Universal PCR Master Mix 12.5 μL;探针(10 μM) 0.5μL;上、下游引物(10 μM)各0.5μL;模板DNA 5μL;加ddH2O至总体积为25μL。反应程序为95℃ 10 min;95℃ 15 s;60℃ 1 min,40个循环。
所使用的检测木薯的引物及探针序列为:
引物序列为SEQ ID No.1和SEQ ID No.2,探针序列为SEQ ID No.3,3’端连接有一个荧光淬灭基团TAMAR,5’端连接有一个荧光报告基团FAM。
所使用的检测主要仪器:
微量移液器(10 µL 、100 µL 、1000 µL,Eppendorf)、荧光定量PCR仪(ABI 7500,Applied Biosystems)、高速台式离心机(Pico17 Thermo,)等。
检测主要试剂:
氯仿、异丙醇分别购于北京六合通公司;CTAB裂解液(20 g/L CTAB,1.4 mol/L NaCl,0.1 mol/L Tris、0.02 mol/L Na2-EDTA)、CTAB沉淀液(5 g/L CTAB,0.04 mol/L NaCl)、1.2 mol/L NaCl均为本实验自行配制;Fast Start Universal Probe Master Mix (Rox)购于罗氏公司;引物及探针由上海英骏生物科技有限公司合成等。
检测主要步骤:
1 DNA提取
检测样本:(1) 木薯、红薯、芋头、山药、马铃薯、莲藕、玉米、小麦、燕麦、大麦、黑麦、大米、荞麦、高粱、薏米、小米、绿豆、赤小豆、豇豆、豌豆、扁豆、菜豆、蚕豆、黄豆、枣、杏、百合、橄榄等28种样品用于特异性分析;(2)将提取的木薯DNA溶液用无菌水分别稀释为10 ng/μL、1ng/μL、0.1ng/μL、0.01ng/μL、0.001ng/μL、0.0001ng/μL的浓度,用于分析引物探针组合的绝对灵敏度;(3)将木薯淀粉和红薯淀粉混合,使木薯淀粉和红薯淀粉的质量比分别为50%、10%、5%、1%、0.1%、0.01%,以确定木薯特异性引物探针组合的相对灵敏度。
称取0.1 g样品粉末至一洁净2.0 mL离心管中,加入1.5 mL CTAB裂解液,65℃ 1 h,间期上下颠倒混匀几次;8000 rpm 15 min,取1 mL上清液至1只洁净2.0 mL离心管中,加入700 μL氯仿,剧烈混匀30 s,14500 rpm 10 min,分别取650μL上清液至洁净2.0 mL离心管中,加入1300 μL CTAB沉淀液,剧烈混匀30 s,室温静置1 h;14500 rpm 10 min,弃上清液,加入350μL 1.2 M NaCl,剧烈振荡30 s,再加入350μL氯仿,剧烈混匀30 s,14500 rpm 10 min;分别取上清液320μL,加入0.8倍体积异丙醇,混匀后,-20℃ 1 h,14500 rpm 20 min,弃上清液,加入500μL 70%乙醇,混匀后,14500 rpm 20min,弃上清液,晾至风干,加入100μL ddH2O溶解,4℃储存备用。
2 实时荧光PCR检测所用引物和探针
引物序列为SEQ ID No.1和SEQ ID No.2;
探针序列为SEQ ID No.3,3’端连接有一个荧光淬灭基团TAMAR,5’端连接有一个荧光报告基团FAM。
3 实时荧光PCR反应体系:
Fast Start Universal PCR Master Mix 12.5 μL
探针(10 μM) 0.5μL
上游引物(10 μM) 0.5μL
下游引物(10 μM) 0.5μL
模板DNA 5μL
加ddH2O至总体积为25μL
注:每次PCR检测均设立相应的空白对照(用配制反应体系的超纯水代替DNA模板,检测试剂是否受到污染);
4 实时荧光PCR反应参数:
95℃ 10 min
95℃ 15 s
60℃ 1 min
40个循环。
注:不同仪器应将PCR各试剂及反应参数做适当调整。
如图1所示,利用实时荧光PCR特异性检测木薯的g3pdh基因序列时,除木薯样品出现典型的S型扩增曲线外,其它样品:红薯、芋头、山药、马铃薯、莲藕、玉米、小麦、燕麦、大麦、黑麦、大米、荞麦、高粱、薏米、小米、绿豆、赤小豆、豇豆、豌豆、扁豆、菜豆、蚕豆、黄豆、枣、杏、百合、橄榄等28种样品及空白对照(ddH2O)均未出现扩增曲线,充分说明本实验设计的引物探针对木薯样品特异。
为确定木薯特异性引物探针组合的绝对检测限,将提取的木薯DNA溶液用无菌水分别稀释为10 ng/μL、1ng/μL、0.1ng/μL、0.01ng/μL、0.001ng/μL、0.0001ng/μL的浓度,分别按上述条件进行实时荧光PCR扩增,结果如图2所示。木薯DNA浓度为10 ng/μL、1 ng/μL、0.1 ng/μL、0.01 ng/μL、0.001 ng/μL时有特异性扩增曲线,而浓度降至0.001 ng/μL以下时,无特异性扩增曲线出现。实验结果表明建立的实时荧光PCR检测方法能够检出木薯成分的含量为0.001 ng/μL。
将木薯淀粉和红薯淀粉混合,使木薯淀粉和红薯淀粉的质量比分别为50%、10%、5%、1%、0.1%、0.01%,分别按上述条件进行实时荧光PCR扩增,以确定木薯特异性引物探针组合的相对灵敏度(图3)。实验结果说明该方法检测木薯成分的相对灵敏度为0.1%。
实施例2
本实施例提供准确检测样品中木薯源性成分的试剂盒。所述试剂盒包括本发明用于实时荧光PCR方法鉴别木薯源性成分的特异性寡核苷酸引物对和探针以及使用说明书。所述试剂盒包括引物对SEQ ID No.1、SEQ ID No.2 和探针SEQ ID No.3,探针的3’端连接有一个荧光淬灭基团TAMAR,5’端连接有一个荧光报告基团FAM,所述使用说明书中给出了PCR扩增条件,该条件为95℃ 10 min;95℃ 15 s;60℃ 1 min,40个循环。对于不同仪器,反应参数做适当调整。
为确保建立的方法具有可行性,选取7份市售样品,包括木薯淀粉2份(1#和2#)、红薯淀粉3份(1#、2#、3#)、藕粉2份(1#和2#)等,与实施例1所述的方法相同,进行实时荧光PCR检测,其中以无菌双蒸水作为试剂盒空白对照品,以木薯DNA作为试剂盒阳性对照品。
如图4所示,利用实时荧光PCR检测木薯g3pdh基因序列时,木薯DNA以及2份木薯淀粉样品以及1份红薯淀粉(3#)在基线以上具有典型的荧光扩增曲线,其它样品及空白对照扩展曲线均在基线位置,表明该方法能有效检测出木薯成分。
虽然已经对本发明的具体实施方案进行了描述,但是本领域技术人员应认识到,在不偏离本发明的范围或精神的前提下可以对本发明进行多种改变与修饰。因而,本发明意欲涵盖落在附属权利要求书及其同等物范围内的所有这些改变与修饰。
- 还没有人留言评论。精彩留言会获得点赞!
- 一种快速区分prv中国型、欧美型及疫苗株的双色荧光检测方法、引物及探针的制作方法
- 实时荧光pcr技术定量检测myd88基因l265p突变的方法、引物和探针的制作方法
- 用于定性检测白血病融合基因的引物、探针、试剂盒及方法
- 在体外检测或/及定量乙型肝炎病毒的方法及其所使用的引物、探针的制作方法
- 用于检测多种呼吸道病毒的pcr引物组、探针组及试剂盒的制作方法
- 一种检测人类met基因14外显子剪接突变的引物、探针及试剂盒的制作方法
- 使用重叠引物和熔解探针检测单核苷酸多态性的制作方法
- 用于检测多种呼吸道病毒的pcr引物组、探针组及试剂盒的制作方法
- 一种检测人类met基因14外显子剪接突变的引物、探针及试剂盒的制作方法
- 使用重叠引物和熔解探针检测单核苷酸多态性的制作方法
- 一种木瑚菌属食用菌鉴别用分子标记及引物和探针的制造方法与工艺
- 一组用于驴源性的实时荧光PCR检测的特异性引物和探针的制造方法与工艺
- 一组用于鸡源性实时荧光PCR检测的特异性引物和探针的制造方法与工艺
- 一种快速检测异鳞蛇鲭和棘鳞蛇鲭源性成分的方法与制造工艺
- 一种检测食管癌相关标志物的探针组合及其试剂盒的制造方法与工艺
- 一种检测皮肤癌相关标志物的探针组合及其试剂盒的制造方法与工艺
- 一种检测骨髓瘤相关标志物的探针组合及其试剂盒的制造方法与工艺
- 一种用于检测样品中牛凸隆病毒的荧光RT-PCR引物、探针和试剂盒及检测方法与制造工艺
- CYP2C19基因多态性检测引物、探针及试剂盒的制造方法与工艺
- 检测CYP2C9和VKORC1基因多态性的引物、探针和试剂盒的制造方法与工艺