猪圆环合成肽疫苗及其制备方法和应用与流程
本发明涉及本发明属于医药技术领域,具体而言,本发明涉及一种猪圆环合成肽疫苗以及其制备方法和应用。
背景技术:
猪圆环病毒病(porcinecircovirus-associateddisease,pcvad)是指由pcv2引起的一系列综合症候群或与pcv2感染有关的疾病。根据pcv抗原性和基因组成不同,将其分为两种基因型(血清型),与临床疾病相关的猪圆环病毒命名为猪圆环病毒2型(pcv2),无临床致病性的猪圆环病毒命名为猪圆环病毒1型(pcv1)。猪圆环病毒是迄今为止发现的一种最小的动物病毒,直径17nm,二十面体对称,无囊膜。病毒基因组由单股负链闭合环状dna组成,其中pcv1含有1759个核苷酸,pcv2含有1767或1768个核苷酸。
pcv2感染机体后侵害其单核细胞和巨噬细胞,导致猪的免疫抑制及机体抵抗力降低,干扰和破坏猪对其他疾病免疫抗体的产生和维持,造成多种疾病的并发或继发感染。猪在感染pcv2病毒后,可以通过胎盘垂直传播给新生仔猪,还可通过粪便等进行水平传播。pcv2病毒耐环境因素能力强,对各种消毒剂都有很强的抵抗性,即使在高温及酸性环境下仍能存活一段时间,猪场很难得到净化。该病毒会存在于机体的多个器官中,尤其是肺脏和淋巴结中,导致相应器官出现功能异常等症状。感染猪不仅会出现呼吸功能障碍,更会因为抑制机体免疫而导致抵抗力下降,提高其它疾病患病可能,包括断奶仔猪多系统衰竭综合征(pmws)、猪皮炎肾病综合征(pdns)、猪呼吸系统混合疾病(prdc)、猪繁殖障碍症、肉芽肿性肠炎、急性肺水肿(ape)、增生性坏死性肺炎(pnp)等病症。
猪圆环病毒病于1997年在加拿大西部首次被证实,相继北美、欧洲及亚洲多数国家均有本病流行的报道。该病的发病率可达50%,死亡率可能因猪场条件、继发感染情况而不同,一般在5%~7%。猪圆环病毒病中,以pmws对养猪业造成的危害最为严重,在欧洲,该病每年可造成养猪业约6亿欧元的损失。
大量的行业养殖现状和试验研究表明,控制pcv2感染的有效手段是对仔猪进行疫苗免疫。目前市售的pcv2商品化疫苗主要为进口的病毒载体疫苗和国产灭活疫苗。这两种疫苗在我国防控pcv2感染发挥了重要作用,但同时也存在灭活疫苗病毒难以培养、生产中批间质量较难统一、生产工艺需要进一步改进等困难,使得灭活苗制备产量不高,同时还存在散毒的危险。而杆状病毒载体疫苗虽然能保证疫苗的稳定性和一致性,容易将免疫动物与感染动物区分开来,但价格昂贵,许多猪场不能大量采购,所以对我国猪圆环病毒病的控制效果有限。由于pcv2疫苗在传统在制备方法或价格上仍然存在缺陷,因此开发高效低廉的新型疫苗逐渐受到学者们的关注。近年来,越来越多的学者将注意力转移至亚单位和多肽疫苗的研究,多肽抗原作为完整病毒蛋白的一部分,其不具备传染疾病的危险性,并且可以大量合成生产,因此已成为疫苗研究开发的重要内容之一。
技术实现要素:
本发明的目的在于提供一种用于制备猪圆环病毒合成肽疫苗的抗原多肽,多肽组合物,以及含有该多肽组合物的疫苗。
为实现上述目的,本实验室根据pcv2-cap基因抗原表位共设计了2条氨基酸组成的多肽序列,分别为seqno.1及seqno.2多肽序列,采用固相法合成,与isa50v佐剂混合制成油乳剂疫苗。通过动物安全性和效力性研究,证明在最小日龄仔猪单剂量、仔猪重复接种、仔猪一次超剂量、和怀孕母猪双倍剂量情况下对猪都是安全的。免疫仔猪后不同时间测定elisa抗体、中和抗体,并用elispot方法检测ifn-γ细胞因子,免疫35天后,elisa抗体和中和抗体达1:4160和1:25.6,ifn-γ细胞因子表达水平明显升高。
合成肽疫苗极大的提高了安全性和特异性,并且其制备工艺更简单、生产成本更低廉、疫苗质量更加可靠,利于规模化生产。作为一种新型圆环疫苗,其优点可以为企业和市场带来新的竞争力和经济增长点,市场空间巨大。
本发明采用了以下技术方案:
本发明提供一种用于制备猪圆环病毒合成肽疫苗的抗原多肽,为序列1或序列2所示的多肽。
本发明提供的用于制备猪圆环病毒合成肽疫苗的多肽组合物,为由序列1和序列2所述多肽组成的组合物。
本发明中所述的多肽及多肽片段可以是通过固相有机合成得到的肽物质。
具体的上述各个多肽的序列如下所示:
多肽1(序列表中序列1所示的多肽):
isiteigkvivrhiatiflεkvdhvgix1x2fensx3εkhx4rfytpkpvldstidyfqpnnkrnql
(x1=g/r,x2=t/i,x3=k/y,x4=s/r)
多肽2(序列表中序列2所示的多肽):
isiteigkvivrhiatiflεktpx1wavdmmrynix2dfx3ppgggx4εktqgdrgvgstavilddnfvtk
(x1=s/r,x2=a/t,x3=v/l,x4=s/r)
其中序列1所述的多肽片段,自按氨基端第19位氨基酸的羧基与第20位氨基酸的ε位氨基形成肽键连接;序列2所示的多肽片段,自氨基端第19位氨基酸的羧基与第20位氨基酸(赖氨酸)的ε位氨基(εk)形成肽键连接,自氨基端第43位氨基酸的羧基与第44位氨基酸(赖氨酸)的ε位氨基(εk)形成肽键连接。(序列自左向右为氨基端向羧基端)
其中,εk是赖氨酸的ε位氨基形成肽键,具体原理如下所示:
每个氨基酸至少包含一个“—cooh”(羧基)和一个“—nh3”(氨基),连接在α碳原子上的羧基和氨基称为“α羧基”和“α氨基”。一般的肽合成反应为上一个氨基酸的“α氨基”和下一个氨基酸的“α羧基”反应形成酰胺键(肽键)而成。
lys(赖氨酸)是一种碱性氨基酸,除了正常的“α氨基”和“α羧基”外,在ε位置上还有一个氨基,如下式。
εk特指参与成肽反应的氨基是“ε氨基”而不是“α氨基”,因其较长的手臂结构,因此,被用于连接需要共同使用但又不互相影响的表位。
其中,如上所述,括序列1所示的多肽、序列2所示的多肽中的具有多态性位点(即一个氨基酸位点存在两种可选氨基酸)时,这些由于位点多态性带来的不同序列的多肽,可以单独或混合存在在多肽组合物中。在本发明的一个实施方式中,在多肽的合成中,在具有两种可选氨基酸位点对两种氨基酸同时加样,随机合成。
当选取上述两种序列所述的多肽组成疫苗组合物时,它们的摩尔比为(0.5-1.5):(0.5-1.5);最优选的,它们的摩尔比为1:1。
所述的多肽组合物在制备猪圆环病毒合成肽疫苗中的应用也属于本发明的保护范围。
本发明提供的一种猪圆环病毒合成肽疫苗,包含上述的多肽组合物。
所述猪圆环病毒合成肽疫苗还包含佐剂。本发明提供了所述的猪圆环病毒合成肽疫苗的制备方法,所述制备方法包括以下步骤:
(1)用注射用水将所述多肽组合物稀释为10-100μg/ml(优选100μg/ml)的浓度,从而得到多肽抗原水相;
(2)将佐剂灭菌(在121℃条件下灭菌30min);
(3)在20~28℃条件下,按照所述多肽抗原水相与所述佐剂1:1的体积比,先将佐剂加入乳化罐内,在90~150rpm下搅拌1.5~3min,然后缓慢加入多肽抗原水相,然后搅拌20~30min,再在8000~10000rpm下搅拌15-30min,静置3-10min(优选5min),分装。
优选地,所述佐剂为选自白油、50v、50vii(montanideisa50v、50vii佐剂(法国seppic公司))中的一种或多种。
本发明还提供了上述多肽聚合物中的多肽的制备方法,所述制备方法包括以下步骤:
(1)以氨基树脂为起始原料,以由9-芴甲氧羰基保护的氨基酸为单体,按照所述氨基酸序列依次缩合接上氨基酸以合成所述多肽,每步缩合反应后用乙酰咪唑封闭未反应的氨基端;
(2)合成完毕后加入裂解试剂,从而将所述多肽从氨基树脂上裂解下来;
(3)使用乙醚沉淀所述多肽;
(4)对所述多肽进行超滤纯化,然后进行无菌处理。
在上述制备方法中,所述步骤(1)具体包括以下步骤:
(1-a)脱保护反应:将氨基树脂置于体积百分比为15%~30%的六氢吡啶的n-甲基吡咯烷酮(nmp)溶液中,在20~28℃条件下反应25~40min,从而脱除氨基树脂上的9-芴甲氧羰基保护基团;
(1-b)洗涤:氮气吹干,然后用n-甲基吡咯烷酮洗涤氨基树脂;
(1-c)缩合反应:加入1-羟基苯丙三唑(hobt)、n,n-二异丙基碳二亚胺(dic)与由9-芴甲氧羰基保护的氨基酸,然后在20~28℃条件下反应0.5~2.5h;
(1-d)洗涤:氮气吹干,然后用n-甲基吡咯烷酮洗涤氨基树脂;
(1-e)封闭反应:加入重量体积百分比为1.5%~4%的乙酰咪唑的n-甲基吡咯烷酮(nmp)溶液,在20~28℃条件下反应20~40min。
在上述制备方法中,所述步骤(2)中裂解试剂的组分为体积比为85:8:6:1的三氟乙酸:三异丙基硅烷:苯酚:h2o;并且,所述步骤(2)的裂解时间为1-4h。
在上述制备方法中,所述步骤(3)具体包括:
(3-a)使用乙醚沉淀所述多肽,然后用二甲基甲酰胺洗涤;
在上述制备方法中,所述步骤(4)具体包括以下步骤:
(4-a)使用切向过滤膜包在20~28℃条件下超滤所述多肽,从而除去小分子杂质;
(4-b)使用0.2μm滤器除菌保存。
还一方面,本发明提供了上述多肽或多肽疫苗在制备用于预防猪圆环病毒合成肽疫苗的生物制品中的用途。
具体而言,本发明通过对国内猪圆环病毒2型流行毒株的序列测定并结合猪圆环病毒疫苗毒株序列,研究猪圆环病毒2型毒株的主要抗原位点的变异情况,针对主要变异的氨基酸位点统计其变异的频率,同时结合计算机辅助进行猪圆环病毒2型抗原位点的分析预测,对可能的抗原位点肽段进行化学合成,即针对易变异位点根据统计的变异频率,在这些位点使用不同的氨基酸,得到涵盖当前所有可能变异位点的多种候选多肽抗原。进而,通过大量的动物试验对这些候选多肽抗原进行筛选,得到能够引起动物的免疫反应,而且免疫反应水平高,能够很好的保护动物免受猪圆环病毒2型流行毒株攻击的多肽抗原。此外,本发明人根据筛选实验结果对猪圆环病毒2型抗原位点进行了优化,并有效组合了t细胞表位和b细胞表位,增强了多肽抗原的免疫效果。
肽疫苗效力实验、安全性实验结果表明,本发明提供的猪圆环病毒合成肽疫苗具有良好的免疫效力,并且不会引发传统疫苗存在的发热、红肿等问题,因此本发明的疫苗可以有效应对目前猪圆环病毒的抗原变异、不存在生物安全性,易于大规模合成,具有良好的应用前景。
附图说明
图1为实施例2中1-8号合成肽疫苗抗原多肽筛选结果;
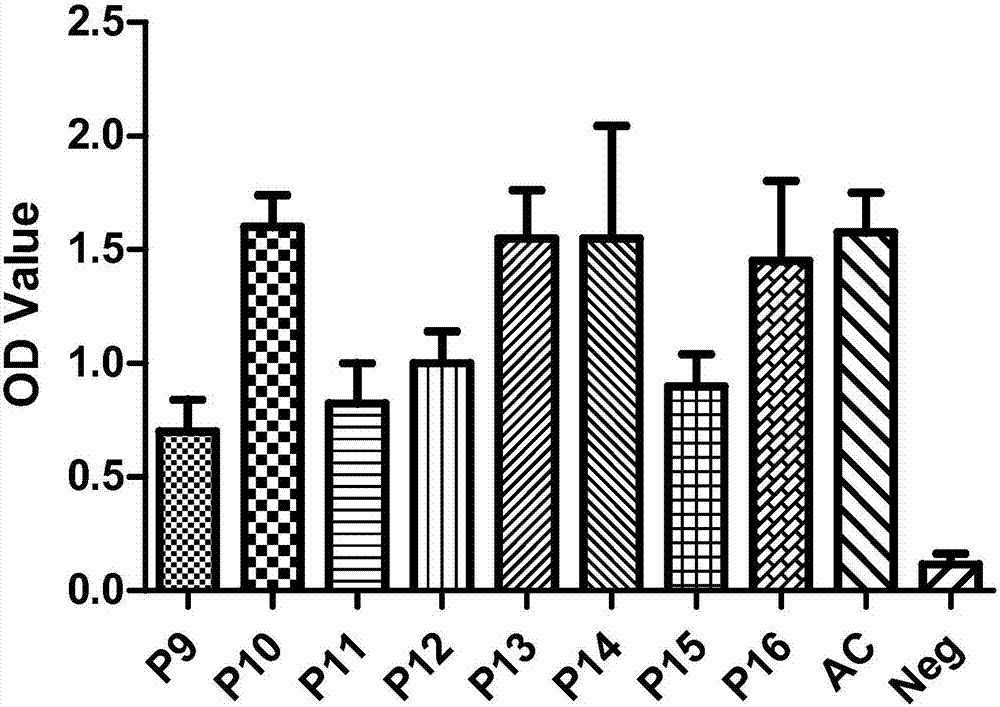
图2为实施例2中9-16号合成肽疫苗抗原多肽筛选结果;
图3为6种pcv2疫苗诱导仔猪产生抗体比较;
图4为6组pcv2疫苗诱导仔猪产生中和抗体比较;
图5为3组多肽疫苗免疫后elispot结果。
具体实施方式
以下参照具体的实施例来说明本发明。本领域技术人员能够理解,这些实施例仅用于说明本发明,其不以任何方式限制本发明的范围。
下述实施例中的实验方法,如无特殊说明,均为常规方法。下述实施例中所用的药材原料、试剂材料等,如无特殊说明,均为市售购买产品。
实施例1、猪圆环病毒合成肽疫苗多肽的固相合成
本发明通过对国内猪圆环病毒2型新近流行毒株的序列测定并结合猪圆环疫苗毒株序列,研究猪圆环病毒2型主要抗原位点的变异情况,针对主要变异的氨基酸位点统计其变异的频率,同时结合计算机辅助进行口蹄疫抗原位点的分析预测,对可能的抗原位点肽段进行化学合成,即针对易变异位点根据统计的变异频率,在这些位点使用不同的氨基酸,得到涵盖当前所有可能变异位点的多种候选多肽抗原。进而,通过大量的动物试验对这些候选多肽抗原进行筛选,得到能够引起动物的免疫反应,而且免疫反应水平高,能够很好的保护动物免受猪圆环病毒2型流行毒株攻击的多肽抗原。此外,本发明人根据筛选实验结果对猪圆环病毒2型抗原位点进行了优化,并有效组合了t细胞表位和b细胞表位,增强了多肽抗原的免疫效果。
通过筛选并鉴定的本发明的合成肽抗原可以使用美国433a全自动多肽合成仪,利用merrifield固相合成法制备,其中采用了由9-芴甲氧羰基(fmoc)修饰的氨基酸,固相载体为天津南开的rinkamidembha树脂。生产过程通常包括多肽抗原的固相合成、多肽的裂解、抗原纯化与除菌保存。
1.1合成肽抗原的固相合成
1.1.1合成原料准备
合成多肽抗原的序列如下:
多肽1(序列表中序列1所示的多肽):
isiteigkvivrhiatiflεkvdhvgix1x2fensx3εkhx4rfytpkpvldstidyfqpnnkrnql
上述序列中,x1=g/r,x2=t/i,x3=k/y,x4=s/r,这些位点所示的两个不同氨基酸同时加样,随机合成。多肽2(序列表中序列2所示的多肽):
isiteigkvivrhiatiflεktpx1wavdmmrynix2dfx3ppgggx4εktqgdrgvgstavilddnfvtk
上述序列中,x1=s/r,x2=a/t,x3=v/l,x4=s/r),这些位点所示的两个不同氨基酸同时加样,随机合成。
其中,多肽1的自氨基端第20位赖氨酸的ε位氨基(εk)与第19位氨基酸的羧基形成肽键。多肽2的自氨基端第20位赖氨酸的ε位氨基(εk)与第19位氨基酸的羧基形成肽键,及自氨基端第44位赖氨酸的ε位氨基(εk)与第43位氨基酸的羧基形成肽键。(在下述合成过程中,反应溶液是碱性,购买的成品赖氨酸其ε位氨基是由碱敏感基团保护,而其α位氨基由酸敏感基团保护。反应过程中,只能将ε位氨基的保护基团脱除,暴露其氨基,与下一个氨基酸的羧基进行反应。)
依据抗原的序列以及1mmol的合成规模,准备合适的fmoc修饰的氨基酸[购自上海吉尔生化],加入相应的氨基酸试剂瓶中。同样按要求称量rinkamidembha树脂,放入反应腔中,将上下盖子拧紧,贴标签,记录所合成肽的名称、批号、反应腔的皮重及所称树脂的重量。将反应腔装入合成仪。配制合成试剂,包括n-甲基吡咯烷酮(nmp)、乙酰咪唑(aim)、哌啶(pip)、甲醇等放置到相对应的试剂瓶中。
1.1.2合成仪状态检测
检查psi300多肽合成仪是否正常运行。另外检查n2是否充足,系统表压是否正常。合成前应对仪器的性能有所了解,所以要对每种合成试剂的流速进行测定。分别运行atorv、btorv、ctorv、dtorv、etorv、ftorv、atoaa、ctoaa。进行测量或观察,若流量不合适,则调节下阀门压力或修改各溶液参数,直至达到要求。
1.1.3合成肽抗原的合成开始
在合成仪的程序中按合成序列编辑sequence,再编辑具体合成program,最后把“sequence”和“program”组合成为一个“runfile”,保存。再在运行文件中打开,设定氨基酸瓶准备数量,开始运行。
1.1.4合成肽抗原的合成
如上述的多肽序列,合成的时候是从c端开始至n端,依照给定的顺序,依次不断地重复如下合成步骤:
(1)脱保护反应:将上述氨基树脂置于含有体积百分比为15%~30%六氢吡啶的nmp溶液中,在20~28℃条件下反应25~40min脱除氨基树脂上的fmoc保护基团;
(2)洗涤:氮气吹干,nmp洗涤氨基树脂;
(3)缩合反应:加入hobt、dic与fmoc保护的氨基酸在20~28℃条件下反应0.5-2.5h;
(4)洗涤:氮气吹干,nmp洗涤氨基树脂;
(5)封闭反应:加入重量体积百分比为1.5%~4%的乙酰咪唑的nmp溶液,在20~28℃条件下反应20~40min。
1.1.5合成肽抗原合成结束
抗原合成结束后合成仪将自动停止。然后从多肽合成仪上取下反应器,再用100%甲醇洗涤多肽树脂3次,然后在通风橱内吹干,将多肽树脂转移至棕色瓶内,放入-20℃冰箱内,封口膜密封备用。
1.2合成肽抗原的裂解及鉴定
1.2.1合成肽抗原的裂解
按照体积比例(三氟乙酸(tfa)/三异丙基硅烷(tis)/苯酚/h2o=85/8/6/1)配制裂解液,然后从冰箱内取出合成的多肽树脂,放入圆底烧瓶内,在通风橱内向烧瓶内加入配制好的裂解液和磁搅拌子,然后稳定地放置在磁力搅拌器上,室温下持续搅拌1h直至反应完全。反应结束后,使用带冷阱的旋转蒸发仪持续蒸发30~120min除去粗产品中的tfa。接着使用乙醚收集、沉淀多肽,然后用二甲基甲酰胺(dmf)多次清洗多肽抗原的粗品,最后将混合在一起的树脂用砂芯漏斗过滤出来,即得到多肽抗原。
1.2.2合成肽抗原的鉴定
多肽抗原合成完毕后用基质辅助激光解吸飞行时间质谱法(maldl-tof)和反相高压液相色谱法(rp-hplc)进行定性定量分析。
1.3合成肽抗原的纯化除菌
合成肽抗原使用循环式切向过滤膜包在20~28℃条件下进行超滤(tangentialflowdevice循环式切向过滤膜包以及与其配套的蠕动泵),多肽抗原是大分子不能通过一定孔径的滤膜,而前期合成过程以及后期环化反应形成或引进的小分子杂质则可以通过滤膜。然后再通过孔径为0.2μm过滤器除菌,将最后得到的溶液分装到无菌塑料瓶内,贴上标签。标签上注明多肽的名称、编号、生产批号、浓度、生产日期、保存期限及保存条件,分装后,储存于-20℃或-40℃备用。
为了便于运输和长期保存的需要,将多肽抗原进行冷冻干燥以得到固体状态的多肽。将预先冻好的多肽抗原取出,在labconco冷冻干燥机上进行干燥,得到固体状态的多肽抗原。同时贴上标签。标签上注明多肽的名称、编号、生产批号、浓度、生产日期、保存期限及保存条件。
实施例2、猪圆环病毒合成肽疫苗抗原多肽的筛选
1.1候选抗原多肽的合成
合成方法同实施例1。
1.2抗原多肽的筛选
将36条候选抗原多肽分别以1μg/ml的浓度包被elisa反应板,4~8℃下放置过夜,使多肽抗原与酶联反应板充分结合。然后按照300μl/孔加入封闭液37℃封闭处理2~3h。用洗涤缓冲液洗涤后甩干。按照100μl/孔加入60倍稀释的猪圆环病毒2型抗体阳性血清(中牧实业股份有限公司成都药械厂提供),37℃温箱或水浴锅中,反应30min。洗涤后,100μl/孔加入10000倍稀释的辣根过氧化物酶标记的兔抗猪igg抗体(sigma,货号a5670),37℃温箱或水浴锅中,反应30min。洗涤后加入底物显色。读取od450值。同时设阴性对照抗原(bsa,2.5μg/ml)包被反应板,阳性对照抗原(锐捷,猪圆环病毒2-dcap-elisa抗体检测试剂盒)包被反应板。
筛选结果见图1、图2。与阳性对照抗原相比较,筛选出8条抗原多肽,多肽的序列见表1。其中,序列表中序列1所示的序列,其中的四个氨基酸位点(27,28,33,36),x1aa=gly或arg,x2aa=thr或ile,x3aa=lys或tyr,x4aa=ser或arg任意组合,合成的多肽抗原其od450值均在1.5左右。序列表中序列2所示的序列,其中的氨基酸位点(23,34,37,43),x1aa=ser或arg,x2aa=ala或thr,x3aa=val或leu,x4aa=ser或arg,合成的多肽抗原其od450值均在1.5左右。
表1.猪圆环病毒2型合成肽疫苗抗原多肽
实施例3、猪圆环病毒合成肽疫苗的配制
1.1抗原水相的配制
分别称取依照实施例1制备的多肽1、多肽2所示的合成肽抗原,按照抗原比例摩尔为1:1混合,然后用灭菌注射用水将合成肽抗原总浓度稀释至100μg/ml。将所得抗原溶液经孔径为0.2μm的过滤器过滤,除菌。
1.2油相佐剂制备
将油相佐剂50v经121℃灭菌30min,备用。
1.3合成肽疫苗的乳化
用灭菌的蒸馏水2000ml清洗ika乳化设备3次,然后在20~28℃条件下按油相佐剂和抗原水相为1:1的体积比,先将油相加入乳化罐内,开动电机以90~150rpm慢速转动搅拌2min后,同时缓慢加入水相抗原,加完后搅拌30min,再以10000rpm高速搅拌20min,静置5min,使疫苗乳化成油包水的单相疫苗,得到含摩尔比为1:1的多肽1、多肽2的混合疫苗。
按上述相同的方法,分别制备以多肽1、多肽2为抗原的疫苗,保证多肽抗原浓度为100μg/ml。
实施例4、猪圆环病毒合成肽疫苗的安全性试验
1.材料与方法
1.1合成肽疫苗配制
同实施例3。将含摩尔比为1:1的多肽1、多肽2的混合疫苗命名为zmpcv2h2;多肽抗原浓度为100μg/ml。
按上述相同的方法,分别制备以多肽1、多肽2为抗原的疫苗,分别命名为zmpcv2001、zmpcv2002;多肽抗原浓度分别为100μg/ml。
1.2试验动物
pcv2elisa抗体阴性和pcv2抗原阴性14、21日龄仔猪、怀孕65~95天的母猪。
1.3试验方法
1.3.1最小免疫日龄仔猪一次单剂量接种
取14日龄哺乳仔猪20头,分别称重,分为4组,每组5头,第1~2组分别肌肉注射zmpcv2001、zmpcv2002的合成肽疫苗,第3组肌肉注射批号为zmpcvh2的合成肽疫苗,接种剂量1ml/头;第4组为空白对照组,剪耳号并称体重后隔离饲养30天,观察仔猪有无临床症状。接种后1~7天每天测量体温(直肠温度)。结束时称量体重。
1.3.2仔猪单剂量重复接种
取21日龄仔猪20头,分别称重,分为4组,每组5头,第1~2组分别肌肉注射批号为zmpcv2001、zmpcv2002的合成肽疫苗,第3组肌肉注射批号为zmpcv2h2的合成肽疫苗,连续2次,每次间隔2周,接种剂量1ml/头/次,第4组为空白对照组。剪耳号并称体重后,隔离饲养45天,观察仔猪有无临床症状。二免后第1~7天每天测量体温(直肠温度)。试验结束时称体重。
1.3.3仔猪一次超剂量接种
取21日龄仔猪20头,分别称重,分为4组,每组5头,第1~2组分别肌肉注射批号为zmpcv2001、zmpcv2002的合成肽疫苗,第3组肌肉注射批号为zmpcv2h2的合成肽疫苗,接种剂量4ml/头;第4组为空白对照组,剪耳号并称体重后隔离饲养30天,观察仔猪有无临床症状。接种后1~7天每天测量体温(直肠温度)。试验结束时称体重。
1.3.4怀孕母猪的安全性(生产性能)
取怀孕65~95天的母猪16头,分为4组,每组4头,第1~2组分别颈部肌肉注射批号为zmpcv2001、zmpcv2002的合成肽疫苗,第3组肌肉注射批号为zmpcvh4的接种剂量8ml/头;第4组作为对照,各组母猪在相同条件下分开饲养,观察至母猪分娩,观察有无早产、死胎、木乃伊胎及弱仔等繁殖障碍出现。
2.试验结果
表2.14日龄仔猪、21日龄仔猪及怀孕母猪的疫苗安全性试验结果
结果表明(表2),免疫单独序列配制的疫苗(zmpcv2001、zmpcv2002)及免疫混合序列配制的疫苗(zmpcv2h2),14日龄仔猪、21日龄仔猪没有不良反应产生,体温及增重正常。怀孕母猪无不良反应产生,食欲正常,生产性能没有受到影响。说明含有序列1及序列2的合成肽疫苗对仔猪和怀孕母猪免疫的安全性良好。
实施例5、猪圆环病毒合成肽疫苗的仔猪免疫试验
1.材料与方法
1.1合成肽疫苗配制
同实施例3。
1.2试验动物
pcv2elisa抗体阴性和pcv2抗原阴性14-21日龄仔猪100头。
1.3试验方法
1.3.1免疫接种
用21~28日龄prrsv-elisa抗体阴性,pcv2-elisa抗体阴性和pcv2抗原阴性健康易感仔猪30头,分成6组,每组5头,第1组每头颈部肌肉注射批号为zmpcv2001合成肽疫苗1ml,2周后按相同途径和剂量进行第2次接种。第2组免疫zmpcv2002合成肽疫苗1ml,2周后按相同途径和剂量进行第2次接种。第3组免疫zmpcv2h2合成肽疫苗1ml,2周后按相同途径和剂量进行第2次接种。第4组免疫pcv2sh株灭活疫苗,第5组免疫猪圆环病毒2型灭活疫苗(lg株),第6组免疫猪圆环病毒2型杆状病毒载体灭活疫苗(cp08株);第7组作非免疫攻毒对照,第8组作空白对照(非免疫、非攻毒),均隔离饲养观察。首免后0天、14天、21天、28天、35天分别采血,分离血清,进行pcv2-elisa抗体、中和抗体检测,21、35天采集合成肽疫苗组全血分离淋巴细胞进行elispot试验。疫苗免疫及分组情况见表3。
表3.疫苗免疫及分组情况
1.3.2elisa抗体的检测
将序列1、序列2所示抗原多肽分别以1μg/ml的浓度包被elisa反应板,4~8℃下放置过夜,使多肽抗原与酶联反应板充分结合。然后按照300μl/孔加入封闭液37℃封闭处理2~3h。用洗涤缓冲液洗涤后甩干。按照100μl/孔加入60倍稀释的免疫后猪血清及猪圆环病毒2型抗体阳性血清(中牧实业股份有限公司成都药械厂提供),37℃温箱或水浴锅中,反应30min。洗涤后,100μl/孔加入40000倍稀释的辣根过氧化物酶标记的兔抗猪igg抗体(sigma,货号a5670),37℃温箱或水浴锅中,反应30min。洗涤后加入底物显色。读取od450值。同时设阴性对照抗原(bsa,2.5μg/ml)包被反应板。
elisa抗体检测结果见图3。由结果可见免疫后14天,免疫各组均检测到pcv2抗体,但抗体滴度较低,大约1:200~400;之后抗体滴度逐步增加,首免后35天,第1组、第2组疫苗免疫组elisa抗体效价平均值达1:2200~3000,含有序列1及序列2的第3组合成肽疫苗组抗体平均值达到1:4160,高于第4组、第5组灭活苗组及第6组杆状病毒载体疫苗组。对照组均未检测到elisa抗体。
1.3.3中和抗体检测
取pk15细胞(中牧股份成都药械厂)悬液铺板,100μl/w铺板,37℃、5%co2培养至细胞长至单层铺于96孔细胞板底部。
将采集获得的免疫猪血清56℃加热灭活后5000r/m离心5min,取上清,倍比稀释后与等体积含有tcid50pcv2-zm病毒混合,37℃孵育1h后接种于培养好的96孔细胞板内,100μl/孔,每一稀释度接种4孔,同时设细胞对照和病毒对照孔。37℃培养60h后,无水乙醇固定细胞,用间接免疫荧光法测定每个稀释度含有荧光的孔数。以能够产生50%特异性荧光细胞数的细胞孔的血清最大稀释度作为待检血清的中和效价,并计算每组平均值。。
中和抗体检测结果见图4,由结果可见免疫后14天,免疫各组均能检测到pcv2中和抗体,但效价较低,二免后,各组中和抗体效价明显升高,首免后35天,各组中和抗体平均值可达1:19.2~25.6,第1组(seqno.1,zmpcv001)、第2组合成肽疫苗(seqno.2,zmpcv002)与第4组、第5组灭活苗组基本相同,含有序列1及序列2的第3组合成肽疫苗组(seqno.1+seqno.2,zmpcv2h2)和杆状病毒载体疫苗中和抗体平均值可达1:25.6,高于其他4组,对照组未检测到pcv2中和抗体。
1.3.4elispot方法检测ifn-γ
采用mabtech公司的猪ifn-γelispot检测试剂盒,按试剂盒的操作说明进行检测。采用mabtech公司的ifn-γ检测试剂盒,按照说明书进行。用pbs稀释单抗,加入pvdf板,100μl/孔,4℃过夜。用10%胎牛血清(fbs)的1640培养基将序列1及序列2所述多肽及两个序列所述多肽的混合物分别稀释到40μg/ml作为刺激物,每孔加入100μl,对照孔加入100μl含10%血清的1640培养基,各作2个重复孔。每孔再加入100μl细胞溶液(细胞液浓度为5×106个/ml),使刺激物终浓度为20μg/ml,37℃co2孵育箱中孵育17h。甩去细胞,用pbs洗涤5遍,200μl/孔,加生物素标记二抗(用含有0.5%fbs的pbs将生物素标记二抗稀释至1μg/ml),100μl/孔,室温孵育1h。pbs洗板5次,加入亲和素标记hrp(用含有0.5%fbs的pbs将亲和素标记hrp稀释至1μg/ml),100μl/孔,室温孵育1h。pbs洗板5次,加底物溶液,当板子底部出现清晰斑点时,用水冲洗板子终止反应。将板子晾干后读数。
elispot结果见图5,结果表明随着免疫时间的延长,inf-γ的分泌有所增加,肽序列seqno.1+seqno.2效果最优,且肽序列seqno.1的刺激效果要优于肽seqno.2,对照组未有斑点出现。
序列表
<110>中牧实业股份有限公司
<120>猪圆环合成肽疫苗及其制备方法和应用
<130>whoi170001
<160>2
<210>1
<211>61
<212>prt
<213>人工序列
<220>
<221>misc_feature
<222>(27)..(27)
<223>x1aa=gly或arg
<220>
<221>misc_feature
<222>(28)..(28)
<223>x2aa=thr或ile
<220>
<221>misc_feature
<222>(33)..(33)
<223>x3aa=lys或tyr
<220>
<221>misc_feature
<222>(36)..(36)
<223>x4aa=ser或arg
<400>1
ileserilethrgluileglylysvalilevalarghisilealathr
151015
ilepheleulysvalasphisvalglyilex1aax2aaphegluasnser
202530
x3aalyshisx4aaargphetyrthrprolysprovalleuaspserthr
354045
ileasptyrpheglnproasnasnlysargasnglnleu
505560
<210>2
<211>65
<212>prt
<213>人工序列
<220>
<221>misc_feature
<222>(23)..(23)
<223>x1aa=ser或arg
<220>
<221>misc_feature
<222>(34)..(34)
<223>x2aa=ala或thr
<220>
<221>misc_feature
<222>(37)..(37)
<223>x3aa=val或leu
<220>
<221>misc_feature
<222>(43)..(43)
<223>x4aa=ser或arg
<400>2
ileserilethrgluileglylysvalilevalarghisilealathr
151015
ilepheleulysthrprox1aatrpalavalaspmetmetargtyrasn
202530
ilex2aaaspphex3aaproproglyglyglyx4aalysthrglnglyasp
354045
argglyvalglyserthralavalileleuaspaspasnphevalthr
505560
lys
65
- 还没有人留言评论。精彩留言会获得点赞!