人PYCR1基因的shRNA干扰序列及其应用的制作方法
本发明属于生物药物领域,具体涉及一种人pycr1基因的shrna干扰序列及其应用。
背景技术:
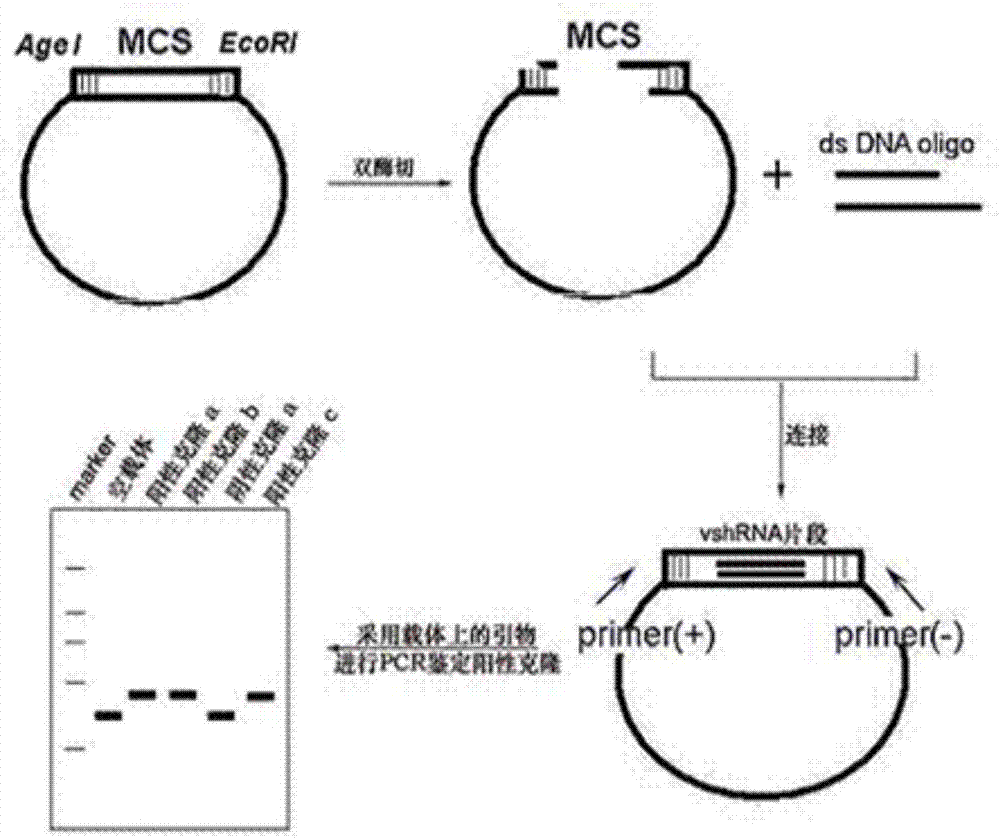
:随着人类生活习惯和行为模式的改变,以及农工业发展过程带来的环境污染和人口老龄化等原因,恶性肿瘤成为人类致死的主要疾病。世界卫生组织国际癌症研究中心(iarc/who)的最新数据显示恶性肿瘤在全球的发病率呈上升趋势,2008年760万人死于恶性肿瘤,其中64%发生在发展中国家。在我国,肿瘤防治面临的形势也极为严峻,最新报告显示,在过去30年间,我国恶性肿瘤的发病率和死亡率均呈明显上升趋势;据预测,在未来20-30年间,我国恶性肿瘤发病率和死亡率不断上升的趋势将继续维持。因此,对肿瘤的研究是生命科学和医学领域的持续研究热点之一。恶性肿瘤传统疗法如放疗、化疗和手术治疗的局限性促使人们寻找新的抗肿瘤方法。随着对肿瘤发生发展分子机制认识的深入,人们已意识到肿瘤是一种基因病,纠正发生缺陷的基因可为肿瘤的治疗提供了新的希望。近年来发展了许多针对肿瘤的基因治疗方法的研究,但迄今为止进入临床应用的几种基因药物的临床疗效有限,且具有潜在的、长期的、延迟的副作用,因此,寻求治疗的新靶点和开发新的基因治疗方法已成为国内外肿瘤基因治疗的研究方向。rna干扰(rnainterference,rnai)是一门基因阻断技术,为一种双链rna(double-strandedrna,dsrna)分子在mrna水平上阻断特异基因的表达或使其沉默的过程,即序列特异性的转录后基因沉默(post-transcriptionalgenesilencing,ptgs)。近年来,rnai已成为肿瘤基因治疗的有效策略。利用rnai技术可以抑制原癌基因、突变的抑癌基因、细胞周期相关基因、抗凋亡相关基因等表达来抑制肿瘤的发生和发展。pycr1位于17号染色体,编码吡咯啉-5羧酸还原酶1,属于吡咯啉-5羧酸还原酶家族,其主要功能是将吡咯啉-5羧酸还原为脯氨酸,pycr1在真核生物中广泛存在,调节细胞内信号传导,进而对多种胞外刺激进行响应。pycr家族的多个成员与癌症发生发展相关,pycr1基因被认为是与年龄和/或衰老有关的基因,如其在治疗如皮肤松弛、皱皮综合征等疾病中通过基因改造或修饰其在动物体内的表达进行过研究,但仅显示出实验水平的倾向。技术实现要素:本发明公开了人pycr1基因的用途及其相关相关药物。本发明公开了人pycr1基因在肿瘤治疗、肿瘤诊断及药物制备中的用途。本发明还进一步构建了人pycr1基因小分子干扰rna、人pycr1基因干扰核酸构建体、人pycr1基因干扰慢病毒,并公开了他们的用途。本发明提供的sirna或包含该sirna序列的核酸构建体、慢病毒能够特异性抑制人pycr1基因的表达,尤其是慢病毒,能够高效侵染靶细胞,高效率抑制靶细胞中pycr1基因的表达,进而抑制肿瘤细胞的生长,促进肿瘤细胞凋亡,在肿瘤治疗中具有重要意义。因此,本发明的第一目的在于提供一种人pycr1基因的shrna干扰序列,包括dnaoligo正链序列与反链序列,其中,所述正链序列为:5’-ccggcacagtttctgctctcaggaactcgagttcctgagagcagaaactgtgtttttg-3’(seqidno1);所述反链序列为:5’-aattcaaaaacacagtttctgctctcaggaactcgagttcctgagagcagaaactgtg-3’(seqidno2)。优选地,在本发明所述的人pycr1基因的shrna干扰序列中,所述dnaoligo正链序列与反链序列包括sirna靶点序列:5’-cagtttctgctctcaggaa-3’(seqidno3)。本发明还提供了一种人pycr1基因的shrna慢病毒载体,所述人pycr1基因的shrna慢病毒载体针对人pycr1基因的sirna靶点序列为:5’-cagtttctgctctcaggaa-3’。本发明的另一目的还在于提供一种人pycr1基因sirna,其中,编码所述人pycr1基因sirna包括针对人pycr1基因的sirna靶点序列为:5’-cagtttctgctctcaggaa-3’。本发明的又一目的还在于提供人pycr1基因sirna核酸载体,其中所述人pycr1基因sirna核酸载体包括针对人pycr1基因的sirna靶点序列为:5’-cagtttctgctctcaggaa-3’。优选地,在本发明所述的人pycr1基因sirna核酸载体中,所述人pycr1基因sirna核酸载体为seqidno4:5’-gttttaaaattatgttttaaaatggactatcatatgcttaccgtaacttgaaagtatttcgatttcttggctttatatatcttgtggaaaggacgaaacaccggcacagtttctgctctcaggaactcgagttcctgagagcagaaactgtgtttttgaattctcgacctcgagacaaatggcagtattcatccacgaattcggatccattaggcggccgcgtggataaccgtattaccgccatgcattagttattaatagtaatcaattacggggtcattagttcatagcccatatatggagttccgcgttacataacttacggtaaatggcccgcctggctgaccgcccaacgacccccgcccattgacgtcaataatgacgtatgttcccatagtaacgccaatagggactttccattgacgtcaatgggtggagtatttacggtaaactgcccacttggcagtacatcaagtgtatcatatgccaagtacgccccctattgacgtcaatgacggtaaatggcccgcctggcattatgcccagtacatgaccttatgggactttcctacttggcagtacatctacgtattagtcatcgctattacca-3’。本发明的另一方面为提供了一种人pycr1基因干扰慢病毒的构建方法,包括以下步骤:1)合成针对人pycr1基因的rna干扰靶点序列的dnaoligo正链与反链,所述正链序列为:5’-ccggcacagtttctgctctcaggaactcgagttcctgagagcagaaactgtgtttttg-3’;所述反链序列为:5’-aattcaaaaacacagtttctgctctcaggaactcgagttcctgagagcagaaactgtg-3’;2)所述正链序列和反链序列退火形成带有粘性末端的双链dna;3)通过酶切使载体线性化,使线性化载体与步骤1)得到的双链dna连接;4)将连接产物转化大肠杆菌感受态细胞,对得到的阳性克隆进行pcr鉴定;5)质粒抽提,病毒包装。优选地,本发明人pycr1基因干扰慢病毒的构建方法中,所述步骤3)中酶切反应为加入agei和ecori双酶切。优选地,本发明人pycr1基因干扰慢病毒的构建方法中,所述步骤4)连接产物转化大肠杆菌感受态细胞的具体方法为:将连接产物加入到大肠杆菌感受态细胞中,冰浴;热激,冰浴;加入无抗生素的lb液体培养基,摇床震荡培养;取菌液均匀涂抹在含有amp的lb固体培养基上,于37℃培养箱中过夜培养;阳性克隆进行pcr鉴定过程中采用的鉴定引物为鉴定引物-f:5’-cctatttcccatgattccttcata-3’(seqidno5)和鉴定引物-r:5’-gtaatacggttatccacgcg-3’(seqidno6),具体过程为:挑取单菌落进行pcr扩增,电泳,测序。本发明还提供了上述人pycr1基因的shrna干扰序列、人pycr1基因干扰核酸构建体、人pycr1基因干扰慢病毒在制备抑制肿瘤细胞的生长,促进肿瘤细胞凋亡,预防或治疗肿瘤的药物中的应用。由上以及本发明后续实施例可知,本发明的方法及提供的序列、载体与慢病毒至少有以下优点:pycr1基因通常被认为是与年龄和/或衰老有关的基因,如其在治疗如皮肤松弛、皱皮综合征等疾病中通过基因改造或修饰其在动物体内的表达进行过研究,而且仅显示出实验水平的倾向,没有在细胞水平中体现出抑制相关基因表达的作用。其次,pycr1基因rnai抑制方法在细胞水平中受到多水平因素的影响,特别是如何选择针对人pycr1基因的sirna靶点序列、如何应用慢病毒介导的rnai方法实现抑制相关基因表达一直以来为困扰相关研究人员的主要难点。而本发明的发明人意外地发现,利用特定的针对人pycr1基因的sirna靶点序列、以及合适的载体与适当地慢病毒介导的rnai方法,在降低pycr1基因在肿瘤细胞中的表达后,可以有效抑制肿瘤细胞的增殖。本研究表明,pycr1基因是一个原癌基因,可促进肿瘤细胞增殖,在肿瘤发生和发展中具有重要的生物学功能,pycr1基因可以作为肿瘤治疗的靶标,慢病毒介导的pycr1基因特异性沉默可作为肿瘤治疗的一种新手段。附图说明图1为本发明一个实施例线性载体酶切电泳图;图2为本发明一个实施例中rna干扰载体构建及阳性克隆鉴定示意图;图3为本发明一个实施例阳性克隆鉴定酶切电泳图;图4为本发明一个实施例中线性载体gv115图谱图;图5为本发明一个实施例中pycr1-rnai慢病毒侵染人肝癌bel-7404细胞3天后,pycr1mrna表达水平柱状图;图6为本发明一个实施例中pycr1-rnai慢病毒侵染人肝癌smmc-7721细胞3天后,pycr1mrna表达水平柱状图;图7为本发明一个实施例中pycr1-rnai慢病毒侵染人肝癌bel-7404细胞5天后,引起细胞增殖抑制图;图8为本发明一个实施例中pycr1-rnai慢病毒侵染人肝癌smmc-7721细胞5天后,引起细胞增殖抑制图;图9为本发明一个实施例中pycr1-rnai慢病毒侵染人肝癌bel-7404细胞后,细胞克隆形成能力下降示意柱状图;图10为本发明一个实施例中pycr1-rnai慢病毒侵染人肝癌smmc-7721细胞后,细胞克隆形成能力下降示意柱状图;图11为本发明一个实施例中pycr1-rnai慢病毒侵染人肝癌bel-7404细胞后,促进细胞凋亡示意柱状图;图12为本发明一个实施例中pycr1-rnai慢病毒侵染人肝癌bel-7404细胞后,促进细胞凋亡示意柱状图。具体实施方式以下通过具体实施例进一步对本发明的技术方案进行说明,应理解以下仅为本发明的示例性说明,并不用于限制本发明权利要求的保护范围。实施例1:针对人pycr1基因rnai慢病毒的制备1rna干扰靶点设计及双链dnaoligo制备(1)设计合成针对人pycr1基因的有效的sirna靶点从genbank调取pycr1(nm_153824)基因信息;设计针对pycr1基因的有效的sirna靶点。表1为针对pycr1基因的有效sirna靶点序列。表1靶向人pycr1基因的有效sirna靶点序列(2))dnaoligo序列合成根据已选靶点序列设计shrna干扰序列,并在两端添加合适的限制性内切酶酶切位点以完成载体构建。除此之外,在正链3’端添加ttttt终止信号,而反链5’端添加终止信号互补序列。合成单链dnaoligo。表2两端含agei和ecori酶切位点粘端的单dnaoligo*ccgg:agei酶切位点;aattc:ecori酶切位点;g:ecori酶切位点互补序列。(3)双链dnaoligo制备将合成的单链dnaoligo干粉溶解于退火缓冲液中(终浓度20μm),90℃水浴15min。自然冷却至室温后,形成带粘性末端的双链。(4)线性化载体制备按照neb说明书配制50μl反应体系,使用agei和ecori双酶切gv115载体(如图4所示)使其线性化。反应体系37℃(最适温度)反应1h,之后切胶回收目的片段。如图1所示,泳道1:1kbmarker:从上至下依次为10kb,8kb,6kb,5kb,4kb,3.5kb,3kb,2.5kb,2kb,1.5kb,1kb,750bp,500bp,250bp;泳道2:agei和ecori双酶切线性化后的载体质粒;泳道3:没有酶切的载体质粒,电泳结果说明线性化载体构建成功。2rna干扰慢病毒载体构建(1)连接按照fermentast4dnaligase说明书配制20μl反应体系,将双链dnaoligo与线性化的载体相连。于16℃反应1h-3h,连接产物命名为psc45562,之后进行转化实验。(2)转化将连接产物转化大肠杆菌感受态细胞,详细操作步骤如下:1)将10μl连接产物psc45562加入到100μl大肠杆菌感受态细胞中,冰浴30min。2)42℃热激90sec,冰浴2min。3)加入500μl无抗生素的lb液体培养基,200rpm于37℃摇床震荡培养1hr。4)取150μl菌液均匀涂抹在含有amp的lb固体培养基上,于37℃培养箱中过夜培养。(3)阳性克隆的pcr鉴定①rna干扰载体构建及阳性克隆鉴定如图2所示,多克隆位点载体(mcs)通过双酶(agei和ecori)切为线性载体,通过t4dnaligase将其与dsdna连接,将连接产物转化大肠杆菌感受态细胞,培养后进行pcr扩增和鉴定阳性克隆。②引物③pcr扩增按下表配制20μlpcr反应体系,用无菌枪头挑取单个菌落为模板,进行pcr扩增,反应条件为:94℃3min;94℃30s,55℃30s,72℃30s,22次循环;72℃5min。pcr结束后,取5μl产物,1%琼脂糖凝胶电泳检测条带。④电泳上样说明如图3所示,泳道1:阴性对照(ddh2o),排除系统中外源核酸污染导致假阳性结果;泳道2:自连对照(空载体自连对照组);泳道3:250bpmarker:从上至下依次为5kb,3kb,2kb,1.5kb,1kb,750bp,500bp,250bp,100bp;泳道4-8:单克隆psc45562-1,2,3,4,5,结果说明:泳道1无显影,说明系统核酸污染;没有连接入shrna片段的空载体克隆pcr片段大小为:307bp(泳道2)。连接入shrna片段的阳性克隆pcr片段大小为:380bp(泳道4-8),由此判断psc45562-1,2,3,4,5为阳性克隆,保存鉴定结果正确的克隆,并进行测序。⑷阳性克隆测序结果分析以鉴定引物-f进行阳性克隆测序,挑选测序结果与目标序列完全一致的克隆用于下一步实验。psc45562测序结果:gttttaaaattatgttttaaaatggactatcatatgcttaccgtaacttgaaagtatttcgatttcttggctttatatatcttgtggaaaggacgaaacaccggcacagtttctgctctcaggaactcgagttcctgagagcagaaactgtgtttttgaattctcgacctcgagacaaatggcagtattcatccacgaattcggatccattaggcggccgcgtggataaccgtattaccgccatgcattagttattaatagtaatcaattacggggtcattagttcatagcccatatatggagttccgcgttacataacttacggtaaatggcccgcctggctgaccgcccaacgacccccgcccattgacgtcaataatgacgtatgttcccatagtaacgccaatagggactttccattgacgtcaatgggtggagtatttacggtaaactgcccacttggcagtacatcaagtgtatcatatgccaagtacgccccctattgacgtcaatgacggtaaatggcccgcctggcattatgcccagtacatgaccttatgggactttcctacttggcagtacatctacgtattagtcatcgctattacca*shrna干扰序列插入片段用红色字体标注,其中agei酶切位点被破坏。3质粒抽提将测序正确的菌液转接于150ml含amp抗生素的lb液体培养基中,37℃摇床震荡培养过夜。按照endofreemaxiplasmidkit说明书提取质粒,质检合格的质粒进入下游流程。详细操作步骤如下:1.8000rpm离心4min收集菌体。2.加入7mlp1,震荡混匀;3.加入7mlp3,颠倒混匀6~8次,静置5min;4.加入7mlp4,颠倒混匀6~8次,冰浴10min;5.9000rpm离心10min,将上清转移到过滤器cs中,过滤后加入10ml异丙醇混匀;6.向吸附柱中加入2.5ml的平衡液bl,8000rpm离心2min,倒掉收集管中的废液,将柱子放回备用;7.将上清分两次倒入吸附柱中,8000rpm离心2min,弃废液;8.向吸附柱中加入10ml漂洗液pw(已加入无水乙醇),相同转速离心2min,弃废液,重复该步骤一次;10.向吸附柱中加入3ml无水乙醇,8000rpm离心2min,弃废液;11.9500rpm空甩5min,除去残留的漂洗液;将吸附柱转移至一新的白管中,在柱中心滴加800μl洗脱缓冲液tb(先预热),室温放置5min,然后9500rpm离心2min;12.将管中的洗脱液转移到一干净的1.5mlep管中,-20℃保存;13.取样电泳,使用分光光度计(thermo_nanodrop2000)测定质粒浓度,质检。14.将质检合格的质粒进行病毒包装。4慢病毒包装人胚肾细胞293t,慢病毒的包装细胞,为贴壁依赖型成上皮样细胞,生长培养基为dmem(含10%fbs),贴壁细胞经培养生长增殖形成单层细胞。大肠杆菌菌株dh5α,用于扩增慢病毒载体和辅助包装载体质粒。以qiagen公司的质粒抽提试剂盒提取rnai质粒,慢病毒包装系统中三种质粒dna(gv载体质粒、phelper1.0载体质粒、phelper2.0载体质粒),配制成100ng/ul储存液。转染前24h,用胰蛋白酶消化对数生长期的293t细胞,以含10%血清的培养基调整细胞密度约5x106细胞/15ml,重新接种于10cm细胞培养皿,37℃、5%co2培养箱内培养。24h待细胞密度达70%~80%时即可用于转染;转染前2h更换为无血清培养基;向一灭菌离心管中加入所制备的各dna溶液(gv载体质粒20μg、phelper1.0载体质粒15μg、phelper2.0载体质粒10μg),不相应体积的转染试剂混合均匀,调整总体积为1ml,在室温下温育15min;混合液缓慢滴加至293t细胞培养液中,混匀,于37℃、5%co2细胞培养箱中培养;培养6h后弃去含有转染混和物的培养基,加入10ml的pbs液清洗一次,轻柔晃动培养皿以洗涤残余的转染混和物后倒弃;缓慢加入含10%血清的细胞培养基20ml,于37℃、5%co2培养箱内继续培养48-72h。慢病毒浓缩与纯化:根据细胞状态,收集转染后48h(转染即可计为0h)的293t细胞上清液;于4℃、4000g离心10min,除去细胞碎片;以0.45μm滤器过滤上清液于40ml超速离心管中;分别配平样品,将带有病毒上清液的超速离心管逐一放入至beckman超速离心机内,设置离心参数为25000rpm,离心时间为2h,离心温度控制在4℃;离心结束后,弃去上清,尽量去除残留在管壁上的液体,加入病毒保存液(可用pbs戒细胞培养基替代),轻轻反复吹打重悬;经充分溶解后,高速离心10000rpm、5min后,取上清分装。实施例2rt-pcr检测pycr1基因的沉默效率处于对数生长期的人肝癌bel-7404、smmc-7721细胞进行胰酶消化,制成细胞悬液(细胞数约为5×104/ml)接种于6孔板,培养至细胞融合度达到约30%。加入适量的实施例1制备的病毒,培养6小时后更换培养基,待侵染时间达到3天后,收集细胞。rna抽提及cdna合成:①收取样品,trizol裂解:收集细胞,2000rpm离心5min,去上清,细胞沉淀中加入1mltrizol,充分混匀后室温静置5min,然后转移至新的1.5mlep管中;②每管加入200μl氯仿,用手上下颠倒ep管15s,室温静置10min。③4℃、12800rpm,离心15min。④吸取上层液体移至新的1.5mlep管,加入等体积预冷的异丙醇,混匀后4℃静置10min。⑤4℃、12800rpm离心12min后,弃上清。⑥加入1ml、75%乙醇(用depc水新鲜配制),洗涤沉淀。⑦4℃、11800rpm离心5min,弃去大部分上清。⑧4℃、11800rpm再次离心5min,弃去上清,室温干燥。⑨待rna沉淀基本透明时,加入rnase-free水(加入体积视rna沉淀量而定)至完全溶解,nanodrop2000/2000c分光光度计分析测定所抽提rna的浓度及质量。⑩将rna逆转录获得cdna(上述体系在42℃水浴反应1h,然后在70℃水浴10min使rt酶失活,将得到的反转录产物cdna)。(逆转录反应体系见表4)。表4rna逆转录反应体系试剂每管加入量5×rtbuffer5μl10mmdntps2μlrnasin(40u/μl)0.4μlm-mlv-rtase(200u/μl)1μlrnase-freeh2o5.6μlrt-pcr:采用agilent公司的mx3000p型的realtimepcr进行实时定量检测。pycr1基因的引物如下:上游引物5’-ggctgcccacaagataatggc-3’和下游引物5’-caatggagctgatggtgacgc-3’。以管家基因gapdh为内参,引物序列如下:上游引物5’-tgacttcaacagcgacaccca-3’和下游引物5’-caccctgttgctgtagccaaa-3’。按表5中的比例配置反应体系。表5rt-pcr反应体系试剂每管加入量sybrpremixextaq10.0μl上游引物(2.5μm)0.5μl下游引物(2.5μm)0.5μlcdna1.0μlrnase-freeh2o8.0μl设定程序为两步法real-timepcr:预变性95℃,30s,之后每一步变性95℃,5s;退火延伸60℃,30s;共进行45个循环。每次在延伸阶段读取吸光值。pcr结束后,95℃变性1min,然后冷却至55℃,,使dna双链充分结合。从55℃开始到95℃,每一步增加0.5℃,保持4s,同时读取吸光值,制作熔解曲线。采用2-δδct分析法计算侵染pycr1mrna的表达丰度。实验结果表明,人肝癌bel-7404细胞中pycr1mrna的表达水平下调了77.9%(图5);人肝癌smmc-7721细胞中pycr1mrna的表达水平下调了95.7%(图6)。实施例3检测侵染pycr1-sirna慢病毒的肿瘤细胞的增殖能力处于对数生长期的人肝癌bel-7404、smmc-7721细胞进行胰酶消化,制成细胞悬液(细胞数约为5×104/ml)接种于6孔板,培养至细胞融合度达到约30%。加入适量的实施例1制备的病毒,培养6小时后更换培养基,待侵染时间达到5天后,收集细胞。完全培养基重悬成细胞悬液(2×104/ml),以细胞密度约为2000个/孔,接种于96孔板。每组3个复孔,每孔100ul。铺好板后,置细胞培养箱培养。从铺板后第二天开始,每天用celigo检测读板一次,连续检测读板3-5天;通过调整analysissettings的输入参数,准确地计算出每次扫描孔板中的带绿色荧光的细胞的数量;对数据进行统计绘图,绘出5天的细胞增殖曲线。根据细胞计数值和时间点,绘制基于细胞计数值的细胞生长曲线。实验结果表明,慢病毒侵染组肿瘤细胞在体外培养5天后,增殖速度显著减缓,远低于对照组肿瘤细胞的增殖速度,人肝癌bel-7404细胞的活力细胞数目下调了64.0%(图7),如图7所示,经shrna慢病毒感染3天后,细胞铺于96孔板,铺板数为2000。celigo连续检测5天,发现实验组bel-7404细胞的增殖速率受到显著抑制。提示pycr1基因与bel-7404细胞的增殖能力显著相关。如图8所示,经shrna慢病毒感染3天后,细胞铺于96孔板,铺板数为2000。celigo连续检测5天,发现实验组smmc-7721细胞的增殖速率受到显著抑制。提示pycr1基因与smmc-7721细胞的增殖能力显著相关。人肝癌smmc-7721细胞的活力细胞数目下调了61.4%(图8)。实施例4检测侵染pycr1-sirna慢病毒的肿瘤细胞克隆形成的能力处于对数生长期的人肝癌bel-7404、smmc-7721细胞进行胰酶消化,制成细胞悬液(细胞数约为5×104/ml)接种于6孔板,将细胞接种于6孔板培养板中各实验组接种400-1000个细胞/孔(根据细胞生长情况确定),每个实验组设3个复孔。将接种好的细胞于培养箱中继续培养到14天或绝大多数单个克隆中细胞数大于50为止,中途每隔3天进行换液并观察细胞状态。实验终止前荧光显微镜下对细胞克隆进行拍照,pbs洗涤细胞1次。每孔加入1ml4%多聚甲醛,固定细胞30-60min,pbs洗涤细胞1次。每孔加入洁净、无杂质giemsa染液500μl,染细胞10-20min。ddh2o洗涤细胞数次,晾干,拍照,克隆计数。如图9、10所示肝癌bel-7404、smmc-7721细胞克隆形成实验的结果,如图9所示,shrna慢病毒感染3天后,细胞铺于6孔板,铺板量为1000。11天后,观察克隆数,发现实验组bel-7404细胞集落数目减少,提示pycr1基因与bel-7404细胞的克隆形成能力显著相关。如图10所示shrna慢病毒感染3天后,细胞铺于6孔板,铺板量为1000。11天后,观察克隆数,发现实验组smmc-7721细胞集落数目减少,提示pycr1基因与smmc-7721细胞的克隆形成能力显著相关。瘤细胞感染pycr1-sirna后克隆形成能力显著降低,与对照组比较,rna干扰组瘤细胞形成克隆斑数显著减少,克隆斑的体积明显减小。表明pycr1沉默导致肿瘤细胞形成克隆的能力下降。实施例5检测侵染pycr1-sirna慢病毒的肿瘤细胞凋亡水平待各实验组6孔板细胞生长至覆盖率约为70%时,干扰组用pycr1-sirna诱导凋亡;胰酶消化,完全培养基重悬成细胞悬液,与上清细胞收集于同一5ml离心管中,每组设三个复孔(为保证上机细胞数足够,细胞数目≥5×105/处理);1300rmp离心5min,弃上清,4℃预冷的d-hanks(ph=7.2~7.4)洗涤细胞沉淀;1×bindingbuffer洗涤细胞沉淀一次,1300rmp、3min离心,收集细胞;200μl1×bindingbuffer重悬细胞沉淀;加入10μlannexinv-apc染色,室温避光10-15min;根据细胞量,补加400-800μl1×bindingbuffer,上机检测。结果表明,如图11所示,shrna慢病毒感染后3天检测,实验组发生凋亡的bel-7404细胞显著增加,提示pycr1基因与bel-7404细胞的凋亡显著相关。如图12所示,shrna慢病毒感染后3天检测,实验组发生凋亡的smmc-7721细胞显著增加,提示pycr1基因与smmc-7721细胞的凋亡显著相关。pycr1-sirna干扰组肿瘤细胞凋亡率显著高于对照组,如图所示在肝癌bel-7404细胞(图11)和smmc-7721细胞(图12)中,沉默pycr1表达,细胞凋亡率显著高于对照组。表明下调pycr1表达水平可导致肿瘤细胞凋亡。以上所述仅是本发明的优选实施方式,应当指出,对于本
技术领域:
的普通技术人员来说,在不脱离本发明原理的前提下,还可以做出若干改进和润饰,这些改进和润饰也应视为本发明的保护范围。sequencelisting<110>上海市第七人民医院<120>人pycr1基因的shrna干扰序列及其制药用途<130>萨达<160>6<170>patentinversion3.5<210>1<211>58<212>dna<213>人工序列<400>1ccggcacagtttctgctctcaggaactcgagttcctgagagcagaaactgtgtttttg58<210>2<211>58<212>dna<213>人工序列<400>2aattcaaaaacacagtttctgctctcaggaactcgagttcctgagagcagaaactgtg58<210>3<211>19<212>dna<213>人工序列<400>3cagtttctgctctcaggaa19<210>4<211>610<212>dna<213>人工序列<400>4gttttaaaattatgttttaaaatggactatcatatgcttaccgtaacttgaaagtatttc60gatttcttggctttatatatcttgtggaaaggacgaaacaccggcacagtttctgctctc120aggaactcgagttcctgagagcagaaactgtgtttttgaattctcgacctcgagacaaat180ggcagtattcatccacgaattcggatccattaggcggccgcgtggataaccgtattaccg240ccatgcattagttattaatagtaatcaattacggggtcattagttcatagcccatatatg300gagttccgcgttacataacttacggtaaatggcccgcctggctgaccgcccaacgacccc360cgcccattgacgtcaataatgacgtatgttcccatagtaacgccaatagggactttccat420tgacgtcaatgggtggagtatttacggtaaactgcccacttggcagtacatcaagtgtat480catatgccaagtacgccccctattgacgtcaatgacggtaaatggcccgcctggcattat540gcccagtacatgaccttatgggactttcctacttggcagtacatctacgtattagtcatc600gctattacca610<210>5<211>24<212>dna<213>人工序列<400>5cctatttcccatgattccttcata24<210>6<211>20<212>dna<213>人工序列<400>6gtaatacggttatccacgcg20当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1